氟苯达唑促进结肠癌细胞自噬性凋亡的研究*
龙 爽,杨 菁,刘 桦,宋海星Δ
1.成都医学院 2013级生物制药本科(成都 610500);2.成都医学院 生物医学实验中心(成都 610500)
·论著·
氟苯达唑促进结肠癌细胞自噬性凋亡的研究*
龙 爽1,杨 菁2,刘 桦2,宋海星2Δ
1.成都医学院 2013级生物制药本科(成都 610500);2.成都医学院 生物医学实验中心(成都 610500)
目的研究氟苯达唑对结肠癌细胞的抑制作用及其作用机制。方法通过MTT法检测氟苯达唑对HCT116细胞的生长抑制作用及其有效作用浓度;免疫荧光检测氟苯达唑对细胞自噬水平的影响;免疫印迹检测经氟苯达唑及自噬抑制剂共处理后细胞凋亡标志蛋白的表达情况。结果氟苯达唑可抑制HCT116细胞的增殖,并呈现药物浓度依懒性。免疫荧光及免疫印迹结果表明,氟苯达唑促进HCT116细胞自噬。自噬抑制剂3-MA与氟苯达唑共处理结果表明,自噬抑制剂能够抵抗氟苯达唑诱发的细胞凋亡。结论氟苯达唑通过诱发结肠癌细胞自噬进而促进结肠癌细胞凋亡。
氟苯达唑;结肠癌;自噬;凋亡
结肠癌作为世界高发癌症之一,每年大约有数百万患者被诊断为结肠癌,同时每年有接近七十万患者死于结肠癌[1]。目前,结肠癌的主要治疗策略为手术和放、化疗,由于该治疗手段有着对身体的极大伤害及对恶性肿瘤的治疗效果甚微的特点,因此迫切需要寻找更有效的治疗策略[2]。氟苯达唑隶属于苯并咪唑家族,是一种安全、有效的驱虫药物,通过抑制线虫的微管蛋白聚合进而抑制线虫,广泛地运用于治疗人类胃肠道的寄生虫[3]。研究[4]报道,氟苯咪唑对肠道肿瘤及白血病细胞都有抑制作用。在体外实验中,氟苯达唑能够有效抑制乳腺癌细胞的增殖,促进乳腺癌细胞凋亡[5],表明氟苯达唑有望成为抗结肠癌药物。本研究拟采用结肠癌细胞HCT116为研究对象,探讨氟苯达唑对结肠癌细胞的抑制作用及作用机制。
1 材料与方法
1.1 材料
氟苯达唑(F129912 ≥98%)和3-MA均购自上海阿拉丁生化科技有限公司;DMEM培养基和胎牛血清均购自美国Gibco公司;MTT购自美国Sigma 公司;蛋白质预染Marker购自美国Thermo公司;Tween-20购自北京中衫金桥生物技术有限公司。LC3、p62、Beclin-1、p53、cleaved-Caspase-3、cleaved-PARP、β-Actin单克隆抗体、兔二抗、鼠二抗均购自美国Cell signaling technology公司;PVDF 膜和 ECL 显影液均购于美国Millpore 公司;X 光胶片购自 Kodak 公司。荧光显微镜(IX-71)购自日本奥林巴斯有限公司。
1.2 方法
1.2.1 细胞培养 人结肠癌细胞株HCT116购于上海中科院细胞库并在含有10%胎牛血清和含100 U/L青霉素,100 mg/L 链霉素的RPMI 1640 培养基中,于37 ℃,5% CO2孵箱中培养。
1.2.2 MTT法检测细胞活力 收集对数期的HCT116细胞,在96孔板中,每孔加入3 000个细胞左右(边缘孔用无菌PBS填充)。于37 ℃,5% CO2孵箱中培养过夜。待细胞贴壁后,加入提前配置为100 μL体系不同浓度的氟苯达唑药物,继续培养48 h,每组均设置6个复孔,不含细胞仅有培养基的空白孔设为空白对照组。44 h后,加入5 mg/mL的MTT,继续37 ℃,5% CO2孵育4 h,以空白孔调零,酶标仪测定OD490 nm处检测各孔吸光值。
1.2.3 Hoechst 33342染核检测细胞凋亡 通过Hoechst 33342染细胞核检测细胞凋亡。收集细胞以每孔10 000个铺在预放了盖玻片的六孔板上,贴壁后,加入不同浓度的氟苯达唑,培养24 h,PBS洗3次,5 min/次,采用4%多聚甲醛固定15 min,去除固定液,PBS洗3次,5 min/次,加入Hoechst33342染液1 mL,染色5 min,PBS洗3次,5 min/次,加上抗荧光猝灭剂,60%甘油封片,荧光显微镜观察。
1.2.4 免疫荧光检测自噬体的形成 参照文献[6]方法,通过LC3抗体免疫荧光强弱检测细胞自噬体的形成。将细胞铺在盖玻片上,细胞贴壁后,加入不同浓度的氟苯达唑,培养24 h,采用5%脱脂奶粉封闭1 h,PBS洗3次,5 min/次,室温孵育LC3一抗1 h,PBS洗3次,5 min/次,室温孵育FITC-荧光二抗1 h,PBS洗3次,5 min/次,加上抗荧光淬灭剂,60%甘油封片,荧光显微镜观察。
1.2.5 免疫印迹 收集药物处理后的细胞,按1×106个细胞加入100 μL RIPA裂解液(含蛋白酶抑制剂)的比例加入细胞裂解液,冰上震摇30 min,4 ℃ 13 000×g离心15 min,取上清液进行蛋白质定量,以确保蛋白上样量一致,加入5 X上样缓冲液,100 ℃加热变性10 min。通过12% SDS-PAGE电泳分离后,转至PVDF膜上,100 V恒压转2 h。5%脱脂奶粉室温封闭1 h,TBST洗3次,5 min/次,分别加入目标蛋白一抗(一抗稀释比例均为1∶1 000),4 ℃孵育过夜,TBST洗3次,5 min/次,辣根过氧化物酶标记二抗(1∶6 000)室温孵育1 h,TBST 洗涤PVDF膜6次,每次10 min,加入ECL显影剂后通过X光胶片曝光。
1.3 统计学分析

2 结果
2.1 氟苯达唑促进HCT116细胞凋亡
采用不同浓度的氟苯达唑(0、0.125、0.25、0.5、1、2、4、8、16、32、64、128 μM)处理HCT116细胞48 h,MTT检测细胞活力。实验结果表明:氟苯达唑增强细胞内毒性,抑制细胞增殖,且呈浓度依赖性。为进一步探究氟苯达唑抑制HCT116细胞增殖的具体作用机制,选用0.5、1 μM处理48 h后采用Hoechst染色剂免疫荧光检测细胞是否发生凋亡。与对照组相比,氟苯达唑促进了HCT116细胞胞内的凋亡小体形成。免疫印迹结果表明:经氟苯达唑处理后,胞内促凋亡基因P53表达量明显增加,且剪切型Caspase-3和PARP受到明显的活化(图1~3)。

图1 氟苯达唑抑制HCT116细胞增殖

图3 免疫印迹检测凋亡相关标志蛋白
2.2 氟苯达唑促进HCT116细胞自噬
研究[7]报道,氟苯达唑诱发乳腺癌细胞自噬进而抑制细胞增殖。为探究自噬是否参与氟苯达唑诱发HCT116细胞凋亡,本实验采用免疫荧光检测自噬体形成情况及免疫印迹检测自噬标志蛋白的表达情况,经氟苯达唑处理后,胞内LC3荧光斑点数明显增加,表明氟苯达唑促进了自噬体形成。免疫印迹结果表明:氟苯达唑激活BECLIN-1的表达,下调自噬抑制基因P62的表达(图4~5)。

图4 免疫荧光检测自噬体形成(×200)注:A: 对照组;B: 0.5 μM氟苯达唑;C: 1 μM氟苯达唑
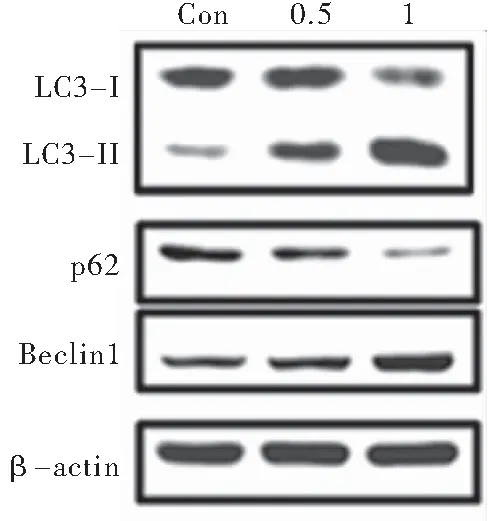
图5 免疫印迹检测自噬相关标志蛋白
2.3 氟苯达唑促进HCT116细胞自噬性死亡
为进一步探究自噬在氟苯达唑诱导HCT116细胞凋亡过程中的生物学功能,本实验采用自噬抑制剂3-MA[8]与氟苯达唑(1 μM)共处理48 h后,免疫印迹检测自噬及凋亡相关的标志性蛋白的表达情况。自噬抑制剂3-MA抑制了氟苯达唑诱导细胞的自噬,同时抑制了凋亡相关蛋白的表达(图6)。

图6 免疫印迹检测自噬、凋亡相关标志物
3 讨论
细胞有机体的生长发育受到细胞生长、细胞分化以及细胞死亡等多方面因素的调控。这些生物学过程相互协调,确保机体器官的完整,使机体维持在正常大小。相反,如果细胞分化或细胞死亡受到阻碍,就可能导致细胞异常增长,最后形成肿瘤[9]。程序性细胞死亡,分为I型和II型,是有机体通过漫长进化过程发展起来的一种细胞死亡机制,其在细胞自我更新,清除受损或异常的细胞,维持机体内环境的稳态以及多个系统的正常持续发育等过程中发挥重要作用[10]。I型又称为Caspase依赖的细胞死亡,即典型的细胞凋亡,以细胞体积缩小、核固缩、形成薄膜结构完整的凋亡小体为重要特征;II型为非Caspase依赖的细胞死亡,包括自噬性程序性细胞死亡、坏死、胀亡等,其中,自噬已成为近年来的研究热点,其与细胞凋亡最大的区别在于自噬为膜包裹部分胞质、长寿命蛋白、受损蛋白和细胞器等形成自噬体,最终与溶酶体融合形成自噬溶酶体,降解所包裹的内容物,来调控细胞稳态和细胞的自我更新。自噬是把双刃剑,对肿瘤的发生发展既有促进作用,也有抑制作用。肿瘤发生早期,肿瘤细胞增殖开始表现异常,生物合成速率大于分解代谢速率[11],此时自噬发挥肿瘤抑制作用,因此,在肿瘤发生早期抑制自噬能有效降低胞内蛋白质降解速率,进而导致癌前细胞持续生长[12]。当肿瘤细胞生长加快,持续分裂增殖,癌症呈局部晚期时,自噬将有助于实体肿瘤内部癌细胞抵抗缺氧、低营养的病理状态,从而有益于肿瘤细胞存活。此外,在抗肿瘤治疗中,细胞自噬也发挥着双重作用:一方面保护某些特定的肿瘤细胞免受放、化疗带来的损伤[13],另一方面介导肿瘤细胞发生自噬性死亡[14]。
综上所述,氟苯达唑是一种苯并咪唑家族抗真菌药物,主要用于抗蛔虫、钩虫、鞭虫等寄生虫,具有良好的驱虫效果[15]。近年来研究[16]报道发现,氟苯达唑还在其他方面发挥作用,包括阻滞细胞周期,抑制肿瘤干细胞、抑制细胞增殖与生长等。还有文献[17]报道称,氟苯达唑能有效抑制乳腺癌细胞的迁移和转移。氟苯达唑还可作为自噬调节基因ATG4B的激动剂,能促进LC3的剪切活化,进而促进乳腺癌细胞自噬。与其他的研究结果类似,本研究发现氟苯达唑能够阻抑结肠癌细胞增殖和促进细胞凋亡。值得注意的是,通过体外实验研究,氟苯达唑也能诱导结肠癌细胞自噬,在加入自噬抑制剂3-MA,阻断前期自噬过程后能有效抑制氟苯达唑诱导的细胞凋亡。
[1]Benson A B 3rd, Arnoletti J P, Bekaii-Saab T,etal. Colon cancer[J]. J Natl Compr Canc Netw, 2011, 9(11): 1238-1290.
[2]Van Cutsem E, Nordlinger B, Cervantes A,etal. Advanced colorectal cancer: ESMO Clinical Practice Guidelines for treatment[J]. Ann Oncol, 2010, 21(Suppl 5): v93-v97.
[3]Dominguez-Vazquez A, Taylor H R, Greene B M,etal. Comparison of flubendazole and diethylcarbamazine in treatment of onchocerciasis[J]. Lancet, 1983, 1(8317): 139-143.
[4]Králová V, Hanušová V, Staňková P,etal. Antiproliferative effect of benzimidazole anthelmintics albendazole, ricobendazole, and flubendazole in intestinal cancer cell lines[J]. Anticancer Drugs, 2013, 24(9): 911-919.
[5]Spagnuolo P A, Hu J, Hurren R,etal. The antihelmintic flubendazole inhibits microtubule function through a mechanism distinct from Vinca alkaloids and displays preclinical activity in leukemia and myeloma[J]. Blood, 2010, 115(23): 4824-4833.
[6]Codogno P, Mehrpour M, Proikas-Cezanne T. Canonical and non-canonical autophagy: variations on a common theme of self-eating[J]. Nat Rev Mol Cell Biol, 2011, 13(1): 7-12.
[7]Zhang L, Guo M, Li J,etal. Systems biology-based discovery of a potential Atg4B agonist (Flubendazole) that induces autophagy in breast cancer[J]. Mol Biosyst, 2015, 11(11): 2860-2866.
[8]Hayashi-Nishino M, Fujita N, Noda T,etal. A subdomain of the endoplasmic reticulum forms a cradle for autophagosome formation[J]. Nat Cell Biol, 2009, 11(12): 1433-1437.
[9]Maiuri M C, Galluzzi L, Morselli E,etal. Autophagy regulation by p53[J]. Curr Opin Cell Biol, 2010, 22(2): 181-185.
[10] Tasdemir E, Maiuri M C, Galluzzi L,etal. Regulation of autophagy by cytoplasmic p53[J]. Nat Cell Biol, 2008, 10(6): 676-687.
[11] Liang X H, Kleeman L K, Jiang H H,etal. Protection against fatal Sindbis virus encephalitis by beclin, a novel Bcl-2-interacting protein[J]. J Virol, 1998, 72(11): 8586-8596.
[12] Karantza-Wadsworth V, Patel S, Kravchuk O,etal. Autophagy mitigates metabolic stress and genome damage in mammary tumorigenesis[J]. Genes Dev, 2007, 21(13): 1621-1635.
[13] Lum J J, Bauer D E, Kong M,etal. Growth factor regulation of autophagy and cell survival in the absence of apoptosis[J]. Cell, 2005, 120(2): 237-248.
[14] Abedin M J, Wang D,McDonnell M A,etal. Autophagy delays apoptotic death in breast cancer cellsfollowing DNA damage[J]. Cell Death Differ, 2007, 14(3): 500-510.
[15] Ceballos L, Elissondo C, Sanchez Bruni S,etal. Comparative performances of flubendazole and albendazole in cystic echinococcosis: ex vivo activity, plasma/cyst disposition, and efficacy in infected mice[J].Antimicrob Agents Chemother, 2011, 55(12):5861-5867.
[16] Pourgholami M H, Cai Z Y, Wang L,etal. Inhibition of cell proliferation, vascular endothelial growth factor and tumor growth by albendazole[J]. Cancer Invest, 2009, 27(2): 171-177.
[17] Hou Z J, Luo X, Zhang W,etal. Flubendazole, FDA-approved anthelmintic, targets breast cancer stem-like cells[J]. Oncotarget, 2015, 6(8): 6326-6340.
AStudyoftheEffectofFlubendazoleonthePromotionofAutophagicApoptosisinColonCancerCells
LongShuang1,YangJing3,LiuHua2,SongHaixing2Δ.
1.Class2013ofBiopharmaceutics,ChengduMedicalCollege,Chengdu610500,China; 2.BiomedicalExperimentCenter,ChengduMedicalCollege,Chengdu610500,China
ObjectiveTo explore the inhibitory effect of flubendazole on colon cancer cells and its mechanisms.MethodsThe MTT method was used to detect the inhibitory effect of flubendazole on colon cancer cells and its effective concentration, the immunofluorescence and Western blot methods were used to detect the effect of flubendazole on the level of autophagy, and the Western blot method was used to detect the changes of the expression levels of apoptosis-related marker proteins after the co-treatment with flubendazole and autophagy inhibitors.ResultsFlubendazole significantly inhibited the proliferation of the colon cancer cell HCT116 with the dependence of drug concentration. The results of the immunofluorescence and Western blot methods showed that flubendazole promoted the autophagy of colon cancer cells. The results of the co-treatment with the autophagy inhibitor 3-MA and albendazole showed that autophagy inhibitors resisted the apoptosis induced by albendazole.ConclusionFlubendazole promotes the apoptosis by inducing the autophagy of colon cancer cells.
Flubendazole; Colon cancer; Autophagy; Apoptosis
http://kns.cnki.net/kcms/detail/51.1705.R.20171113.1513.010.html
10.3969/j.issn.1674-2257.2017.06.003
R735.3+5
A
四川省教育厅自然科学基金项目(No:130300);成都医学院自然科学基金项目(No:CYZ12-013);国家级大学生创新实验项目(No:201413705021)
△
宋海星,E-mail:shx@cmc.edu.cn

