分泌抗山羊γ干扰素单克隆抗体杂交瘤细胞株的制备与鉴定
张洪杰,桑锋锋,刘阿华,李言言,王 毅,陈德坤
(西北农林科技大学动物医学院,陕西杨凌 712100)
分泌抗山羊γ干扰素单克隆抗体杂交瘤细胞株的制备与鉴定
张洪杰,桑锋锋,刘阿华,李言言,王 毅,陈德坤*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为筛选分泌山羊γ干扰素(IFN-γ)单克隆抗体的杂交瘤细胞,以原核表达的山羊rIFN-γ蛋白免疫Balb/c小鼠,取其脾脏细胞与SP2/0瘤细胞进行细胞融合,以间接ELISA方法筛选分泌山羊IFN-γ单克隆抗体杂交瘤细胞,采用山羊外周血淋巴细胞产生的IFN-γ包被酶标板对IFN-γ的特异性进行鉴定,用试纸条对IFN-γ单克隆抗体类别和亚型进行鉴定。结果获得了1株能特异性识别山羊IFN-γ的杂交瘤细胞3C,3C分泌的单克隆抗体能够特异性识别天然结构的山羊IFN-γ,单克隆抗体类别为IgG,轻链为 κ型。
山羊;γ干扰素;杂交瘤细胞
γ干扰素(IFN-γ)主要由活化T细胞和NK细胞产生,参与细胞免疫,具有抗病毒感染、抗肿瘤等生物学活性,IFN-γ能够增强受体介导的吞噬功能,加强巨噬细胞和中性粒细胞的杀伤活性。一方面,IFN-γ可诱导巨噬细胞、T细胞、B细胞等细胞MHCⅡ类分子表达,提升抗原呈递能力;另一方面,能活化巨噬细胞促进杀伤胞内寄生病原。活化的巨噬细胞杀伤肿瘤细胞的水平也明显提高。而且,在局部炎症反应中, IL-1β、IL-17等细胞因子量的变化会引起IFN-γ表达量的差异[1]。因此,炎症部位IFN-γ含量的变化可作为评估机体免疫功能的重要指标,为疾病的诊断治疗和相关机理研究提供新的思路。目前市面上尚未见到山羊IFN-γ单克隆抗体的相关产品,这不利于山羊IFN-γ的相关研究。本试验通过ELISA方法筛选分泌山羊IFN-γ单克隆抗体的杂交瘤细胞,并对抗体的特异性、亚型等进行鉴定,获得了山羊IFN-γ单克隆抗体,为山羊IFN-γ检测奠定了技术基础[2]。
1 材料与方法
1.1 材料
1.1.1 材料 雌性Balb/c小鼠,6周龄,购自空军大学实验动物中心;纯化的山羊rIFN-γ蛋白、纯化山羊rIL-1β蛋白、纯化山羊rIL-17蛋白、纯化空载体融合标签蛋白、SP2/0细胞,由西北农林科技大学动物医学院兽医免疫学实验室(以下简称本实验室)保存。
1.1.2 主要试剂与仪器 完全弗氏佐剂、不完全弗氏佐剂为Sigma公司产品;羊抗鼠IgG酶标抗体为北京博奥森公司产品;TMB显色液为天根生化科技有限公司产品;小鼠抗体亚型鉴定试剂盒为Roch公司产品;Ni-NTA琼脂糖凝胶镍柱为上海TransGen公司产品;异丙基-β-D-硫代半乳糖苷(IPTG)为购自Sigma公司产品;酶标仪为Bio-Rad公司产品;酶标板为Castor公司产品;其他试剂为进口或国产分析纯。
1.2 方法
1.2.1 免疫原制备 将纯化的山羊rIFN-γ蛋白冻干粉[3]溶于蒸馏水,测定浓度,配制成1 mg/mL。取完全弗氏佐剂1 mL与等量山羊rIFN-γ蛋白溶液混匀,用注射器吸入三通管置于冰上来回推打乳化,约1 h后,取一小滴滴于平静水面上,乳化物20 min内不散开,此作为免疫原备用;按照同样方法取1 mL山羊rIFN-γ蛋白溶液与等量不完全弗氏佐剂混匀乳化备用。以上抗原的制备均现用现配。
1.2.2 小鼠免疫 取上述制备好的抗原,按照200 μL/只,对6周龄雌性Balb/c小鼠进行首免。首免后第21天进行二免,二免用的抗原为不完全弗氏佐剂与山羊rIFN-γ乳化所制,免疫剂量和途径同首免。二免后第15天进行第3次免疫,三免抗原、剂量和途径同二免一样。三免后第9天测定免疫小鼠血清抗体效价。免疫次数以小鼠血清抗体效价达到要求为目标。
1.2.3 山羊IFN-γ抗体的ELISA 检测 取上述配制好的1 mg/mL山羊rIFN-γ蛋白溶液,调整其蛋白浓度为10 μg/mL,100 μL/孔加入96孔ELISA 酶标板内,封口后4℃放置14 h;弃去酶标板内液体,加入PBST溶液洗涤,重复洗涤3遍后,加入10 mL/L鸡血清的PBST溶液100 μL/孔封闭,置于37℃生化培养箱1 h;弃去孔内液体,按如上方法洗涤3遍,加入本试验制备的稀释1 000倍的抗山羊IFN-γ单克隆抗体、稀释1 000倍的IFN-γ阳性小鼠血清(免疫鼠剪尾采血)、稀释1 000倍的阴性血清(未免疫鼠剪尾采血),100 μL/孔,每个样品做3个重复,封口后置于37℃生化培养箱1 h;弃去板内溶液,按如上步骤洗涤3遍,用排枪吸取配制的羊抗鼠酶标二抗(二抗∶PBST=1∶5 000)溶液100 μL/孔加入板内,封口后置于37℃培养温箱1 h;弃去板内溶液,按如上方法用PBST溶液清洗5遍,避光加入TMB溶液100 μL/孔,于37℃生化培养箱20 min;加入2 mol/L稀硫酸100 μL/孔,立即置于酶标仪上读数。
1.2.4 脾细胞与SP2/0细胞融合 于细胞融合前1周复苏SP2/0细胞,扩大培养备用;融合前1 d,制备饲养层细胞,具体操作为将健康未免疫小鼠眼球摘除取血并分离血清,作为阴性血清,处死小鼠无菌处理后,注射RPMI1640基础培养基到小鼠腹腔,轻柔柔压后收集,重复3次,将收集的腹腔液1 000 r/min离心10 min,用HAT选择培养基重悬后,加入96孔细胞培养板,37℃、体积分数为5% CO2条件下培养备用;融合当天取免疫小鼠按上述方法取其血清后无菌处理,然后剖解小鼠取其脾脏去除筋膜后置于200目筛网上研磨分离脾细胞,;取培养至对数生长期的SP2/0细胞,调整细胞浓度使脾细胞数量比SP2/0细胞数量在108∶(1~2)×107范围,按照融合剂PEG1500的操作说明来进行细胞融合,最后将融合细胞加入到上述含有饲养层细胞的96孔培养板内,37℃、体积分数为 5% CO2条件下培养[8]。
1.2.5 分泌抗山羊IFN-γ单克隆抗体的杂交瘤细胞筛选 每天观察培养板内的细胞,当观察到大部分孔内有细胞团时,吸取孔内培养基,按照1.2.3方法检测,保留阳性孔,按照有限稀释法进行至少3次亚克隆,并按1.2.3方法检测,最终获得目的杂交瘤细胞。
1.2.6 抗山羊IFN-γ单克隆抗体特异性测定 以本实验室保存的纯化山羊rIFN-γ蛋白、纯化山羊rIL-1β蛋白、纯化山羊rIL-17蛋白、纯化空载体融合标签蛋白和参照文献[3]制备的山羊外周血淋巴细胞培养上清为包被抗原,以筛选获得的杂交瘤细胞分泌的抗体为一抗进行ELISA检测,检测获得的单克隆抗体与这几种抗原的反应性。
1.2.7 抗山羊IFN-γ单克隆抗体效价测定 将上述筛选所得杂交瘤细胞计数,调整细胞浓度为106个/mL,注射500 μL到提前1周用液体石蜡预处理的Balb/c小鼠腹腔内,待小鼠腹部膨大后,抽取腹水离心收集上清,分装后置-20℃保存备用;将腹水分别稀释102、103、104、105、106倍,按1.2.3 ELISA检测,确定腹水中抗体的效价。
1.2.8 抗山羊IFN-γ单克隆抗体亚型鉴定及杂交瘤细胞染色体组型分析 本试验采用Roch公司Iso Strip Mouse Monoclonal Antibody Isotyping Kit(抗体亚型检测试剂盒)测定单克隆抗体类别和亚型,操作步骤为先将腹水抗体稀释2×105倍,使其浓度在0.1 μg/mL~1 μg/mL之间,吸取150 μL加入显色管内;在15℃~25℃下作用30 s,轻轻晃动,使蓝色粉末完全混匀;取一条试纸条将黑色端插入显色管底部,作用3 min左右观察结果。分泌抗山羊IFN-γ单克隆抗体的杂交瘤细胞染色体组型分析结果由西安交通大学第一附属医院提供。
2 结果
2.1 免疫小鼠血清抗体效价测定结果
小鼠第4次免疫后第9天,尾部采血分离血清,进行ELISA检测,检测结果表明,其抗体效价达到1∶105(表1)。

表1 第4次免疫后小鼠血清效价
2.2 脾细胞与SP2/0细胞融合结果
对融合后细胞进行观察、检测后,其融合率达到了70%,初次检测阳性率为3%(图1)。
2.3 抗山羊IFN-γ单克隆抗体特异性鉴定结果
筛选结果获得了1株阳性杂交瘤细胞,命名为
3C。该杂交瘤细胞分泌的单克隆抗体不识别rIL-1β、rIL-17、空载标签蛋白等,只识别山羊rIFN-γ ;其分泌的单克隆抗体与含有IFN-γ的山羊外周血淋巴细胞培养上清液发生反应,即本株单克隆抗体不仅能识别原核表达山羊rIFN-γ,还能识别天然山羊IFN-γ (表2)。
2.4 单克隆抗体效价检测结果
如表3所示,使用间接ELISA方法测定,将腹水稀释为1∶106后,其OD450为0.161,杂交瘤细胞上清液稀释为1∶103,其OD450为0.134,P/N均大于2/1,即腹水抗体效价为1∶106,杂交瘤细胞上清效价为1∶103。
2.5 抗山羊IFN-γ单克隆抗体亚型鉴定和杂交瘤细胞染色体组型分析结果
结果显示(图2和图3),单克隆抗体3C类别为IgG1,轻链类型为κ型;杂交瘤细胞染色体数目为SP2/0细胞染色体数目与正常小鼠脾细胞的染色体数目之和,符合融合细胞的染色体数目规律[8]。
图1 融合第7 d杂交瘤细胞

表2 抗山羊IFN-γ单克隆抗体特异性鉴定结果
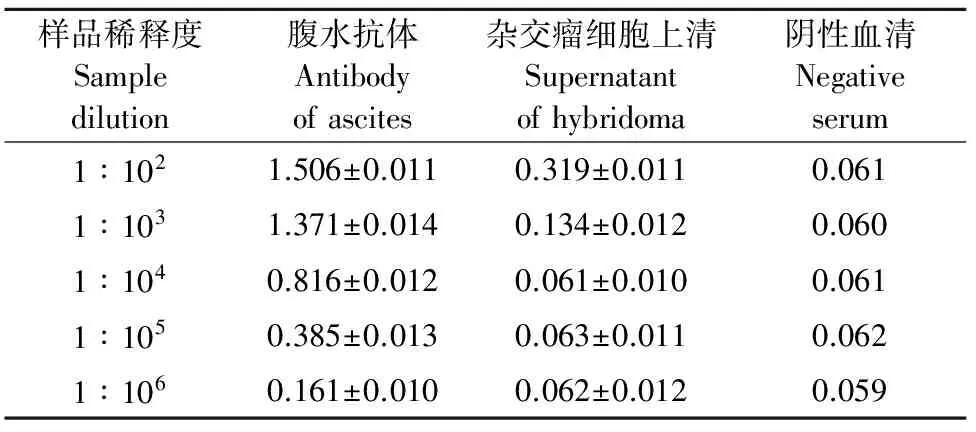
表3 抗体效价检测结果
3 讨论
本研究采用间接ELISA方法筛选到1株分泌抗山羊IFN-γ单克隆抗体的杂交瘤细胞株,对其分泌的单克隆抗体特异性、抗体类别鉴定表明,该单克隆抗体能特异性识别山羊IFN-γ,抗体类别为IgG1。同时本研究分离并培养了山羊外周血淋巴细胞,用con-A刺激淋巴细胞产生天然山羊IFN-γ,收集后作为包被抗原,检测结果表明,本试验所得的单克隆抗体能特异性识别天然山羊IFN-γ蛋白,弥补了山羊IFN-γ单克隆抗体的空白。后续试验会针对抗体特性来决定其具体应用,如胶体金试纸条的相关研究和流式细胞标记用抗体[9]。
免疫小鼠过程中所用抗原为山羊IFN-γ原核表达蛋白,原核表达蛋白具有生产周期短、易于纯化、表达量高等优点,但其活性及表位完整度却不及真核表达产物;而真核表达的山羊IFN-γ蛋白,表达量低、难于纯化,不符合免疫小鼠的抗原要求。本试验分离培养了山羊外周血淋巴细胞,用con-A刺激淋巴细胞产生天然山羊IFN-γ,验证了所获单克隆抗体既可识别原核表达山羊IFN-γ,又可识别天然山羊IFN-γ[10]。单克隆抗体的制备过程中,有很多关键性因素,如免疫小鼠用的抗原中杂蛋白过多,会造成脾脏内针对杂蛋白活化的淋巴细胞过多,导致阳性率偏低,也为筛选增加了工作难度。因此,在单克隆抗体制备过程中,免疫小鼠的抗原应纯化到最大程度。

图2 杂交瘤细胞亚型鉴定

图3 杂交瘤细胞染色体数目分析
[1] 赵燕清.奶山羊隐性乳腺炎的流行病学调查及S.aureus感染小鼠乳腺后Th细胞免疫应答机制研究 [D]:陕西杨凌:西北农林科技大学,2015.
[2] Boshra H,Truong T,Nfon C,et al.A lumpy skin disease virus deficient of an IL-10 gene homologue provides protective immunity against virulent capripoxvirus challenge in sheep and goats[J].Antiviral Res,2015,123:39-49.
[3] 安 贝.山羊IFN-γ基因的克隆表达及抗ORFV活性鉴定 [D]:陕西杨凌:西北农林科技大学,2014.
[4] 刘鹤媛,周 铭,岳进华,等.山羊IFN-γ免疫血清制备及抗体ELISA检测方法的建立[J].动物医学进展,2016,37(12):24-27.
[5] Liu Y,Li X,Li Z,et al.Preparation and identification of monoclonal antibodies against infectious bursal disease virus (IBDV) VP4[J].Shengwu Gongcheng Xuebao , 2014,30:1660-1668.
[6] Hao Z,Xu L,Bai Y,et al.Preparation of monoclonal antibodies against hFGF-21 and identification of epitope[J].Xibao Yu Fenzi Mianyi Xue Zazhi,2013,29:834-837.
[7] Zhou J,Zhao L,Hu J H,et al.Preparation and identification of monoclonal antibodies against recombinant N protein of mouse hepatitis virus[J].Xibao Yu Fenzi Mianyi Xue Zazhi,2012,28:841-843.
[8] Yang Y,Ma Y,Li H,et al.Preparation and identification of monoclonal antibodies against omega-conotoxin MVIIA[J].Monoclonal Antibodies Immunodiagnosis Immunotherapy,2014,33:254-260.
[9] 金 标.山羊干扰素-γ与白细胞介素-2的克隆、原核表达及其抗血清的制备[D].黑龙江哈尔滨:东北农业大学,2007.
[10] 李 川,谭亚娣,陈颖钰,等.牛IFN-γ原核表达、单克隆抗体制备及其ELISA检测方法的建立[J].生物工程学报 2007,23:40-45.
DetectionandPhylogeneticAnalysisofSheepPoxvirus
ZHAO Lin1,2,LI Meng2,LUO Jing2,WANG Cheng-min2,WANG Yu-tian3, ZHAO Bao-hua1,HE Hong-xuan2
(1.CollegeofLifeScience,HebeiNormalUniversity,Shijiazhuang,Hebei,050024,China; 2.NationalResearchCenterforWildlifeBornDiseases,KeyLaboratoryofAnimalEcologyandConservationBiology,InstituteofZoology,ChineseAcademyofSciences,Beijing,100101,China; 3.AnimalHusbandryStation,Beijing,100101,China)
Capripox virus (CaPV) is one of the most concerned infectious diseases around the world.In recent years,CaPV circulated in North and Middle Africa,Middle East and Asia,which have caused great damage to the breeding industry.In this research,four sheep were preliminarily speculated to be infected with CaPV.A final diagnosis was made based on clinical signs,postmortem examinations,histopathological analysis,and PCR detection.Phylogenetic analysis indicated that the causative CaPV belongs to Asia-lineage,and they are few genetic mutation in China.Our results provided useful information for the diagnosis of capripox.Additionally,the research is valuable for the analysis of virus evolution and mutation.
Sheep pox; clinical sign; histopathological examination; PCR; phylogenetic analysis
PreparationandIdentificationofHybridomaCellLinesSecretingAntibodiesagainstGoatIFN-gamma
ZHANG Hong-jie,SANG Feng-feng,LIU A-Hua,LI Yan-yan,WANG Yi,CHEN De-kun
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
S852.4
A
1007-5038(2017)12-0014-04
2017-04-10
陕北白绒山羊主要疫病防控关键技术研究与示范(2015KTTSNY04-04)
张洪杰(1990-),男,河南驻马店人,硕士研究生,主要从事兽医病原学与免疫学研究。*
Abstract:In order to prepare hybridoma cells secreting monoclonal antibodies against goat IFN-γ,Balb/c mice were immunized with purified prokaryotic recombiant goat IFN-γ (rIFN-γ) and the splenocytes were isolated and fused with SP2/0 myeloma to generate hybridoma cells.Then the supernatant was collected to identify the monoclonal antibodies recognizing goat IFN-γ specifically.In the present study,an I-ELISA method was established to detect antibodies against goat IFN- γ when the antigen was coated with goat lymphocytes.Then the classes and types of monoclonal antibodies against goat IFN-γ were characterized by quick test strip.The results suggested that a strain of hybridoma cell named 3C which showed high specificity was prepared successfully,and the monoclonal antibody was identified as IgG class and kappa type.
Keywords:goat; IFN-γ; hybridoma cell

