2016年鲁北地区鸡群病毒性肿瘤病例的检测分析
徐晴晴,孙 培,褚仁忠,王文秀,王金良,肖跃强,王 艳,魏 凤,莫 玲,苗立中*
(1.山东省滨州畜牧兽医研究院 山东省滨州畜禽蜂胶疫苗研究开发推广中心,山东滨州 256600;2.滨州经济技术开发区农村工作部,山东滨州 256600;3.阳信县畜牧兽医局,山东滨州 256600;4.山东省滨州畜牧兽医研究院,山东滨州 256600)
2016年鲁北地区鸡群病毒性肿瘤病例的检测分析
徐晴晴1△,孙 培2△,褚仁忠3,王文秀4,王金良4,肖跃强4,王 艳4,魏 凤1,莫 玲4,苗立中4*
(1.山东省滨州畜牧兽医研究院 山东省滨州畜禽蜂胶疫苗研究开发推广中心,山东滨州 256600;2.滨州经济技术开发区农村工作部,山东滨州 256600;3.阳信县畜牧兽医局,山东滨州 256600;4.山东省滨州畜牧兽医研究院,山东滨州 256600)
为了解鸡马立克病病毒(MDV)、禽白血病病毒(ALV)和禽网状内皮组织增生症病毒(REV)在鲁北地区鸡群中的感染情况,对来自21个鸡群的送检病例进行了病原核酸的PCR检测。结果显示, MDV阳性率为28.5%,ALV-J阳性率为23.8%,REV阳性率为14.3%,肿瘤病毒的二重感染率为28.6%。结果表明,3种肿瘤病毒在鲁北地区蛋鸡和地方品种鸡群中的感染严重,病毒的混合感染较多。因此,做好MD的疫苗防护,对ALV-J及REV的感染状况要进行定期检测,控制好养殖环境,尽量避免3种肿瘤病毒的继发感染。
鸡马立克病病毒;禽白血病病毒;禽网状内皮组织增生症病毒;PCR检测
外源性禽白血病病毒(ALV)、马立克病病毒(MDV)和网状内皮细胞增生症病毒(REV)是引起鸡产生肿瘤的3种最常见病毒。这3种病毒不同程度的存在我国鸡群中,常呈混合感染[1-3],均能导致鸡体产生免疫抑制,引起生产性能下降、继发感染和致死性肿瘤,给养禽业造成了严重的经济损失。目前,针对ALV和REV没有商品化的疫苗来免疫预防,MDV感染主要靠免疫弱毒疫苗来预防,包括MDV-1型的CVI988株、MDV-2型的SB-1株和HVT型疫苗的FC126株,一般通过皮下或肌肉接种于1日龄雏鸡。免疫接种后7 d才能产生保护力,所以如果早期接触了MDV野外强毒也能引起免疫鸡群发病。近年来,从一些症状不典型或者病变多样化的病鸡中经常检测到这3种肿瘤病毒的感染。鲁北地区是黄河三角洲高效生态农业核心规划区,本研究通过剖检诊断和PCR检测对2016年来自鲁北地区的21份病料进行了3种常见肿瘤病毒的检测,为了解当前3种肿瘤病毒的感染情况及其防控提供参考。
1 材料与方法
1.1 材料
1.1.1 病例 2016年2月至12月送至本单位门诊进行诊断的病鸡,包括肉鸡和蛋鸡,30日龄~360日龄不等。根据发病的临床症状初步判断为鸡3大常见肿瘤病毒感染的共有21份病例,这其中有5次送检的为病死鸡。对发病鸡的来源、品种、症状等进行记录。
1.1.2 主要试验材料 病毒RNA提取试剂盒为OMEGA公司产品;反转录试剂盒为Thermo公司产品;2 ×TaqPCR Star Mix with Loading Dye为Gen Star公司产品;DNA Marker和pMD18-T载体为TaKaRa公司产品;SPF鸡胚购自济南斯帕法斯家禽有限公司;高糖DMEM、胎牛血清均为Gibco公司产品;ALV-p27抗原ELISA检测试剂盒为美国IDEXX公司产品。
1.1.3 引物信息 参考文献中报道的检测鸡3种主要致肿瘤病毒(ALV、MDV、REV)的6对引物[4-7](表1),引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 病例剖检 对剖检后发现有内脏肿瘤的病鸡剪取肿瘤部位的组织,提取该组织的RNA后进行反转录,以反转录获得的cDNA为模板,用表1的特异性引物进行PCR检测。
1.2.2 PCR检测 合成的6对特异性引物中,B1/B2扩增的目的基因为1 100 bp是这些目的基因中最长的。分别用本单位从病料中提取的ALV-A/B/J、MDV和REV阳性DNA进行预试验,优化试验条件后这6对引物可以在同一个PCR反应程序扩增:提取病料组织中的DNA为模板,用2 ×TaqPCR Star Mix with Loading Dye 按说明书配置20 μL反应体系,按照如下程序进行PCR扩增:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,共30个循环;最后72℃延伸8 min。用10 g/L琼脂糖凝胶电泳检测扩增产物。

表1 鉴别诊断引物信息
注:M1/M2引物扩增毒株的毒力不同,目的基因大小不同。含2~3个重复序列的为高毒力毒株(即目的基因为300 bp或400 bp时)。
Note:The sizes of target genes which M1/M2 primer amplified are different because of different strains virulence.High virulent strains usually have 2-3 repeats (i.e.,the target gene is around 300 bp or 400 bp).
1.2.3 病毒分离与鉴定 将检测为ALV-J阳性的相应病变组织研磨,反复冻融后,0.22 μm无菌滤器过滤后接种9日龄SPF鸡胚制备的成纤维细胞(CEF),感作2 h后,无血清DMEM洗涤2次,换含50 mL/L胎牛血清的DMEM继续培养6 d。用ALV-p27抗原ELISA检测试剂盒检测CEF上清。提取上清为ALVp27抗原阳性的CEF RNA,反转录后用针对ALV-J gp85基因的特异性引物(表1中的ALV-J P1/P2)扩增目的基因后连接克隆载体pMD18-T并送上海生工生物工程技术服务有限公司测序。
2 结果
2.1 病例剖检
送检的21份怀疑为致肿瘤病毒感染的病鸡剖检后发现有典型内脏肿瘤病变的有5份,其中肝脏、脾脏、肾脏有明显大小不一的肿瘤结节,5份肿瘤病例中的典型肿瘤病变见图1。
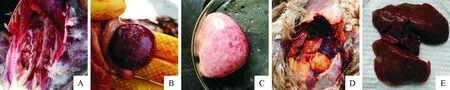
A.360日龄芦花蛋鸡种公鸡,肾脏充满了黄豆粒大小的白色肿瘤结节(济南商河);B.150日龄芦花蛋鸡,脾脏表面有绿豆样肿瘤结节(滨州惠民);C.120日龄海兰褐病死蛋鸡,脾脏高度肿胀,花白相间,布满了白色的肿瘤小结节(滨州无棣);D.179日龄病死海兰褐蛋鸡,肝脏肿大且破裂出血(德州庆云);E.60日龄柴鸡,肝脏布满了大小不一界限清晰的肿瘤结节(滨州里则)
A.White tumor nodules of soybean grain size filled with kidney in 360-days old breeder cock of Luhua layers (Jinan Shanghe); B.Mung bean-like tumor nodules in spleen surface of 150-days old Luhua layers (Binzhou Huimin ); C.The spleen swells severely,gray and white,full of white tumor nodules (Binzhou Wudi) of Hyline brown layers which dead at 120-days old; D.Swelling and rupture hemorrhage in liver of Hyline layers which dead at 179-days old (Dezhou Qingyun); E.The liver is covered with different sizes of tumor nodules with clear boundaries of 60-days old Domestic chicken (Binzhou Lize)
图1病例剖检的典型肿瘤病变
Fig.1 The pathological lesions of typical tumorous
2.2 PCR检测结果
采用PCR方法检测了21份送检病例MDV、ALV和REV感染情况(表2)。其中有9份病例检测结果显示存在3种病毒的感染(表3)。图2为典型病例的检测结果,其中图2a显示病鸡存在ALV-J感染,图2b中病鸡存在MDV和REV的混合感染,图2c中病鸡存在REV和ALV-J的混合感染,图2d中存在MDV和ALV-J的混合感染。
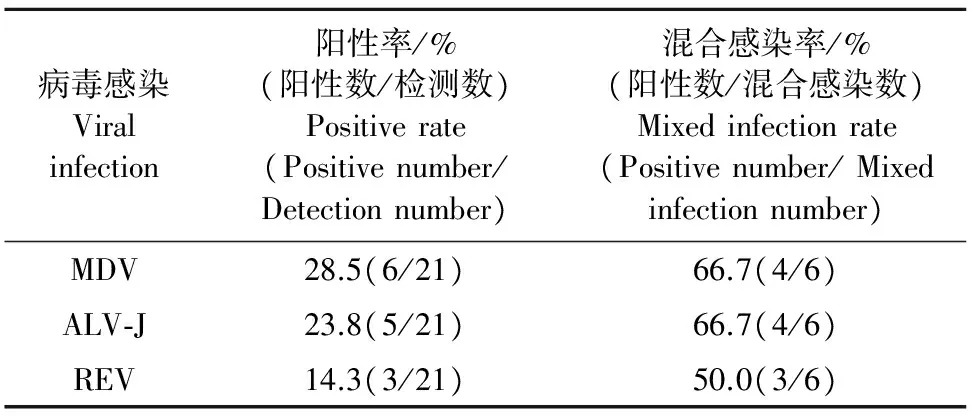
表2 肿瘤病毒单纯/混合感染的检测结果
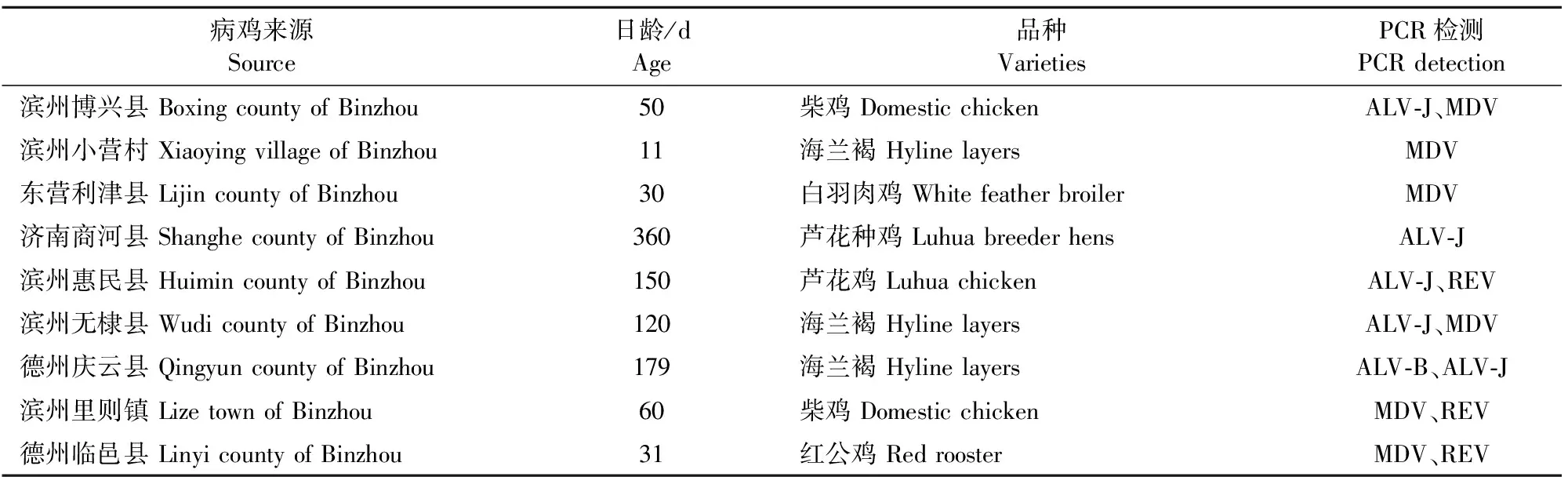
表3 9份肿瘤病毒感染病例的PCR检测结果
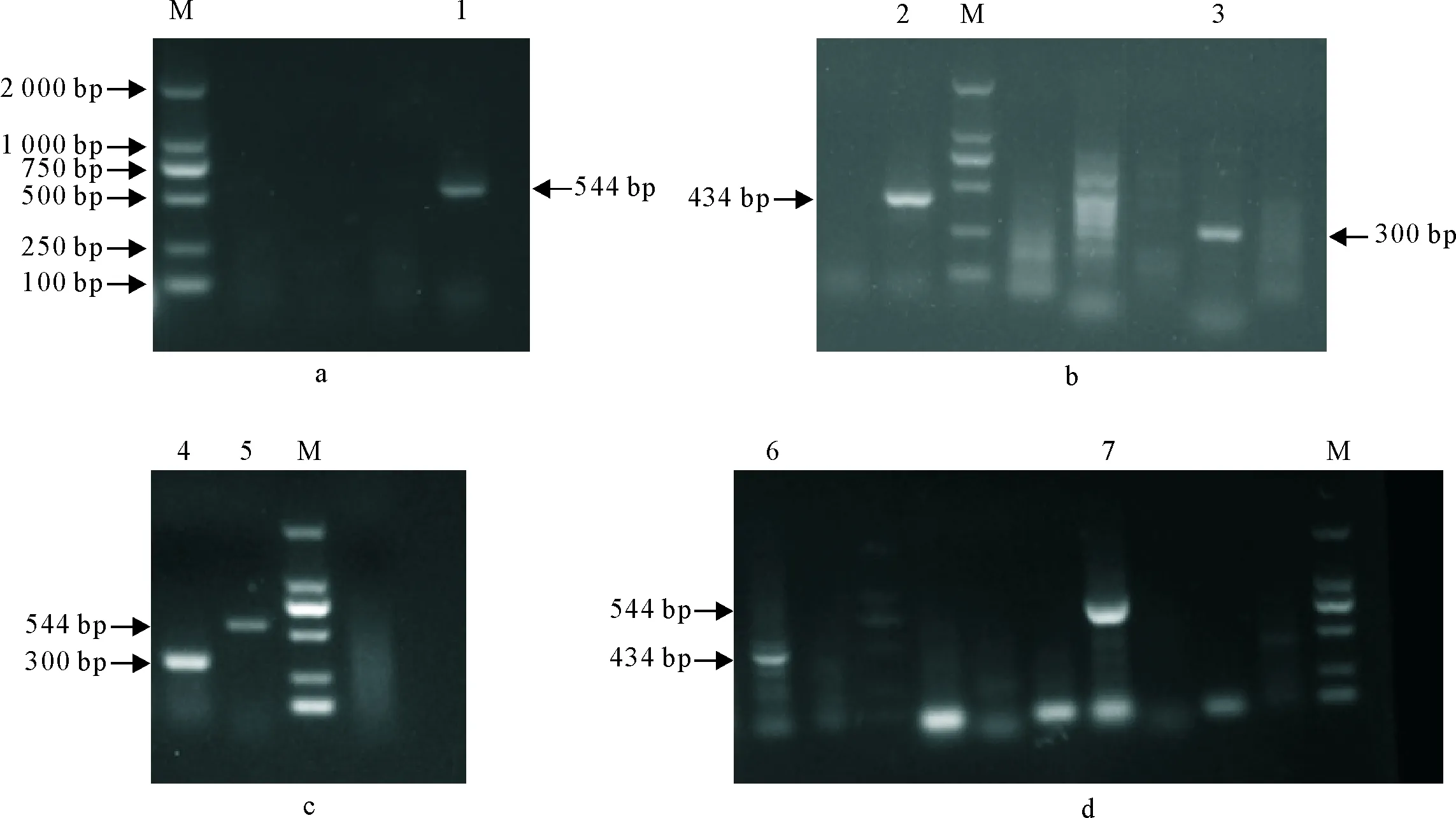
M.DNA标准DL 2 000;1.544 bp的ALV-J基因片段;2.434 bp的MDV基因片段;3.300 bp的REV基因片段;4.300 bp的REV基因片段;5.544 bp的ALV-J基因片段;6.434 bp的MDV基因片段;7.544 bp的ALV-J基因片段
M.DNA Marker DL 2 000 ; 1.ALV-J 544 bp; 2.MDV 434 bp; 3.REV 300 bp; 4.REV 300 bp; 5.ALV-J 544 bp; 6.MDV 434 bp; 7.ALV-J 544 bp
图2目的基因的PCR检测
Fig.2 PCR detection of target gene
2.3 病毒分离与鉴定
9份肿瘤病毒感染的病例中有MDV、ALV-J、REV单独感染的,也有两两混合感染的,混合感染的病料不适合分离纯病毒,单独感染MDV的有2例,都是病死鸡不适合该细胞结合型病毒的分离,故最终只从感染了ALV-J并引起肾脏、脾脏肿瘤的病鸡中分离到了一株ALV-J命名为BZ-0415,将BZ-0415分离株的gp85基因克隆测序后与部分国内外ALV-J毒株的gp85基因核苷酸序列进行同源性分析,结果表明该毒株与中国黑龙江ALV-J分离株HLJ13SH01的同源性最高,达92.8%(图3)。

图3 BZ-0415分离株与部分国内外ALV-J毒株核苷酸同源性比较
3 讨论
用PCR检测病料中是否存在某种病原的感染,无论是准确性还是敏感性,都是一种快速方便的方法。21份病例的检测结果显示,有9份中检测到致肿瘤病毒,这3种常见的鸡肿瘤病毒检出率分别为ALV-J 23.8%、MDV 28.5%和REV 14.3%,且多数情况下是2种病毒的混合感染。在6份的肿瘤病毒混合感染病例中,MDV的检出率为66.7%,在9份的肿瘤病毒感染的病例中,MDV的检出率也高达66.7%,高于其他2种肿瘤病毒的检出率(表2),这种情况应该引起足够重视。近年来,MDV毒株的毒力不断增强,免疫失败时有发生[8]。疫苗只能降低宿主的感染率不能阻止病毒在细胞内增殖,感染宿主后病毒能在体内持续存在[9]。MDV毒株的毒力进化趋势分析表明,其毒力大约十几年就发生一次跃迁[10],这可能是MDV危害加重的原因之一。因此,在新型疫苗的研发过程中,必须要考虑到MDV毒株毒力的进化态势,采取有效手段阻止病毒毒力增强,开发出当下需要的高效疫苗。
国内外育种公司经过十几年的努力,已经在白羽肉鸡中完成了ALV的净化工作。近年来,关于白羽肉鸡ALV感染鲜有报道。但ALV-J在我国蛋鸡和地方品种鸡中却普遍存在。由于我国养殖场数量多、养殖模式多样化、分布散、规模参差不齐,且ALV-J的净化工作需要若干世代,周期长。因此,我国鸡群要实现ALV-J的净化,任务艰巨。在自然、免疫、宿主适应性、抗反转录病毒药物等选择压下,ALV-J囊膜蛋白基因(env)变异迅速,导致其毒力和致瘤性增强,感染的宿主范围扩大,也可能是宿主细胞表面存在未发现的新受体。研究表明,以ALV-J为模型,通过免疫共沉淀、质谱分析、荧光定量PCR等技术鉴定出78 ku葡萄糖调节蛋白(GRP78)和膜联蛋白(ANXA2)是ALV-J的新受体[11]。病毒的抗原能够变异但是靶细胞表面的受体分子是保守的,因此可以利用细胞受体研制保护性抗体或疫苗抑制病毒进入细胞从而降低被感染的风险。
据报道,临床上经常检测到REV与ALV-J、MDV、鸡传染性贫血病毒(CAV)和传染性法氏囊病病毒(IBDV)等免疫抑制性病毒的混合感染的病例[12-14]。REV已成为威胁我国养禽业的重要病原。在当前生物制品污染概率较低的情况下REV阳性率仍然较高,说明养殖环境对该病的发生与传播有重要影响,已证明野鸟也能携带该病毒[15]。由于对REV在鸡群中的危害性认识不够,目前我国尚无检测REV的商品化产品。研发REV相关的检测方法与产品,既满足我国养禽业的技术需求,也拥有巨大的市场潜力。
MDV、ALV-J、REV等免疫抑制性病毒的流行,必将会增加鸡场中各种疾病的危害程度[16]。ALV-J和 REV感染目前尚无商品化疫苗可用,只能通过鸡场净化从源头上阻断这两种病毒的传播。对于这3种常见肿瘤病毒感染的防控,一方面要加强综合管理,另一方面要加快表位疫苗等新型疫苗的研发,通过免疫预防将疾病控制在最低水平。
[1] 杨永立,钟兴福,王培坤,等.2014年广西地方鸡群病毒性肿瘤病例的检测分析[J].中国家禽,2015,37(17):53-56.
[2] 成子强,张玲娟,刘 杰,等.蛋鸡中发现J亚群白血病与网状内皮增生症自然混合感染[J].中国兽医学报,2006,26(6):586-590.
[3] 张洪海,刘 青,邱 波,等.地方柴鸡中J亚群禽白血病与马立克病的混合感染[J].畜牧兽医学报,2009,40 (8):1215-1221.
[4] Silva R F,Fadly A M,Taylor S P,et al.Development of a polymerase chain reaction to differentiate avian leukosis virus(ALV)subgroups:detection of an ALV contaminant in dommercial Marek's disease vaccines[J].Avian Dis,2007,51:663-667.
[5] Smith L M,Brown S R,Howes K,et al.Development and application of polymerase chain reaction (PCR) tests for the detection of subgroup J avian leukosis virus[J].Virus Res,1998,54:87-98
[6] Silva R F,Smith E J.PCR as a tool for the diagnosis of avian tumor virus and tumor.IN:Avian tumor viruses symposium[C].WI:Omnipress,1997,19-22.
[7] 汪德生,罗明星,史开志,等.鸡马立克病病毒强毒与疫苗毒 PCR 鉴别检测方法的建立[J].动物医学进展,2010,31(7):26-30.
[8] Biggs P M,Nair V.The long view:40 years of Marek's disease research and Avian Pathology[J].Avian Pathol,2012,41:3-9.
[9] Mackinnon M J,Read A F.Immunity promotes virulence evolution in a malaria model[J].PLoS Biol,2004,2:E230.
[10] Haq K,Karel A.Immunity to Marek’s disease:Where are we now [J].Develop Comp Immunol,2013,41:439-446.
[11] Mei M,Ye J,Qin A,et al.Identification of novel viral receptors with cell line expressing viral receptor-binding protein[J].Sci Rep,2015,(5):7935.
[12] 杨卫铮,韩 雪,张 倩,等.2014 年我国鸡群中禽网状内皮组织增生症血清学调查[J].中国预防兽医学报,2015,37(8):641-643.
[13] 彭 昊,吴元俊,秦丽莉,等.不同品种禽类ALV和REV感染情况调查[J].畜牧兽医学报,2013,44(12),1989-1993.
[14] 任玉鹏,张焕容,王小楠,等.四川部分鸡场禽网状内皮组织增生症病毒感染情况调查[J].动物医学进展,2015,36(6):162-166.
[15] 邓小芸,祁小乐,李 凯,等.禽网状内皮组织增生病流行现状及防控[J].中国家禽,2015,37(1):1-4.
[16] 常维山,郭慧君,孙淑红.近年来我国禽白血病流行现状及发展趋势分析[J].中国家禽,2010,32(1):8-10.
DetectionandAnalysisofNeoplasticDiseaseCasesinChickensfromLubeiAreain2016
XU Qing-qing1,SUN Pei2,CHU Ren-zhong3,WANG Wen-xiu4,WANG Jin-liang4, XIAO Yue-qiang4,WANG Yan4,Wei Feng1,MO Ling4,MIAO Li-zhong4
(1.ShandongBinzhouAnimalScienceandVeterinaryMedicineAcademy,ShandongBinzhouResearch,DevelopmentandPromotionCenterforLivestockandPoultryPropolisVaccine,Binzhou,Shandong,256600,China; 2.RuralWorkDepartmentofBinzhouEconomicandTechnologicalDevelopmentZone,Binzhou,Shandong,256600,China; 3.YangxinAnimalScienceandVeterinaryMedicineBureau,Binzhou,Shandong,256600,China; 4.ShandongBinzhouAnimalScienceandVeterinaryMedicineAcademy,Binzhou,Shandong,256600,China)
In order to know the infection status of chicken Marek's disease virus,avian leukemia virus and reticuloendotheliosis virus in chicken farms of Lubei area,the PCR detection was carried out in 21 cases of inspection from various chicken flocks.The results showed that the positive rate of MDV was 28.5%,23.8% of ALV-J and 14.3% of REV.Dual infections were accounted for 28.6% positive.Infection of three kinds of tumor viruses in hens and local chicken breeds was becoming more and more serious,meanwhile,mixed infection of two viruses was more common.Obviously,chickens in related areas have to be immunized for MDV,and carrying out regular testing for ALV-J and REV.The breeding environment should be controlled well to avoid infections of these three tumor viruses and the incidence of secondary infections.
Chicken Marek's disease virus; Avian leukemia virus; Reticuloendotheliosis virus; PCR detection
2017-05-09
山东省自然科学基金项目(ZR2016CB32);山东省现代农业产业技术体系家禽创新团队滨州试验站(SDAIT-11-16)
徐晴晴(1986-),女,山东淄博人,助理研究员,主要从事禽免疫抑制病毒分子生物学研究。△同等贡献作者,*
S852.659.3
B
1007-5038(2017)12-0123-05

