奶牛乳房炎常见致病菌多重PCR检测方法的建立
刁巧虹,卞国志,王 娟,罗蔼剑,张 莹,高潇祎,贾 坤,孙凌霜*,袁建丰*
(1.华南农业大学兽医学院,广东广州 510642;2.广东海大畜牧兽医研究院有限公司,广东广州 511400;3.广东海大集团股份有限公司,广东广州 511400;4.广东省兽医临床重大疾病综合防控重点实验室,广东广州 5106421)
奶牛乳房炎常见致病菌多重PCR检测方法的建立
刁巧虹1,2,4,卞国志1,3,王 娟2,3,罗蔼剑1,4,张 莹1,4,高潇祎1,贾 坤1,4,孙凌霜1,4*,袁建丰2,3*
(1.华南农业大学兽医学院,广东广州 510642;2.广东海大畜牧兽医研究院有限公司,广东广州 511400;3.广东海大集团股份有限公司,广东广州 511400;4.广东省兽医临床重大疾病综合防控重点实验室,广东广州 5106421)
为建立同时快速检测奶牛奶样中无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌的方法,根据无乳链球菌sip基因、停乳链球菌isp基因、乳房链球菌pauA基因和金黄色葡萄球菌nuc基因各设计1对特异性引物,建立多重PCR检测体系。结果显示,该检测方法具有高特异性,无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌敏感性分别为105、104、105、105CFU/mL。对临床采集的460份奶样检测结果表明,建立的多重PCR体系可以用于临床上无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌感染引起的奶牛乳房炎的检测。
乳房炎;多重PCR;无乳链球菌;停乳链球菌;乳房链球菌;金黄色葡萄球菌
奶牛乳房炎是危害奶牛生产的重要临床疾病之一,是世界奶牛业的主要危害因素之一,据报道我国奶牛乳房炎的发病率为41%~60%[1-2],不仅引起产奶量的减少及其品质下降,造成严重的经济损失,某些病原体还可引起人类感染[3-4]。奶牛乳房炎常呈混合性感染,无乳链球菌(Streptococcusagalactiae)、金黄色葡萄球菌(Staphylococcusaureus)、乳房链球菌(Streptococcusuberis)和停乳链球菌(Streptococcusdysgalactiae)是最常见的病原[5]。目前,对于动物细菌的检测主要还是依靠传统细菌培养、生化鉴定等方法,其操作繁琐、耗时长、敏感性较低,不能适应快速检测的需要[6]。因此,建立一种同时检测多种病原的快速检测技术体系,对奶牛乳房炎的定期检测、混合感染和及时诊断和防治有重要意义。
普通PCR、实时荧光定量PCR、环介导等温扩增(LAMP)、基因芯片、凝集法等均有应用于细菌检测领域。奶牛乳房炎经常出现多种病原混合感染的情况,以上的方法检测通量均不高,采用多重PCR,可以实现一次快速检测多种病原菌,尤其适用于乳房炎的检测。本研究建立无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌的多重PCR检测体系,为奶牛乳房炎的快速诊断提供技术方法。
1 材料与方法
1.1 材料
1.1.1 菌株 无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌、大肠埃希菌(Escherichiacoli)、肺炎链球菌(Streptococcuspneumoniae)、蜡样芽胞杆菌(Bacilluscereus)和沙门菌(Salmonella)为本实验室分离保存菌株。
1.1.2 主要试剂 PCR及连接转化相关制剂为TAKARA产品;大豆胰蛋白胨琼脂培养基(TSA)、大豆胰蛋白胨培养基(TSB)为广东环凯微生物科技有限公司产品;金黄色葡萄球菌显色培养基、革兰染色液为青岛海博生物公司产品;胎牛血清(FBS)为Hyclone公司产品;胶回收试剂盒为Omega产品;快速质粒小提试剂盒为天根生化科技(北京)有限公司产品;细菌基因组DNA小量试剂盒为AxyPrep产品;其他试剂均为国产分析纯或试剂纯。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank公布的无乳链球菌表面免疫相关蛋白(surface immunogenic proteins,sip)基因(HQ878436),停乳链球菌免疫分泌蛋白(immunogenic secreted protein,isp)基因(CP002215),乳房链球菌纤溶酶原激活物A(plasminogen activactor A,pauA)基因(KT006567.1),金黄色葡萄球菌菌耐热核酸酶(thermonuclease,nuc)基因(DQ399678),各设计了1对特异性引物(表1),由英潍捷基(上海)贸易有限公司合成。
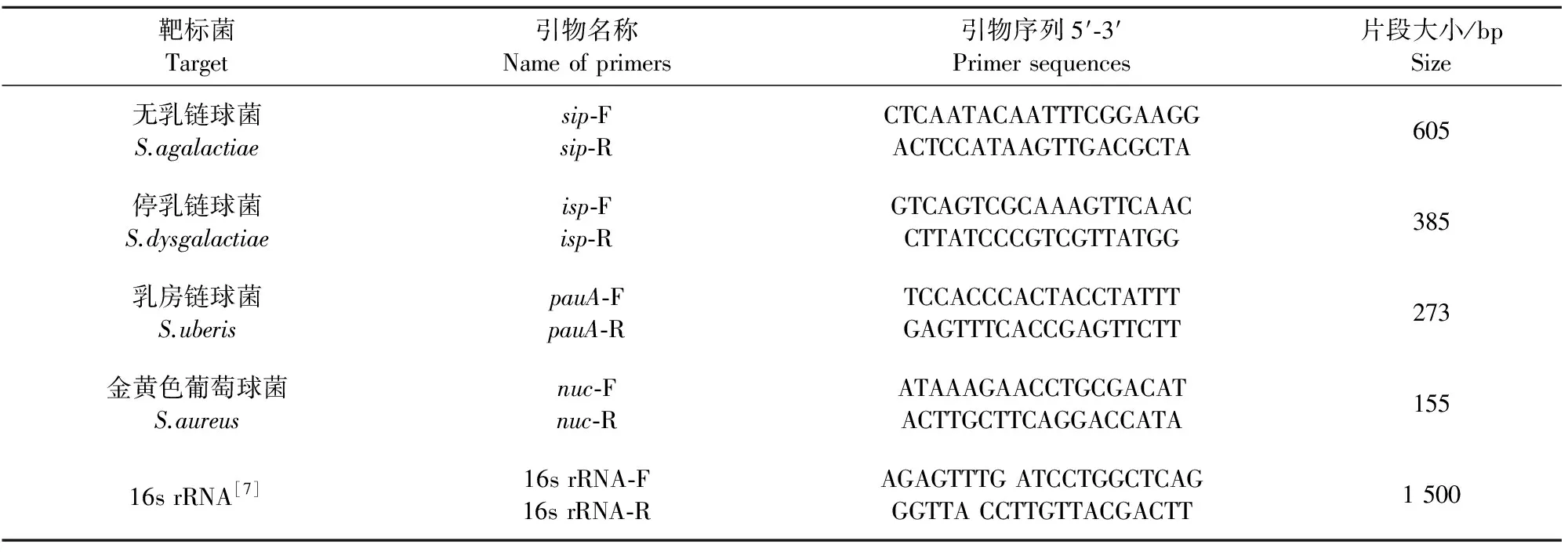
表1 引物名称及其序列
1.2.2 模板DNA制备 按照AxyPrep细菌基因组DNA小量试剂盒说明书操作,提取细菌DNA模板,置-20℃保存。
1.2.3 pMD-18T重组载体的构建 分别通过GenBank中无乳链球菌sip基因、停乳链球菌免疫分泌蛋白isp基因、乳房链球菌pauA基因、金黄色葡萄球菌nuc基因的标准参考序列,人工合成相应基因的模板序列,连接到pMD-18T载体,构建4种含有目的基因的重组载体。
1.2.4 PCR条件优化 以无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌4种菌的基因组DNA为多重PCR反应模板,先用单重PCR方法对退火温度进行优化。根据单重PCR优化结果,再对多重PCR退火温度、引物浓度、Taq酶、MgCl2浓度、dNTP浓度等进行优化,确定最佳反应条件。
1.2.5 特异性试验 以无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌、大肠埃希菌、沙门菌、蜡样芽胞杆菌和肺炎链球菌基因组DNA为模板,进行PCR扩增,以检测其特异性。
1.2.6 敏感性试验 无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌分别以pMD-18T-sip、pMD-18T-isp、pMD-18T-pauA和pMD-18T-nuc4种重组载分别做10倍梯度稀释,取108、107、106、105、104、103、102CFU/mL 7个浓度梯度分别为模板,进行PCR扩增反应,检测其敏感性。
1.2.7 临床奶样的检测 用多重PCR方法对广东地区10个规模化奶牛场随机采集的460份临床奶牛奶样进行检测,同时用传统细菌分离结合16S rRNA测序鉴定法进行复检。
2 结果
2.1 pMD-18T重组载体的构建
对扩增sip基因、isp基因、pauA基因和nuc基因进行连接转化,构建的重组载体测序结果为,经比对pMD-18T-sip与sip基因序列同源性为99%,pMD-18T-isp与isp基因序列同源性为99%,pMD-18T-pauA与pauA基因序列同源性为100%,pMD-18T-nuc与nuc基因序列同源性为99%。说明成功构建了这4种基因的重组载体。
2.2 多重PCR优化结果
通过固定无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌4种菌的基因组DNA模板浓度,在单重PCR的基础上,对多重PCR退火温度、引物浓度、Taq酶、MgCl2浓度、dNTP浓度等进行优化,最终确定多重PCR最佳反应条件(50 μL)为:Taq酶 2.50 U,10×PCR buffer 5 μL, 1.5 mmol/L MgCl2, 200 μmol/L dNTP,无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌引物浓度分别为0.05、0.06、0.16、0.16 μmol/L,50 ng/μL DNA模板,双蒸水补足50 μL;反应程序为:95℃ 5 min;95℃ 30 s,50℃ 1 min,72℃ 1min 30 s,35个循环;72℃ 10 min。
2.3 特异性试验结果
根据优化结果,以无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌、大肠埃希菌、沙门菌、蜡样芽胞杆菌和肺炎链球菌基因组DNA为模板,进行多重PCR扩增,无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌为模板均能扩增出相应605、385、273、155 bp的目的条带。而对大肠埃希菌、沙门菌、肺炎链球菌和蜡样芽胞杆菌的扩增结果均为阴性,特异性好(图1)。
2.4 敏感性试验结果
无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌分别以pMD-18T-sip、pMD-18T-isp、pMD-18T-pauA和pMD-18T-nuc4种重组载分别用双蒸水做梯度稀释,取108、107、106、105、104、103、102CFU/mL 7个浓度梯度分别为模板,设置pMD-18T-sip、pMD-18T-isp、pMD-18T-pauA和pMD-18T-nuc4种重组载体为阳性对照,设置双蒸水为阴性对照。分别进行PCR扩增反应。结果显示,无乳链球菌多重PCR的检测限为105CFU/mL(图2);停乳链球菌多重PCR的检测限为104CFU/mL(图3);乳房链球菌多重PCR的检测限为105CFU/mL(图4);金黄色葡萄球菌多重PCR的检测限为105CFU/mL(图5)。
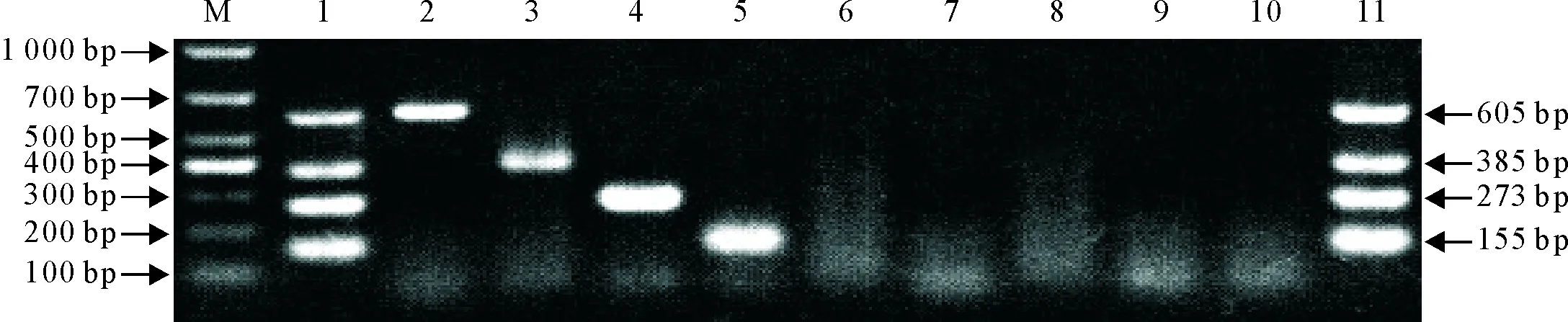
M.DNA标准DL 1 000 ; 1.无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌; 2.无乳链球菌; 3.停乳链球菌; 4.乳房链球菌;5.金黄色葡萄球菌; 6.沙门菌; 7.大肠埃希菌; 8.蜡样芽胞杆菌; 9.肺炎链球菌; 10.阴性对照; 11.阳性对照
M.DNA Marker DL 1 000 ; 1.S.agalactiae,S.dysgalactiae,S.uberisandS.aureus; 2.S.agalactiae; 3.S.dysgalactiae; 4.S.uberis; 5.S.aureus;6.Salmonella; 7.E.coli; 8.B.cereus; 9.S.pneumoniae; 10.Negative control; 11.Positive control
图1多重PCR特异性试验
Fig.1 Specificity test of multiplex PCR

M.DNA标准DL 1 000; 1~7.108 CFU/mL~102 CFU/mL; 8.阴性对照; 9.阳性对照 M.DNA Marker DL 1 000 ; 1-7.108 CFU/mL-102 CFU/mL; 8.Negative control; 9.Positive control

M.DNA标准DL 1 000; 1~7.108 CFU/mL~102 CFU/mL; 8.阴性对照; 9.阳性对照 M.DNA Marker DL 1 000 ; 1-7.108 CFU/mL-102 CFU/mL; 8.Negative control; 9.Positive control
2.5 临床样品检测结果
采用多重PCR方法对广东地区10个规模化奶牛场随机采集460份临床奶样进行检测,共检测出无乳链球菌22份(4.78%),停乳链球菌10份(2.17%),乳房链球菌40份(8.70%),金黄色葡萄球菌29份(6.30%),其中含有2种及以上目标菌的奶样有9份(表2)。与传统细菌分离结合16S rRNA测序鉴定法相比较,多重PCR的检出率高于传统细菌分离方法,共有59份结果不同,符合率为87.17%。

M.DNA标准DL 1 000; 1~7.108 CFU/mL~102 CFU/mL; 8.阴性对照; 9.阳性对照 M.DNA Marker DL 1 000 ; 1-7.108 CFU/mL-102 CFU/mL; 8.Negative control; 9.Positive control

细菌Bacteria无乳链球菌S.agalactiae停乳链球菌S.dysgalactiae乳房链球菌S.uberis金黄色葡萄球菌S.aureus阳性奶样总数Totalpositivecase阳性奶样/总数(阳性率)Positivecase/Total(Positiverate)22/460(4.78%)10/460(2.17%)40/460(8.70%)29/460(6.30%)91/460(19.78%)
3 讨论
奶牛乳房炎是危害奶牛业最常见的疾病之一,严重影响奶牛业健康稳定发展。建立简单、快速的乳房炎常见致病菌的诊断方法,对加强疾病的防治和减少抗生素的使用有重要的意义[8]。多重PCR方法的优势在可以同时对多种病原进行检测,在缩短检测周期的同时节约了检测材料[9]。奶牛乳房炎致病菌繁多,经常出现混合感染,无乳链球菌、金黄色葡萄球菌、乳房链球菌和停乳链球菌是最常见的病原,特别适合建立多重PCR检测体系。本研究建立多重PCR所选取的无乳链球菌sip[10]基因,停乳链球菌isp[11]基因,乳房链球菌pauA[12-13]基因,金黄色葡萄球菌nuc[14-15]基因都具有高度保守又广泛存在的特点。结果显示,这4个基因具有良好的特异性;体系敏感性在104~105CFU/mL之间,与单重PCR相比下降了102~103倍,这可能与引物间的相互作用有关。通过对460份临床奶样进行检测结果表明,该方法能够准确的检测出临床奶样中的无乳链球菌、金黄色葡萄球菌、乳房链球菌和停乳链球菌,对临床奶样检测的结果与传统细菌分离鉴定法相比,多重PCR方法对4种菌有着更高检出率,检测结果符合率为87.17%,这与传统细菌分离鉴定的灵敏度较低有一定的关系[16],表明多重PCR法与传统分离法相比拥有更高的灵敏度,能够满足临床上这4种菌的单一或者混合感染的快速检测。
综上所述,本试验建立的多重PCR方法具有快速、简便、特异性强、灵敏度高的特征,可有效用于临床上奶牛乳房炎中无乳链球菌、停乳链球菌、乳房链球菌和金黄色葡萄球菌的检测,适用于大量样本的流行病学调查。
[1] 陈亚明.奶牛乳房炎致病菌分离鉴定及快速诊断试剂盒的研发与应用[D].广西南宁:广西大学,2014.
[2] 栾廷波,李蓓蓓.石河子地区规模化牛场奶牛隐性乳房炎的检测与流行特点分析[J].中国奶牛.2015(9):55-58,59.
[3] 黄冬青.浅谈奶牛乳房炎发病机理及对奶牛生产的影响[C].中国河北石家庄:今日畜牧兽医,2016.
[4] 万遂如.目前奶牛主要疫病流行状况与防控技术(上)[J].现代畜牧兽医,2015(5):53-56.
[5] Berg L,Nyman A,Aspán A,et al.Udder infections withStaphylococcusaureus,Streptococcusdysgalactiae,andStreptococcusuberisat calving in dairy herds with suboptimal udder health[J].J Dairy Sci,2016,99(3):2102-2117.
[6] Chandrashekhar K M,Isloor S,Veeresh B H,et al.Limit of detection of genomic DNA by conventional PCR for estimating the load ofStaphylococcusaureusandEscherichiacoliassociated with bovine mastitis[J].Folia Microbiol (Praha).2015,60(6):465-472.
[7] Edwards U,Rogall T,Blocker H,et al.Isolation and direct complete nucleotide determination of entire genes.Characterization of a gene coding for 16S ribosomal RNA[J].Nucleic Acids Res,1989,17(19):7843-7853.
[8] Detilleux J,Kastelic J P,Barkema H W.Mediation analysis to estimate direct and indirect milk losses due to clinical mastitis in dairy cattle[J].Prevent Vet Med,2015,118(4):449-456.
[9] 陈 诺,唐善虎,岑璐伽,等.多重PCR技术在食品微生物检测中的应用进展[J].中国畜牧兽医.2010,37(10):72-75.
[10] 高菊梅.宁夏地区牛源无乳链球菌主要毒力基因和耐药基因的检测与序列分析[D].宁夏银川:宁夏大学,2015.
[11] 李月颖,朱 松,剧慧栋,等.停乳链球菌ISP基因的克隆与表达及其免疫原性研究[J].河北师范大学学报:自然科学版,2015,39(2):158-164.
[12] Perrig M S,Ambroggio M B,Buzzola F R,et al.Genotyping and study of thepauAandsuagenes ofStreptococcusuberisisolates from bovine mastitis[J].Revista Argentina de Microbiología,2015,47(4):282-294.
[13] Mcvey D S,Shi J,Leigh J A,et al.Identification of multiple linear epitopes of the plasminogen activator A (pauA) ofStreptococcusuberiswith murine monoclonal antibodies[J].Vet Immunol Immunopathol,2005,104(3-4):155-162.
[14] 王 新,韦艺媛,张 静,等.乳房炎奶牛金黄色葡萄球菌毒素基因的检测及PFGE分型研究[J].畜牧兽医学报,2011(07):974-980.
[15] 胡 瑜.金黄色葡萄球菌耐热核酸酶的功能鉴定及表达调控[D].上海:上海交通大学,2013.
[16] 高 健,刘 海,周玉财,等.奶牛乳房炎病原菌的PCR诊断技术研究进展[J].中国奶牛,2013(4):31-33.
DevelopmentofaMultiplexPolymeraseChainReactionAssayforDetectionofCommonPathogensinCowMastitis
DIAO Qiao-hong1,2,4,BIAN Guo-zhi1,3,WANG Juan2,3,Luo Ai-jian1,4,ZHANG Ying1,4, GAO Xiao-yi1,JIA Kun1,4,SUN ling-shuang1,4,YUAN Jian-feng2,3
(1.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China; 2.GuangdongHaidInstituteofAnimalHusbandry&Veterinary,Guangzhou,Guangdong,511400,China; 3.GuangdongHaidGroupCo.,Limited,Guangzhou,Guangdong,511400,China;4.GuangdongProvincialKeyLaboratoryofPreventionandControlforSevereClinicalAnimalDiseases,Guangzhou,Guangdong,510642,China)
To establish a rapid assay forStreptococcusagalactiae,Streptococcusdysgalactiae,StreptococcusuberisandStaphylococcusaureusdetection,in this study,four pairs of specific primers were designed according to the sequences published in GenBank,by thesipgene ofStreptococcusagalactiae,ispofStreptococcusdysgalactiae,pauAofStreptococcusuberisandnucofStaphylococcusaureus.Development of the PCR assay for detection of these bacteria.The result showed that the assay had the advantages of high sensitivity and good specificity,the sensitivity ofS.agalactiae,S.dysgalactiae,S.dysgalactiae,S.uberisandS.aureuswere 105CFU/mL,104CFU/mL,105CFU/mL and 105CFU/mL,respectively.The performance of the multiplex PCR was evaluated by examining 460 clinical mastitis milk samples.The results showed that the multiplex PCR can be used for detection these four bacteria in milk samples.
Mastitis; multiplex PCR;Streptococcusagalactiae;Streptococcusdysgalactiae;Streptococcusuberis;Staphylococcusaureus
2017-04-10
广州市科技计划项目(201510010250);广东省科技计划项目(2014A020208052,2015B020203005,2015A020224039);广东省兽医临床重大疾病综合防控重点实验室项目(2013A061401013);广东省现代农业科技创新联盟建设项目(2016LM2150);广州市珠江科技新星专项(201610010073)
刁巧虹(1991-),女,硕士研究生,主要从事临床兽医学研究。*
S857.26
A
1007-5038(2017)12-0059-05

