2016年-2017年四川省部分地区猪繁殖与呼吸综合征病毒的分子流行病学调查
覃思楠,宝志鹏,阮文强,陈新诺,何 欢,岳 华,2,张 斌,2*
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.国家民族事务委员会青藏高原动物疫病防控创新团队,四川成都 610041;3.云南农业职业技术学院,云南昆明 650212)
2016年-2017年四川省部分地区猪繁殖与呼吸综合征病毒的分子流行病学调查
覃思楠1,宝志鹏3,阮文强1,陈新诺1,何 欢1,岳 华1,2,张 斌1,2*
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.国家民族事务委员会青藏高原动物疫病防控创新团队,四川成都 610041;3.云南农业职业技术学院,云南昆明 650212)
为了解近年来四川省猪繁殖与呼吸综合征病毒(PRRSV)流行毒株的遗传变异和分子流行病学情况,通过RT-PCR方法,对四川省各地疑似病料进行PRRSV检测,确定获得阳性样本基因型和对GP5基因遗传进化进行分析。结果显示,149份疑似病料中经ORF7片段检测33份为阳性,阳性率为22.15%(95% CI:15.8%~29.7%);通过对NSP2片段的检测,其中有9份为PRRSV高致病性毒株(HP-PRRSV),5份为PRRSV经典毒株,8份为PRRSV NADC-30样毒株;通过对GP5基因进行扩增和序列测定,得到11株部分的GP5基因序列数据,所获序列与已报道对应核苷酸序列同源性为60.4%~99.8%,推导的氨基酸序列的同源性为74.3%~100%。结果表明,近两年四川地区PRRSV主要流行毒株为HP-PRRSV,同时新的变异毒株NADC30的流行呈上升趋势。四川地区乃至国内各地区的PRRSV基因在逐渐变异,且毒株的流行趋势在转变,提示应加强对PRRSV流行及变异的监测。
猪繁殖与呼吸综合征病毒;GP5;分子流行病学
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)又称为“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种猪的高度接触性传染病。临床表现主要为母猪流产、死胎、弱胎、木乃伊胎以及生长育肥各阶段猪呼吸道症状[1-3]。1987年该病首次在美国报道,随后在全世界流行,已给全球养猪业造成了巨大的经济损失。PRRSV为单股正链RNA病毒,含9个开放阅读框(ORF),分别编码2个非结构蛋白和7个结构蛋白。ORF7基因编码保守结构蛋白,常常作为检测的分子靶点;ORF5基因编码GP5结构蛋白,GP5蛋白是主要的囊膜糖基化蛋白,在抗病毒感染上起着重要的作用,是诱导机体产生中和抗体的主要抗原[4],GP5蛋白是PRRSV中变异最为显著的结构蛋白,现在许多学者都把ORFS基因的变异情况作为一个分析病毒的遗传演化规律的重要标志[5];Nsp2基因编码的非结构蛋白是PRRSV中变异最大的区域,具有调节其他编码非结构蛋白区域剪切的活性,是病毒复制的关键[6]。2006年,因在Nsp2上缺失30个氨基酸而变异的HP-PRRSV毒株在我国流行。据报道我国2013年四川地区也开始暴发了以HP-PRRSV毒株为主的PRRS,造成严重的经济损失[7]。近年来,PRRSV新变异毒株不断出现,尤其是传入我国的NADC-30样PRRSV新毒株,已经在我国河南、河北、广东、湖北和山西等地区流行[8-9]。本研究主要通过采集2016年-2017年四川省部分地区疑似PRRSV感染保育猪的肺、脾、淋巴结和血清等临床样本,利用RT-PCR方法研究四川地区PRRSV流行株GP5基因变异情况和发展趋势,对四川地区PRRSV进行分子流行病学调查,为更好地控制该病提供科学依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 Trizol试剂、氯仿、异丙醇、750 mL/LDEPC水-乙醇、ddH2O均由本实验室提供;反转录试剂盒、pMD19-T Vector、MarkerⅡ为宝生物工程(大连)有限公司产品;QuickTaqHS DyeMix为东洋纺(上海)生物科技有限公司产品;PCR产物纯化试剂和胶回收试剂盒为OMEGA公司产品;大肠埃希菌DH5α购自北京天根生化科技有限公司;高速离心机5804购自Eppendor公司;普通PCR仪、核酸蛋白电泳仪、凝胶成像系统Versa Doc 2 000均购自Bio-Rad公司。
1.1.2 引物 参照文献[9]中引物序列合成针对ORF7基因的特异性引物,参考文献[11]中引物序列合成针对GP5基因的特异性引物,应用Primer 5.0软件设计针对PRRSV的Nsp2基因使用可以区分经典株、高致病性变异株和NADC30样毒株的特异性引物,所有引物均由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 病料采集 采集四川省绵阳、邛崃、崇州、北川、大邑等地不同地区31个猪场共141份疑似PRRSV阳性患病保育猪的血清、肺脏、脾脏、淋巴结等组织器官。置于-80℃冰箱保存。
1.2.2 RNA的提取 将采集的少量猪肺脏、脾脏、淋巴结剪碎和血清取400 μL加入1.5 mL管中,加700 μL Trizol剧烈混匀,室温静止5 min。加入200 μL氯仿,颠倒混合,在涡旋仪上剧烈混匀,使液体呈乳白色(无分层现象)室温静止5 min,放到离心机以1 200 r/min 4℃离心15 min。将离心后的上清液移至新EP管中加入等体积(400 μL)异丙醇,上下来回颠倒,室温静止10 min,放到离心机以1 200 r/min 4℃离心15 min。倒掉上清液,加入1 mL 750 mL/L的DEPC水乙醇,洗涤RNA沉淀及壁管,弹起沉淀物再涡旋,放到离心机以1 200 r/min 4℃离心10 min。弃上清液,对EP管进行干燥。最后用15 μL~20 μL DEPC水将RNA溶解,置-20℃保存。
1.2.3 cDNA的合成 以20 μL体系反转录:RNA模板4 μL,5×Prime Script buffer 4 μL,Prime ScriptRT Enzyme Mix 1 μL,Random 6 mers 2 μL,RNase free dH2O 9 μL。反应条件为:37℃ 15 min;85℃ 15 s,16℃ 10 min得到的cDNA用于PCR扩增。转录产物于-20℃保存。
1.2.4 阳性病料的筛选 以cDNA为模板,用PRRSV的保守ORF7基因序列设计的检测引物(表3)对样本进行PCR扩增。反应体系10 μL:模板cDNA 1 μL,QuickTaqHS Dye Mix 5 μL,上、下游引物各 0.5 μL,ddH2O 3 μL。ORF7 F/R引物反应条件:94℃ 4 min;94℃ 30 s,56℃ 30 s,68℃ 40 s,35个循环;72℃延伸8 min。PCR产物用15 g/L琼脂糖凝胶电泳进行检测,筛选出阳性样本。
1.2.5 Nsp2基因和GP5基因的PCR扩增与克隆 利用Nsp2引物和GP5引物分别对PRRSV的阳性样本的cDNA进行PCR扩增,PCR按25 μL反应体系:模板cDNA 2 μL,QuickTaqHS DyeMix 12.5 μL,上下游引物各1 μL,ddH2O 8.5 μL。Nsp2 F/R引物反应条件: 94℃ 2 min;94℃ 30 s,58℃ 30 s,68℃ 1 min,共35个循环;72℃ 8 min。GP5 F/R引物反应条件:94℃ 2 min;94℃ 30 s,56℃ 30 s,68℃ 1 min ,共35个循环;72℃延伸8 min。得到的PCR产物用15 g/L琼脂糖凝胶电泳进行检测,再一次筛选阳性样本,根据用Nsp2引物扩增的PCR产物跑的电泳条带区分经典毒株、变异株及NADC30样毒株。并将这两种引物扩增的阳性样本,PCR产物纯化试剂盒或胶回收试剂盒切胶回收纯化后与pMD19-T 载体连接,转化大肠埃希菌DH5α感受态细胞,用PCR方法鉴定重组质粒,将阳性质粒的菌液送上海生工生物工程技术服务有限公司测序。
1.2.6 GP5基因遗传变异分析 应用DNA Star 7.1中的Meg Align对不同毒株的GP5基因进行序列比对和同源性分析,并用MEGA 5.2绘制出系统发育进化树。
2 结果
2.1 ORF7基因扩增结果
对2016年-2017年从四川各地采集的149份PRRSV疑似病料提取RNA,利用RT-PCR扩增PRRSV的ORF7基因,结果获得与预期片段大小相等的特异性片段,ORF7片段大小为561 bp,检出阳性样本33份,阳性率为22.15%(95% CI:15.8%~29.7%)。
2.2 Nsp2基因的检出结果
对33份阳性样本的Nsp2基因进行RT-PCR扩增,结果获得5份经典毒株PRRSV Nsp2片段大小为887 bp(图1),检出率为15.2%(95% CI:5.1%~31.9%);9份高致病性变异株PRRSV Nsp2片段大小为797 bp(图1),检出率为27.3%(95% CI:13.3%~45.5%);8份NADC30样毒株PRRSV Nsp2片段大小为493 bp(图1),检出率为24.2%(95% CI:11.1%~42.3%)。
2.3 GP5基因序列的扩增和测定
通过对33份阳性样本的GP5基因进行RT-PCR扩增及序列的测定,结果获得11份与目的片段大小相同的特异性片段,GP5片段大小为864 bp。
2.4 GP5基因结果分析
获得的11株PRRSV GP5基因(GenBank号:KY806209-KY806219)与NCBI基因库中参考序列对应核苷酸序列同源性为60.4%~99.8%之间,氨基酸序列同源性为74.3%~100%之间。与PRRSV美洲型代表毒株的核苷酸序列同源性62.4%~99.4%,氨基酸序列同源性为77.3%~100%,与中国经典毒株CH-1a的核苷酸序列同源性65.3%~95.6%,氨基酸序列同源性为80.2%~97.6%。与高致病性毒株PRRSV JAX1美洲毒株和NADC30的核苷酸序列同源性分别为67.5%~99.0%和61.9%~95.7%,氨基酸序列同源性分别为81.6%~99.3%和76.4%~98.3%。通过用MEGA 5.2软件构建所得毒株与参考毒株的核苷酸系统进化树(图3),得到3株HP-PRRSV毒株,3株NADC30样毒株,5株经典毒株。亚群Ⅰ中的试验毒株各为一小支,并处在变异毒株JXA1和中国经典CH-1a毒株之间,可看出这3个毒株是由中国内地的经典毒株向变异毒株转变的。处于亚群Ⅱ里的2个试验毒株聚为一支,与NADC30样毒株距离较近,有一个毒株与北美毒株HNyc15为一支,与NADC30样毒株相比有一定程度的变异。在亚群Ⅲ中4个试验毒株聚为一支,与北美经典毒株VR2332存在一定差异。

M.DNA标准DL 2 000;N.阴性对照;1~10.样本 M.DNA Marker DL 2 000;N.Negative control;1-10.Samples
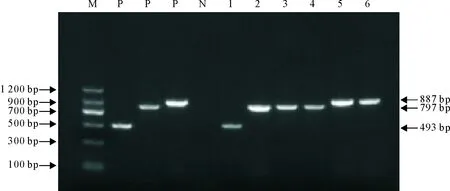
M.DNA标准DL 2 000;P.阳性对照;N.阴性对照;1~6.样本 M.DNA Marker DL 2 000;P.Positive control;N.Negative control;1-6.Samples
3 讨论
20世纪80年代末PRRS首次在中国被发现,是严重危害养猪业的最重要传染病之一。由于该病毒具有遗传多样性,导致了造成全球猪养殖大国的经济损失[12]。本研究针对2016年-2017年四川部分地区疑似PRRSV感染病料,通过RT-PCR进行ORF7、Nsp2和GP5基因的检测及对GP5基因序列的遗传进化分析。经RT-PCR对ORF7基因的检测得到33份阳性样本;对Nsp2基因的检测得到21份,其余12份阳性样本未检出,分析12份样本的Nsp2基因可能发生了变异,用特异性引物未能检出;对GP5基因的检测与序列测定,获得11株病毒序列,说明四川部分地区的PRRSV病毒变异性较大。
研究表明,Nsp2为PRRSV基因组中变异最大的非结构蛋白,Nsp2的变异主要表现为核苷酸的缺失和插入。Shen S[13]于2000年首次报道与VR-2332毒株相比,PRRSV北美洲型SP株813~814处插入了36个氨基酸。Choi H W等[12]研究韩国PRRSV分离株NSP2存在392和393个核苷酸的缺失。常用Nsp2作为监测PRRSV变异的独特标记,用于对PRRSV进行分子流行病学分析[14]。由Nsp2基因的检测可得知,四川部分地区流行的PRRSV仍以HP-PRRSV为主,经典毒株同时存在,而新发现的NADC30变异毒株的流行呈上升趋势,这些新毒株的流行很有可能与引种有关[15-16],但这还需进一步证实。

图3 基于GP5基因推导的核苷酸序列的遗传进化树
近年来,全球依据PRRSV的抗原特性将其分为2种基因型,分别是以VR2332毒株为代表的美洲型和以LV毒株为代表的欧洲型。ORF5基因编码的GP5结构蛋白在PRRSV中突变率最大,GP5蛋白不仅具有很强的免疫原性,能诱导机体产生主要抗原,GP5基因已成为分析PRRRSV遗传变异情况的靶基因。有研究表明四川地区的PRRSV流行毒株在GP5基因上的变异区域较大[16],GP5蛋白上的氨基酸易变异,使病毒逃避机体的体液免疫。通过分析GP5基因序列,11株PRRSV GP5基因与国内外参考序列对应核苷酸序列同源性为60.4%~99.8%之间,推导氨基酸序列同源性74.3%~100%之间,且所获得的PRRSV毒株均属于美洲型毒株。这表明四川部分地区PRRSV流行毒株与标准毒株在GP5基因区域的变异比较大。在GP5基因的进化树中,有3株位于基因进化树中亚群Ⅰ,与中国流行PRRSV变异毒株JXA1、WUH4高度同源,这些流行毒株很有可能由HP-PRRSV演化而来;有3株位于基因进化树中亚群Ⅱ,与美国毒株NADC30、HNyc15高度同源,这种新毒株的出现和流行与引种和跨地区传播有很大的联系;有5株在基因进化树中位于经典毒株VR2332、BJ4为代表的亚群Ⅲ中,提示四川省部分地区的经典PRRSV至今还在不断的进化重组中。近几年发现的新变异毒株NADC30,表明了PRRSV流行毒株的变异和多样性。由于PRRSV在不断的变异和进化,使得对其的临床诊断、实验室诊断和疫苗防控造成了一定的困难,应实时监测分析PRRSV的流行情况和遗传进化,为防控该病提供重要的参考依据。
[1] 李建玲,杨小亮.高致病性猪蓝耳病的研究进展[J].中国兽医杂志,2014,50(6):61-63.
[2] 张显浩,陈瑞爱,李 冰,等.2012年~2014年我国东南地区HP-PRRSV GP5基因的遗传进化与变异分析[J].中国预防兽医学报,2015,37(1):71-74.
[3] Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[4] Pirzadeh B,Dea S.Monoclonal antibodies to the ORF5 product of porcine reproductive and respirat-ory syndrome virus define linear neutralizing determinants.[J].1997,78(Pt 8)(8):1867-1873.
[5] An T Q,Zhou Y J,Liu G Q,et al.Genetic diversity and phylogenetic analysis of glycoprotein 5 of PRRSV isolates in mainland China from 1996 to 2006:coexistence of two NA-subgenotypes with great diversity.[J].Vet Microbiol,2007,123(1-3):43-52.
[6] Han J,Wang Y,Faaberg K S.Complete genome analysis of RFLP 184 isolates of porcine reproductive and respiratory syndrome virus[J].Virus Res,2006,122(1-2):175.
[7] 蔡雨函,杨 雪,徐志文,等.四川省猪繁殖与呼吸综合征病毒分子流行病学调查[J].中国兽医学报,2015,35(2):195-200.
[8] 杨汉春.2014年猪病流行情况与2015年流行趋势及防控对策[J].猪业科学,2015(2):38-40.
[9] Zhou F,Zhao J,Chen L,et al.Complete genome sequence of a novel porcine reproductive and respiratory syndrome virus that emerged in China[J].Genome Announcements,2015,3(4).e00702-15.
[10] Zhou L,Chen S,Zhang J,et al.Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China[J].Virus Res,2009,145(1):97-105.
[11] 周 峰,常洪涛,赵 军,等.2012年―2013年猪繁殖与呼吸综合征病毒河南流行株的分离鉴定及分子流行病 学调查[J].中国兽医学报,2014,34(9):1398-1404.
[12] Choi H W,Nam E,Lee Y J,et al.Genomic analysis and pathogenic characteristics of Type 2 porcine reproductive and respiratory syndrome virus nsp2 deletion strains isolated in Korea[J].Vet Microbiol,2014,170(3-4):232-245.
[13] Shen S,Kwang J,Liu W,et al.Determination of the complete nucleotide sequence of a vaccine strain of porcine reproductive and respiratory syndrome virus and identification of the Nsp2 gene with a unique insertion.[J].Arch Virol,2000,145(5):871-83.
[14] 韦祖樟,孙 志,袁世山.猪繁殖与呼吸综合症病毒分子生物学研究进展[J].微生物学通报,2008,35(3):408-413.
[15] Zhao K,Ye C,Chang X B,et al.Importation and recombination are responsible for the latest emergence of highly pathogenic PRRSV in Chian[J].J Virol,2015,89(20):10712-10718.
[16] Zhou L,Wang Z,Ding Y,et al.NADC30-like strain of porcine reproductive and respiratory syndrome virus,China[J].Emerg Infecti Dis,2015,21(12):2256.
MolecularEpidemiologicalInvestigationofPorcineReproductiveandRespiratorySyndromeVirusinSichuanProvincefrom2016to2017
QIN Si-nan1,BAO Zhi-peng3,RUAN Wen-qiang1,CHEN Xin-ruo1, HE Huan1,YUE Hua1,2,ZHANG Bin1,2
(1.CollegeofLifeScienceandTechnology,SuothwestMinzuUniversity,Chengdu,Sichuan,610041,China; 2.AnimalDiseasePreventionandControlInnovationTeamintheQinghaiTibetPlateauofStateEthnicAffairsCommission,Chengdu,Sichuan, 610041,China; 3.YunnanVocationalandTechnicalCollegeofAgriculture,Kunming,Yunnan,650212,China)
In order to investigate the genetic variation and molecular epidemics of porcine reproductive and respiratory syndrome virus (PRRSV) in Sichuan province during 2016 to 2017,149 PRRSV-suspected samples were collected from in different regions of Sichuan province and were detected by RT-PCR.The PRRSV-positive samples were used to identify the genotypes and genetic analysis of GP5 gene.The result showed that the 33 out of 149 samples was identified as the PRRSV targeting the ORF7 gene,and the positive rate was 22.15% (95% CI:15.8%-29.7%).By targeting NSP2 gene,the 33 PRRSV-positive samples was identified as 9 of highly pathogenic strains(HP-PRRSV),5 of PRRSV classical strains and 8 of PRRSV NADC-30 like strains.The partial of GP5 genes were amplified and sequenced from 11 samples.The nucleic acid / deduced amino acid sequences shared 60.4%-99.8%/74.3%-100% similarities to each other.The study indicated that HP-PRRSV was predominant genotype and the prevalence of novel NADC30 like strains was obviously increased in Sichuan regions for last two years.Therefore,the study suggested that the monitoring of prevalence and mutant in PRRSV should been further strengthened.
PRRSV; GP5; molecular epidemiology
2017-05-10
“十三五”国家重点研发计划项目(2016YFD0500705);西南民族大学研究生创新科研项目(CX2017SZ052)
覃思楠(1993-),女(布依族),贵州独山人,硕士研究生,主要从事动物病原分子生物学研究。*
S852.659.6
A
1007-5038(2017)12-0029-05

