绵羊痘病毒的检测与遗传进化分析
赵 琳,李 萌,罗 静,王承民,王玉田,赵宝华,何宏轩*
(1.河北师范大学,河北石家庄 050024;2.中国科学院动物研究所,北京 100101;3.北京畜牧总站,北京 100101)
绵羊痘病毒的检测与遗传进化分析
赵 琳1,2,李 萌2,罗 静2,王承民2,王玉田3,赵宝华1*,何宏轩2*
(1.河北师范大学,河北石家庄 050024;2.中国科学院动物研究所,北京 100101;3.北京畜牧总站,北京 100101)
羊痘是全球最严重的动物传染性痘病。近年来,羊痘病毒在非洲北部和中部、中东、亚洲大部分地区广泛流行,给养殖业带来巨大的经济损失。论文对4只疑似羊痘病毒感染绵羊进行诊断,通过临床观察,病理剖检,病理组织学观察,实验室检测,确定该病为绵羊痘,并对分离的病毒主要基因进行PCR扩增及遗传进化分析,发现此毒株属于亚洲系,且我国流行株基因比较稳定,变异不大。这不仅为绵羊痘病的诊断提供了技术手段,还丰富了我国羊痘病毒感染的流行病学资料,为进一步研究羊痘病毒的变异等提供数据支持。
羊痘;临床症状;病理组织学检查;PCR扩增;进化分析
羊痘病毒(Capripox virus,CaPV)属于痘病毒科(Poxviridae),羊痘病毒属[1]。羊痘是由羊痘病毒引起的一种高致病动物源性传染病,是所有动物痘病中最严重的一种,其发病率高达50%,病死率可达100%。临床上,羊痘包括山羊痘(Goat poxvirus,SPP)、绵羊痘(Sheep poxvirus,GTP)和牛结节性疹(Lumpy skin disease,LSDV)等几种类型,主要通过皮肤接触、呼吸道和蚊虫叮咬在牛、羊等动物之间传播[2],以发热、全身皮肤和内脏痘状病变及淋巴结肿大为特征[3],受感染的羊群极易流产,产奶量、体重、毛品质大大降低,给养殖业带来巨大的经济损失,严重影响国际贸易和养羊业的发展[4]。
羊痘最早报道于13世纪的英国,后来陆续在世界其他地区发现,现在主要分布在亚洲、非洲、欧洲部分地区和印度次大陆[5]。近年来,我国的西北、华南、华中等地羊痘分布广泛,且部分地区呈暴发性流行[6]。
羊痘的主要防控措施包括早期诊断、扑杀感染动物或与其接触紧密的动物、限制动物的迁移范围、检疫和消毒、疫苗免疫等。其中疫苗免疫是最有效控制羊痘传播的方法,相应的弱毒苗可以成功防控羊痘的大规模暴发[7]。目前由于缺乏免费的、持续的接种疫苗的措施,以及无效的流动限制,造成了羊痘传播难以控制[8]。
本研究通过对患病绵羊的临床症状、病理观察,分子生物学检测及进化分析一例绵羊痘暴发情况,不仅丰富我国羊痘病毒感染的流行病学资料,为羊痘病毒的变异等提供数据支持,同时为羊痘的诊断和防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品处理 通过对北京市畜牧总站提供的患病绵羊的临床观察,怀疑该患病绵羊为羊痘病毒感染。在生物安全柜中无菌采集病畜内脏,皮肤等病变明显部位。
1.2 方法
1.2.1 临床观察 通过兽医临床诊断对患病羊进行体温,呼吸,脉搏和临床症状进行观察,同时对患病绵羊进行剖检,观察其内脏器官的病理变化,并进行记录。
1.2.2 病理诊断 用100 mL/L福尔马林对患病绵羊的皮肤、胃、肺等组织进行固定,制作病理组织切片,进行观察。
1.2.3 分子生物学诊断 采集绵羊患病组织,用研磨器研磨,加入灭菌的磷酸缓冲盐溶液(phosphate-buffered saline,PBS)制成组织悬液,反复冻融2次~3次,取上清,使用北京科龙生物医学技术有限公司的病毒基因组提取试剂盒提取病毒的基因组DNA,提取步骤按照试剂盒说明书进行。参照文献[9]中羊痘病毒基因设计引物,由华大基因合成,进行特异性检测,10 g/L的琼脂糖凝胶电泳检测PCR产物,用紫外检测仪观察PCR扩增结果。引物序列如下:SPPV-F:5′-GCCAGGAACTTTATATTCG- ATG-3′;GTPV-F:5′-GATATAGAATAGGGC- TAGTTGCAG-3′; SPPV(GTPV)-R:5′-CATCAAAAATGACATCTACATATATAGC-3′。
PCR反应体系为50 μL,即2×Taqmix 25 μL,模板(病毒提取的基因)2 μL,引物F、R各1 μL,补超纯水至50 μL。反应条件为:95℃ 5 min;95℃ 30 s,63℃ 30 s,72℃,30 s,35个循环;72℃ 7 min。
1.2.4 遗传进化分析 选取羊痘病毒RNA聚合酶亚基(RNA polymerase subunit,RPO30)和G蛋白偶联趋化因子受体(G-protein-coupled receptors,GPCR)基因进行遗传进化分析,参照Chen[1]文献,设计特异性引物,由华大基因合成。引物序列如下:RPO30-F:5′-CTC TGT TCC AAA CTA AAT CAT-3′;RPO30-R:5′-TTT TTG TAT TAC CAA TTT CTG-3′;GPCR-F:5′-TTT ATC AGC ACT AGG TCA TTA TCT-3′; GPCR-R:5′-TAT CAC TCC CTT CCA TTT TTA T-3′。
PCR反应体系为50 μL,即2×Taqmix 25 μL,模板(病毒提取的基因)2 μL,引物F、R各1 μL,补超纯水至50 μL。反应条件为:95℃ 5 min;95℃ 30 s,53℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。
将扩增的RPO30、GPCR基因送华大基因公司测序,其他羊痘病毒的RPO30、GPCR基因序列通过GenBank获取,然后利用Clustal W比对这些序列,并通过MEGA 5程序以Hasegawa-Kishino-Yano和Tajima-Nei模型构建Maximum Likelihood进化树,进化树的拓扑结构以1 000的Bootstrap进行分析。
2 结果
2.1 临床症状的观察
通过临床症状观察,发现发病绵羊具有以下的共同临床特征:体温升高,脉搏和呼吸加速,精神萎靡,废食,喜卧。眼结膜潮红、肿胀、鼻液黏稠。部分病羊无毛或毛少的部位出现红色圆形斑点,有的已经变成黄豆或蚕豆大的丘疹,触感较硬,甚至结痂成黑色(图1A),或破溃脱痂,形成红色溃疡(图1B)。进一步对病死绵羊剖检观察,发现患病绵羊的主要病变集中于胃部和肺部。具体来说,胃浆膜上出现了大量的黄豆粒乃至扁豆大的白色结节,触感坚硬,突出表面(图1C)。肺部表面亦有多量灰白色豌豆大小的痘斑,突出表面,触感坚硬,同时肺部局部严重出血 (图1D)。其余部位,如心、肝、脾、肠等部位未见明显异常,以上病变均为绵羊痘的典型病理变化。
2.2 病理组织切片
根据临床症状及剖检变化,初步怀疑病、死绵羊源于羊痘病毒感染。为进一步验证我们的判断,我们取典型病变部位病健交界处组织,制作病理切片,通过HE染色,镜检,我们发现病死绵羊肺泡内多量炎性细胞渗出,肺泡壁明显增生,肺泡结构消失(图2A);肺出血、水肿(图2B);在皮下组织出现多量炎性细胞渗出、聚集,此外皮肤结节典型的组织病理变化(图2C)。
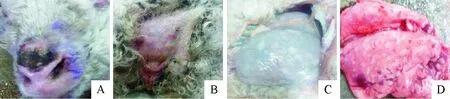
A.口鼻部位结痂;B.尾部痘疹、溃疡;C.胃部多量结节;D.肺结节及出血 A.Scab on mouth and nose; B.Pox on tail; C.Nodules in stomach; D.Nodules and hemorrhage in lungs
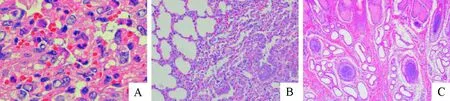
A.肺泡壁增生;B.肺水肿;C.皮肤结痂 A.Thickened alveolar walls; B.Pulmonary edema ; C.Scab on skin
2.3 羊痘病毒基因检测
根据剖检症状及组织病理学观察,初步诊断病、死绵羊为羊痘病毒感染。之后,采集典型病变部位病健交界处组织,提取病毒基因组DNA,进一步验证羊痘病毒。设计羊痘病毒特异性引物对样品进行分子生物学检测。结果显示(图3),绵羊的肺和皮肤组织的基因检测产生条带均为293 bp和133 bp,与预期条带大小一致[9],表明病羊确属羊痘病毒感染。

M.DNA 标准DL 2 000 ;1.肺;2.皮肤;3.胃
M.DNA Marker DL 2 000; 1.Lung; 2.Skin; 3.Stomach
图3绵羊痘病毒基因PCR扩增结果
Fig.3 PCR amplification of sheep poxvirus gene
2.4 羊痘相关基因的遗传进化分析
通过对病、死羊的临床观察、病理学检查和分子生物学检测,确诊该致病毒株为羊痘病毒。为了分析此株羊痘病毒的遗传进化关系,对羊痘病毒GPRC基因和RPO30基因进行扩增。Blast比对分析发现此毒株的GPCR基因和RPO30基因与已报道的羊痘病毒基因的同源性很高,分别为95%~99%和93%~96%。
基于此毒株的RPO30和GPCR基因序列使用MEGA5软件构建进化树,2个进化树均显示相同的拓扑架构,即羊痘病毒分为3个主要的分支,即LSDV、SPPV、GTPV。本研究分离到的毒株与SPPV属于同一个分支,并且都聚集在了亚洲系(图4和图5)。系统进化关系发现本研究分离毒株与中国其他地方报道的绵羊痘病毒进化关系较近,表明目前我国SPPV的流行株比较稳定,基因的变异不大。
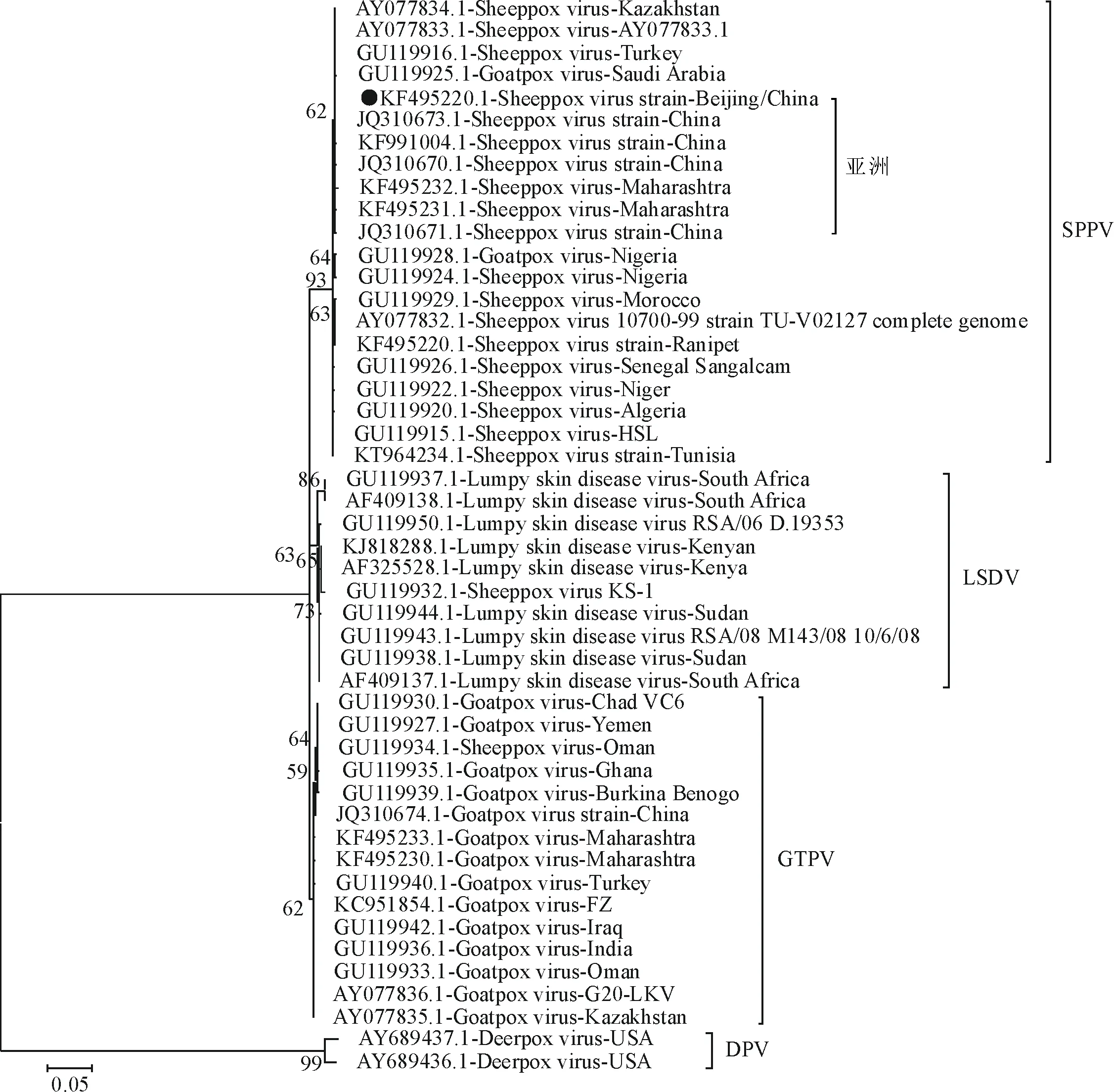
“●”为本试验分离毒株序列 “●”Represents the isolate of this study
“●”为本试验分离毒株序列 “●”Represents the isolate of this study
3 讨论
羊痘是一个古老的动物疫病,1879年Hanse在挪威首次报道羊痘病毒[10]。之后在一战期间,马其顿发生暴发性羊痘流行病,病死率高达15%[11]。目前这种疾病主要发生在亚洲、非洲和欧洲,但是在世界其他地方也有报道,流行较为严重。羊痘被世界动物卫生组织(OIE)列为法定报告的传染病,我国将其列为一类动物疫病,可造成羊群大批死亡[12]。
羊痘病毒传播快,病死率高,大多是通过呼吸道进入宿主,且大部分感染是由于直接或间接接触病畜。羊痘的传播方式还包括皮肤的摩擦和昆虫的接触,如厩螫蝇和舌蝇[13]。患病动物的主要临床症状一般为高热、厌食、呼吸困难、鼻腔和眼有黏液脓性排出物,偶发腹泻,在病畜的眼、鼻、嘴、耳和腹部也会有皮肤损伤和结痂等。所有品种、性别和年龄的羊群均可感染羊痘,羔羊较成龄羊敏感,病死率高,该病主要流行于冬末春初,寒冷、潮湿、饲料营养水平低下和管理不当等因素可促使发病或加重病症,并且对养殖经济效益及养殖者身体安全均有较大危害[14]。
羊痘病毒可分为绵羊痘病毒(SPPV)、山羊痘病毒(GTPV)和牛结节性疹病毒(LSDV),病毒的感染一般为特异性,但后来的研究发现它们之间也存在交叉感染,且它们的临床症状都是由发热发展为皮肤斑疹,使得初始诊断很容易,然而区分这3种病毒却很困难[15]。随着遗传学和分子生物学的发展,研究发现羊痘病毒的GPCR基因可以抵御宿主的炎症免疫反应[16-17],其RPO30基因和牛痘病毒E4L同源,可以编码一个30 ku的RNA聚合酶亚基,这两个基因都可以用来区分SPPV和GTPV和LSDV[18-19]。因此本研究通过对病畜中分离的病毒GPCR、RPO30这两个基因进行PCR扩增及遗传进化分析,确诊此毒株为SPPV,属于亚洲系。
绵羊痘是家畜痘病中最为严重的一种,该病经常引起绵羊的大批感染或死亡,病死率可达100%[20],不仅给养羊业带来巨大的经济损失,还严重阻碍了养羊业的发展。本研究凭借遗传分析对该病毒重要基因进行分子进化分析,发现该毒株属于SPPV,与中国报道的毒株关系较近,表明我国的SPPV的流行毒株未发生大的基因变异。这不仅为羊痘感染的流行病学积累资料,同时为进一步研究羊痘病毒的变异等提供数据支持。
[1] Zhou T,Jia H,Chen G,et al.Phylogenetic analysis of Chinese sheeppox and goatpox virus isolates[J].Virol J,2012,9(1):25-28.
[2] Tian H,Chen Y,Wu J,et al.Serodiagnosis of sheeppox and goatpox using an indirect ELISA based on synthetic peptide targeting for the major antigen P32[J].Virol J,2010,7(1):245-248.
[3] 施程洪,兰虎云,朱明旺,等.羊痘病毒的研究进展[J].中国兽药杂志,2014,48(9):61-65.
[4] Bandyopadhyay S K,Rao T V S.A comprehensive review of goat pox and sheep pox and their diagnosis[J].Animal Health Res Rev,2000,1(2):127-136.
[5] 史宗勇,史新涛,袁建琴,等.羊痘研究进展[J].中国畜牧兽医,2011,38(1)186-188.
[6] 颜新敏,吴国华,李 健,等.羊痘在中国的流行现状分析[J].中国农学通报,2010,26(24):6-9.
[7] Carn V.Control of capripoxvirus infections [J].Vaccine,1993,11(13):1275-1279.
[8] 刘 霞.羊痘防控难点及综合防治理念[J].中国畜牧兽医,2016,32(5):167.
[9] Venkatesan G,Balamurugan V,Bhanuprakash V.Multiplex PCR for simultaneous detection and differentiation of sheeppox,goatpox and orf viruses from clinical samples of sheep and goats[J].J Virol Meth,2014,195(1):1-8.
[10] Rafyi A,Ramyar H.Goat pox in Iran:serial passage in goats and the developing egg,and relationship with sheep pox[J].J Comp Pathol Therapeutics,1959,69(2):141-147.
[11] Blanc G,Melanidi C,Stylianopoulo M.Variola in goat in Greece[J].Cited Tropic Vet Bull,1929,17(2):129-140.
[12] 康文玉,徐自忠,高 洪,等.羊痘病毒[J].中国畜牧兽医,2004,31(12):33-36.
[13] Tuppurainen E S,Venter E H,Shisler J L,et al.Review:Capripoxvirus diseases:current status and opportunities for control[J].Transb Emerg Dis,2015,63(1).
[14] 杨 军.绵羊痘和山羊痘的防治[J].草业与畜牧,2012(8):54-55.
[15] Babiuk S,Bowden T R,Boule D B,et al.Capripoxviruses:an emerging worldwide threat to sheep,goats and cattle[J].Transb Emerg Dis,2008,55(7):263-272.
[16] Chensue S W.Molecular machinations:chemokine signals in host-pathogen interactions[J].Clin Microbiol Rev,2001,14(4):821-835.
[17] Seet B T,McFadden G.Viral chemokine-binding proteins[J].J Leukocyte Biol,2002,72(1):24-34.
[18] Ahn B Y,Gershon P D,Jones E V,et al.Identification of rpo30,a vaccinia virus RNA polymerase gene with structural similarity to a eucaryotic transcription elongation factor[J].Mol Cell Biol,1990,10(10):5433-5441.
[19] Tulman E R,Afonso C L,Lu Z,et al.The genomes of sheeppox and goatpox viruses[J].J Virol,2002,76(12):6054-6061.
[20] Bhanuprakash V,Indrani B K,Hosamani M,et al.The current status of sheep pox disease[J].Comp Immunol Microbiol Infect Dis,2006,29(1):27-60.
2017-02-27
中国科学院战略生物资源科技支撑体系运行专项(CZBZX-1)
赵 琳(1990-),女,河北保定人,硕士研究生,主要从事动物疫病研究。*
S852.654
A
1007-5038(2017)12-0009-06

