大鼠无创性肺功能检测指标的建立
刘俊丹,邱文才,李紫元,梁伟燊,唐陆平,何永明
(佛山科学技术学院兽医系,广东佛山 528000)
大鼠无创性肺功能检测指标的建立
刘俊丹△,邱文才△,李紫元,梁伟燊,唐陆平*,何永明*
(佛山科学技术学院兽医系,广东佛山 528000)
用双腔法测量大鼠肺功能的基础数据,为呼吸系统疾病相关的大鼠动物模型的肺功能检测提供参考。采用EMKA无创肺功能监测系统,对40只SD大鼠肺功能的17项指标(潮气量,TV;最大呼气量,EV;每分通气量,MV;吸气时间,Ti;呼气时间,Te;吸气流峰值,PIF;呼气流峰值,PEF;间歇时间,RT;呼吸频率,f;吸气末期停顿,EIP;呼气末期停顿,EEP;暂时停顿,Pau;支气管收缩程度,Penh;延迟时间,dT;特殊气道阻率,SRaw;特殊气道导率,SGaw;呼气中期流速,EF50)进行检测。TV值为1.01 mL (0.41~2.23),EV为1.01 mL (0.41~2.22),MV为226.02 mL (76~517),Ti为144.17 msec (108~204),Te为172.45 msec (118~265),PIF为11.05 mL/s (4.6~27.1),PEF为10.58 mL/s (3.4~23.9),RT为107.08 msec (76~188),f为196.88 bpm(141~255),EIP为2.72 msec (2~4),EEP为19.56 msec (13~32),Pau为0.63 (0.41~0.88),Penh为0.62 (0.33~1.06),dT为39.56 ms (4.56~96.38),SRaw为38.53 cm H2O.s (2.27~83),SGaw为0.078 l/cmH2O.s (0.01~0.37),EF50为9.5 mL/s (3~20)。试验同时发现,大鼠肺功能部分指标在不同时间段、不同性别差异具有显著意义。首次测得SD大鼠无创肺功能多项指标,对呼吸系统疾病的研究和相关标准的制定有着重要的参考价值。
无创式动物肺功能检测分析仪;气流信号;双腔法;肺功能
肺功能检查是呼吸系统疾病的必要检查之一,对于评估疾病的病情严重程度、诊断病变部位、评及对危重病人的监护等方面有重要的指导意义。随着呼吸生理及药理学研究的发展,在很多呼吸系统疾病的动物模型中动物肺功能的测定显得尤为重要。双腔法检测具有其独特的优势,具有无创伤的特点,且灵敏度强。而特殊气道阻率(SRaw)和特殊气道导率(SGaw)都是双腔法检测的一个特点,也是学术界广泛认可的无创肺功能检测指标。虽然双腔体积描记法在1979年已作为一种参考技术用于豚鼠肺功能的检测,但用于大鼠肺功能基础数据的检测未见报道。EMKA无创式动物肺功能检测分析仪是一种无创特殊气道阻力与气道高反应的检测分析系统,具有操作简便,数据稳定,敏感性高的特点[1]。EMKA能对多种动物进行检测,无需麻醉及气管插管,能够完全自动校准,且能够自动感应动物种类并调整软件分析参数设定,是清醒动物有约束类检测系统中唯一适合量筛选试验的仪器。本试验运用无创双腔法对正常大鼠的肺功能进行检测分析,为呼吸系统疾病的临床研究提供科学、合理的基础试验数据[2]。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 健康SPF级6周龄~7周龄SD大鼠80只,大鼠平均体重200 g±20 g,雌雄各半。SD大鼠由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。将雄大鼠(♂)编号为A1至A20,雌大鼠(♀)编号为B1至B20。大鼠适应环境1周后用于试验。试验期间正常饮食,室内温度保持在23℃~25℃、湿度60%左右,光照时间保持在12 h左右(9:00 am ~21:00 pm),笼具保持清洁卫生。
1.1.2 试验仪器 EMKA小动物无创式肺功能监测系统购于法国EMKA Technologies公司,小动物无创式肺功能监测系统包括EMKA 肺功能IOX数据采集软件操作系统(IOX v 2.9)、EMKA 肺功能数模转换器、前置放大器、传感器、通气泵等。
1.2 方法
1.2.1 试验环境模拟 正式试验前1周,每天对大鼠进行模拟试验训练,试验时保持安静,直至数据比较稳定和有规律后进行试验。
1.2.2 正式试验 试验开始第1天早晨6:00,按照标号顺序从A1到A20,将每只雄性大鼠放入双腔室内进行实际测量,系统自动生成数据并保存,每次测定时间约5 min。正式试验开始第1天中午12点,按照标号顺序从B1到B20,将每只雌性大鼠放入双腔室内进行实际测量,同上。第1天剩余的两个时间段,按照前两个步骤要求重复操作。第2天开始,调换A、B组的试验顺序,重复上面三个步骤操作。按照以上步骤重复以上操作2次,结束试验(表1)。

图1 EMKA肺功能分析系统连接示意图

时间Time6:0012:0018:0024:00-4d(simulation)♂♀-3d(simulation)♂♀-2d(simulation)♀♂-1d(simulation)♀♂0d(Rest)+1d(Start)♂♀♂♀+2d(Start)♀♂♀♂+3d(Start)♂♀♂♀+4d(Start)♀♂♀♂
连接好设备后,将大鼠引入双腔室,固定住大鼠并尽量减少应激,使其在双腔室内保持平静后开始进行数据采集。使用EMKA 肺功能IOX数据采集软件操作系统按规范程序进行测量。

2 结果
2.1 不同时间段大鼠肺功能指标检测结果
40只健康大鼠进行4天的肺功能测试,其数据采集采用EMKA肺功能分析系统(图2),将大鼠在四个时间段各项肺功能指标的变化情况进行整理(表2)。试验结果表明大鼠肺功能的各项指标都有不同程度的变化:TV与EV的18:00分别与6:00和12:00差异显著(P<0.05);MV和EF50的6:00与18:00差异显著(P<0.05);Ti的12:00与其他3个时间段差异显著(P<0.05);Te、PIF、PEF、RT、Penh、f、EIP的6:00与其他3个时间段的值差异具有显著性(P<0.05);EEP的6:00与12:00、24:00差异显著(P<0.05);SRaW的6:00与12:00、18:00差异显著(P<0.05);SGaW的12:00与24:00差异显著(P<0.05),而6:00与其他3个时间段具有显著性(P<0.05)差异;同时Pau与dT的4个时间段的值均无差异(P>0.05)。
2.2 不同性别大鼠肺功能指标检测结果
分别对雌、雄大鼠肺功能各项指标统计分析,发现除了TI、Pau、penh和EEP外,所有检测结果差异显著(P<0.05)。结果如表3所示。
2.3 大鼠肺功能正常参数值范围
通过上述指标测定结果,本试验计算了正常生理情况下,SD大鼠肺功能正常参考范围,如表4所示。
3 讨论
目前对大鼠肺功能检测的方法与指标不多,对动物存在较大损伤,且尚未有完整的SD大鼠肺功能正常参考值范围报道。比如安志远等在麻醉动物手术中切开气管后用AniRes2005动物肺功能分析系统检测了Wistar大鼠部分肺功能指标[3],如吸气阻力(Ri)、呼气阻力(Re)、最大通气量(MVV)等,试验设计简单,检测指标比较少,而且对动物造成伤害较大。本研究采用无创方法检测SD大鼠肺功能基础数据,对动物无伤害、且测量的数据比较全面,高达17项,能够为临床呼吸系统肺功能检测提供科学、合理的试验依据。

图2 EMKA肺功能分析系统数据采集图

项目Item时间Time6:0012:0018:0024:00TV1.16±0.23a1.04±0.20a0.85±0.24b1.00±0.33abEV1.16±0.29a1.04±0.20a0.85±0.23b1.00±0.03abMV254.90±66.64a208.32±49.88ab187.40±54.99b213.38±62.45abTi141.23±15.80b152.13±17.99a139.67±16.60b143.65±17.67bTe156.30±22.67b182.84±32.72a173.82±34.27a176.81±33.66aPIF13.11±3.15a10.58±2.45b9.56±2.65b10.95±30bPEF12.69±2.54a10.11±2.79b9.19±2.92b10.33±3.02bRT96.46±13.73b114.62±25.11a110.80±28.23a109.31±19.58af218.30±19.56a191.52±20.65b192.66±17.64b184.90±16.92bEIP2.40±0.62b2.87±0.53a2.85±0.49a2.75±0.55aEEP17.90±2.46b20.58±3.58a19.40±3.62ab20.36±4.07aPau0.65±0.05a0.62±0.09a0.62±0.10a0.64±0.08aPenh0.67±0.12a0.60±0.13b0.60±0.14b0.61±0.10bdT43.95±15.32a37.83±9.70a39.63±14.91a40.59±14.54aSRaw47.62±10.79a34.49±9.26b34.33±13.08b37.68±13.24abSGaw0.02±0.005c0.11±0.042a0.10±0.053b0.07±0.024bEF5010.82±2.00a9.02±2.40ab8.05±2.64b9.33±2.81ab
注:同一行小写字母不同,表示差异显著,P<0.05。
Note:Data with different small letters mean significant difference (P< 0.05).
大鼠肺功能TV表示平静呼吸时每次吸入或呼出的气体,EV是指一定时间内所能呼出的气体量,两者的生理学意义完全不同,但是本试验结果发现TV与EV的平均值相等都为1.01 mL,我们推测造成这种结果的原因是动物不能有意识的尽最大的力呼吸,因而仪器检测到的最大呼气量并不准确,导致两个数值的平均值一样,更深的其他原因还有待进一步研究。PEF是深吸气后用力快速呼气时的最高呼气流速。PIF指用力呼气和吸气的最大流速。f是指每分钟呼吸的次数。有报道指出[4-5],使用BUXCO@HOP系统检测雄性大鼠的f在100 bpm~250 bpm,MV在200 mL~300 mL,而本研究结果发现这几个指标分别为200.44 bpm±17.04 bpm、1.31 mL±0.40 mL、279.45 mL±73.36 mL,与报道相符合。同时,本研究结果发现用全身体积描计(WBP)测量的f、TV、MV、PIF与PEF的值(本文未列出)跟用双腔法测量的有很大差异。除此之外,我们的试验结果表明双腔法还可以测定SRaw、SGaw和EF50,而WBP则不能检测。这是由于WBP是整个动物的呼吸气流都一起检测,动物不受约束,而双腔法是动物的鼻部与胸部分开测量,因此对具体部位肺功能指标检测更精确。Penh是标准通气指标,该值用于小动物整个肺功能的总体筛选,可反映气道反应性[6]。 哮喘是一种气道梗阻常伴有不同程度的气道高反应性,Penh值越大,说明哮喘模型越成功,因此,在哮喘模型以及治疗时经常把Penh作为一个重要检测指标[7]。同时,哮喘模型还关注PEF、PIF、f和TV等指标的变化[8-9]。SRaw表示气道的反应性,适用于各种阻塞式通气功能障碍性疾病,阻力增大可表现为咳嗽、气短,在慢性支气管炎、肺气肿情况下阻力明显增加;EF50直接与气道阻力相关[10],有研究报道双腔体积描记法检测EF50是首次用于测量清醒小鼠气道反应性的有效方法,并常用于试验性哮喘的动物模型、肺切除后的动物模型、高氧动物模等[11]。以上结果提示我们采用双腔法检测肺功能指标在哮喘、咳嗽、支气管炎等呼吸道疾病的检测中更为准确、可靠。
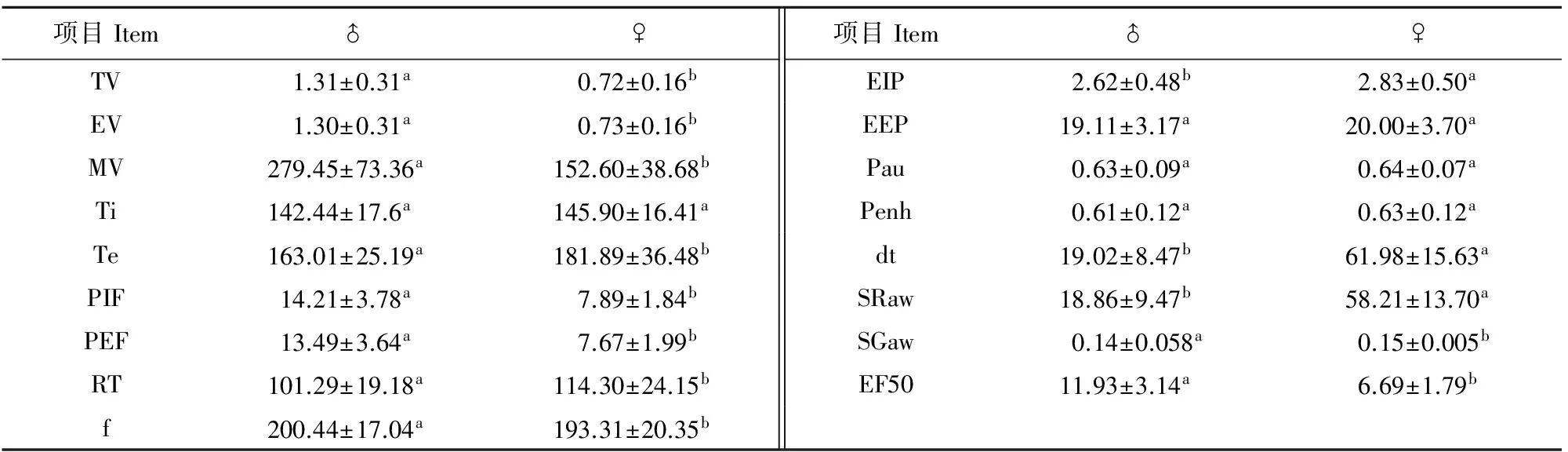
表3 大鼠肺功能不同性别检测结果
注:同行小写字母不同,表示差异显著,P<0.05。
Note:Data with different small letters mean significant difference (P< 0.05).

表4 大鼠肺功能参考值范围
昼夜节律对大鼠的能量代谢有一定的影响,在夜间休息状态下,其生理的能量代谢也会降低,早上生理代谢比较旺盛[12]。本研究发现大鼠TV、MV、PIF、PEF、f、Pau、Penh、SRaW和EF50的6:00的测量值均比其他三个时间段高,其中PIF、PEF、f、Penh、SRaw、SGaW和EF50明显高于24点,说明机体夜间代谢相对较低。同时,潮气量、最大呼吸量等都与呼吸习惯、肌体的新陈代谢有一定的关系[13]。本研究表明大鼠肺功能其他各个指标在不同的时间段都有显著性差异,说明在一天不同的时间段大鼠肺的生理功能是变化的,但试验发现其变化都在正常生理范围内。因此,可以选择在任一时段进行药理学、毒理学等方面的研究,但为了试验的齐性更好,应尽量避免夜间睡眠时间进行试验。
不同性别对肺病的敏感性是不同的,男女在正常生理状态下的呼吸功能也有小部分不同[21]。本研究分别对雌、雄大鼠肺功能各项指标检测后进行统计分析,试验结果表明大鼠肺功能主要指标Ti、Penh和EEP这4项指标在不同性别中无显著差异外,其他指标检测结果都有显著差异,这与已有报道相符合[14]。由于性别不同引起部分参数有差异,这提示我们在药物研发中,如果用药目标不是单一性别,那么必须选择两种性别的大鼠进行试验,而且需分别统计分析。
以上试验结果表明,采用无创双腔法检测SD大鼠肺功能基础数据,可以制定一份准确全面的肺功能检测参考值范围,为后期进行各种药理学试验以及呼吸系统、免疫系统疾病的诊断、治疗和评估[15]提供试验依据,对呼吸系统疾病动物医学研究和临床治疗具有重要的指导意义。
[1] 方贤磊,李 杨,聂李亚,等.肺功能分析在放射性肺损伤防治药物药效评价中的作用[J].军事医学,2015,39(7):519-522.
[2] Debley J S,Stamey D C,Cochrane E S,et al.Exhaled nitric oxide,lung function,and exacerbations in wheezy infants and toddlers [J].J Allergy Clin Immunol,2010,125(6):1228-1234.
[3] 安志远,庞宝森.Wistar大鼠肺功能参考值范围测定[J].中国实验动物学报,2013,21(6):102-104.
[4] Harun S N,Wainwright C,Klein K,et al.A systematic review of studies examining the rate of lung function decline in patients with cystic fibrosis[J].Paediatric Respiratory Rev,2016,20:55-66.
[5] 王志旺,程小丽,郭 玫,等.归喘宁滴丸对哮喘模型大鼠的平喘作用[J].中药药理与临床,2013(3):162-164.
[6] 胡天羽,李 华,马 璟.单次鼻滴入油酸对SD大鼠的呼吸系统急性损伤作用[J].中国医药工业杂志,2013,44(2):166-170.
[7] 任 媛,苏新明,李孟露,等.HDAC8抑制剂PCI-34051对慢性支气管哮喘小鼠的治疗作用[J].中国组织化学与细胞化学杂志,2015,24(6):501-506.
[8] 李 蕴,梁宗安,李素云,等.复方黄龙汤对哮喘小鼠气道炎症的影响与机制[J].西部医学,2012,24(11):2051-2056.
[9] 王志旺,刘雪枫,妥海燕,等.当归对阴虚哮喘小鼠肺组织水通道蛋白1表达的影响[J].中药药理与临床,2016,31(1):95-98.
[10] 妥海燕,任 远,王志旺,等.当归挥发油对哮喘BALB/c小鼠的平喘作用及对Th17免疫活性的影响[J].中国应用生理学杂志,2016,32(2):137-141.
[11] 何进伟.肺通气功能三项参考值与地理环境的组合模型分析[D].陕西师范大学,2014.
[12] Glaab T,Taube C,Braun A,et al.Invasive and noninvasive methods for studying pulmonary function in mice[J].Respiratory Res,2007,8(1):1-10.
[13] 卞宏生.昼夜节律对大鼠的睡眠模式和能量代谢的影响及褪黑素的干预作用研究[D].黑龙江中医药大学,2015.
[14] 王 冰.慢性阻塞性肺病急性加重期中医证候的性别差异研究[D].北京:中国中医科学院,2012.
[15] 赵新合,王金平,赵志强.肺功能测定的质量控制[J].中国医疗设备,2010,25(5):57-58.
DevelopmentofDetectionIndicesofNoninvasiveLungFunctioninRats
LIU Jun-dan,QIU Wen-cai,LI Zi-yuan,LIANG Wei-shen,TANG Lu-ping,HE Yong-ming
(DepartmentofVeterinaryMedicine,FoshanUniversity,Foshan,Guangdong,528000,China)
The basic data of the rat lung functions were measured by double cavity method,which would provide a reference for the detection of pulmonary function in the rat animal models related to respiratory system diseases.17 items of lung functions in 40 (Sprague-Dawley) SD rats were determined by EMKA noninvasive pulmonary function monitoring system,which were tidal volume,TV; expired volume,EV; minute volume,MV; inspiratory time,Ti; expiratory time,Te; peak inspiratory flow,PIF; peak expiratory flow,PEF; relaxtion time,RT; breathing frequency,f; end-inspiratory pause,EIP; end-expiratory pause,EEP; pause,Pau; enhanced pause,Penh; time delay,dT; specific airway resistance,SRaw; specific airway conductance,SGaw and mid-expiratory flow,EF50.The measured values were as follows : TV was 1.01 mL (0.41-2.23),EV 1.01 mL (0.41-2.22),MV 226.02 mL (76-517),Ti 144.17 msec (108-204),Te 172.45 msec (118-265),PIF 11.05 mL/s (4.6-27.1),PEF 10.58 mL/s (3.4-23.9),RT 107.08 msec (76-188),f 196.88 bpm (141-255),EIP 2.72 msec (2-4),EEP 19.956 msec (13-32),Pau 0.63 (0.41-0.88),Penh 0.62 (0.33-1.06),dT 39.56 msec (4.56-96.38),SRaw 38.53 cmH2O.s (2.27-83 ),SGaw 0.078 l/cmH2O.s (0.01-0.37) and EF 50 9.5 mL/s(3-20).Meanwhile,the results showed that partial indicators of pulmonary functions in rats had significant differences between different periods and gender.Multi-indices of noninvasive lung function in SD rats were measured for the first time,which had irreplacable value for the study of respiratory diseases and the establishment of relevant standards.
noninvasive lung function testing analyzer; air flow signal; double body cavity; lung function
2017-03-04
十二五农村领域国家科技计划课题(2011BAD34B00);农业部行业科技专项(201003060-09);广东省省级科技计划项目(2015A040404048);佛山市科技计划项目(佛财工〔2015〕143 )
刘俊丹(1991-),女,广西人,硕士研究生,主要从事中兽药研制和开发工作。△同等贡献作者。*
S852.2
A
1007-5038(2017)12-0049-05

