非洲马瘟病毒RT-LAMP检测方法的建立
姜睿姣,邬旭龙,张鹏飞,王 印,2*,杨泽晓,2,姚学萍,2
(1.四川农业大学动物医学院,四川成都 611130;2.动物疫病与人类健康四川省重点实验室,四川成都 611130)
研究论文
非洲马瘟病毒RT-LAMP检测方法的建立
姜睿姣1,邬旭龙1,张鹏飞1,王 印1,2*,杨泽晓1,2,姚学萍1,2
(1.四川农业大学动物医学院,四川成都 611130;2.动物疫病与人类健康四川省重点实验室,四川成都 611130)
为了建立非洲马瘟病毒(AHSV)环介导等温扩增(loop-mediated isothermal amplification,LAMP)快速检测方法,基于AHSV VP7基因保守序列,设计2对特异性扩增引物。通过对反应体系中各组分浓度,反应温度及时间的优化,建立了快速、灵敏的AHSV RT-LAMP检测方法,并对该方法特异性、灵敏度、重复性进行探索。结果表明,在63℃恒温下反应45 min,便可进行高效率的特异性扩增。反应产物经琼脂糖凝胶电泳和染料可视化鉴定,能够快速有效检测AHSV。用建立的方法检测马属动物易感的4种疫病病原,结果均为阴性,证实具有较高的特异性。灵敏度是RT-PCR的1 000倍。建立了AHSV RT-LAMP检测方法,具有快速、特异、灵敏、操作简单、设备要求低的特点,适合用于现场AHSV快速检测。
非洲马瘟病毒;环介导等温扩增;检测
非洲马瘟(African horse sickness,AHS)是由非洲马瘟病毒(African horse sickness virus,AHSV)引起马属动物的一种急性或亚急性的虫媒传染病[1-2]。其主要病理特征有发热、皮下组织水肿、肺水肿、脏器出血等。所有马属动物中,马对此病最易感,病死率可高达90%。AHS被世界动物卫生组织(OIE)列为法定报告的动物疫病,我国将其列为一类动物疫病。AHS主要流行于非洲撒哈拉沙漠以南地区,在欧洲、中东的部分国家和地区偶有发生[3]。
AHSV属呼肠病毒科(Reoviridae)环状病毒属(Orbiviru),现已知有9种血清型,不同型病毒的毒力强弱不相同,各型之间具有交互免疫关系,如5型与8型、6型与9型[3-4]。该病毒无囊膜,直径约75 nm,基因组由10个大小不等的双链RNA片段构成,共编码7种结构蛋白(VP1-7)和4种非结构蛋白(NS1、NS2、NS3、NS3A)。其中VP7在ASHV各血清中高度保守,是该病毒的血清群特异性抗原[5]。
日本学者Notomi T等[6]发明了环介导等温扩增法(loop-mediated isothermal amplification,LAMP)。目前,RT-LAMP技术也广泛用于RNA病毒的检测,如SARS冠状病毒、口蹄疫病毒[7-11]。与传统PCR相比,该技术通常可在15min~60min内实现109倍~1010倍的扩增,白色产物焦磷酸酶沉淀可通过肉眼观察到,除此以外,还能用荧光染色剂SYBR Green I染色观察。LAMP不需要复杂的仪器设备,仅依靠2对~3对特异引物和一种链置换 DNA 聚合酶(Bst DNA polymerase),在恒温下短时间内便能高效、快捷、特异扩增靶序列。目前,LAMP方法已经广泛应用于病原体的检测,如猪细小病毒[12]。本研究建立了一种检测非洲马瘟病毒的RT-LAMP方法。
目前中国虽无非洲马瘟的发生,但随着各国贸易往来变频繁、气候改变,加之此病通过蚊虫传播,并不能完全保证AHS不会传入进中国。因此,建立一种快速、灵敏、特异的检测方法,有助于现场立即检测出本病或排除本病,尽可能减小损失。
1 材料与方法
1.1 材料
马传染性贫血病毒(Equine infectious anemia virus,EIAV)、日本脑炎病毒(Japanese encephalitis virus,JEV)、链球菌(Streptococcus)、狂犬病病毒(Rabies virus,RV)由四川农业大学动物检疫实验室提供。利用DNA/RNA提取试剂盒提取病毒DNA/RNA,RNA反转录为cDNA,置-80℃保存备用。
1.2 主要试剂
Bst DNA聚合酶、Mg2+购于New England Biolabs(NEB);dNTP、2×TaqPCR Master Mix、RNA反转录试剂盒、DNA Marker DL 2 000购于宝生物工程(大连)有限公司;质粒提取试剂盒、DNA/RNA提取试剂盒购于生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯产品。
1.3 方法
1.3.1 DNA的制备 在NCBI中获取AHSV VP7基因序列(GenBank:KT030566.1),通过DNAStar软件比对分析,人工合成AHSV VP7保守基因序列。将载有目的基因质粒的菌株纯培养后,利用质粒提取试剂盒提取目的基因质粒作为模板,送至华大公司测序鉴定后,置-80℃保存备用。
1.3.2 引物设计 根据GenBank公布的AHSV VP7保守基因序列,利用在线软件 Primer Explorer V5,设计并筛选出2对引物(包括2条外引物F3、B3,2条内引物FIP、BIP)。引物序列见表1,由擎科生物公司合成。

表1 引物序列
1.3.3 AHSV RT-LAMP反应优化 AHSV RT-LAMP的反应体系为25 μL,依次对dNTP浓度、Mg2+浓度、甜菜碱浓度、引物浓度及温度进行优化。具体梯度如下:dNTP终浓度为0.8、1、1.2、1.4、1.6、1.8 mmol/L;Mg2+终浓度分别为2、4、6、8、10 mmol/L;甜菜碱终浓度分别为0、0.5、1、1.5、2 mol/L;内引物终浓度分别为0.8、1.2、1.6、2.0、2.4、2.8、3.2 μmol/L;外引物终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7 μmol/L,10×Bst buffer 2.5 μL,Bst DNA 聚合酶8 U,模板2 μL,反应温度优化分别为61℃、62℃、63℃、64℃、65℃,反应时间优化分别为30、45、60、75、90 min。所有体系恒温反应后,80℃加热 2 min终止反应。取5 μL反应产物于20 g/L琼脂糖凝胶电泳鉴定,以确定最佳的反应体系。添加 SYBR Green Ⅰ染料,并在紫外灯下观察。
1.3.4 RT-LAMP产物酶切鉴定 用Primer Premier 5软件分析目的片段的酶切位点,并筛选出具有单一位点的酶EcoRV,预计酶切产物为163 bp和65 bp。20 μL反应体系中含EcoRV 10 U,RT-LAMP 产物5 μL,10×缓冲液2 μL,37℃反应4 h,取8 μL的酶切产物在20 g/L琼脂糖凝胶中电泳鉴定。
1.3.5 RT-PCR检测 利用外引物F3、B3进行AHSV RT-PCR扩增,反应体系为25 μL:2×TaqPCR Master Mix 12.5 μL,F3、B3各1 μL,模板2 μL,ddH2O 8.5 μL。按如下程序进行:94℃ 3 min;94℃ 15 s、55℃ 30 s、72℃ 30 s共34个循环;72℃ 5 min。取5 μL反应产物于20 g/L琼脂糖凝胶电泳后,将产物送至华大基因测序鉴定。
1.3.6 RT-LAMP灵敏度检测 利用Nano Drop 2 000核酸蛋白分析仪对AHSV重组质粒进行定量测定,根据核酸浓度计算质粒拷贝数[13]。将AHSV重组质粒进行10倍梯度稀释,利用的AHSV RT-LAMP和RT-PCR检测方法,分别对1×106copies/μL~1 copies/μL的DNA进行试验,对比两者检测灵敏度。
1.4 RT-LAMP特异性和重复性试验
根据建立的AHSV RT-LAMP检测方法,分别对AHSV、EIAV、JEV、Streptococcus、RV进行特异性试验。扩增产物经20 g/L琼脂糖凝胶电泳鉴定。以AHSV阳性质粒为模板,3次不同时间进行反应,同时设立3次重复,对建立的RT-LAMP检测方法进行重复性探索及检测。
2 结果
2.1 AHSV RT-LAMP方法的建立
经过对AHSV RT-LAMP反应体系和条件的优化,最终反应体系为25 μL:外引物F3、B3各0.2 μmol/L;内引物FIP、BIP各1.6 μmol/L;Mg2+6 mmol/L;甜菜碱1 mol/L;dNTP混合液1.2 mmol/L;10×Bst buffer 2.5 μL;Bst DNA 聚合酶8 U;模板2 μL;ddH2O补足25 μL。反应在63℃恒温反应45 min后,80℃灭活2 min。产物经20 g/L琼脂糖凝胶电泳分析,可见清晰的阶梯状条带。在体系反应结束后添加 SYBR Green Ⅰ荧光染料,在紫外灯照下,阴性反应管呈橘红色,而阳性反应管散发绿色荧光,介于两者之间的反应管有黄绿色荧光(图1)。
2.2 RT-LAMP特异性试验
以AHSV质粒作为阳性对照,检测马传染性贫血病病毒、日本脑炎病毒、链球菌、狂犬病病毒进行特异性试验,验证所建立RT-LAMP方法的特异性。结果表明,只有AHSV呈阳性,其他试验样品呈阴性(图2)。
2.3 RT-LAMP灵敏度检测
将AHSV重组质粒进行10倍梯度稀释,分别对1×106copies/μL~1 copies/μL的DNA进行灵敏度检测,对比两者检测灵敏度。结果表明,用传统RT-PCR的检测极限为1×104copies/μL,而用RT-LAMP检测方法检测量为1×101copies/μL,RT-LAMP的灵敏度为传统RT-PCR的1 000倍,RT-PCR目的扩增条带为228 bp(图3)。

1.空白对照;2.未优化的反应体系;3.最优反应体系
1.Blank control; 2.Not optimized reaction system; 3.The optimal reaction system
图1 SYBR GreenⅠ染色结果
Fig.1 Coloration results of SYBR GreenⅠ
2.4 RT-LAMP产物酶切鉴定
RT-LAMP反应产物经EcoRV酶切后,取5 μL反应产物上样于20 g/L琼脂糖凝胶电泳(图4),可以看到一条163 bp和65 bp的条带,与理论值相符,说明RT-LAMP 扩增的条带是AHSV的VP7基因。以F3、B3为外引物,LAMP扩增产物为模板,进行PCR反应,产物测序鉴定后,在NCBI BLAST进行比对,证实扩增序列为AHSV特异性序列。
M.DNA标准DL 2 000;1~5.依次为AHSV、EIAV、JEV、Streptococus、RV样本;6.阴性对照
M.DNA Marker DL 2 000; 1-5.Simples of AHSV,EIAV,JEV,Stretococus,RV respectively; 6.Blank control
图2 RT-LAMP特异性检测
Fig.2 Specificity test for RT-LAMP
M.DNA标准DL 2 000;1~6.样品依次为106、105、104、103、102、101copies/μL;8~13.样品依次为106、105、104、103、102、101copies/μL;7、14.阴性对照
M.DNA Marker DL 2 000; 1-7.106,105,104,103,102,101copies/μL samples,respectively; 8-13.106,105,104,103,102,101copies/μL samples,respectively; 7,14.Blank control
图3灵敏度检测
Fig.3 Sensitivity test
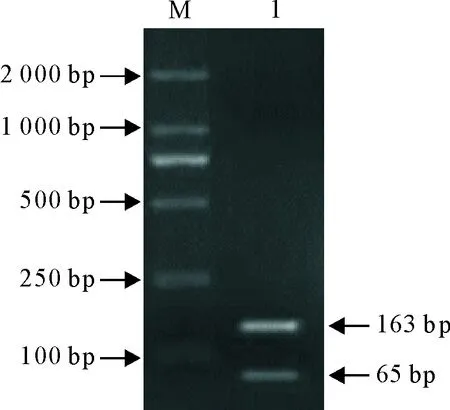
M.DNA 标准 DL 2 000; 1.RT-LAMP酶切产物
M.DNA Marker DL 2 000; 1.RT-LAMP products digested withEcoRV
图4 RT-LAMP产物酶切鉴定
Fig.4 Determination of RT-LAMP products digested withEcoRV
3 讨论
AHS作为一种高致病性的虫媒传染病,能引起马属动物皮下组织水肿、肺水肿、内脏出血等症状。由于AHS发病迅速,病死率极高,我国将其列为一类动物疫病。各国贸易往来越发频繁、进出口马匹越多,此病的传播就会越发迅速。因此,中国现在虽未发生本病,但建立一种高效、迅速检测方法的储备,有利于及时检测此病病原,将该病拒亡国门之外。
RT-LAMP是一种新型的核酸等温扩增方法,此方法相比较于RT-PCR有诸多优点。首先,RT-LAMP的扩增效率极高,在短短的15min~60 min内,就能将目的片段扩增109~1010倍,极大程度节省了检测的时间,对于现场及时检测具有重大的意义。其次,RT-LAMP检测方法的灵敏度高,特异性强。就本研究而言,RT-LAMP的灵敏度是传统RT-PCR的1 000倍;1对外引物和1对内引物保证了扩增时的高特异性。使得检测的结果更加清晰、准确。再者,结果的检测简单,可通过肉眼观察是否有白色的焦磷酸镁产生,亦或加入SYBR Green I染料观察是否有荧光绿,便判断是否有产物生成,且全程无需复杂的设备。因而,此技术已用于人、动物、植物的多种病原体检测检测,具有很高的实用价值。由于RT-LAMP的灵敏度极高,一旦开盖容易形成气溶胶污染,加之实验室并无严格分区,假阳性的情况发生较频繁。所以在操作时应谨慎,切忌把反应后的反应管打开。
本研究发现,针对本套引物,在整个反应体系内Mg2+浓度为6 mmol/L反应条带最佳,与大多文献报道最佳Mg2+浓度为8 mmol/L不一致[7,12-13]。内、外引物浓度比值比引物的绝对浓度更重要,本研究浓度比值为8∶1时,扩增的效率最高。这与以往文献报道的一般选取4∶1或8∶1的内、外引物比值有高扩增效率一致。一般情况下,RT-LAMP在15 min~60 min之内、61℃~65℃之间能观察到明显的条带。本研究在45 min之后才能观察到条带,反应温度以63℃最佳。由此可见,对于不同的引物和模板,反应体系各组分的最佳浓度、反应最短时间以及最适温度也会随之改变。因此,优化一个反应体系,对于建立某种病毒最理想的检测方法是必不可少的。
[1] OIE.Manual of diagnosis tests and vaccines for terrestrial animals [M].2008:823-828.
[2] Meiswinkel R,Paweska J T.Evidence for a new fieldCulicoidesvector of African horse sickness in South Africa[J].Prev Vet Med,2003,60(3):243-253.
[3] 张海明,段晓冬,相文华,等.非洲马瘟诊断技术研究概况[J].动物医学进展,2013,34(6):175-178.
[4] 曾昭文,花群义,段 纲.非洲马瘟病毒分子生物学研究进展[J].动物医学进展,2006,27(10):1-6.
[5] Maree S,Paweska J T.Preparation of recombinant African horse sickness virus VP7 antigen via a simple method and validation of a VP7-based indirect ELISA for the detection of group-specific IgG antibodies in horse sera[J].J Virol Meth,2005,125(1):55-65.
[6] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[7] 李 健,陈 沁,熊 炜,等.口蹄疫病毒RT-LAMP检测方法的建立[J].病毒学报,2009,25(2):137-142.
[8] 秦智锋,曾少灵,阮周曦,等.口蹄疫病毒RT-LAMP检测方法的建立[J].中国预防兽医学报,2008,30(5):375-378.
[9] 吴绍强,孙晓智,林祥梅,等.亚洲Ⅰ型口蹄疫病毒环介导等温扩增(LAMP)检测方法的建立[J].检验检疫科学,2008,18(1):9-12.
[10] Parida M,Horioke K,Ishida H,et al.Rapid detection and differentiation of dengue virus serotypes by real-time reverse transcription-loop-mediated isothermal amplification assay[J].J Clini Microbiol,2005,43(6):2895-2903.
[11] Parida M M.Rapid and real-time detection technologies for emerging viruses of biomedical importance[J].J Biosciences,2008,33(4):617-628.
[12] 刘业兵,张 磊,宁宜宝,等.猪细小病毒LAMP检测方法的建立[J].中国农业科学,2010,43(14):3012-3018.
[13] Xie Z,Luo S,Xie L,et al.Simultaneous typing of nine avian respiratory pathogens using a novel GeXP analyzer-based multiplex PCR assay[J].J Virol Meth,2014,207(10):188.
[14] 蔡树东,成大荣,朱善元,等.大肠埃希菌ETT2毒力岛ECs3703基因和HPI毒力岛irp2基因双重LAMP检测方法的建立[J].动物医学进展,2017,38(1):1-5.
[15] Suarez P,Zardoya R,Martin M J,et al.Phylogenetic relationships of European strains of porcine reproductive and respiratory syndrome virus (PRRSV) inferred from DNA sequences of putative ORF-5 and ORF-7 genes[J].Virus Res,1996,42(1-2):159-165.
[16] 江彦增,朱鸿飞.非洲猪瘟病毒环介导等温扩增快速检测方法的建立.中国畜牧兽医,2009,36(2):72-74.
[17] 马艳平,刘振兴,郝 乐,等.环介导等温扩增技术的研究进展[J].河北科技师范学院学报,2011,25(1):77-80.
[18] 黄火清,郁 昂.环介导等温扩增技术的研究进展[J].生物技术,2012,22(3):90-94.
[19] 史亚东,赵子方,朱 丹,等.LAMP(环介导等温扩增)的原理及在寄生虫检测上的应用[J].中国人兽共患病学报,2011,27(10):935-939.
[20] 田桢干,阎 俊,陆 晔,等.LAMP技术快速检测沙门氏菌方法的建立及其应用[J].中国国境卫生检疫杂志,2011,34(5):296-299.
[21] 王韦华,刘桂梅.环介导等温扩增技术在畜牧兽医中的应用研究[J].甘肃畜牧兽医,2016,46(13):11-12.
[22] 卞 璐,张 旭.环介导等温扩增技术及其在食品检测中的应用[J].现代食品,2016,10(6):43-46.
[23] 贾雅菁,付博宇,王 羽,等.实时荧光环介导等温扩增技术检测牛乳中的蜡样芽胞杆菌[J].食品科学,2016,37(6):184-189.
[24] 戴婷婷,陆辰晨,郑小波.环介导等温扩增技术在病原物检测上的应用研究进展[J].南京农业大学学报,2015(5):695-703.
2017-03-28
“十二五”国家科技支撑计划项目(2013BADl2804)
姜睿姣(1996-),女,四川雅安人,本科生,主要从事动物传染病病原微生物及其分子生物学研究。*
S852.65
A
1007-5038(2017)12-0001-05

