基于SWI检测的大鼠脑微出血后血胱抑素C水平的变化分析
韩玉庆,许阳阳,董力庆,赵理乐,杨新宇
基于SWI检测的大鼠脑微出血后血胱抑素C水平的变化分析
韩玉庆,许阳阳,董力庆,赵理乐,杨新宇
目的通过磁敏感加权成像(SWI)检查,探讨血胱抑素C水平在SHR大鼠脑微出血(cerebral microbleeds,CMBs)发生后的变化。方法30只SHR大鼠,随机分为CMBs组和对照组,每组各15只。采用立体定向技术在脑实质内注入10 μl自体股动脉血制作CMBs大鼠模型;对照组大鼠予相同干预,但不进行注血。在造模前、后行SWI扫描检查。在造模前、造模后3 h、6 h取自体股动脉血检测胱抑素C水平;取血后用断髓法处死大鼠取脑行病理学检查。结果造模后CMBs组大鼠SWI检查清晰地显示脑部点状血肿,与病理检查结果吻合。造模前两组血胱抑素C水平比较,差异无统计学意义(P>0.05)。造模后3 h、6 h, CMBs组的血胱抑素C水平为(0.31±0.03)mg/dl、(0.36±0.05)mg/dl,明显高于对照组的(0.10±0.03)mg/dl、(0.10±0.03)mg/d,差异均有统计学意义(均P<0.001)。结论在大鼠发生CMBs后血胱抑素C水平逐步升高,与SWI及病理检查结果相符合,可以作为CMBs的敏感生物学检测指标。
胱抑素C;脑微出血;SHR大鼠;磁敏感加权成像
脑微出血(cerebral microbleeds, CMBs)是多种危险因素损害血-脑屏障与神经血管后,血液通过病变的微小血管壁漏出并被巨噬细胞吞噬,在血管周围形成含铁血黄素沉积的现象,其没有明显的临床特征[1-2]。相关研究报道,通过磁共振磁敏感加权成像(SWI)扫描可大大提高CMBs的检出率[3]。目前共识CMBs的出现会增加血管的出血倾向,对急性缺血性脑卒中患者的溶栓治疗有重要的指导意义,很可能成为脑出血事件风险增加的一个重要参考指标[4-5]。本研究根据急性脑梗死发生后的溶栓治疗时间窗窄,溶栓术后症状性出血致死率高这一问题,制作CMBs大鼠模型,用SWI扫描确定微出血灶,在造模前、后进行血胱抑素C(CysC)水平检测;以探讨CMBs发生后血胱抑素C水平变化的特点,为急性缺血性脑卒中患者早期干预治疗提供更多的监测指标,减少症状性出血的发生率。
1 材料与方法
1.1 实验动物及分组 清洁级10周龄SHR大鼠30只,雌雄各15只,体质量350~400 g;随机分为CMBs模型组(CMBs组)和对照组,每组15只。
1.2 CMBs模型制作 参照文献方法制作CMBs大鼠模型[6]。大鼠制模前8 h禁食水,用10%水合氯醛(3.5 ml/kg)腹腔注射麻醉,于股动脉置留置针(取血)。用耳杆将麻醉后大鼠固定在立体定向仪(瑞沃德公司)上,剪除头部术区鼠毛,消毒后于中线旁切开皮肤约5 mm,于前卥门右侧3 mm、向前1 mm处用微型磨钻钻1 mm骨孔1个,不损伤硬脑膜,用微量注射器抽取自体股动脉血10 μl沿此点缓慢垂直刺入脑组织,深度为3 mm,匀速缓慢注射,30 s注血完毕,保留穿刺针1 min后,小心缓慢退针,使用骨蜡封闭骨孔,用6-0丝线缝合切口。对照组大鼠前面干预步骤相同,但不进行脑组织注血。
1.3 血胱抑素C水平检测 使用大鼠胱抑素C ELISA试剂盒。于术前、术后3 h、6 h经大鼠股动脉抽血,用3.2%柠檬酸钠抗凝,混合30 min,以3 000 r/min 离心20 min;收集上清液,使用双抗体夹心法测定标本中胱抑素C水平。再使用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算标本中胱抑素C浓度。
1.4 MR检查 在大鼠造模前、后采用西门子 1.5 T磁共振机,进行SWI和T1WI、T2WI序列扫描。用手腕线圈将麻醉大鼠俯卧包裹于线圈中,用3D扫描定位鼠脑坐标。调整参数为:TE 20 ms,TR 29 ms,矩阵256×256,FOV 70 mm×70 mm,层厚0.6 mm,层间距0.12 mm,层数20,翻转角15°。
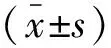
2 结 果
2.1 造模前后MRI检查 造模前CMBs组大鼠MRI各序列扫描未见异常信号。造模后MRI检查,T1WI及T2WI未见异常信号,但SWI上出现点灶状短信号(图1),证实CMBs模型制作成功。

A:造模前SWI,未见异常信号; B:T1WI;C:T2WI,未见异常信号; D:造模后SWI,表现为点灶状短信号图1 造模前后MRI检查
2.2 两组大鼠造模前后血胱抑素C水平比较 见表1。CMBs组造模前、造模后3 h、6 h血胱抑素C水平逐步升高,3个时间点之间比较差异有统计学意义(F=208.745,P=0.000)。对照组造模前、造模后3 h、6 h血胱抑素C水平之间的差异无统计学意义(F=1.244,P=0.299)。CMBs组与对照组造模前血胱抑素C水平比较,差异无统计学意义(P=0.541);CMBs组造模后3 h、 6 h的血胱抑素C水平明显高于对照组,差异有统计学意义(均P<0.001)。
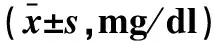
表1 两组大鼠造模前、后血清胱抑素C水平的比较
2.3 病理学检查 造模后6 h取血后,将CMBs组大鼠用断髓法处死取脑行病理学检查。结果显示,脑组织内有出血病灶(图2)与SWI扫描的影像学特征相吻合。
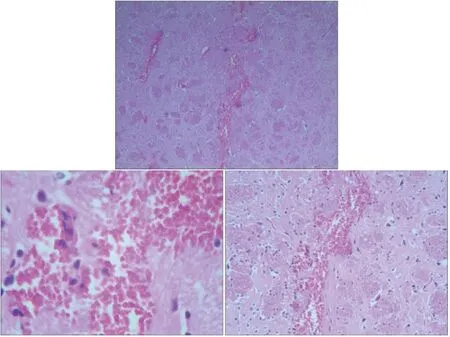
图2 通过普鲁士蓝染色显示微出血病灶,与影像学检查符合
3 讨 论
CMBs属于脑小血管病变的一种,局限于皮质区的CMBs主要与淀粉样血管病(cerebral amyloid angiopath, CAA)相关;深部的CMBs与高血压或动脉粥样硬化有关[7]。脑内的实质小动脉、微动脉、小静脉、毛细血管是其主要靶点,由于各种病因致使小动脉粥样硬化、脂质透明样变性和淀粉样变性等病理变化,最终导致CMBs。其具体病理机制目前尚不确定,包括内皮激活、炎症机制、局部脑血流量失调以及血-脑屏障破坏等假说[8]。
目前临床主要通过磁共振SWI扫描进行CMBs检查,可明显提高检出率。与其他磁共振检查序列不同,SWI比T2WI能够更清晰地发现出血后含铁病灶的变化[9-10],可以明显增强图像的对比和组织间的磁敏感的差异。本研究中,造模后脑组织内微出血在SWI上呈类圆形小灶,边界清楚,而在T1WI和T2WI上边界模糊不清,不易分辨。
研究表明,25%~70%的缺血性脑卒中患者都存在脑部微出血的现象[11]。合并CMBs的急性缺血性脑卒中患者接受溶栓治疗后,出现症状性颅内出血的概率很高,时间窗内接受溶栓治疗后出现症状性颅内出血的概率如何,目前尚无客观的临床观察指标。本研究通过对SHR大鼠模型血清胱抑素C的研究,来证实其与CMBs发生的相关机制,进而增加客观的溶栓后症状性出血概率判定指标。
研究发现大脑与肾脏的小血管病变存在密切相关性,通过解剖及血管调节机制,包括高灌注压,终末低阻力血管结构和一氧化氮在维持肾小球或脑穿通动脉微循环的作用方面都有相似之处。还有报道发现,肾功能不全与脑卒中发生CMBs的患者之间可能存在着密切的关系[12-13]。考虑到这方面,一个适当的指标可能会反映大脑和肾脏的小血管病变的严重程度;而以往对CMBs的研究大多基于传统定义的肾功能不全(肌酐,肾小球滤过率,尿微量白蛋白等)。
胱抑素C广泛存在于细胞外液中,是一种半胱氨酸蛋白酶抑制剂,参与细胞外基质产生和降解的动态平衡。当胱抑素C水平减低,对组织蛋白酶活性的抑制就会减弱,导致蛋白酶活性增加,最终造成病理损害;随之会释放大量炎症因子,诱导多种组织蛋白酶的大量增加,组织蛋白酶抑制剂进而增加,导致胱抑素C水平增高,促使蛋白酶和其抑制剂达到平衡[14]。
胱抑素C只通过肾脏代谢,几乎完全被肾小球滤过,再由肾小管重吸收,最终在肾小管细胞中完全代谢,不再参与血液循环。其具有维持血管壁正常生理的功能,与心脑血管病的关系密切。有研究证实,肾脏小血管损害和脑小血管病存在着共同的病理基础,由于胱抑素C参与了炎性反应过程,那么炎性因素可能是皮质区及深部CMBs存在的相对独立的危险因素。另一方面由于胱抑素C水平与动脉粥样硬化性疾病密切相关,其可能会通过影响动脉粥样硬化的过程及程度,间接反映CMBs的存在[15]。Spearman等研究显示,血胱抑素C水平与CMBs的严重程度呈正相关;表明血清胱抑素C水平越高,CMBs病灶可能越多[5]。本研究结果显示,造模前两组大鼠血清胱抑素C水平比较,差异无统计学意义;造模后3 h、6 h CMBs组血清CysC水平均明显高于对照组,差异均有统计学意义(均P<0.001);且伴随着出血时间的延长,血胱抑素C水平呈逐渐升高趋势。可见胱抑素C对CMBs有较好的诊断价值,独立于常见的危险因素,血胱抑素C水平是诊断CMBs很好的生物标志物。
综上所述,胱抑素C有望成为急性缺血性脑卒中溶栓治疗前是否存在CMBs筛查的生物学标志物之一;用于提高溶栓后可能发生症状性出血患者的筛查效率,可更敏感、更准确地反映溶栓后的病情变化。
[1] Carusillo TB,Woo SK,Karimy JK,etal.Cerebral microbleeds in a neonatal rat model[J].PLoS One,2017,12:0171163.
[2] 潘小滨.急性脑梗死患者经尤瑞克林治疗前后脑微出血灶的对比研究[Z].福建医科大学,2015.
[3] Buch S,Cheng Y,Hu J,etal.Determination of detection sensitivity for cerebral microbleeds using susceptibility-weighted imaging[J].NMR Biomed,2017,30:3551.
[4] Zand R,Tsivgoulis G,Singh MA,etal.Cerebral microbleeds and risk of intracerebral hemorrhage post intravenous thrombolysis[J].J Stroke Cerebrov Dis,2017,26:538.
[5] 杨松,魏宁,吴坚.缺血性脑卒中患者血清胱抑素C与脑微出血的关系[J].中华老年心脑血管病杂志,2016,18:535.
[6] 尹春雨,朱东亚.卒中动物模型的研究进展[J].中国卒中杂志,2017,12:364.
[7] Zerna C,Modi J,Bilston L,etal.Cerebral microbleeds and cortical superficial siderosis in patients presenting with minor cerebrovascular events[J].Stroke,2016,47:2236.
[8] 吕雅静,孙虹,赵娇,等.脑小血管病非传统危险因素与其影像学指标研究新进展[J].中华老年心脑血管病杂志,2017,19:442.
[9] 刘春岭.MRI磁敏感加权成像(SWI)在脑出血中的应用价值分析[J].中国CT和MRI杂志,2015,13:13.
[10] 田亚楠,范敬争,李冠武,等.SWI评价大鼠脑出血模型血肿演变进程的实验研究[J].中国中西医结合影像学杂志,2014,12:14.
[11] 成帅,丁长霞.血清CysC与脑梗死患者脑微出血的关系[J].中国实用神经疾病杂志,2016,19:89.
[12] Nayak-Rao S,Shenoy MP.Stroke in patients with chronic kidney disease... :how do we approach and manage it?[J].Indian J Nephrol,2017,27:167.
[13] Falsetti L,Capeci W,Tarquinio N,etal.Serum uric acid,kidney function and acute ischemic stroke outcomes in elderly patients:a Single-Cohort,perspective study[J].Neurol Int,2017,9:6920.
[14] 张平,朱斌,闫海清,等.中青年进展性脑卒中患者病因分型及危险因素分析[J].脑与神经疾病杂志,2014,22:184.
[15] 杨亚超,刘英霞,张江山,等.脑出血并发脑微出血患者的肾脏损伤标志物研究[J].中华神经科杂志,2015,48:469.
MechanismanalysisofcorrelationbetweencystatinCandbrainmicrohemorrhageinratsbasedonSWI
HANYu-qing,XUYang-yang,DONGLi-qing,etal.
DepartmentofNeurosurgery,TianjinMedicalUniversityGeneralHospital,Tianjin300052,China
Correspondingauther:YANGXin-yu
ObjectiveThe changes of cystatin C levels in brain hemorrhage of SHR rats were investigated by SWI sequence analysis.Methods30 SHR rats underwent autologous femoral artery cystatin C blood test and SWI scanning before modeling.15 in the trial group,10μl autologous arterial blood were injected in the brain parenchyma by stereotary and again underwent SWI scanning,15 in the control group were given the same intervention,but without blood injection. Femoral artery blood cystatin C level were analyzed 3 h and 6 h after modeling,and the rats were treated with marrow breaking for brain pathology.ResultsBefore modeling,the level of cystatin C in the observation group was (0.08±0.03) mg/dl.After modeling,the hematoma can be clearly detected by SWI,and it is consistent with the pathological findings.After 3 hours,the level of cystatin C in the observation group was (0.31±0.03) mg/dl,and that of the control group was (0.10±0.03) mg/dl.The cystatin C level in the 6 hour observation group was (0.36±0.05) mg/dl,and the control group was (0.10±0.03) mg/d.P<0.01.ConclusionCystatin C level micro hemorrhage in the brain of SHR rats is increased,consistent with the results of SWI and pathological results,can be used as SHR of rat brain microvascular hemorrhage sensitive index.
cystatin C;cerebral hemorrhage;SHR rats;SWI
300052天津,天津医科大学总医院神经外科(韩玉庆,杨新宇);天津市西青医院神经外科(许阳阳,董力庆,赵理乐)
杨新宇
10.3969/j.issn.1672-7770.2017.06.003
R743.3
A
1672-7770(2017)06-0413-04
(收稿2017-04-23 修回2017-09-10)

