Evi1基因对胶质瘤细胞株U87/U251增殖、侵袭的影响
余仁春,胡圆,孙春明,殷洪伟,周幽心
Evi1基因对胶质瘤细胞株U87/U251增殖、侵袭的影响
余仁春,胡圆,孙春明,殷洪伟,周幽心
目的探讨Evi1基因在不同级别胶质瘤组织中的表达,以及调控该基因对胶质瘤细胞株U87和U251细胞增殖、细胞周期和侵袭影响,为靶向癌基因治疗胶质瘤提供客观依据。方法首先通过实时定量PCR(qRT-PCR)分别检测人脑不同级别胶质瘤组织以及U87和U251细胞株中Evil基因的表达水平。用合成的小分子干扰RNA(small interfering RNA,siRNA)干扰下调U87和U251细胞Evi1基因表达作为干扰组,同时设空白和阴性对照组。qRT-PCR检测转染前后Evi1基因在U87和U251细胞中的表达和转染效率。CCK-8法检测实验组细胞的增殖能力,流式细胞仪分析Flow Cytometer(FCM)其细胞周期。Transwell以及划痕试验检测各组U87和U251的侵袭和迁移能力。以及用qRT-PCR分析下调Evi1基因后U87和U251细胞基质金属蛋白酶2(MMP2)的表达水平。结果Evi1基因在胶质瘤组织中呈现高表达,且随着胶质瘤级别程度增加其表达水平亦上升,其中Ⅲ和Ⅳ级的胶质瘤组织以及U87、U251细胞Evi1基因表达明显高于非瘤脑组织(均P<0.05)。通过siRNA下调Evi1基因后,胶质瘤细胞株U87和U251的增殖减缓(均P<0.05),其侵袭和迁移能力明显下降(均P<0.01),并能阻滞其细胞周期G1期(P<0.05)。干扰组U87和U251细胞MMP2表达水平明显降低(均P<0.01)。结论Evi1基因在胶质瘤中呈高表达,干扰U87和U251细胞Evi1基因可抑制胶质瘤的增殖和侵袭。
Evi1基因;胶质瘤;RNA干扰;增殖;侵袭
在颅脑肿瘤中胶质母细胞瘤具有高发病率、高复发率、高死亡率和低治愈率等特点,越来越引起了高度重视。目前该肿瘤的治疗手段包括手术治疗、化学药物治疗、放射治疗,但中位生存期只有14.6个月左右[1]。随着人类对肿瘤分子生物学研究的深入,认识到某些基因的突变可能是肿瘤发生发展的关键,基因治疗日逐渐成为一个新的研究热点。文献报道,作为原癌基因的Evi1基因定位于人类染色体3q26,在正常人骨髓和外周血细胞中均不表达,但在肝癌、卵巢癌以及AML/MDS等疾病中呈现高表达;且证实下调其表达后,对那些实体肿瘤细胞的增殖、侵袭以及凋亡均有影响[2-5]。在胶质瘤组织及细胞株中是否也有类似的现象,未见报道。本实验通过研究Evi1基因在胶质瘤中的表达水平及其对胶质瘤细胞增殖、侵袭的影响,探讨神经胶质瘤的潜在分子治疗靶点,为临床治疗胶质瘤提供理论基础。
1 材料与方法
1.1 胶质瘤组织标本 人脑神经胶质瘤标本来自苏州大学第一附属医院从2010年1月至2014年12月神经外科手术切除的胶质瘤组织,共有40例胶质瘤标本和7例非肿瘤脑组织标本。其中,包括15例低级别胶质瘤组织(WHOⅡ级,少突胶质瘤2例,星形细胞瘤13例)和25例高级别胶质瘤组织(WHO Ⅲ级12例,间变型少突胶质瘤1例,星形细胞瘤8例,间变型室管膜瘤3例;WHO Ⅳ级13例,全部为胶质母细胞瘤)。所有组织标本从患者颅内切除后立刻放入液氮中以供实验使用。
1.2 细胞及试剂 胶质瘤细胞株U87、U251(中国上海生命科学院生物细胞研究所),在添加10%胎牛血清的DMEM培养液中培养,培养箱设置条件为37℃、5%CO2。取对数生长期的细胞用于实验。Lipofectamine 2000(invitrogen公司),DMEM(Corning公司),血清(Gbico公司),CCK8试剂(碧云天公司),细胞周期试剂盒(碧云天公司), transwell小室(Corning公司)。
1.3 引物 Evi1基因引物和基质金属蛋白酶2(MMP2)引物,以及GADPH内参引物均由生工生物工程(上海)股份有限公司合成。Evi1扩增引物sence:5′-TTTCCAGGTCACTGCCACTT-3′,antisence:5′-ACACCCATGTGTAGGGGACA-3′。MMP2扩增引物sence:5′-AGGATGGCAAGTACGGCTTC-3′,antise-nce:5′-CTTCTTGTCGCGGTCGTAGT-3′。GAPDH 引物sence:5′- AGAAGGCTGGGGCTCATTTG-3′,antise-nce 5′-AGGGGCCATCCACAGTCTTC-3′。3条体外人工合成siRNAolgio的序列如下,siRNA-1sence:5′-GCUGAUUGCAGAACCCAAA-3′,antisence:5′-UUU-GGGUUCUGCAAUCAGC-3′;siRNA-2sence:5′-GCA-CUACGUCUUCCUUAAA-3′,antisence:5′-UUUAAG-GAAGACGUAGUGC-3′;siRNA-3sence:5′-GGAAG-CAACGUCGAAUCAA-3′,antisence:5′-UUGAUUC-GACGUUGCUUCC-3′;以及1条阴性对照(siRNA-Negative Control)sence:5′-UUCUCCGAACGUGUCA-CGU-3′,antisence:5′-ACGUGACACGUUCGGAGAA-3′由苏州吉玛基因股份有限公司合成。
1.4 细胞转染 调整细胞密度为15~20×104/ml,铺6孔板,转染时要求细胞汇合率80%~90%。首先以lipofectamine 2000为转染试剂,将20 μmol/L的siRNAolgio 5 μl与250 μl DMEM稀释,室温下温育5 min。同时,将5 μl的lipofectamine 2000与DMEM培养液250 μl混匀,形成混悬液,最后将两者混匀,在室温下孵育20 min,形成siRNA与lipofectamine2000稀释液的转染复合物。并将其加入U87以及U251细胞,然后置细胞培养箱。3条siRNA干扰链和siRNA Negative Control链最终浓度为 100 μmol/L。
分别予以3条干扰链以及阴性对照链处理U87以及U251细胞,包括未予以任何处理的空白组,24 h 后提取RNA,以阴性对照作为参考,同样将RNA逆转录成cDNA。分别用Evi1基因和GAPDH内参基因引物于荧光定量PCR仪进行实时定量PCR(qRT-PCR)扩增,最后以阴性对照作参照,用2-△△CT方法计算3条干扰链对Evi1基因下调水平,选择干扰效果最好的1条链用作后续试验。
1.5 组织及细胞株的RNA提取 用Trizol法分别提取胶质瘤组织标本,非瘤脑组织和转染前后的胶质瘤细胞株的总RNA,逆转录成cDNA。分别用Evi1基因和GAPDH引物于荧光定量PCR仪进行qRT-PCR扩增,以GAPDH作参照。按照试剂盒说明书,扩增体系为20 μl,2×All-in-One qPCMix 10 μl,miRNAqPCR Primer 2 μl,Universal Adaptor PCR Primer 2 μl,cDNA 2 μl,50×ROX Referenc Dye 0.4 μl,ddH2O 3.6 μl。反应条件:95 ℃预变性10 min,95 ℃变性10 s,63℃退火20 s,72℃延伸20 s,反应40个循环,溶解曲线温度范围:65~95℃。qRT-PCR结果判定:△Ct=CT目的基因-CT内参(GAPDH),△△CT=△CT治疗组-△CT对照组,RQ(relative quantification)治疗组=2-△△CT,RQ对照组=1[6]。
1.6 CCK8及细胞周期试验 将转染24 h的空白对照和阴性对照组,以及干扰组胶质瘤细胞(U251或U87)重新制成单细胞悬液,2×104个细胞/ml,取100 μl接种到96孔板中,每组设3个复孔,置于37℃,5%CO2培养箱中培养6 h、24 h、48 h、72 h后,向每孔中加入10 μl CCK-8溶液,置于培养箱再培养4 h,用酶标仪在450 nm波长处测定各孔的吸光度(OD值),用Graphpad Prism5.0绘制增殖曲线。将转染后的胶质瘤细胞用胰酶消化后收集于离心管,PBS清洗后再加入70%乙醇1 ml,4℃过夜。PBS洗涤过夜细胞后加入碘化丙啶染色液与RNase A以及染色缓冲液,缓慢并充分重悬细胞沉淀,37℃避光温浴30 min,应用流式细胞仪检测细胞周期分布。
1.7 细胞侵袭与划痕试验 用无血清培养基6∶1稀释Matrigel胶后匀铺于Transwell小室,每孔40 μl,37 ℃反应30 min,使Matrigel聚合成胶。将实验3组转染后24 h的胶质瘤细胞胰酶消化,并用不含血清的DMEM培养基制成单细胞悬液,密度为5×105/ml,取100 μl并加入200 μl DMEM接种于transwell上层小室,下层小室加入750 ml含血清培养基,在37℃、5%CO2培养箱中37℃连续培养48~72 h。用湿棉签擦去上层细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色1 min,高倍镜下随机取6个视野计数,取平均数。重复3次。细胞铺于6孔板,并且予以siRNA-1以及siRNA阴性对照转染24 h 后,用200 μl黄枪头的枪尖在细胞培养板各孔中央垂直划出一条贯穿培养孔的划痕;吸去细胞培养液,PBS漂洗细胞,去除悬浮细胞和细胞碎片,各孔拍照,作为0 h的细胞迁移图;重新再各孔添加培养基,继续培养6 h、12 h、24 h时各孔拍照,观察细胞迁移情况。
1.8 转染siRNA-oligo后各组细胞的MMP2表达 分别用干扰链以及阴性对照链处理U87以及U251细胞(同细胞转染步骤),包括未予以任何处理的空白组;24 h后提取RNA,以阴性对照作为参考,同样采用将RNA逆转录成cDNA。分别用MMP2基因和GAPDH内参基因引物于荧光定量PCR仪进行PCR扩增,以阴性对照作参照,用2-△△CT方法计算干扰组对MMP2基因下调的影响。
1.9 统计学方法 应用SPSS 13.0统计软件分析处理数据。多组均数间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 qRT-PCR结果 通过Trizol法提取的胶质瘤组织以及非瘤脑组织的RNA,用紫外分光光度计检测RNA组织的纯度A260/280均在1.90以上,浓度在450 ng/μl以上,表明提取的RNA质量符合要求。采用2-△△CT计算显示,正常脑组织与高级别胶质瘤组织(Ⅲ级和Ⅳ级) Evi1基因表达水平比较,差异有统计学意义(均P<0.05),并且胶质瘤级别越高,Evi1基因的表达水平也越高(图1)。

图1 正常脑组织与不同级别胶质瘤组织Evi1基因的表达水平(注:与正常脑组织比较*P<0.05)
2.2 胶质瘤细胞株U87和U251细胞的Evi1基因表达水平及转染效率 见图2。胶质瘤细胞株U87、U251的Evi1基因表达水平均高于于非瘤脑组织。用带荧光的小分子合成的siRNA转染U87、U251细胞,用荧光显微镜和流式细胞仪检测转染效率,U87的转染效率为90.1%,U251的转染效率为97.9%,均在90%以上。

图2 A:Evi1基因在U87和U251胶质瘤细胞株与非瘤脑组织之间的表达差异;B:转染NC-FAM后荧光显微镜下,转染前、后的细胞对比;C:流式细胞仪检测胶质瘤细胞株U87和U251的转染效率
2.3 siRNA最佳干扰链的选择 吉玛公司设计可供选择的3条siRNA干扰链中,siRNA-1和siRNA-3干扰链对细胞的干扰效果好,基因表达水平下降明显(均P<0.01);siRNA-1干扰效果又好于siRNA-3(P<0.01);见图3。故本实验选用siRNA-1干扰链用于后续的试验。
2.4 转染siRNA-1后对细胞周期和增殖的影响 胶质瘤细胞株U87和U251细胞干扰组与空白组及阴性对照组相比,Evi1基因表达水平下降。CCK8实验显示,转染siRNA可抑制胶质瘤细胞株的生长,细胞生长变慢;实验组比阴性对照组及空白组的OD值明显下降(均P<0.05)。细胞周期实验显示,细胞更多停留在G1期,延缓进入S期(P<0.05);细胞增殖受到明显抑制。见图4。
2.5 转染siRNA-1对胶质瘤细胞侵袭能力的影响 见图5、图6。U87和U251细胞转染siRNA-1后,干扰组与空白组和阴性对照组相比,U87和U251细胞的Evi1基因表达水平下降。48 h观察肿瘤细胞穿过Matrigel胶的数目要明显少于阴性对照及空白组(均P<0.01)。
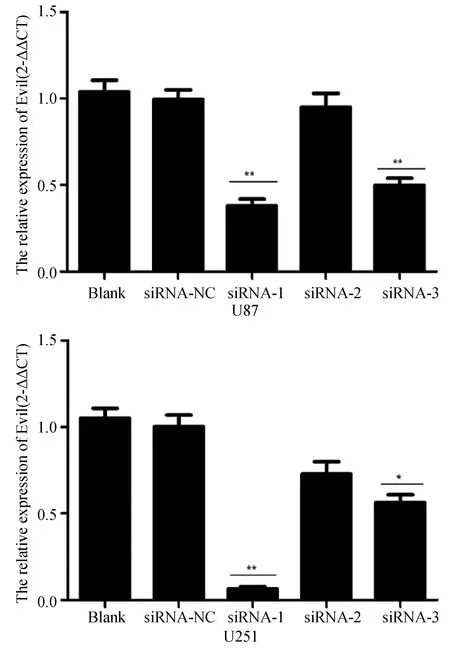
图3 3条siRNA干扰链对基因表达水平的影响

图4 A:干扰组、阴性对照组及空白组的CCK8增殖曲线;B:干扰组、空白组和阴性对照组的细胞周期;C、D:分别为U87和U251 FCM不同时期(G1,S,G2/M)和分布
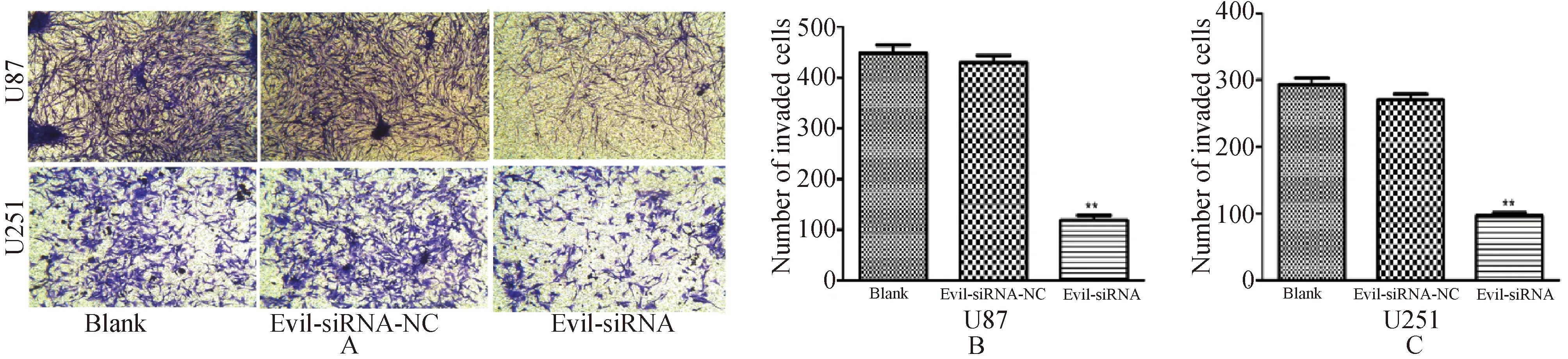
图5 A:Transwell实验显微镜下,空白组、阴性对照组、干扰组U87和U251细胞的浸润状态;B、C:转染48 h后,空白组、阴性对照组、干扰组U87和U251细胞穿过Matrigel胶的数目
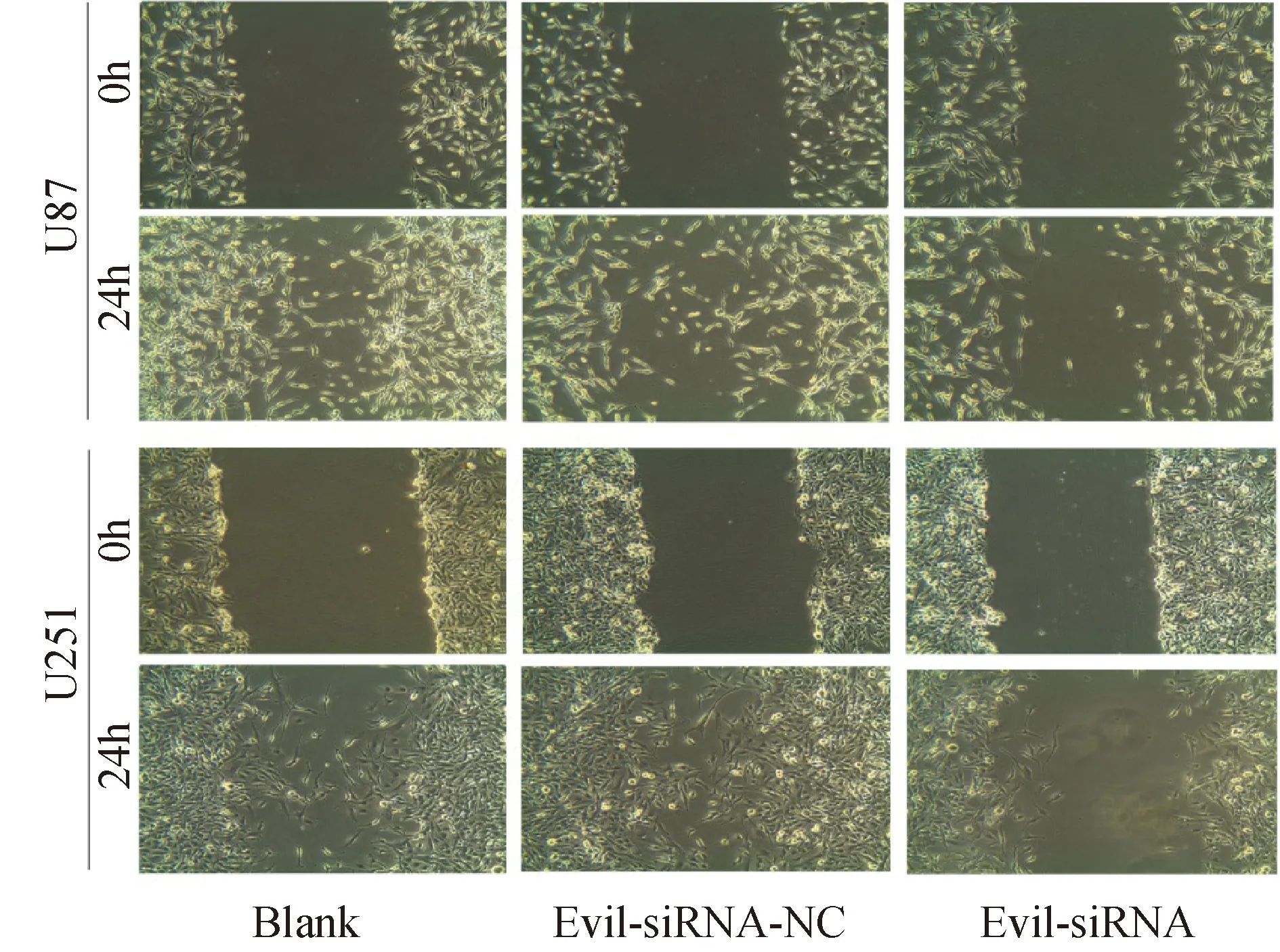
图6 转染siRNA-1后划痕实验显示,U87和U251细胞的迁移能力受到抑制
划痕实验结果显示,24 h后干扰组迁移的胶质瘤细胞明显少于阴性对照组及空白组。表明下调Evi1基因后,胶质瘤细胞的侵袭和迁移能力有明显降低。
2.6 U87、U251细胞转染siRNA-1后MMP2 mRNA表达水平的改变 见图7。转染EVI1基因后,U87、U251细胞MMP2 mRNA表达水平比阴性对照组及空白组明显减低(均P<0.01)。表明U87、U251细胞的侵袭以及浸润能力明显下降。

图7 U87、U251细胞转染siRNA-1后MMP2 mRNA表达水平的变化
3 讨 论
目前胶质瘤的治疗仍以外科手术切除为主。术前影像学检查,术中多模态神经导航,术中电生理监测、荧光显影等微创技术的应用,使胶质瘤组织的精准切除率越来越高,神经功能的保护也越来越好。手术后对于胶质母细胞瘤常规使用标准化的替莫唑胺化疗,以及更加精确化的适形放疗[7]。然而胶质母细胞瘤的疗效仍然很不理想。随着精准医疗的发展,在许多肿瘤治疗方面,分子靶向药物的运用越来越广泛;越来越多的研究发现此类疾病的根源在于基因的改变,进而造成原癌基因激活成为癌基因,以及抑癌基因的失活,进而造成信号通路的激活,引起级联反应,造成疾病的加剧和进展。故而人们设想在基因层面治疗癌症,从而希望能从根源上治愈恶性肿瘤,改善患者的预后。在血液系统疾病的研究中,有学者发现Evi1基因的表达差异对骨髓异常增生综合征/急性髓细胞白血病(MDS/AML)患者的预后造成极其严重的影响,其阳性表达的白血病转归较阴性表达的白血病转归预后更差[8]。在肝癌、前列腺癌、肠癌等实体肿瘤发生进展过程中,无论在体外,或者体内试验发现,Evi1基因对实体肿瘤细胞的增殖、侵袭有促进作用,同时抑制细胞凋亡,减弱肿瘤细胞对放化疗的敏感性。本实验发现,Evi1基因在胶质瘤组织中呈高表达,尤其是在高级别胶质瘤组织中。应用siRNA下调其表达后,对胶质瘤细胞株U87、U251的增殖、侵袭有抑制作用,把肿瘤细胞周期阻止在G1期。在本实验中,通过流式细胞仪检测到转染Evi1-siRNA后,U87、U251细胞G1期细胞显著增多,S期细胞明显减少,幼稚期细胞数明显增加,细胞增殖受抑制,使细胞阻滞在G1期,抑制细胞的有丝分裂。提示利用siRNA抑制Evi1基因的表达可能是一种治疗由Evi1过表达引起的颅脑恶性肿瘤,尤其是胶质瘤的新途径。因此推断,由于某些理化因素导致Evi1基因激活成为癌基因,进而导致癌细胞过度增殖。
Evi1基因所编码的蛋白位于核内,可通过锌指蛋白结合DNA序列。其作为转录因子,可以通过基因突变、移位、插入等导致基因功能改变,从而导致下游靶向通路某些蛋白发生改变。在许多类型的恶性肿瘤中,PTEN作为Evi1基因的靶向蛋白,基因可调节PTEN的表达,进而激活PI3K/AKT通路,促进肿瘤的生长;这点已经有学者在白血病以及其他恶性实体肿瘤的细胞模型研究中得以证实[9]。但是否在胶质瘤,尤其是在恶性胶质母细胞瘤中,也存在同样的机制,值得进一步研究和探讨;以及进一步研究靶向该基因的药物,延长胶质瘤患者,尤其是恶性胶质母细胞瘤患者的生存期,且能提高患者的生活质量。
本研究发现,Evi1基因可以激活U87、U251细胞下游的肿瘤侵袭相关基因MMP2。MMP2属于Ⅳ型胶原酶/明胶酶,可降解基底膜Ⅳ型胶原和变性的间质胶原(明胶),对肿瘤侵袭、浸润起着至关重要的作用[10]。基底膜是颅内血-脑屏障,以及神经胶质细胞的作用造成天然的防御作用。但肿瘤细胞分泌的MMP2或激活MMP2通路后,对肿瘤内和周围组织的基底膜能起到破坏作用,造成肿瘤细胞和血-脑屏障的破坏;导致肿瘤细胞的浸润加剧,进而肿瘤实体的形成和发展扩散。
[1] Wen PY,Kesari S.Malignant gliomas in adults[J].N Engl J Med,2008,359:492.
[2] Buonamici S,Chakraborty S,Senyuk V,etal.The role of EVI1 in normal and leukemic cells[J].Blood Cells Mol Dis,2003,31:206.
[3] Fuchs O.EVI1 and its role in myelodysplastic syndrome,myeloid leukemia and other malignant diseases [J].Cas Lek Cesk,2006,145:619.
[4] Nanjundan M,Nakayama Y,Cheng KW,etal.Amplification of MDS1/EVI1 and EVI1,located in the 3q26.2 amplicon,is associated with favorable patient prognosis in ovarian cancer[J].Cancer Res,2007,67:3074.
[5] Yasui K,Konishi C,Gen Y,etal.EVI1,a target gene for amplification at 3q26,antagonizes transforming growth factor-β-mediated growth inhibition in hepatocellular carcinoma[J].Cancer Sci,2015,106:929.
[6] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25:402.
[7] Wang Y,Gao S,Wang W,etal.Temozolomide inhibits cellular growth and motility via targeting ERK signaling in glioma C6 cells[J].Mol Med Rep,2016,14:5732.
[8] Ho PA,Alonzo TA,Gerbing RB,etal.High EVI1 expression is associated with MLL rearrangements and predicts decreased survival in paediatric acute myeloid leukaemia:a report from the children's oncology group[J].Br J Haematol,2013,162:670.
[9] Yoshimi A,Goyama S,Watanabe-Okochi N,etal.Evi1 represses PTEN expression and activates PI3K/AKT/mTOR via interactions with polycomb proteins[J].Blood,2011,117:3617.
[10] Kunz P,Sähr H,Lehner B,etal.Elevated ratio of MMP2/MMP9 activity is associated with poor response to chemotherapy in osteosarcoma[J].BMC Cancer,2016,16:223.
EffectsofEvi1geneonproliferationandinvasionofgliomacelllineU87/U251
YURen-chun,HUYuan,SUNChun-ming,etal.
DepartmentofNeurosurgery,TaizhouSecondPeople’sHospital,TaiZhou225500,China
SUNChun-ming
ObjectiveTo investigate the expression of Evi1 gene in different grades of glioma tissues,and to investigate the effects of Evi1 gene on the proliferation,cell cycle and invasion of glioma cell lines U87 and U251,and to provide objective evidence for targeting oncogene treatment of glioma.MethodsFirst,real-time quantitative PCR (QRT-PCR) was used to detect the expression of Evil gene in glioma tissues and U87 and U251 cell lines.The interference of U87 and U251 cells with small interfering RNA(siRNA )was used as the interference group,and blank control group and negative control group were set up.The expression and transfection efficiencies of Evi1 gene in U87 and U251 cells were detected by QRT-PCR before and after transfection.CCK-8 assay was used to detect the proliferation of the cells in the experimental group,cell cycle analysis was performed by flow cytometry (FCM).Transwell assay and scratch test were used to detect the invasion and migration of U87 and U251 cells.And we can detect the expression of matrix metalloproteinase-2 (MMP-2) in U87 and U251 cells after down-regulation of Evi1 gene by QRT-PCR.ResultsEvi1 gene was highly expressed in glioma tissues,and its expression level also increased with the increase of glioma grade.The expression of Evi1 gene in grade III and IV glioma and U87 and U251 cells was significantly higher than that in non-tumor brain tissue (allP<0.05).After down-regulating the Evi1 gene by siRNA,The proliferation of glioma cell lines U87 and U251 was slowed down (allP<0.05),and the ability of invasion and migration was significantly decreased (allP<0.01),and block the cell cycle G1 phase (P<0.05).The expression of MMMP2 in interference groupU87 and U251 cells was significantly decreased (allP<0.01).ConclusionEvi1 gene was highly expressed in glioma.By interfering with the Evi1 gene,it can inhibit the U87 / U251 glioma cell line proliferation and invasion.
Evi1 gene;glioma;RNA interference;proliferation;invasion
国家自然科学基金(81372689)
225500 泰州市第二人民医院神经外科(余仁春);苏州大学附属第一医院神经外科暨脑神经研究室(胡圆,孙春明,殷洪伟,周幽心)
孙春明
10.3969/j.issn.1672-7770.2017.06.004
R739.41
A
1672-7770(2017)06-0417-06
(收稿2017-03-02 修回2017-04-27)

