糖痹康对糖尿病周围神经病变大鼠坐骨神经PERK-Nrf2信号通路的影响*
穆晓红,高 健,刘铜华,秦灵灵,孙 文,吴丽丽,李伟笠,邓博文,李筱叶
(1.北京中医药大学东直门医院,北京100700;2.对外经济贸易大学,北京100023;3.北京中医药大学,北京100029)
糖痹康对糖尿病周围神经病变大鼠坐骨神经PERK-Nrf2信号通路的影响*
穆晓红1,高 健2,刘铜华3,秦灵灵3,孙 文3,吴丽丽3,李伟笠3,邓博文3,李筱叶3
(1.北京中医药大学东直门医院,北京100700;2.对外经济贸易大学,北京100023;3.北京中医药大学,北京100029)
目的:观察糖痹康对糖尿病大鼠坐骨神经中PERKNrf2信号通路的影响。方法:将雄性SD大鼠采用STZ法造模,成功后随机分为模型对照组,弥可保组,糖痹康高、中、低剂量组,另选正常SD大鼠为正常对照组。弥可保组腹腔注射弥可保0.026 8g/(kg·d);糖痹康高、中、低剂量组依次灌胃糖痹康16.700,8.350,4.175 g/(kg·d)。所有药物均以9 g/L生理盐水配制,给药量为0.01 mL/g体质量。模型对照组和正常对照组均予等量的生理盐水灌胃,1 d 1次,连续16周。剖取大鼠坐骨神经,Western blot检测坐骨神经中磷酸化的蛋白激酶样内质网激酶(PERK)、转录因子NF-E2相关因子2(Nrf2);Real-time PCR检测坐骨神经中血红素加氧酶-1(HO-1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)mRNA 表达。结果:与正常对照组对比,模型对照组大鼠坐骨神经PERK、Nrf2蛋白表达显著降低,HO-1、γ-GCS mRNA表达显著降低,差别有统计学意义(P<0.05)。与模型对照组对比,弥可保组和糖痹康高、中、低剂量组大鼠坐骨神经PERK、Nrf2蛋白表达显著升高,HO-1、γ-GCS mRNA表达显著升高,差别有统计学意义(P<0.05)。结论:糖痹康通过上调PERK-Nrf2信号通路表达,发挥抗氧化作用,延缓糖尿病周围神经病变进展。
糖痹康/药效学;糖尿病周围神经病变;磷酸化的蛋白激酶样内质网激酶(p-PERK);转录因子NF-E2相关因子2(Nrf2);血红素加氧酶-1(HO-1);γ-谷氨酰半胱氨酸合成酶(γ-GCS);动物;大鼠
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病患者常见并发症,常导致感觉神经、运动神经损伤,出现肢体麻木、疼痛、肌肉无力及萎缩等症状。研究发现,神经病变与氧化应激关系密切[1-3],其中磷酸化的蛋白激酶样内质网激酶(PERK)—转录因子NF-E2相关因子2(Nrf2)信号通路对高糖环境下活性氧的产生有抑制作用,能够改善抗氧化应激损伤[4],在DPN的防治中发挥重要作用。血红素加氧酶-1(HO-1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)是PERK-Nrf2信号通路调节的抗氧化蛋白,同样参与抗氧化应激作用[5]。糖痹康由黄芪、女贞子、桂枝、赤芍、黄芩、黄连、水蛭等组成,是在《金匮要略》黄芪桂枝五物汤基础上根据临床经验加减化裁而成,已获发明专利(专利申请号:200810167551.1)。前期研究[6-8]发现:糖痹康能够改善DPN大鼠神经传导速度、调节大鼠血清及坐骨神经中神经生长因子(nerve growth factor,NGF)含量和表达、抑制神经细胞凋亡等发挥抗氧化应激的作用。本研究建立DPN大鼠模型并以糖痹康进行干预,研究PERK-Nrf2及其下游基因 HO-1、γ-GCS的表达,以探讨糖痹康对DPN的作用机制。
1 材料与方法
1.1 动 物
SPF级雄性健康SD大鼠80只,6~7周龄,体质量180~230 g,购自北京维通利华动物实验中心,动物许可证号:SCXK(京)2006-0009。大鼠饲养于北京中医药大学实验动物中心SPF级动物实验室,温度(23±2)℃、湿度(55±10)%,12/12 h光照、黑暗循环,自由摄食、饮水。
1.2 药品、试剂与仪器
糖痹康颗粒处方组成:黄芪、女贞子、桂枝、赤芍、黄芩、黄连、水蛭等,颗粒剂由北京中医药大学中药学院提取、制备;弥可保(a-硫辛酸),购自卫材药业有限公司,批号141003;链脲佐菌素(STZ),美国Sigma公司产品,批号S0130;高脂饲料(基础饲料65.75%、蔗糖20%、猪油10%、蛋黄粉3%、胆固醇1%、猪胆盐0.25%),北京科奥协力饲料有限公司产品;Trizol试剂盒,购自Life Technologies公司,批号98903;I抗 Nrf2 Rabbit mAb(货号 12721)、Phospho-PERK Rabbit mAb(货号3179)、Ⅱ抗Anti-rabbit IgG(H+L)(货号14708),均为 CST公司产品;THUNDERBIRD SYBR qPCR Mix,日本 TOYOBO 公司产品,货号QPS-201;ECL发光液,购自美国BIORAD公司,批号170-5060。E9032型酶标仪,美国Promega公司产品;Prism 7 500型PCR扩增仪,美国ABI公司产品;BX53型光学显微镜,日本Olympus公司产品;Mini-PROTEAN Tera System型垂直电泳仪、转移槽,美国Bio-Rad公司产品;ChemiDocTM XRS+with Image LabTM Software凝胶成像系统,美国Bio-Rad公司产品。
1.3 模型的建立、分组与给药
将雄性SD大鼠适应性喂养1周,按体质量随机取10只作为正常对照组,以普通饲料喂养;其余大鼠以高脂饲料喂养8周后,禁食不禁水过夜,次日腹腔注射STZ 45 μg/g造模,72 h后用血糖仪测尾尖血血糖,血糖水平持续≥16.7 mmol/L且稳定3 d者为造模成功[7]。将造模成功的大鼠按体质量、血糖随机分为模型对照组,弥可保组,糖痹康高、中、低剂量组5组,每组10只。各组大鼠按体表面积法换算给药剂量:弥可保组腹腔注射弥可保0.026 8 g/(kg·d);糖痹康高、中、低剂量组依次灌胃糖痹康16.700 0,8.350 0,4.175 0 g/(kg·d)。所有药物均以 9 g/L生理盐水配制,给药量为0.01 mL/g体质量,模型对照组和正常对照组均予等量的生理盐水灌胃,1 d 1次,连续16周。
1.4 检测指标
连续给药16周后,禁食不禁水12 h,根据大鼠体质量,按350 μg/g的剂量腹腔注射100 g/L水合氯醛麻醉,腹主动脉取血,处死大鼠,迅速剖取大鼠两侧坐骨神经并以液氮冻存,待用。
1.4.1 大鼠坐骨神经中PERK、Nrf2蛋白表达
以Western blot测定。取冻存的大鼠坐骨神经,按RIPA试剂盒步骤提取总蛋白,加上样缓冲液,100℃ 5 min 蛋白变性;上样 20 μg/孔,10%SDSPAGE凝胶跑电泳,100V 2 h;半干法凝胶转膜100 A 1 h;TBS溶液室温洗膜15 min;Blocking one/Blocking one-P封闭30 min,I抗(1∶1 000稀释)孵育,4℃ 过夜;洗膜后II抗(1∶10 000稀释)孵育,室温1 h;洗膜后,ECL发光液室温反应1 min,凝胶成像系统成像,以Image J 7.0分析蛋白条带。
1.4.2 坐骨神经中 HO-1、γGCS mRNA 表达
以Real-time PCR测定。取冻存的大鼠坐骨神经,Trizol提取总RNA;GoScriptTMReverse Transcription System试剂盒反转录,退火25℃ 5min,延伸42℃ 1 h,灭活 70℃ 15 min,得到 cDNA。配制20 μL反应体系:2 μL cDNA 稀释液 +10 μL GoTaq反应液 +7.2 μL Nuclease-Free Water+0.8μL 引物混合,Applied Biosystems 7500 Real Time PCR System扩增,条件:95℃ 10 min;95℃ 15 s,60℃1 min(共40次循环);95℃ 15s,60℃ 15 s溶解。结果采用2-△△CT相对定量法比较各组目标mRNA表达差异。引物见表1。

表1 引物
1.5 统计学方法
2 结果
2.1 各组大鼠坐骨神经PERK、Nrf2蛋白表达对比
与正常对照组对比,模型对照组大鼠坐骨神经PERK、Nrf2蛋白表达显著降低,差别有统计学意义(P<0.05)。与模型对照组对比,各给药组PERK、Nrf2蛋白表达显著升高,差别有统计学意义(P<0.05)。见表2、图1。
表2 各组大鼠坐骨神经PERK、Nrf2蛋白表达对比n=10±s

表2 各组大鼠坐骨神经PERK、Nrf2蛋白表达对比n=10±s
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05
分组 剂量/(g·kg-1·d -1)PERK/β-actin Nrf2/β-actin正常对照组 —0.86 ±0.13 0.80 ±0.04模型对照组 — 0.37±0.06* 0.28±0.11*弥可保组 0.026 8 0.82 ±0.17# 0.78 ±0.07#糖痹康高剂量组 16.700 0 0.94 ±0.10# 0.98 ±0.14#糖痹康中剂量组 8.350 0 0.76 ±0.07# 0.85 ±0.15#糖痹康低剂量组 4.175 0 0.70 ±0.12# 0.80 ±0.10#

图1 各组大鼠坐骨神经PERK、Nrf2蛋白条带
2.2 各组大鼠坐骨神经HO-1、γGCS mRNA表达对比
与正常对照组对比,模型对照组大鼠坐骨神经HO-1、γGCS mRNA表达显著降低,差别有统计学意义(P<0.05)。与模型对照组对比,各给药组HO-1、γGCS mRNA表达显著升高,差别有统计学意义(P <0.05)。结果见表3。
表3 各组大鼠坐骨神经HO-1、γGCS mRNA表达对比n=10,±s
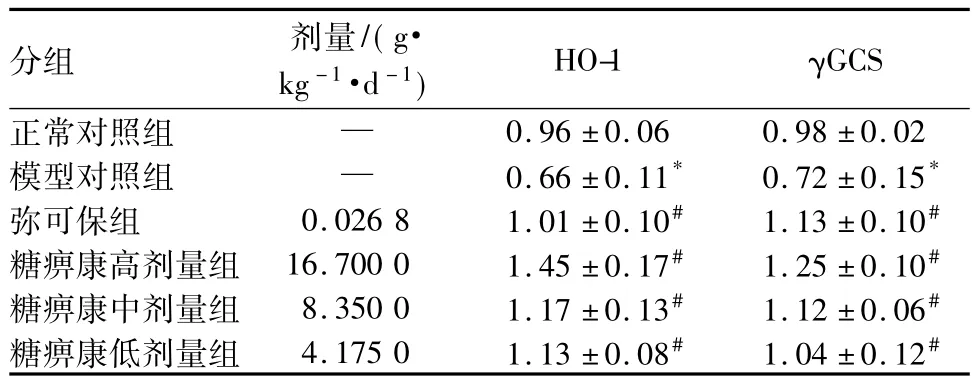
表3 各组大鼠坐骨神经HO-1、γGCS mRNA表达对比n=10,±s
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05
分组 剂量/(g·kg-1·d -1) HO-1 γGCS正常对照组 —0.96 ±0.06 0.98 ±0.02模型对照组 — 0.66±0.11* 0.72±0.15*弥可保组 0.026 8 1.01 ±0.10# 1.13 ±0.10#糖痹康高剂量组 16.700 0 1.45 ±0.17# 1.25 ±0.10#糖痹康中剂量组 8.350 0 1.17 ±0.13# 1.12 ±0.06#糖痹康低剂量组 4.175 0 1.13 ±0.08# 1.04 ±0.12#
3 讨论
氧化应激是机体氧自由基生成和(或)消除能力之间的不平衡,出现活性氧簇(ROS)增加与抗氧化清除减弱,最终导致损伤组织细胞、蛋白的过程[9]。研究表明,高糖状态下机体多条旁路代谢途径激活,引起细胞内产生过多ROS,诱导氧化应激发生[10]。因此,氧化应激在在糖尿病发展中至关重要。据糖尿病并发症的统一机制学说,DPN发病核心是高糖引起线粒体中ROS生成过多,引发组织细胞发生氧化应激,导致DNA损伤,引起周围血管、神经病变,出现血流变异常,神经传导速度减低以及病理改变等,最终导致 DPN[11]。
PERK作为内质网上跨膜蛋白之一,正常情况下发生磷酸化而被激活,激活后的PERK能够激活Nrf2,活化后的Nrf2进入细胞核内与小Maf蛋白结合调控基因转录,包括 HO-1、γGCS[12-13]。PERKNrf2是重要的抗氧化应激通路,在延缓糖尿病及其并发症的发展中发挥重要作用。研究表明,DPN患者存在氧化应激导致体内ROS产生过多,各种抗氧化物质如 HO-1、γGCS 等降低,抗氧化能力下降[14]。PERK-Nrf2信号通路激活可降低DPN患者ROS的产生,同时调控抗氧化基因HO-1、γGCS的转录,而HO-1、γGCS能够启动机体抗氧化系统,清除自由基起到保护细胞的作用[15-16]。本研究结果显示:模型对照组大鼠坐骨神经内PERK、Nrf2蛋白表达与HO-1、γGCS mRNA表达均较正常大鼠显著降低,而经过糖痹康治疗后,此4个指标表达均显著升高,表明糖痹康对PERK-Nrf2信号通路及其下游分子HO-1、γGCS的表达具有调控作用。
中医学认为DPN属于“痹症”“痿证”等范畴,是气阴两虚基础上导致久病入络、脉络瘀阻、气血运行阻滞的过程,治疗上应以益气养阴、化瘀通络为法[17]。糖痹康方中黄芪、女贞子益气养阴,黄芩、黄连清热解毒,赤芍、水蛭活血化瘀通络,桂枝通脉。全方共奏益气养阴清热、化瘀通络之效。本实验结果提示:糖痹康通过调控调PERK-Nrf2信号通路及其下游分子HO-1、γGCS的表达而抵抗活跃氧化应激,从而改善神经细胞功能来状态,进而起到了神经保护作用。
[1]安春耀,刘德山.晚期糖基化终末产物与糖尿病周围神经病变关系新进展[J].医学综述,2017,23(15):3062-3067.
[2]饶潇潇,姚广涛,文小平.中药干预糖尿病周围神经病变作用机制研究进展[J].中国中医药信息杂志,2017,24(4):130-133.
[3]秦保锋,朱旭莹,翁伟力,章丽琼,张红智,郭咏梅.黄芪桂枝五物汤对糖尿病周围神经病变患者血清谷胱甘肽过氧化物酶活性的影响[J].上海中医药大学学报,2017,31(2):36 -39.
[4]YANG X,YAO W,LIU H,et al.Tangluoning,a traditional Chinese medicine,attenuates in vivo and in vitro diabetic peripheral neuropathy through modulation of PERK/Nrf2 pathway[J].Sci Rep,2017,7(1):1014.
[5]姚伟洁,杨鑫伟,李情琴,等.糖络宁对糖尿病周围神经病变大鼠Nrf2/ARE通路的影响[J].北京中医药,2016,35(3):218 -221,289.
[6]易文明,孙文,郭翔宇,等.糖痹康对糖尿病周围神经病变大鼠氧化应激及细胞凋亡的影响[J].环球中医药,2015,8(7):798 -802.
[7]张岩,穆晓红,孙文,等.糖痹康对糖尿病大鼠坐骨神经Keap1/Nrf2信号的作用机制[J].中华中医药杂志,2016,31(5):1822 -1827.
[8]吕翠岩,张胜容,徐暾海,等.中药复方糖痹康改善氧化应激的分子机制探讨[J].中华中医药学刊,2016,34(3):529-531.
[9]ZHAI CM,JIA BY,WANG ZB,et al.Nrf2-NF-κB pathway axes,epigenetic regulation and traditional Chinese medicine(natural medicine)to treat type 2 diabetes[J].Zhongguo Zhong Yao Za Zhi,2016 ,41(23):4314 -4319.
[10]COUDRIETGM, DELMASTRO-GREENWOODMM,PREVITE DM,et al.Treatment with a Catalytic Superoxide Dismutase(SOD)Mimetic Improves Liver Steatosis,Insulin Sensitivity,and Inflammation in Obesity-Induced Type 2 Diabetes[J].Antioxidants(Basel),2017 ,6(4):E85
[11]JI ZH,LIU ZJ,LIU ZT,et al.Diphenyleneiodonium Mitigates Bupivacaine-Induced Sciatic Nerve Damage in a Diabetic Neuropathy Rat Model by Attenuating Oxidative Stress[J].Anesth Analg,2017 ,125(2):653 -661.
[12]YANG X,YAO W,LIU H,et al.Tangluoning,a traditional Chinese medicine,attenuates in vivo and in vitro diabetic peripheral neuropathy through modulation of PERK/Nrf2 pathway[J].Sci Rep,2017,7(1):1014.
[13]SZTANEK F,MOLNRN MOLNR ,BALOGH Z.The role of oxidative stress in the development of diabetic neuropathy[J].Orv Hetil,2016 ,157(49):1939 -1946.
[14]MCDONNELL C,LENEZ S,POL O.The induction of the transcription factor Nrf2 enhances the antinociceptive effects of delta-opioid receptors in diabetic mice[J].PLoS One,2017,12(7):e0180998.
[15]THIPKAEW C,WATTANATHORN J,MUCHIMAPURA S.Electrospun Nanofibers Loaded with Quercetin Promote the Recovery of Focal Entrapment Neuropathy in a Rat Model of Streptozotocin-Induced Diabetes[J].Biomed Res Int,2017,2017:2017493.
[16]SHI Y,LIANG XC,ZHANG H,et al.Combination of quercetin,cinnamaldehyde and hirudin protects rat dorsal root ganglion neurons against high glucose-induced injury through Nrf-2/HO-1 activation and NF-κB inhibition[J].Chin J Integr Med,2017 ,23(9):663-671.
[17]方朝晖,吴以岭,赵进东.糖尿病周围神经病变中医临床诊疗指南(2016年版)[J].中医杂志,2017,58(7):625-630.
R573.1
B
10.3969/j.issn.1001 -6910.2017.11.32
1001-6910(2017)11-0070-04
刘铜华,北京中医药大学,教授,thliu@vip.163.com
国家自然基金项目(81202970);教育部新世纪人才项目(NCET-12-0805)
2017-10-19;
2017-11-16(编辑 陶 珠)

