白藜芦醇对TRAIL耐药HT29细胞的干预作用及机制研究
车 佳
白藜芦醇对TRAIL耐药HT29细胞的干预作用及机制研究
车 佳
目的 探讨白藜芦醇是否能提高耐药结直肠癌细胞对TRAIL的敏感性并研究其机制。方法 将TRAIL耐药HT29细胞(TR-HT29细胞)按对照组、白藜芦醇组、TRAIL组、白藜芦醇+TRAIL组及白藜芦醇+TRAIL+HAX-1质粒组进行分组后,CCK-8法检测TR-HT29细胞活力,流式细胞术检测TR-HT29细胞的凋亡程度和线粒体膜电位,Western blot实验检测TR-HT29细胞HAX-1表达水平、细胞色素C的释放和Caspase-3的活化。结果 TR-HT29细胞对TRAIL的半数有效浓度(IC50)(19.4±1.3)ng/mL 显著高于 HT29 细胞的(1.8±0.2)ng/mL,(P<0.05)。白藜芦醇处理可显著抑制TR-HT29细胞HAX-1蛋白的表达水平。白藜芦醇+TRAIL组TR-HT29的细胞活力抑制率(53.6±4.4)%,凋亡诱导率(39.4±2.9)%,显著高于TRAIL组的细胞活力抑制率[(14.3±1.0)%,P<0.05]、凋亡诱导率[(9.6±0.7)%,P<0.05]和白藜芦醇+TRAIL+HAX-1质粒组的细胞活力抑制率[(19.9±1.5)%,P<0.05]、凋亡诱导率[(13.8±1.1)%,P<0.05]。白藜芦醇+TRAIL组TR-HT29的线粒体膜电位显著低于TRAIL组和白藜芦醇+TRAIL+HAX-1质粒组。白藜芦醇+TRAIL组TR-HT29细胞色素C的释放和Caspase-3的活化显著高于TRAIL组和白藜芦醇+TRAIL+HAX-1质粒组。结论白藜芦醇通过下调HAX-1表达提高耐药结直肠癌细胞对TRAIL的敏感性。
结直肠癌;TRAIL;白藜芦醇;HAX-1;凋亡
TNF相关凋亡诱导配体(TNF-related apoptosis- inducing ligand,TRAIL)是一种由巨噬细胞分泌的细胞因子,能选择性地诱导肿瘤细胞发生凋亡而不影响正常细胞的功能,因此TRAIL是一种很有前景的抗肿瘤药物[1]。然而肿瘤细胞对TRAIL的获得性耐药严重降低了它的抗肿瘤疗效[2]。本研究的目的在于探讨白藜芦醇是否能提高耐药结直肠癌细胞对TRAIL的敏感性并研究其机制。
1 实验材料
1.1 试 剂 TRAIL(批号P50591)购于美国Ramp;D system公司。白藜芦醇(批号R5010)、细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8,批号 96992)、凋亡检测试剂盒(批号APOAF)购于美国Sigma-Aldrich。HCLS1 相关蛋白-1(HCLS1 associated protein X-1,HAX-1,批号 sc-28268)、细胞色素 c(批号sc-13560)、活化半胱天冬酶(活化 caspase-3,批号sc-22171)和 β-肌动蛋白(β-actin,批号 sc-1615)抗体购于美国Santa Cruz公司。增强型化学发光(Enhanced chemiluminescence,ECL) 试 剂 盒 (批 号32106)购于美国Pierce公司。细胞线粒体分离试剂盒(批号C3601)购于江苏碧云天生物科技有限公司。pcDNA3.1(批号V79020)和转染试剂脂质体2000(Lipofectamine 2000,批号 11668019)购于美国Invitrogen 公司。线粒体膜电位染料 JC-1(5,5,6,6-tetrachloro-1,1,3,3-tetraethylbenzimidazolylcarbocyanine iodide,批号65-0851-38)购于美国Molecular Probes公司。
1.2 细胞培养 本研究2014年12月—2016年11月完成于本院实验室。人结直肠癌细胞系HT29购于中科院上海细胞库。细胞培养在含10%胎牛血清的RPMI-1640培养基中,置于37°C恒温培养箱中并通入5%CO2。细胞每2~3天传代一次,传代时,用胰酶消化液使细胞进入悬浮状态并用含10%胎牛血清的RPMI-1640培养基洗涤两次,将细胞悬液按1:3稀释后传代。TRAIL耐药HT29(TR-HT29)细胞用TRAIL梯度暴露法进行诱导构建,简要步骤如下:首先将HT29细胞用含0.1ng/mL的TRAIL的培养基培养10周,之后每3周将TRAIL浓度提高0.02ng/mL,最终使HT29细胞稳定培养在含0.3ng/mL TRAIL的培养基中。在进行实验前,先将TR-HT29细胞置于不含TRAIL的培养基中培养1周,以消除残余TRAIL对实验的影响。
2 实验方法
2.1 质粒构建及转染 将HAX-1基因的开放阅读框架序列以分子克隆的方法与pcDNA3.1连接后构建成HAX-1重组真核表达质粒。使用Lipofectamine 2000按照试剂操作说明书步骤将2μg/mL HAX-1重组质粒转染入TR-HT29细胞中,培养24h。
2.2 TRAIL半数有效浓度(IC50)的测定 将HT29或TR-HT29细胞按5×103/孔接种在96孔板上孵育过夜,分为HT29细胞组和TR-HT29细胞组。两组细胞用不同浓度的TRAIL处理48h后进行CCK-8细胞活力检测实验,根据CCK-8细胞活力实验结果计算TRAIL对HT29细胞和TR-HT29细胞的IC50。
2.3 CCK-8细胞活力检测实验 将TR-HT29细胞按5×103/孔接种在96孔板上孵育过夜。实验分为对照组、白藜芦醇组、TRAIL组、白藜芦醇+TRAIL组及白藜芦醇+TRAIL+HAX-1质粒组。对照组为TRHT29细胞用生理盐水处理48h,白藜芦醇组为TRHT29细胞用10μmol/L白藜芦醇处理48h,TRAIL组为TR-HT29细胞用5ng/mL TRAIL处理48h,白藜芦醇+TRAIL组为TR-HT29细胞用10μmol/L白藜芦醇+5ng/mL TRAIL处理48h,白藜芦醇+TRAIL+HAX-1质粒组为TR-HT29细胞用10μmol/L白藜芦醇+5ng/mL TRAIL+2μg/mL HAX-1质粒处理 48h。在经过药物处理的TR-HT29细胞培养体系中加入20μL的CCK-8试剂并在37°C下培养2h,培养后将96孔板用450nm波长的酶标仪检测OD值,细胞活力抑制率用以下公式计算:抑制率=(OD对照组-OD药物处理组)/OD对照组×100%。
2.4 细胞凋亡实验 将TR-HT29细胞按上述进行分组处理,之后按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20min,采用流式细胞术检测TR-HT29细胞的凋亡,凋亡率用Annexin-V阳性细胞数占总细胞数的百分比表示。
2.5 细胞线粒体膜电位检测 将TR-HT29细胞按上述进行分组处理,处理完毕后将细胞用JC-1试剂孵育20min。之后将细胞用生理盐水离心洗涤5次并用流式细胞仪进行检测。JC-1能聚集在正常线粒体并发出红色荧光,若线粒体膜电位降低则JC-1不能聚集在线粒体中,因此红色荧光越强表明细胞线粒体膜电位越高。
2.6 线粒体分离 将TR-HT29细胞按上述进行分组处理,之后用细胞线粒体分离试剂盒按照试剂操作说明书步骤将TR-HT29细胞的线粒体分离出来,细胞质进行Western blot实验用于检测细胞色素C的释放。
2.7 Western blot实验 将TR-HT29细胞按上述进行分组处理,之后将细胞用细胞裂解液进行裂解,提取总蛋白质(或线粒体分离试剂盒分离出的细胞质)进行Western blot实验。样品用12%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用HAX-1、细胞色素C、活化caspase-3和β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2h,蛋白条带用ECL试剂盒显色发光。
3 结果
3.1 白藜芦醇提高TR-HT29细胞对TRAIL的敏感性 测定HT29细胞和TR-HT29细胞对TRAIL的敏感性,结果显示TRAIL对TR-HT29细胞的IC50显著高于HT29细胞(见表1),表明TR-HT29细胞有明显药物抵抗性。将TR-HT29细胞用白藜芦醇和TRAIL进行体外处理,CCK-8实验结果显示联合白藜芦醇后,TRAIL对TR-HT29的细胞活力抑制率显著提高;流式细胞实验结果显示白藜芦醇也同样能显著增强TRAIL对TR-HT29细胞的凋亡诱导活性(见表2),表明白藜芦醇能提高耐药结直肠癌细胞对TRAIL的敏感性。Western blot实验结果显示白藜芦醇处理能显著抑制TR-HT29细胞中HAX-1蛋白的表达水平,而TRAIL处理对HAX-1无影响(见图1)。在TR-HT29细胞中转染HAX-1质粒使之强制表达,从而对抗白藜芦醇对HAX-1蛋白的抑制作用。实验结果显示,转染HAX-1质粒后,白藜芦醇对TRAIL的协同抗肿瘤效应受到明显抑制(见表2),表明白藜芦醇是通过抑制HAX-1蛋白的表达提高耐药结直肠癌细胞对TRAIL敏感性。
表1 TRAIL对HT29细胞及TR-HT29细胞IC50(±s)
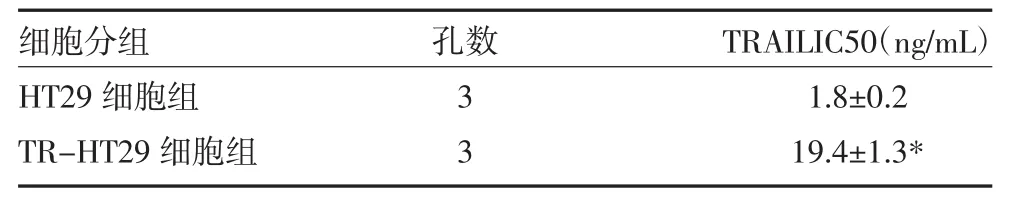
表1 TRAIL对HT29细胞及TR-HT29细胞IC50(±s)
注:与HT29细胞比较,*P<0.05
孔数细胞分组HT29细胞组TR-HT29细胞组3 3 TRAILIC50(ng/mL)1.8±0.2 19.4±1.3*

图1 白藜芦醇下调TR-HT29细胞HAX-1蛋白表达水平
3.2 白藜芦醇通过下调HAX-1蛋白表达促进TRAIL对TR-HT29细胞线粒体的损伤 流式细胞结果显示,白藜芦醇能显著增强TRAIL对TR-HT29细胞线粒体的损伤,而转染HAX-1质粒后,白藜芦醇联合TRAIL的线粒体的损害效应受到显著抑制(见图2),表明白藜芦醇能通过下调HAX-1蛋白的表达促进TRAIL对TR-HT29细胞线粒体的损伤。
表2 白藜芦醇提高TR-HT29细胞对TRAIL的敏感性(±s)
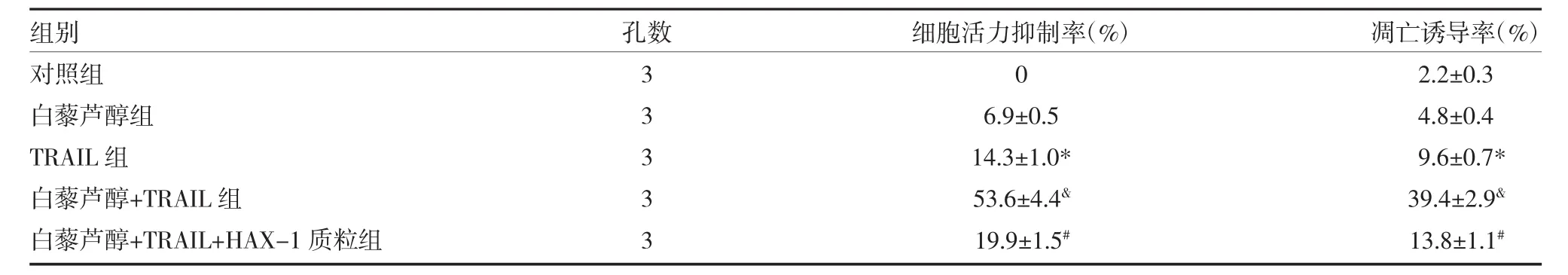
表2 白藜芦醇提高TR-HT29细胞对TRAIL的敏感性(±s)
注:与对照组比较,*P<0.05,与 TRAIL 组比较,amp;P<0.05,与白藜芦醇+TRAIL 组比较,#P<0.05
组别对照组白藜芦醇组TRAIL组白藜芦醇+TRAIL组白藜芦醇+TRAIL+HAX-1质粒组孔数3 3 3 3 3细胞活力抑制率(%)0 6.9±0.5 14.3±1.0*53.6±4.4amp;19.9±1.5#凋亡诱导率(%)2.2±0.3 4.8±0.4 9.6±0.7*39.4±2.9amp;13.8±1.1#
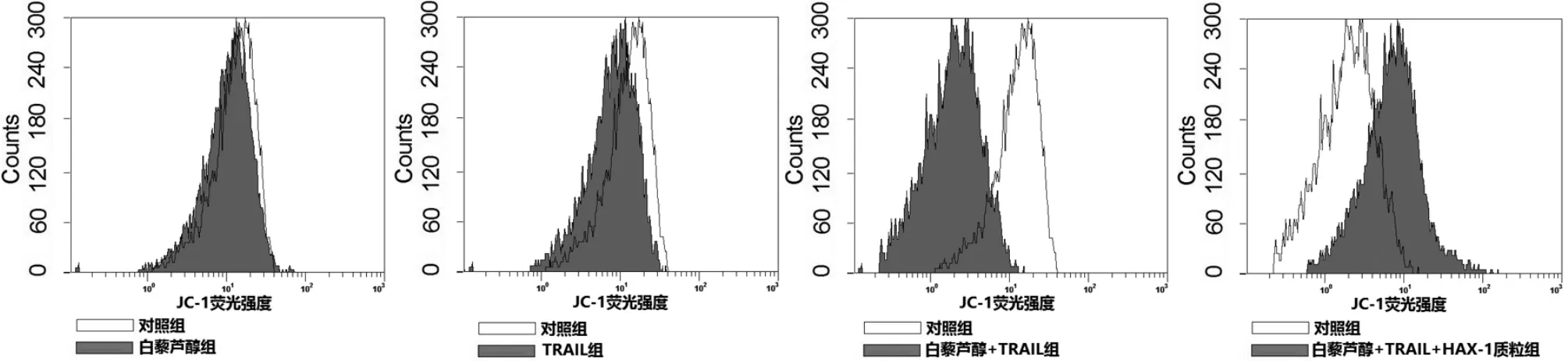
图2 白藜芦醇通过下调HAX-1蛋白的表达促进TRAIL对TR-HT29细胞线粒体的损伤
3.3 白藜芦醇通过下调HAX-1蛋白的表达促进TRAIL诱导的细胞色素C的释放和Caspase-3的活化 Western blot结果显示白藜芦醇能显著增强TRAIL诱导的细胞色素C的释放和Caspase-3的活化,而同时转染HAX-1质粒后,两者联合诱导的细胞色素C的释放和Caspase-3的活化受到显著抑制(见图3),表明白藜芦醇通过下调TR-HT29细胞中HAX-1蛋白的表达增强TRAIL依赖的线粒体途径凋亡。

图3 白藜芦醇通过下调TR-HT29细胞中HAX-1蛋白的表达增强TRAIL依赖的细胞色素C的释放和Caspase-3活化
4 讨论
结直肠癌是一种很常见的消化道恶性肿瘤,其发病率居于全球第三位。结直肠癌的恶性程度很高,肿瘤转移能力很强,因此结直肠癌的致死率非常高[3]。在结直肠癌的常规治疗中,抗肿瘤药物的使用是不可替代的方法,其疗效在很大程度上决定了结直肠癌患者的预后,然而随着抗肿瘤药物的持续使用,结直肠癌细胞会逐渐产生耐药性[4]。因此药物治疗对耐药结直肠癌细胞的疗效很差,提高耐药结直肠癌细胞对药物的敏感性具有十分重要的临床意义。
TRAIL能与肿瘤细胞表面的死亡受体4或死亡受体5发生结合,形成死亡诱导信号复合物(deathinducing signaling complex,DISC)。这个复合物能使Caspase-8发生活化,诱导线粒体膜电位的降低,从而使线粒体发生损伤。受损的线粒体会大量释放其中的细胞色素c这一强烈的凋亡诱导因子,最后使Caspase-3发生活化并使细胞进入凋亡程序[5-7]。由于TRAIL能选择性地诱导肿瘤细胞发生凋亡而对正常细胞影响不大,因此,TRAIL是一种很好的抗结直肠癌药物。然而由于重复给药很容易造成结直肠癌细胞的获得性药物抵抗,因此通过辅助治疗手段提高结直肠癌细胞对TRAIL的敏感性,减弱获得性药物抵抗是提高TRAIL疗效的有效方法。
白藜芦醇是一种天然存在的多酚类药物,对多种疾病均有良好的治疗效果。近期的研究表明白藜芦醇还有一定的抗肿瘤效应,如能在一定程度上抑制结直肠癌细胞的增殖和转移[8],大剂量还可通过ROS途径诱导卵巢癌细胞发生凋亡[9]。然而,白藜芦醇是否对已产生获得性TRAIL耐药的结直肠癌细胞有增敏作用,至今还未充分报道。本研究的实验结果表明白藜芦醇能显著增强TRAIL对耐药结直肠癌细胞的杀伤活性和凋亡诱导活性,因此白藜芦醇是良好的辅助抗肿瘤药物。
HAX-1是一种定位在线粒体外膜上的抗凋亡蛋白[10]。研究表明,过表达的HAX-1能阻碍肿瘤细胞的凋亡途径,抑制抗肿瘤药物引起的肿瘤细胞线粒体的损伤,因此肿瘤细胞的HAX-1往往过度表达,且HAX-1的过表达程度与肿瘤细胞对化疗药物的敏感性呈负相关[11]。本研究证实白藜芦醇能下调TRAIL耐药结直肠癌细胞中HAX-1蛋白的表达,从而促进TRAIL损伤肿瘤细胞的线粒体,释放细胞色素C进入细胞质进而诱导耐药结直肠癌细胞发生Caspase-3依赖的凋亡。当转染HAX-1表达质粒使HAX-1蛋白发生过表达后,白藜芦醇的协同抗肿瘤效应明显减弱,表明白藜芦醇发挥作用的机制和HAX-1蛋白的下调有关。
综上所述,白藜芦醇能显著提高耐药结直肠癌细胞对TRAIL的敏感性。其机制为白藜芦醇下调HAX-1蛋白的表达,诱导耐药结直肠癌细胞在TRAIL的作用下发生线粒体途径的凋亡。这些研究为提高结直肠癌的化疗敏感性提供了新的思路和理论依据。
[1]Park SH,Lee DH,Oh SC,et al.Metformin enhances TRAIL-induced apoptosis by Mcl-1 degradation via Mule in colorectal cancer cells[J].Oncotarget,2016,7(37):59503-59518.
[2] Jiang C,Long J,Kuang M,et al.Mcl-1 Is a Novel Target of miR-26b That Is Associated with the Apoptosis Induced by TRAIL in HCC Cells[J].Biomed Res Int,2015,2015:572738.
[3] Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[4]Han P,Li JW,Cui BB,et al.The lncRNA CRNDE promotes colorectal cancer cell proliferation and chemoresistance via miR-181a-5p-mediated regulation of Wnt/β-catenin signaling[J].Mol Cancer,2017,16(1):9.
[5]Han B,Yao W,Sun SY,et al.The novel proteasome inhibitor carflzomib activates and enhances extrinsic apoptosis involving stabilization of death receptor 5[J].Oncotarget,2015,6(19):17532-17542.
[6] Salvesen GS,Walsh CM.Functions of caspase 8:the identified and the mysterious[J].Semin Immunol,2014,26(3):246-252.
[7]Laussmann MA,Passante E,Rehm M,et al.Proteasome inhibition can impair caspase-8 activation upon submaximal stimulation of apoptotic tumor necrosis factor-related apoptosis inducing ligand(TRAIL)signaling[J].J Biol Chem,2012,287(18):14402-14411.
[8]Du Z,Zhou F,Huang P,et al.The hedgehog/Gli-1 signaling pathways is involved in the inhibitory effect of resveratrol on human colorectal cancer HCT116 cells[J].Iran J Basic Med Sci,2016,19(11):1171-1176.
[9]Seino M,Okada M,Kitanaka C,et al.Differential contribution of ROS to resveratrol-induced cell death and loss of selfrenewal capacity of ovarian cancer stem cells[J].Anticancer Res,2015,35(1):85-96.
[10] Trebinska A,Hogstrand K,Fadeel B,et al.Exploring the anti-apoptotic role of HAX-1 versus BCL-XL in cytokine-dependent bone marrow-derived cells from mice[J].FEBS Lett,2014,588(17):2921-2927.
[11] Li X,Jiang J,Luo X,et al.Expression of HAX-1 in colorectal cancer and its role in cancer cell growth[J].Mol Med Rep,2015,12(3):4071-4078.
Intervention of Resveratrol on the Sensitivity of Drug-resistant Colorectal Cancer Cells to TRAIL and the Underlying Mechanism
CHE Jia.
Clinical Laboratory,Tongde Hospital of Zhejiang Province,Hangzhou(310012),China
Objective To investigate the effect of resveratrol on increasing the sensitivity of drug-resistant colorectal cancer cells to TRAIL treatment and the related mechanism.Methods TRAIL-resistant HT29(TR-HT29)cells were divided into control group,resveratrol group,TRAIL group,resveratrol+TRAIL group and resveratrol+TRAIL+HAX-1 plasmid group.CCK-8 assays were applied to evaluating the cell viability of TR-HT29 cells,flow cytometry analysis was performed to detect the cell apoptosis and mitochondrial membrane potential.Western blot analysis was used to detect the release of cytochrome C and the activation of caspase-3.Results IC50 of TRAIL to TR-HT29 was significantly higher than that to HT29 cells[(19.4±1.3)ng/mL vs(1.8±0.2)ng/mL,P<0.05].Resveratrol treatment was able to suppress the expression of HAX-1 in TR-HT29 cells.Inhibitory rate of cell viability(53.6±4.4)%and apoptotic rate(39.4±2.9)%in TRAIL+resveratrol group was significantly higher than the inhibitory rate of cell viability[(14.3±1.0)%,P<0.05]and apoptotic rate[(9.65±0.7)%,P<0.05]in TRAIL group and the inhibitory rate of cell viability[(19.95±1.5)%,P<0.05]and the apoptotic rate[(13.8±1.1)%,P<0.05]in TRAIL+resveratrol+HAX-1 plasmid group.Mitochondrial membrane potential of TR-HT29 in TRAIL+resveratrol group was significantly higher than that in TRAIL group and TRAIL+resveratrol+HAX-1 plasmid group.Release of cytochrome C and activation of caspase-3 in TRAIL+resveratrol group was significantly higher than that in the TRAIL group and TRAIL+resveratrol+HAX-1 plasmid group.Conclusion Resveratrol increased the sensitivity of drug-resistant colorectal cancer cells to TRAIL through downregulating the expression of HAX-1.
colorectal cancer;TRAIL;Resveratrol;HAX-1;apoptosis
浙江省立同德医院检验科(杭州 310012)
(收稿:2017-05-17 修回:2017-06-20)
——一道江苏高考题的奥秘解读和拓展

