生物法制备有机酸研究进展
刘晶晶,刘延峰,李江华,刘龙,堵国成,陈坚
江南大学生物工程学院,无锡 214122
生物法制备有机酸研究进展
刘晶晶,刘延峰,李江华,刘龙,堵国成,陈坚
江南大学生物工程学院,无锡 214122
有机酸是一类重要的平台化学品,因其在日常生活中的广泛应用,经过多年的发展,其相关产业领域日益扩展且生产方法日趋成熟。主要总结了有机酸相关产品的应用和工业生产的最新进展,着重介绍了有机酸作为生物质的高附加值产品,其生物法生产的发展状况及目前的研究成果。
有机酸;生物基产品;生物催化;微生物发酵;代谢工程
石化行业长久以来深刻影响着人们日常生活的各个方面。自工业革命开始,主要依赖于化石资源的各种有价值的化学品的市场需求持续增长,导致全球石化资源供给日趋紧张[1]。公众对环境污染、温室气体的排放和原油短缺的担忧日益增加的同时,也将注意力转向开发利用可再生的生物质生产化学品[2]。有机酸作为生物细胞的中间代谢物,经过多年的研究已成为成熟的生物技术商品,被广泛应用于食品、制药、化妆品、洗涤剂、聚合物和纺织品等行业[1]。其中,乙酸和柠檬酸的第一次生产过程可分别追溯到1823年和1913年。从那时起,不断增长的市场需求和新颖应用的层出不穷产生了不同类型的生物合成来源的有机酸的多样化投资组合[1]。2004年,美国能源部发布的《可源自生物基质大规模生产的12种高附加值的平台化合物》的报告中,就包括了四碳二羧酸(琥珀酸、富马酸和苹果酸)、2,5-呋喃二甲酸、3-羟基丙酸、葡萄糖二酸、衣康酸和乙酰丙酸等有机酸[3]。
天然有机酸广泛存在于水果中,如葡萄、苹果、桃等。原始的萃取法提取有机酸是将未成熟的果汁煮沸,加入石灰水,生成钙盐沉淀,再通过酸化处理即可制得有机酸。目前商业上有机酸的生产方法主要有化学合成法、酶转化法和微生物发酵法。
1 化学合成法生产有机酸
关于化学合成各种有机酸的途径已经有诸多报道,该方法是利用官能团之间的相互作用和产物的物化性质,通过分液、过滤、萃取等过程制备有机酸。如乙酸的化学法生产,是在阔叶木硫酸盐溶浆的预水解液中,加入三异辛胺进行反应,萃取回收乙酸[4];或在流化床上使用ZnCl2快速热解玉米穗联产糠醛和乙酸[5];在水-乙醇的混合酸中,采用双极膜电渗析生产水杨酸[6];使用Aliquat 336回收丙酸等[7]。
工业上通过热处理和萃取分离生产有机酸的传统化学方法简单易行,然而其制备过程普遍存在高能耗、高投入、生产条件苛刻且安全性低、环境污染严重不符合可持续发展的社会目标等缺点,不仅严重破坏生态环境,同时产品的安全性也限制了其在食品及医药领域的应用。另外,分子内含有一个不对称碳原子的有机酸,在自然界存在的均为人体可以直接吸收的L型,而化学法制备的有机酸多为DL型,也限制了产品的应用领域。
2 酶转化法生产有机酸
随着人们环保意识的日益增强,利用生物制造技术开发环境友好型的生物基化学品已成为实现经济绿色可持续发展的必要战略需求[1]。近年来生物制造技术的快速发展,已经对有机酸的生物合成进行了深入研究,多种类型的酶和微生物被开发用于有机酸的生物法生产[8-9]。生物法生产几种常见有机酸的研究进展如表1所示。
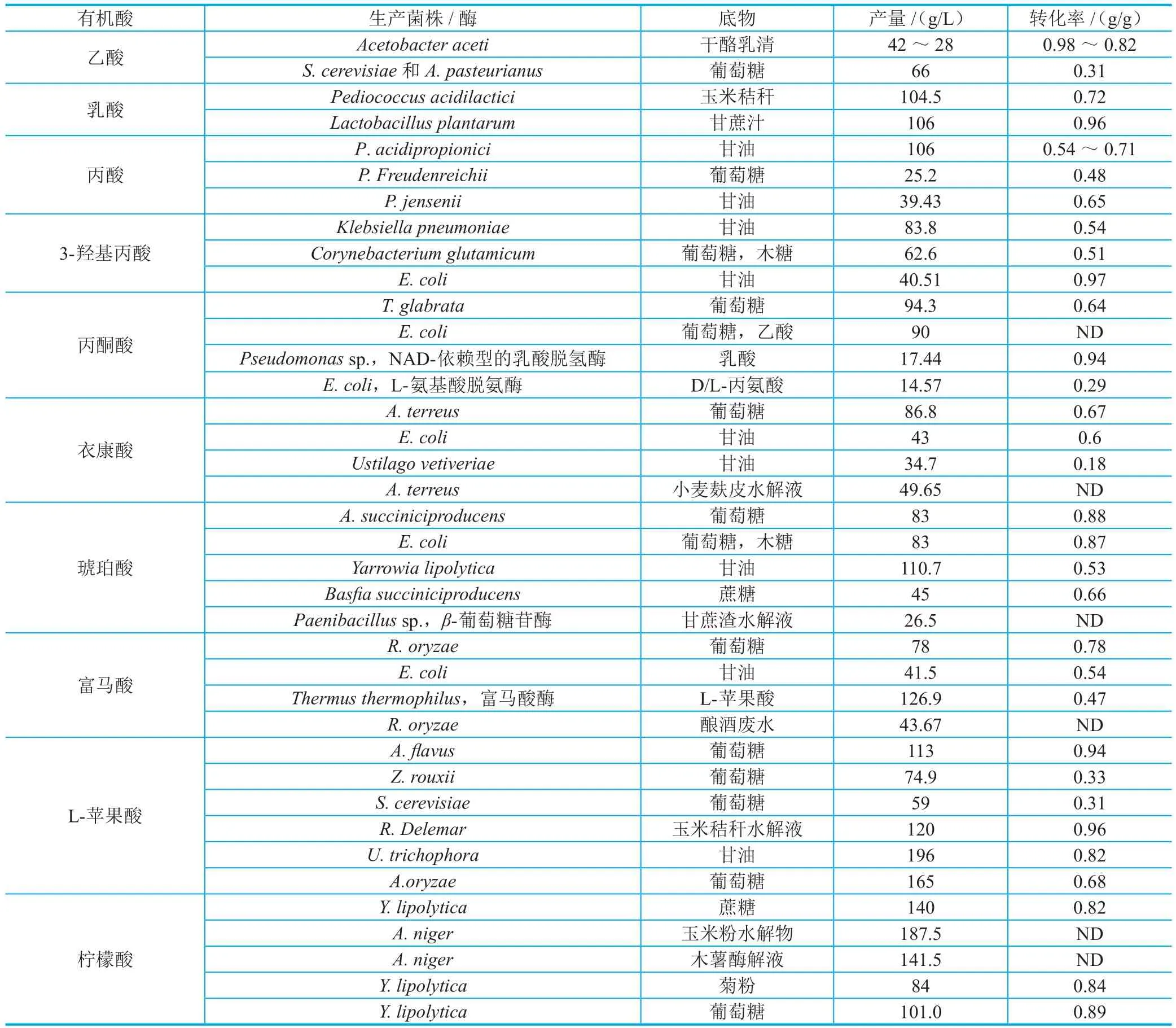
表1 常见有机酸生物法生产的研究进展
酶转化法,包括使用游离或固定化的酶催化和全细胞转化。其中游离或固定化的酶是利用单一的酶催化底物生成产物,如富马酸酶可催化富马酸生成L-苹果酸[10]。多种酶可用于丙酮酸的合成,如L-氨基酸脱氨酶(AAD)、D-氨基酸氧化酶、丙酮酸合酶、甲醛脱氢酶、酒石酸脱水酶、乙醇酸氧化酶、乳酸脱氢酶(LDH)等[11-12]。在工业上,以廉价的乳酸作为底物生产丙酮酸具有一定的商业价值。其中NAD+依赖型的LDH可以有效地将乳酸转化为丙酮酸,避免形成H2O2[13]。固定化酶技术可以增加游离酶的稳定性,易于分离控制且能反复多次使用。
与游离或固定化酶相比,全细胞催化法随着反应时间的延长会更加稳定,因为该技术利用的是微生物细胞中的一系列的酶,而不仅仅依赖于单一的酶[14]。催化反应中利用的L-LDH为诱导型酶,诱导剂的添加也增加了工艺成本。利用进化的E.coli来源的L-AAD,可以在不添加诱导剂的条件下,一步催化DL-丙氨酸合成丙酮酸[11]。
虽然固定化酶技术研究较早,但由于酶的提取过程复杂、收率较低且半衰期短,在实际生产中为了降低成本多采用固定化细胞。固定化细胞需要先将产酶菌株培养成熟、收集菌体、包埋、固定化,经过反应转化底物,提取制得目标有机酸。然而该方法合成有机酸很难直接获得高产,且底物一般同为有机酸或有机化合物,生产成本较高。同时,从混合液中将产物与底物彻底分离一般难度较大,产品质量很难达到要求[15]。
3 发酵法生产有机酸
发酵法生产有机酸具有原料来源丰富、生产工艺经济、产品安全性高等优点,是目前研究和应用最为广泛、最有发展前景的生物制造方法[1]。近年来随着诸多工程和组学技术的发展,有机酸的发酵法生产(以一步发酵法为主)已经成为了相关产业研究的热门。
3.1 生产菌株
多种类型的微生物可以用于生产有机酸,如曲霉、酵母和细菌等。某些菌株对于特定有机酸的生产具有天然的优势,如Propionibacteria合成丙酸[16],衣康酸的优势生产菌为Aspergillus terreus[17],Actinobacillus succinogenes和Anaerobiospirillum succiniciproducens高产琥珀酸[18],柠檬酸的工业生产菌是A. niger[19]。酵母是最简单的单细胞真核模式生物,能够耐受高渗透压和低pH环境,且遗传背景清晰、基因操作工具成熟,是理想的有机酸生产宿主[20],如多营养缺陷型的Torulopsis glabrata用于生产丙酮酸已有10多年的历史。尽管酵母菌作为生产宿主具有诸多优势,但也仅适用于部分有机酸的生产,因其往往产量较低或生产强度远达不到产业化的需求。丝状真菌,以食品安全级的A. oryzae、A. niger为主,是理想的生产E. coli等原核细菌不能表达的真核生物活性蛋白的理想载体,包括蛋白酶、淀粉酶、糖化酶、纤维素酶、植酸酶等,在食品级产品的生产中有悠久的历史,同时也是天然的有机酸高产菌株[4]。但是与单细胞的细菌或酵母发酵相比,丝状真菌因其独特的形态学特点,在不同的搅拌、通气条件下具有复杂的菌丝体形态,影响溶氧、传质等,进而影响产酸[21]。
3.2 合成途径
微生物可以利用多种碳水化合物为底物合成有机酸,包括葡萄糖、木糖、蔗糖、甘油等小分子物质,以及纤维素、木质素、淀粉等大分子原料。葡萄糖是最容易被微生物代谢利用的碳源。微生物通过细胞膜上的糖转运系统进入细胞,经过糖酵解途径合成二羧酸和三羧酸代谢的中间物——丙酮酸。故从理论上来说,生产二羧酸和三羧酸的菌株均可以通过代谢改造用于生产丙酮酸[22]。丙酮酸通过异型发酵途径形成乙酰磷酸,经乙酸激酶催化生成乙酸。在辅酶A存在下,乙酰磷酸也可以形成乙醛,在多种脱氢酶作用下,经Wood-Ljungdahl途径再次生成乙酸[23]。另一方面, 丙酮酸也可以在L-LDH和其他修饰酶的作用下,生成L-乳酸(图1)。
在有氧条件下,糖酵解产生的丙酮酸经过TCA循环的一系列反应最终生成草酰乙酸。在此循环的系列反应中,多种有机酸中间体被合成,包括柠檬酸、异柠檬酸、α-酮戊二酸、琥珀酸、富马酸和苹果酸。原核生物的TCA循环位于胞质内,真核生物在线粒体内进行。在多种微生物的胞质内还存在还原TCA(rTCA)途径,该途径中丙酮酸通过固碳作用,经草酰乙酸直接转化成苹果酸、富马酸和琥珀酸,是合成四碳二羧酸得率最高的途径[15]。
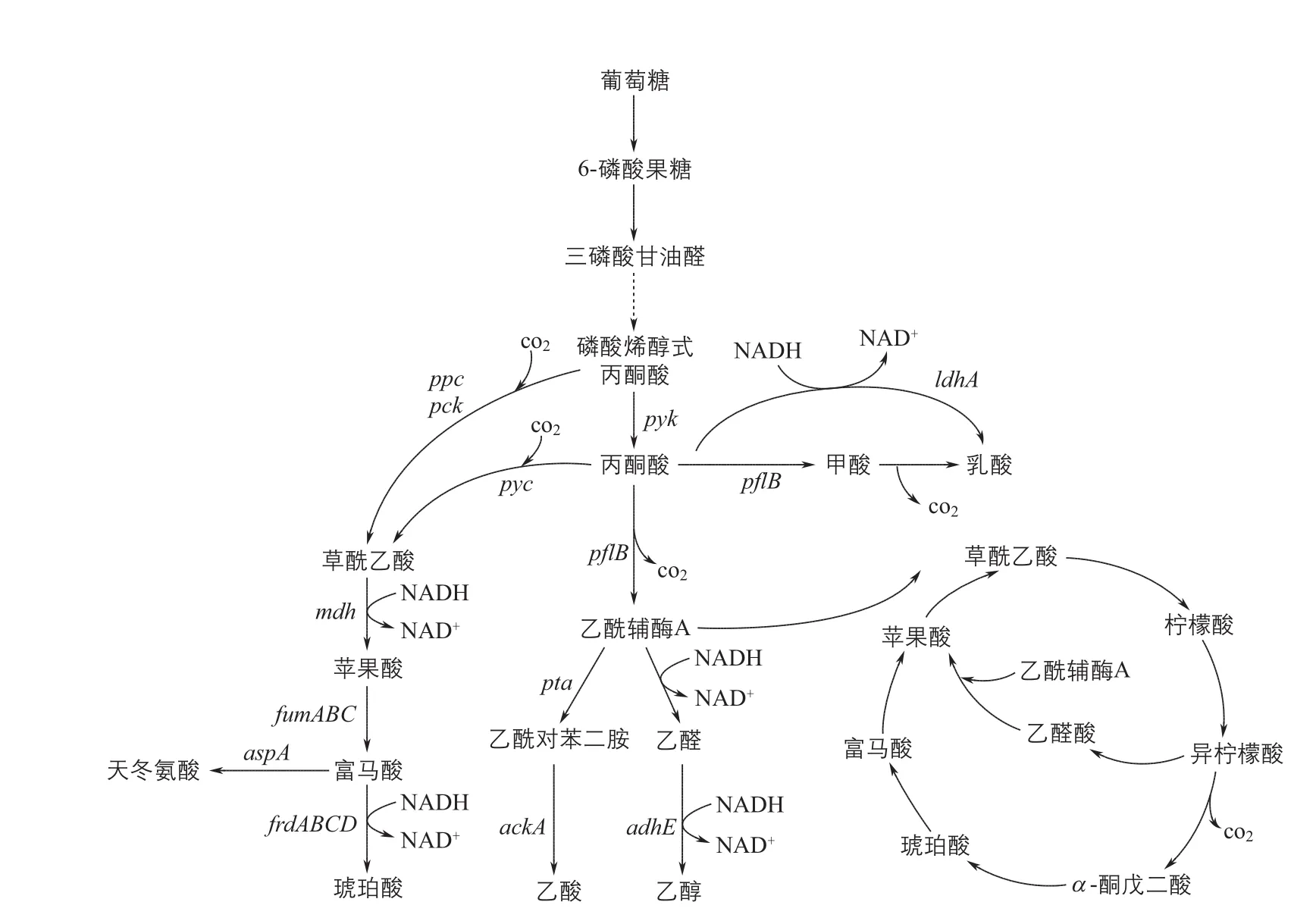
图1 大肠杆菌中与有机酸合成相关的中心代谢途径
3.3 代谢途径优化
与传统的诱变育种相比,代谢工程在菌种的改良中更具有针对性。微生物代谢途径的优化包括提高底物的分解和吸收、增强产物的胞内合成和向胞外运输、阻断副产物的合成、能量和辅因子的水平优化等。
3.3.1 提高底物的利用能力
天然菌株具有利用多种碳源的能力,某些碳源对于特定产物的合成具有代谢优势,如Propionibacteria在发酵甘油过程中产生乙酸的量较少,所以甘油通常是丙酸发酵的良好碳源[24]。过表达甘油脱氢酶(GDH)不仅能够加快甘油的吸收速率,还能为发酵体系提供NADH[25]。多种代谢工程方法用于提高菌体利用廉价底物的效率。在Yarrowia lipolytica中表达Saccharomyces cerevisiae来源的蔗糖裂解酶基因(suc2),Y. lipolytica可利用蔗糖生产140g/L的柠檬酸[26]。同时,通过表达Kluyveromyces marxianus的菊粉酶,Y.lipolytica可利用菊粉高产柠檬酸和少量异柠檬酸[27]。
E. coli也可以利用多种廉价碳源合成有机酸,通过代谢工程手段提高其糖化作用和混合糖发酵能力是提高有机酸发酵性能的重要策略[28]。
3.3.2 强化合成和转运途径
强化目的产物高效合成途径的代谢通量和跨膜转运速率是代谢改造工程菌的基本策略。强化Wood-Werkman途径中的关键酶[磷酸烯醇式丙酮酸羧化酶(PPC)、丙酮酸羧化酶(PYC)、甲基丙二酰-CoA脱羧酶(MMD)和甲基丙二酰CoA羧基转移酶(MMC)]的表达,可以有效提高草酰乙酸合成的碳代谢流量,进而提高丙酸的生产[29]。在多种微生物胞内过表达A. terreus衣康酸合成和转运途径相关的酶,包括顺乌头酸脱羧酶(CAD)、转运子家族蛋白(MFS)、顺乌头酸酶(ACN)和线粒体三羧酸转运蛋白(MTT)等,可以提高或赋予菌株衣康酸的合成能力[30-31]。如A. niger由于缺少CAD蛋白而不能合成衣康酸,通过过表达CAD、MTT和MFS,可以合成7.1g/L的衣康酸[32]。
胞质内的rTCA途径是绝大多数微生物合成四碳二羧酸最简便高效的途径,因此是代谢工程研究的重点。过表达PPC、PYC、MDH和苹果酸转运蛋白(C4T318、SpMAEI),可显著提高曲霉、酵母、细菌等合成L-苹果酸的能力[33-35]。进一步过表达富马酸还原酶(FRD)和富马酸酶(FUM),可提高琥珀酸的生产[36]。
3.3.3 杂酸的消除关注的焦点。目前,有机酸的发酵法生产存在的主要问题有缺少优良的工业生产菌株、副产物浓度较高以及下游分离提取困难等。通过酶工程与代谢工程、传统诱变与现代生物技术、生物过程与发酵调控、上游发酵和下游提取等相结合的配套研究,有助于实现有机酸相关产业的高效绿色制造。
有机酸作为细胞代谢的中间体,在胞内酶的催化作用下可以转化成其他的化学物,导致副产物的生成。副产物的生成量与微生物的种类、发酵条件和酶的性质等有关。丙酮酸的生产菌中,为了阻断乙酸、乳酸等杂酸的生成,首先敲除磷酸烯醇式丙酮酸合成酶(PPS)、LDHA、丙酮酸氧化酶(PYO)、丙酮酸甲酸裂解酶(PFL)和丙酮酸脱氢酶(PYD)复合体等酶的编码基因[37]。敲除R. oryzae FUM编码基因(Psfum1和Psfum2),可以阻断线粒体内富马酸向苹果酸的转化,提高富马酸的产量[38]。E. coli中iclR、fumABCD、arcA、ptsG和aspA等基因的敲除,可有效阻断富马酸的分支代谢途径[39]。
尽管多种生产菌株中杂酸的合成途径较为明确,但仍有部分杂酸合成的机制尚不确定,如在A. oryzae胞质内催化苹果酸转化成琥珀酸的酶[40]。而且有机酸合成途径多为微生物所必需,部分基因的敲除可能会导致菌体死亡、生长缓慢、菌丝形态改变等副作用,进而影响产物合成。
随着代谢组学、基因组学、转录组学和蛋白组学的发展和协作应用,各种生产菌株中有机酸合成的基因及其表达水平、不同代谢途径的代谢流分配均得到了深入的研究,为生产菌株的代谢改造提供了精准的靶点,进而快速高效地构建出更多的可满足大规模生产的基因工程菌。
4 结束语
目前多种有机酸在新兴产业领域已得到广泛应用,有机酸的需求量也逐年递增,因此利用可再生生物质资源实现有机酸的清洁高效生产成为有机酸相关产业领域的发展目标,而高产量、高产率、高生产强度相统一的发酵过程始终是有机酸生产技术
[1] BECKER J,WITTMANN C. Advanced biotechnology:metabolically engineered cells for the bio-based production of chemicals and fuels,materials,and health-care products[J]. Angewandte Chemie,2015,54(11):3328-3350.
[2] ARSLAN D,STEINBUSCH K J J,DIELS L,et al. Effect of hydrogen and carbon dioxide on carboxylic acids patterns in mixed culture fermentation[J]. Bioresour Technol,2012,118:227-234.
[3] WERPY T,PETERSEN G. Top value added chemicals from biomass:Volume I-Results of screening for potential candidates from sugars and synthesis gas[R]. Boston:U.S. Department of Energy,2004.
[4] YANG G,JAHAN M S,AHSAN L,et al. Recovery of acetic acid from pre-hydrolysis liquor of hardwood kraft-based dissolving pulp production process by reactive extraction with triisooctylamine[J].Bioresource Technol,2013,138:253-258.
[5] OH S J,JUNG S H,KIM J S. Co-production of furfural and acetic acid from corncob using ZnCl2through fast pyrolysis in a fl uidized bed reactor[J]. Bioresource Technol,2013,144(6):172-178.
[6] LIU X,LI Q,JIANG C,et al. Bipolar membrane el ectrodialysis in aqua-ethanol medium: production of salicylic acid[J]. J Membrane Sci,2015,482:76-82.
[7] KESHAV A,CHAND S,WASEWAR K L. Recovery of propionic acid from aqueous phase by reactive extraction using quarternary amine(Aliquat 336)in various diluents[J]. Chem Eng J,2009,152(1):95-102.
[8] ALONSO S,RENDUELES M,DIAZ M. Microbial production of specialty organic acids from renewable and waste materials[J]. Crit Rev Biotechnol,2015,35(4):497-513.
[9] HABE H,SATO S,MORITA T,et al. Bacterial production of shortchain organic acids and trehalose from levulinic acid: a potential cellulose-derived building block as a feedstock for microbial production[J]. Bioresour Technol,2015,177:381-386.
[10] SU R R,WANG A,HOU S T,et al. Identification of a novel fumarase C from Streptomyces lividans TK54 as a good candidate for L-malate production[J]. Mol Biol Rep,2013,41(1):497-504.
[11] HOSSAIN G S,SHIN H D,LI J,et al. Transporter engineering and enzyme evolut ion for pyruvate production from D/L-alanine with a whole-cell biocatalyst expressingl-amino acid deaminase from Proteus mirabilis[J]. RSC Adv,2016,6(86):82676-82684.
[12] KAWAI S,OHASHI K,YOSHIDA S,et al. Bacterial pyruvate production from alginate,a promising carbon source from marine brown macroalgae[J]. J Biosci Bioeng,2014,117(3):269-274.
[13] GAO C,XU X,HU C,et al. Pyruvate producing biocatalyst with constitutive NAD-independent lactate dehydrogenases[J]. Process Biochem,2010,45(12):1912-1915.
[14] XU P,QIU J,GAO C,et al. Biotechnological routes to pyruvate production[J]. J Biosci Bioeng,2008,105(3):169-175.
[15] LIU J,LI J,SHIN H D,et al. Protein and metabolic engineering for the production of organic acids[J]. Bioresource Technol,2017,239:412-421.
[16] GUAN N,ZHUGE X,LI J,et al. Engineering propionibacteria as versatile cell factories for the production of industrially important chemicals: advances,challenges,and prospects[J]. Appl Microbiol Biotechnol,2015,99(2):585-600.
[17] SAHA B C. Emerging biotechnologies for production of itaconic acid and its applications as a platform chemical[J]. J Ind Microbiol Biot,2017,44(2):303-315.
[18] CARVALHO M,ROCA C,REIS M A M. Improving succinic acid production by Actinobacillus succinogenes from raw industrial carob pods[J]. Bioresource Technol,2016,218:491-497.
[19] XU J,SU X F,BAO J W,et al. A novel cleaner production process of citric acid by recycling its treated wastewater[J]. Bioresource Technol,2016,211:645-653.
[20] SITEPU I R,GARAY L A,SESTRIC R,et al. Oleaginous yeasts for biodiesel: current and future trends in biology and production[J].Biotechnol Adv,2014,32(7):1336-1360.
[21] KRULL R,WUCHERPFENNIG T,ESFANDABADI M E,et al.Characterization and control of fungal morphology for improved production performance in biotechnology[J]. J Biotechnol,2013,163(2):112-123.
[22] SONG Y,LI J,SHIN H D,et al. Biotechnological production of alpha-keto acids: current status and perspectives[J]. Bioresour Technol,2016,219:716-724.
[23] PAL P,NAYAK J. Acetic acid production and puri fi cation: critical review towards process intensification[J]. Sep Purif Rev,2016,46(1):44-61.
[24] ZHU Y,LI J,TAN M,et al. Optimization and scale-up of propionic acid production by propionic acid-tolerant Propionibacteriu m acidipropionici with glycerol as the carbon source[J]. Bioresour Technol,2010,101(22):8902-8906.
[25] XIN Z,LONG L,HYUN-DONG S,et al. Development of a Propionibacterium-Escherichia coli shuttle vector for metabolic engineering of Propion ibacterium jensenii,an ef fi cient producer of propionic acid[J]. Appl Environ Microbiol,2013,79(15):4595-4602.
[26] FORSTER A,AURICH A,MAUERSBERGER S,et al. Citric acid production from sucrose using a recombinant strain of the yeast Yarrowia lipolytica[J]. Appl Microbiol Biotechnol,2007,75(6):1409-1417.
[27] LIU X Y,CHI Z,LIU G L,et al. Both decrease in ACL1 gene expression and increase in ICL1 gene expression in marine-derived yeast Yarrowia lipol ytica expressing INU1 gene enhance citric acid production from inulin[J]. Marine Biotech,2013,15(1):26-36.
[28] LIU R,LIANG L,LI F,et al. Ef fi cient succinic acid production from lignocellulosic biomass by simultaneous utilization of glucose and xylose in engineered Escherichia coli[J]. Bioresour Technol,2013,14:84-91.
[29] AMMAR E M,JIN Y,WANG Z,et al. Metabolic engineering of Propionibacterium freudenreichii: effect of expressing phosphoenolpyruvate carboxylase on propionic acid production[J].Appl Microbiol Biotechnol,2014,98(18):7761-7772.
[30] HUANG X,LU X,LI Y,et al. Improving itaconic acid production through genetic engineering of an industrial Aspergillus terreus strain[J]. Microb Cell Fac t,2014,13(1):119.
[31] THAKKER C,MARTINEZ I,LI W,et al. Metabolic engineering of carbon and redox fl ow in the production of small organic acids[J]. J Ind Microbiol Biot,2015,42(3):403-422.
[32] VAN DER STRAAT L,VERNOOIJ M,LAMMERS M,et al.Expression of the Aspergillus terreus itaconic acid biosynthesis cluster in Aspergillus niger[J]. Microb Cell Fact,2014,13(1):1-21.
[33] LIU J,XIE Z,SHIN H D,et al. Rewiring the reductive tricarboxylic acid pathway and L-malate transport pathway of Aspergillus oryzae for overproduction of L-malate[J]. J Biotechnol,2017,253:1-9.
[34] ZELLE R M,DE HULSTER E,VAN WINDEN W A,et al.Malic acid production by Saccharomyces cerevisiae: engineering of pyruvate carboxylation,oxaloacetate reduction,and malate export[J]. Appl Environ Microbiol,2008,74(9):2766-2777.
[35] CHI Z,WANG Z P,WANG G Y,et al. Microbial biosynthesis and secretion of L-malic acid and its applications[J]. Crit Rev Biotechnol,2016,36(1):99-107.
[36] YAN D,WANG C,ZHOU J,et al. Construction of reductive pathway in Saccharomyces cerevisiae for effective succinic acid fermentation at low pH value[J]. Bioresour Technol,2014,156:232-239.`
[37] ZHU Y,EITERMAN M A,ALTMAN R,et al. High glycolytic flux improves pyruvate production by a metabolically engineered Escherichia coli strain[J]. Appl Environ Microbiol,2008,74(21):6649-6655.
[38] WEI L,LIU J,QI H,et al. Engineering Scheffersomyces stipitis for fumaric acid production from xylose[J]. Bioresource Technol,2015,187:246-254.
[39] SONG C W,KIM D I,CHOI S,et al. Metabolic engineering of Escherichia coli for the production of fumaric acid[J]. Biotechnol Bioeng,2013,110(7):2025-2034.
[40] KNUF C,NOOKAEW I,REMMERS I,et al. Physiological characterization of the high malic acid-producing Aspergillus oryzae strain 2103a-68[J]. Appl Microbiol Biotechnol,2 014,98(8):3517-3527.
Development status and achievements of organic acid related industries by biological method
LIU Jingjing,LIU Yanfeng,LI Jianghua,LIU Long,DU Guocheng,CHEN Jian
School of Biotechnology, Jiangnan University, Wuxi 214122, China
Organic acids are important platform chemicals. Because of their extensive application in daily life, after years of development, their related industries have been expanding and production methods are advancing toward maturity.This paper mainly summarizes the application of organic acid related products and the latest development of industrial production, and reviews the development status and current research results in the process of biological methods and productivities with focus on organic acids as high value-added biomass products from biomass.
organic acids; biobased products; biocatalysis; microbial fermentation; metabolic engineering
10.3969/j.issn.1674-0319.2017.06.004

陈坚,教授,博士生导师。长期从事发酵工程、食品生物技术领域的研究和教学工作。以第一完成人获国家技术发明二等奖2项、国家科技进步二等奖1项,部省级科技成果一等奖6项,何梁何利基金科学与技术创新奖,中国专利奖金奖;国家“973”项目首席科学家、国家杰出青年基金获得者、全国百篇优秀博士学位论文指导教师。兼任中国食品科技学会副理事长、中国生物发酵产业协会副理事长、国际食品科学院(IAFoST)Fellow、国际工业生物过程协会(IFIBiop)Fellow。E-mail:jchen@jiangnan.edu.cn
刘晶晶,博士研究生。主要从事代谢途径的理性设计与调控高效合成有机酸的研究。E-mail:7150201003@vip.jiangnan.edu.cn
“973”课题(2013CB733602)、国家自然优秀青年基金项目(31622001)

