聚氨基酸功能高分子的发展状况与应用前景
徐虹,冯小海,徐得磊,邱益彬
南京工业大学食品与轻工学院,南京 211816
聚氨基酸功能高分子的发展状况与应用前景
徐虹,冯小海,徐得磊,邱益彬
南京工业大学食品与轻工学院,南京 211816
聚氨基酸是一类重要的功能性高分子,利用生物法可制得结构特殊、分子量可控的聚氨基酸,如γ-聚谷氨酸(γ-PGA)和ε-聚赖氨酸(ε-PL)。作为生物聚合物,其分子量和用途直接关联。目前聚氨基酸已在食品、医药、农业和工业领域得到应用,但合成酶聚合机制和分子量调控机制尚未完全阐明,其次生产成本过高也制约了聚氨基酸应用。文章介绍了最新的研究和应用进展。
天然聚氨基酸;生物合成;应用范围

徐虹,教授,博士生导师。现任南京工业大学食品与轻工学院院长,材料化学工程国家重点实验室副主任。一直致力于生物高分子合成机理、发酵代谢调控及应用开发研究,主持了包括国家自然科学基金、国家“863”项目、国家“973”课题等30余项国家与省部级项目及20多项企业合作项目,实现了多个产品的产业化生产,取得了显著的经济与社会效益,作为第一完成人获国家技术发明二等奖。发表学术论文150余篇,其中SCI/EI论文60余篇,申请和授权国家发明专利50余项,出版学术专著一部。E-mail:xuh@njtech.edu.cn
1 天然聚氨基酸的结构
天然聚氨基酸是一类微生物合成的由酸性或碱性氨基酸通过酰胺键连接而成的氨基酸同聚物,其侧链存在的大量羧基或氨基基团,使其具有良好的水溶性、保湿性、抗菌性、易螯合金属离子、易修饰等优点,并赋予一些特殊的生理功能[1],可应用于食品、医药、农业和新材料领域,成为天然生物高分子的典型代表。目前自然界发现的由单一种类氨基酸聚合而成的天然聚氨基酸为[2]:γ-聚谷氨酸(γ-PGA)、ε- 聚赖氨酸(ε-PL)、 γ-聚二氨基丁酸(γ-PAB)和β-聚二氨基丙酸(β-PDAP),结构式如图1所示。其中 γ-PGA和ε-PL已被规模化生产和应用。
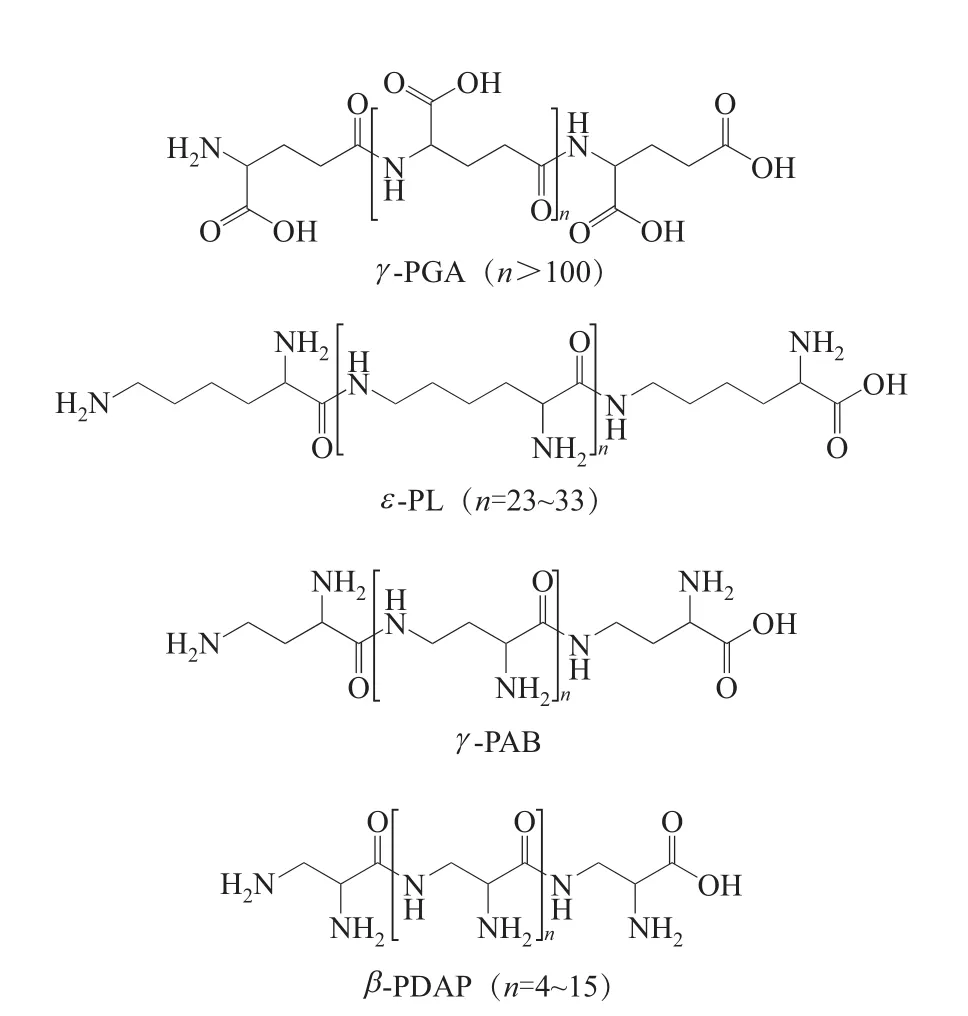
图1 目前已发现的微生物源聚氨基酸的化学结构式
γ -PGA是微生物利用 L-谷氨酸和D-谷氨酸单体通过 γ-酰胺键聚合而成的一种阴离子多肽型聚合物,具有直链纤维状的基本骨架,分子量为100~2500kDa[3]。γ-PGA的分子量与其应用领域直接相关[4]。在农业方面,高分子量γ-PGA(>700kDa)可作为肥料增效剂,作为化妆品原料使用时不同分子量γ-PGA则体现出不同的功效,超高分子量γ-PGA(>2000kDa)具有成膜性,有效防止水分流失,低分子量γ-PGA(1~10kDa)利于透皮吸收,深层保湿并护理皮肤,另外,低分子量γ-PGA还可作为药物载体和水处理剂。
ε-PL是微生物利用L-赖氨酸的α-羧基和ε-氨基通过酰胺键连接而成的线性聚合物,其常见分子量为3.2~4.5kDa[5]。由于具有抑菌谱广、安全性高、稳定性强等优良特性,ε-PL作为一种天然食品防腐剂目前已被日本、韩国、欧美等国家/地区广泛使用,2014年我国也批准ε-PL及其盐酸盐作为新型食品添加剂[6]。ε-PL的聚合度主要分布在25~35,低聚合度产生菌分布较少。研究表明,不同分子量的ε-PL往往表现出不同的特性,聚合度大于9的ε-PL才表现出较高的抑菌活性[5],15~27的低聚合度ε-PL相比于25~35高聚合度ε-PL对革兰阴性菌、阳性菌以及酵母具有更好的抑菌效果[7]。同时,在食品行业添加低聚合度ε-PL,能够消除大量添加高聚合度ε-PL带来的苦味。而作为新型抗菌材料时,高聚合度的ε-PL在保持优良抗菌性能的同时更利于分子修饰,衍生得到更多存在形式的功能型材料。离子型更强,能形成交联性更强的凝胶[8]。
γ-PAB和β-PDAP两者都是作为ε-PL产生菌副产物鉴定时被发现的[9-10]。γ -PAB和β-PDAP分别由L-二氨基丁酸和L-2,3-二氨基丙酸(L-DAP)单体聚合形成,其中,γ-PAB平均分子量为2.1~2.2 kDa,β-PDAP分子量分布在0.5~1.5kDa,目前研究结果显示,γ-PAB和β-PDAP在热稳定性、水溶性等方面具有与ε-PL类似的性质,由于两者链长小于ε-PL,故γ-PAB和β-PDAP的电荷密度要高于ε-PL,表现为对酵母具有极强的抑制能力和一定的细菌与霉菌抑制活力,这与ε-PL抗菌谱有互补性,在食品防腐领域具有潜在的应用前景。
2 天然聚氨基酸生物合成及聚合机制
2.1 γ-PGA的生物合成过程
2.1.1 γ-PGA产生菌
目前报道的γ-PGA 生产菌株主要集中在芽孢杆菌属,根据其对外源谷氨酸的利用情况可以分为两类[11]:一类为谷氨酸依赖型(培养基中需加入谷氨酸才能生产γ-PGA),这类菌株具有较高的γ-PGA合成效率,产物浓度可达20~50g/L,是目前γ-PGA主要工业生产菌株,但由于培养基中需加入大量谷氨酸,导致成本较高。而与之相对应的另一类为谷氨酸非依赖型,这类菌株无需额外添加谷氨酸,只需普通培养基即可生产γ-PGA,然而,这类菌株的γ-PGA产率极低(<10g/L),至今还未见用于工业生产的报道。另一方面,目前所报道的生产菌株合成的γ-PGA分子量普遍较大,如Bacillus subtilis NX-2合成的γ-PGA分子量为1000~ 2500kDa[12],Bacillus licheniformis WX-02合成的γ-PGA分子量为1000~1200kDa[13],Bacillus licheniformis ATCC 9945a合成的γ-PGA分子量为140~980kDa[14]。研究表明,γ-PGA不同的生理活性会随着分子量的变化而发生改变,同时,在工业生产过程中,大分子量的γ-PGA易导致发酵体系黏度增加,造成发酵液中的溶氧量下降,低溶氧则限制了菌体的生长以及γ-PGA的进一步合成;另外,高黏度的发酵产物对下游的分离工艺又提出了较高的要求,不利于γ-PGA的工业化生产。因此,鉴于不同分子量γ-PGA在不同领域上的应用,通过发酵调控生产不同分子量的γ-PGA成为未来的发展趋势。
2.1.2 γ-PGA的合成机制
γ-PGA作为一种新型生物高分子,对其合成机理的解析一直是研究的热点。近年来,有关γ-PGA代谢途径及关键酶的研究已取得一定的进展。γ -PGA是由D /L-谷氨酸单体通过γ-酰胺键聚合而成,如何将这些单体有序地连接成最终产物成为研究γ-PGA合成机制的突破口。Ashiuchi等[15]对γ-PGA聚合酶基因(pgs)的揭示开启了γ-PGA研究的新时代,如图2所示,研究发现pgsB,pgsC,pgsA及pgsE为聚合酶的4个基因,它们在基因组上排列成一个基因簇,在其他γ -PGA产生菌中对应的同源基因分别是ywsC,ywtAB和capBCA。其中pgsA编码的PgsA负责将PgsBCA复合体锚定在细胞膜上,并且将已合成的γ-PGA分子从紧密的细胞膜上去除;PgsB具有亲水性结构,经鉴定为酰胺连接酶,主要负责催化聚合反应;P gsC的结构与乙酰转移酶相似,主要负责γ-PGA的转运;目前PgsE的具体功能还尚未可知,有研究猜测其可能与膜蛋白CapE相似,但在缺失PgsE的条件下,菌株同样可以合成γ-PGA,说明PgsE对于γ-PGA的合成并非是必需的。
虽然目前已经获知Pgs具有的一部分功能,但是由于其晶体结构尚未得到解析,其在γ-PGA合成过程中具体的作用机制尚不明晰,因此通过协调控制Pgs来合成不同分子量的γ-PGA的想法还较难实现,未来还有待进一步探索。
2.2 ε-PL的生物合成过程
2.2.1 ε-PL产生菌
ε -PL生产菌株主要分布在放线菌中的白色链霉菌种、北里孢菌属和麦角真菌属。其中,采用白色链霉菌经液体好氧发酵的方式生产ε-PL已成功实现工业化[16]。此外,不同ε-PL产生菌株所分泌的ε-PL在分子量上存在着明显的差异,但绝大多数聚合度为25 ~ 35[17]。
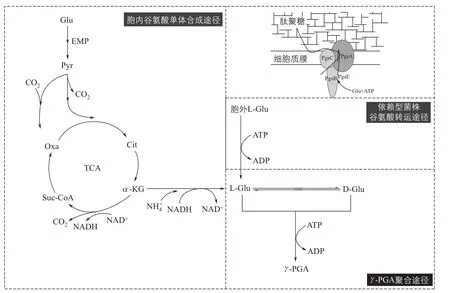
图2 γ-PGA生物合成途径
2.2.2 ε-PL的合成机制
日本学者Yamanaka等首先报道了Streptomyces albulus NBRC14147的ε-PL合成酶(Pls)的纯化和性质表征工作[5]。ε-PL的合成机制如图3所示,在合成初始阶段,L-赖氨酸首先作为底物在A结构域被腺苷酸化,成为Lys-O-AMP,然后Lys-O-AMP转移到与A域紧密相邻的T结构域被巯基化,形成氨酰硫酯,并释放出AMP,氨酰硫酯随后被转移到3个串联的可溶性C结构域,如此迭代延伸聚合。有趣的是,笔者课题组在ε-PL产生菌株Streptomyces albulus PD-1中首次发现了自然界第4种聚氨基酸β-PDAP,通过对其代谢途径和合成酶组装机制研究发现[2]:①如图3所示,L-DAP前体由半胱氨酸合成酶VioB和鸟氨酸环化脱氨酶VioK两个关键酶合成,此发现进一步完善了Streptomyces albulus PD-1中ε-PL代谢网络;②通过对β-PDAP聚合酶分析发现其结构功能与Pls非常相似,这种阳性聚氨基酸合成酶的共有特征,为以后挖掘和人工设计聚氨基酸提供了借鉴。
由于高聚合度ε-PL呈苦味,不利于在食品中大量添加。因此,如何高效获得低聚合度的ε-PL一直是研究的热点。目前,合成不同分子量的ε-PL主要方式为:①添加短链脂肪醇以及环糊精衍生物控制ε-PL 链长,但是外来物质的加入在食品安全性方面存在隐患[18-19];②化学方式合成,在食品领域应用存在潜在的安全隐患[20];③利用ε-PL降解酶调控分子量,存在分子量难以精确控制的问题[21]。除此之外,随着对Pls聚合机制研究的深入,现已证明ε-PL分子量的大小并不是由降解酶的降解作用决定,而是由Pls自身决定,其上游linkers区域是控制分子量大小重要的结构域[7]。从分子水平入手,分析和揭示微生物合成ε-PL分子量的调控机制,对未来ε-PL的高效生产具有一定的指导作用。例如,随着ε-PL合成机制研究的深入,能够合成不同分子量且聚合度单一的ε-PL,这将极大扩大ε-PL的应用范围。
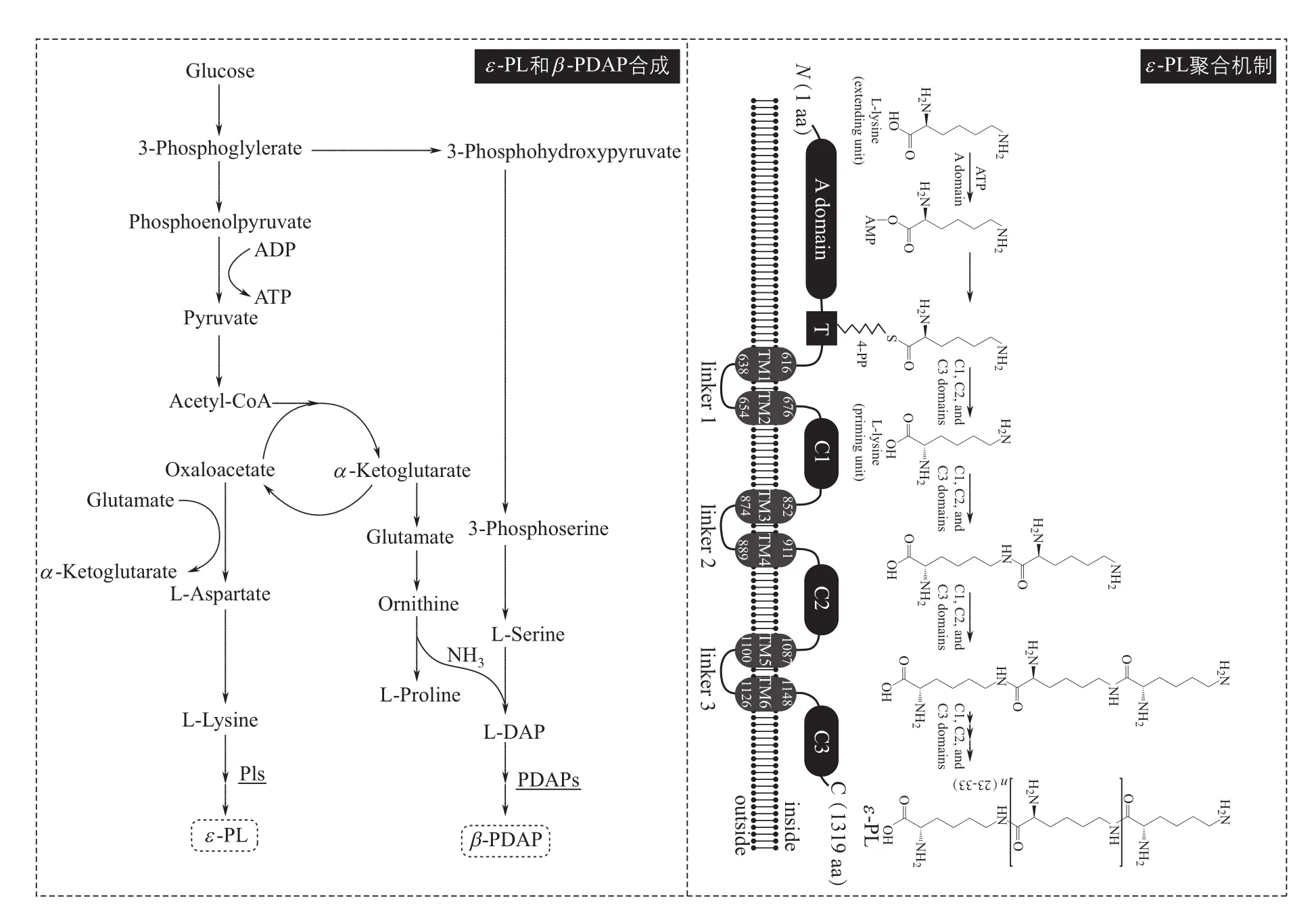
图3 ε-PL和β-PDAP生物合成途径
3 天然聚氨基酸发酵过程调控策略
γ-PGA和ε-PL由于产物黏度高、难以规模化生产,导致聚氨基酸价格一直居高不下,限制了其市场化应用。随着对聚氨基酸生物合成机理研究的深入,从合成机理层面调控聚氨基酸合成已成为可能。如图4所示,针对限制聚氨基酸规模化生产的4个问题,综合代谢工程、生化工程及系统生物学的理论与策略,笔者课题组通过以下措施提升微生物生产聚氨基酸的能力。①针对聚氨基酸发酵体系下的底物摄取与溶氧困难,以及菌株生长与谷氨酸转运两者最佳pH的不一致性,采用pH两步调控策略、谷氨酸低初始浓度流加补料策略,显著促进了底物的转运,使底物利用率增加了20%,达到了90.5%[22];②通过外源添加氧胁迫调节剂、整合透明颤菌血红蛋白基因等手段,提高了γ-PGA和ε-PL生产菌株氧胁迫下的适应能力和培养基溶氧能力,最终使得γ-PGA和ε-PL产率分别提高了20%、50%以上[23-24];③针对γ-PGA胞外分泌困难,通过添加Tween-80和DMSO增加细胞膜的通透性,促进外源底物的利用和产物的分泌,并且提高α-酮戊二酸节点异柠檬酸脱氢酶的活性,从而使该节点通向谷氨酸的代谢流量增加了28%~33%,达到了促进产物γ-PGA合成的目的[25];④针对聚氨基酸积累度低和生产成本高的问题,筛选得到了一株不依赖外源谷氨酸的生产菌株,该菌株能够以非粮原料菊芋作为原料一步法发酵生产γ-PGA,由于省去谷氨酸成本,相比于之前所报道的谷氨酸非依赖型菌株,该过程合成γ-PGA效率较高、生产成本低[26];⑤针对ε-PL发酵周期长、生产过程难以控制,自行设计开发了吸附固定化生物反应器结合多阶段溶氧调控技术发酵生产ε-PL,最终ε-PL产率由16g/L提高至30g/L以上,发酵时间由120h缩短至72h[27]。另外,笔者课题组针对ε-PL发酵过程中存在的副产物β-PDAP,借鉴石油化工和生物炼制的理念:一个生产线获得多种物质,基于一种溶氧和pH的集成调控,从一批发酵产物中高效获得两种聚氨基酸,实现了ε -PL与β-PDAP联产的目的,有效地降低了ε-PL单批次发酵成本[28]。笔者课题组在成功解决以上难题的基础上,建立了面向不同市场用途的产物提取工艺,实现了γ-PGA和ε-PL的工业化生产。同时,开发了农业级γ-PGA系列产品,并完成了在水稻、玉米和小麦等粮食作物以及数十种蔬菜和瓜果类经济作物中的推广应用,取得了良好的经济与社会效益。基于以上研究成果,“功能性高分子聚氨基酸生物制备关键技术与产业化应用”项目荣获了国家技术发明奖二等奖。
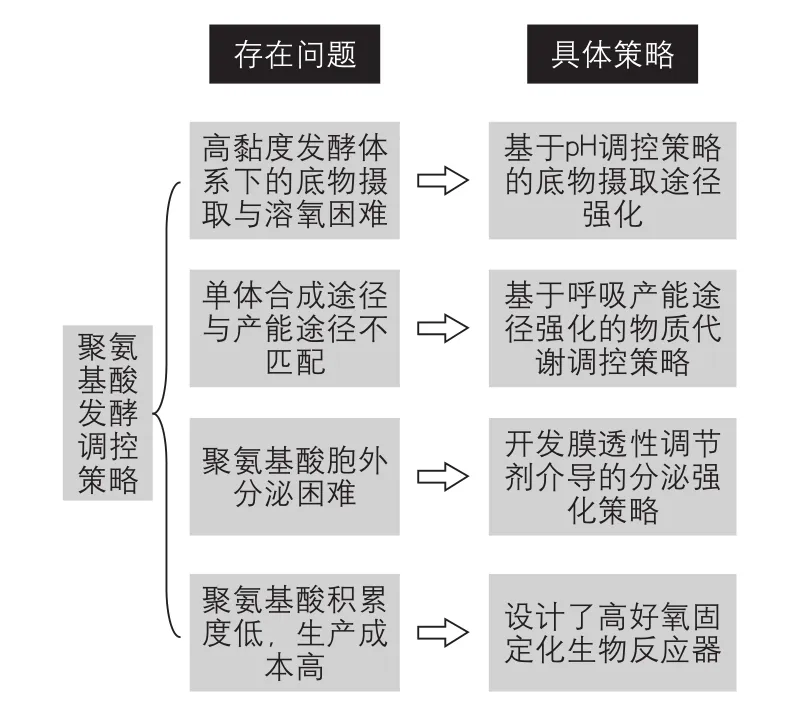
图4 聚氨基酸发酵调控策略概要
4 聚氨基酸的应用
4.1 γ-PGA应用
4.1.1 农业领域的应用
笔者对γ-PGA合成机理和应用机理进行了长达20年的研究,发现γ-PGA是一种优良的植物刺激剂,施用于植物根部或叶部,γ-PGA主要通过Ca2+/CaM信号途径来调节植物氮代谢关键酶的活性,提高植物对氮素的吸收和同化,同时通过调节植物内源激素水平及其稳态平衡来传递其信号,进而调控植物的生长[29]。当与肥料同时使用时,γ-PGA可以使更多的肥料养分在作物生长的前期被固定,这些被固定的营养元素在作物生长的中后期又逐渐被释放出来供作物生长所用,从而有效提高了肥料利用率[30]。另外,在非生物胁迫条件下,γ-PGA通过与植物细胞膜上的互作蛋白结合,启动抗逆机制,提高作物的对干旱、高盐、低温等抗逆性[31-33]。
4.1.2 日化领域的应用
在化妆品领域,高分子量γ-PGA良好的成膜特性及小分子产品优异的渗透皮肤能力,使其在防止皮肤水分流失、增加皮肤弹性、抚平肌肤皱纹、消除皮肤黑色素等方面效果突出。
4.1.3 水处理领域的应用
由于γ-PGA侧链带有大量游离带负电荷的羧基,改性后可同时对阴、阳离子起到螯合和絮凝作用,且γ-PGA具有可降解、生物相容性和无毒副作用特点,因而其在水处理方面是一种性能卓越以及环境友好型的水处理剂[34],已被开发出一系列市场化应用产品。例如,日本聚谷氨酸株式会社开发的一种磁性絮凝剂PG-M(主要成分为γ-PGA),利用磁分离装置,可高效、快速分离出净化水和污泥[35];新加坡Goodwater公司开发的一种γ-PGA污水絮凝剂粉末,该产品使用便捷,使用时只需与污水按照一定比例混合,即可实现污水的快速处理,目前该产品已被用于净化水质[36]。
4.1.4 其他领域的应用
在食品行业,高分子量γ-PGA可以包埋食物分子,掩盖食物的苦涩味,降低食物的流动性,增加黏稠口感,同时γ-PGA可以作为抗冻剂来减少低温对食品的冻害作用,保留原有的风味以及弹性[3]。研究表明,不同分子量的γ-PGA具有不同的抗冻性能,当分子量低于200 kDa时,其抗冻活性比目前已知的抗冻性能较好的葡萄糖效果更佳。此外γ-PGA及其衍生物在药物载体、医用黏合剂、组织工程支架等医药领域也具有广阔的应用前景。
4.2 ε-PL 应用
目前,ε-PL 作为一种天然食品防腐剂,已广泛应用于食品的防腐保鲜,且相比于其他生物防腐剂具有明显的优势。例如,乳酸链球菌素仅能够抑制部分革兰阳性菌,纳他霉素仅专一性抑制真菌,溶菌酶由于来自鸡蛋,对鸡蛋出现免疫症状的人群不可使用,使其应用领域受到限制,而ε-PL具有广谱抑菌性(对革兰阴性和阳性细菌均具有极强的抑制效果,对酵母菌、真菌乃至病毒也有抑制作用)[37]。在日化行业,ε-PL作为一种天然防腐剂可被添加在化妆品、漱口液、洗手液、厨房清洗消毒液等产品中。ε-PL在生物材料、药物缓释等领域同样具有广阔的应用前景。因其在溶液中带正电,可以携带带负电的基因片段跨膜转运进入细胞,可被用作基因治疗的载体。王瑞等[38]以ε-PL为主要原料制备了贻贝仿生水凝胶,该水凝胶表现出优异的体外抗菌和体内抗感染能力,与创面组织高效整合并诱导皮肤再生修复。吴凌天等[39]利用ε-PL和二氧化钛复合制备固定化材料作为蔗糖异构酶的载体,大大提高了该酶的催化效率。
5 总结与展望
聚氨基酸功能高分子具有良好的水溶性、生物可降解等优点,随着对聚氨基酸生物合成及聚合机理研究的不断深入,聚氨基酸生产成本必将大幅降低,同时开发不同特性的聚氨基酸材料(如不同分子量以及进一步改性的聚氨基酸材料),将进一步拓展其在食品、医药、农业和工业领域的应用范围。此外,随着生物信息数据库的不断丰富以及分子生物学的飞速发展,相信未来,在深入解析生物高分子聚合机理的基础上,通过聚合酶基因组数据挖掘与人工设计优化,获得新型聚氨基酸高分子也将成为可能。
[1] 徐虹,欧阳平凯. 生物高分子:微生物合成的原理与实践[M]. 北京:化学工业出版社,2010.
[2] XU Z X,SUN Z Z,LI S,et al. Systematic unravelling of the biosynthesis of poly(L-diaminopropionic acid)in Streptomyces albulus PD-1[J]. Scienti fi c Reports,2015,5:17400.
[3] LUO Z,GUO Y,LIU J,et al. Microbial synthesis of poly-γ-glutamic acid:current progress,challenges,and future perspectives[J].Biotechnology for Biofuels,2016,9(1):134.
[4] 于林艳. 聚谷氨酸降解、交联及在化妆品中应用研究[D]. 济南:山东大学,2016.
[5] YAMANAKA K,MARUYAMA C,TAKAGI H,et al. ε-Poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase[J]. Nature Chemical Biology,2008,4(12):766-772.
[6] 余春槐,叶盛德,吕皓. ε-聚赖氨酸盐酸盐在食品工业中应用前景广阔[N]. 中国食品报,2014-01-06(6).
[7] HAMANO Y,KITO N,KITA A,et al. ε-poly-L-lysine peptide chain length regulated by the linkers connecting the transmembrane domains of ε-poly-L-lysine synthetase[J]. Applied and Environmental Microbiology,2014,80(16):4993-5000.
[8] 王静. Streptomyces cattleya DSM 46488中ε-聚赖氨酸生物合成机制的研究[D]. 上海:上海交通大学,2015.
[9] TAKEHARA M,SAIMURA M,INABA H,et al. Poly (γ-L-diaminobutanoic acid),a novel poly(amino acid),coproduced with poly(ɛ-L-lysine)by two strains of Streptomyces celluloflavus[J].FEMS Microbiology Letters,2008,286(1):110-117.
[10] XIA J,Xu H,FENG X H,et al. Poly(L-diaminopropionic acid),a novel non-proteinic amino acid oligomer co-produced with poly(ε-L-lysine)by Streptomyces albulus PD-1[J]. Applied Microbiology and Biotechnology,2013,97(17):7597-7605.
[11] 刘婷. 发酵液中γ-聚谷氨酸的分离纯化及初步鉴定研究[D]. 西安:陕西科技大学,2016.
[12] XU H,JIANG M,LI H,et al. Ef fi cient production of poly(γ-glutamic acid) by newly isolated Bacillus subtilis NX-2[J]. Process Biochemistry,2005,40(2):519-523.
[13] TIAN G M,FU J T,WEI X T,et al. Enhanced expression of pgdS gene for high production of poly-γ-glutamic aicd with lower molecular weight in Bacillus licheniformis WX-02[J]. Journal of Chemical Technology amp; Biotechnology,2015,89(12):1825-1832.
[14] FENG J,SHI Q S,ZHOU G,et al. Improved production of polyγ-glutamic acid with low molecular weight under high ferric ion concentration stress in Bacillus licheniformis ATCC 9945a[J].Process Biochemistry,2017,56:30-36.
[15] ASHIUCHI M,SODA K,MISONO H. A poly-γ-glutamate synthetic system of Bacillus subtilis IFO 3336:gene cloning and biochemical analysis of poly-γ-glutamate produced by Escherichia coli clone cells[J]. Biochemical and Biophysical Research Communications.1999,263:6-12.
[16] BANKAR S B,SINGHAL R S. Panorama of poly-ε-lysine[J]. RSC Advances,2013,3(23):8586-8603.
[17] XU Z X,XU Z,FENG X H,et al. Recent advances in the biotechnological production of microbial poly(ɛ-L-lysine)and understanding of its biosynthetic mechanism[J]. Applied Microbiology and Biotechnology,2016,100(15):6619-6630.
[18] NISHIKAWA M,OGAWA K. Inhibition of epsilon-poly-L-lysine biosynthesis in Streptomycetaceae bacteria by short-chain polyols[J].Applied and Environmental Microbiology,2006,72(4):2306-2312.
[19] NISHIKAWA M. Molecular mass control using polyanionic cyclodextrin derivatives for the epsilon-poly-l-lysine biosynthesis by Streptomyces[J]. Enzyme and Microbial Technology,2009,45(4):295-298.
[20] TAO Y H,CHEN X Y,JIA F,et al. New chemosynthetic route to linear ε-poly-lysine[J]. Chemical Science,2015,6(11):6385-6391.
[21] YAMANAKA K,KITO N,IMOKAWA Y,et al. Mechanism of ε-poly-L-lysine production and accumulation revealed by identification and analysis of an ε-poly-L-lysine-degrading enzyme[J]. Applied and Environmental Microbiology,2010,76(17):5669-5675.
[22] WU Q,XU H,YING H,et al. Kinetic analysis and pH-shift control strategy for poly (γ-glutamic acid) production with Bacillus subtilis CGMCC 0833[J]. Biochemical Engineering Journal,2010,50(1):24-28.
[23] ZHANG D,FENG X H,LI S,et al. Effects of oxygen vectors on the synthesis and molecular weight of poly(γ-glutamic acid)and the metabolic characterization of Bacillus subtilis NX-2[J]. Process Biochemistry,2012,47(12):2103-2109.
[24] XU Z X,CAO C H,SUN Z Z,et al. Construction of a genetic system for Streptomyces albulus PD-1 and improving poly (epsilon-L-lysine) production through expression of Vitreoscilla hemoglobin[J].J Microbiol Biotechnol,2015,25(11):1819-1826.
[25] WU Q,XU H,SHI N N,et al. Improvement of poly(γ-glutamic acid) biosynthesis and redistribution of metabolic flux with the presence of different additives in Bacillus subtilis CGMCC 0833[J]. Applied Microbiology and Biotechnology,2008,79(4):527.
[26] QIU Y B,SHA Y Y,ZHANG Y T,et al. Development of Jerusalem artichoke resource for efficient one-step fermentation of poly-(γ-glutamic acid) using a novel strain Bacillus amyloliquefaciens NX-2S[J]. Bioresource Technology,2017,239:197-203.
[27] ZHANG Y,FENG X H,XU H,et al. ε-Poly-L-lysine production by immobilized cells of Kitasatospora sp. MY 5-36 in repeated fedbatch cultures[J]. Bioresource Technology,2010,101(14):5523-5527.
[28] XU Z X,FENG X H,SUN Z Z,et al. Economic process to coproduce poly(ε-L-lysine) and poly(L-diaminopropionic acid)by a pH and dissolved oxygen control strategy[J]. Bioresource Technology,2015,187:70-76.
[29] XU Z Q,LEI P,FENG X H,et al. Calcium involved in the poly(γ-glutamic acid)-mediated promotion of Chinese cabbage nitrogen metabolism. Plant Physiology and Biochemistry,2014,80:144-152.
[30] XU Z Q,LEI P,FENG X H,et al. Effect of poly(γ-glutamic acid)on microbial community and nitrogen pools of soil[J]. Acta Agriculturae Scandinavica,Section B-Soil amp; Plant Science,2013,63(8):657-668.
[31] LEI P,XU Z Q,LIANG J F,et al. Poly(γ-glutamic acid) enhanced tolerance to salt stress by promoting proline accumulation in Brassica napus L[J]. Plant Growth Regulation,2016,78(2):233-241.
[32] LEI P,XU Z Q,DING Y,et al. Effect of poly(γ-glutamic acid) on the physiological responses and calcium signaling of rape seedlings(Brassica napus L.)under cold stress[J]. Journal of Agricultural and Food Chemistry,2015,63(48):10399-10406.
[33] LEI P,PANG X,FENG X H,et al. The microbe-secreted isopeptide poly-γ-glutamic acid induces stress tolerance in Brassica napus L.seedlings by activating crosstalk between H2O2and Ca2+[J]. Scienti fi c Reports,2017,7:41618.
[34] CAMPOS V,FERNANDES A R A C,MEDEIROS T A M,et al. Physicochemical characterization and evaluation of PGA bioflocculant in coagulation-flocculation and sedimentation processes[J]. Journal Of Environmental Chemical Engineering,2016,4(4):3753-3760.
[35] NIPPON POLY-GLU CO. ,LTD. Water purifying powder [EB/OL].[2017-08-20]. http://www.poly-glusb.jp/basic.html.
[36] THE GOODWATER COMPANY. GoodWater Poly-Glu Flocculant Powder [EB/OL]. [2017-08-20]. http://egoodwater.com/good-innovations/polyglu-water-treatment-agent-solution/.
[37] 宋庆超,张然,贾士儒. ε-聚赖氨酸的活性及其应用[J]. 中国食品添加剂,2012 ,03:179-183.
[38] WANG R,LI J Z,CHEN W,et al. A biomimetic mussel-inspired ε-poly-L-lysine hydrogel with robust tissue-anchor and anti-infection capacity[J]. Advanced Functional Materials,2017,27,1604894.
[39] WU L T,WU S S,XU Z,et al. Modified nanoporous titanium dioxide as a novel carrier for enzyme immobilization[J]. Biosensors and Bioelectronics,2016,80:59-66.
Recent developments and potential applications of poly(amino acid)-based functional polymers
Xu Hong, Feng Xiaohai, Xu Delei, Qiu Yibin
College of Food Science and Light Industry, Nanjing Tech University, Nanjing 211816, China
Poly(amino acid)s are important functional polymers, which can be biologically synthesized. These polymers have unique structures and controllable molecular weights. Examples of poly(amino acid)s include poly(γ-glutamic acid)and poly(ε-L-lysine). Being biopolymers, their applications are molecular weight-dependent. At present, poly(amino acid)s have been applied in the fi elds of food, medicine, agriculture, and industry. However, their assembly and molecular weight regulation have not been fully elucidated. Further, high production costs also restrict the applicability of poly(amino acid)s. This article provides insights into the state-of-the-art research developments and potential applications of poly(amino acid)-based polymers.
natural poly(amino acid)s; biosynthetic mechanism; application fi eld
10.3969/j.issn.1674-0319.2017.06.013
国家重点基础研究发展计划“973”计划(2013CB733600),国家自然科学基金(21476112)

