工业生物过程系统集成优化在有机酸生产中的应用
田锡炜 ,路飞 ,钱江潮 ,庄英萍 ,夏建业 ,储炬
1.生物反应器工程国家重点实验室,华东理工大学,上海 200237 2.国家生化工程技术研究中心(上海),华东理工大学,上海 200237
工业生物过程系统集成优化在有机酸生产中的应用
田锡炜1,2,路飞1,2,钱江潮1,2,庄英萍1,2,夏建业1,2,储炬1,2
1.生物反应器工程国家重点实验室,华东理工大学,上海 200237 2.国家生化工程技术研究中心(上海),华东理工大学,上海 200237
生物基化学品在人类社会、经济和环境中的应用受到越来越多关注。工业生物过程是由高复杂性生命系统和大规模性工程系统组成的有机整体,因此实现工业生物过程的系统集成对提升生产效率和资源利用率以及降低能耗和排放具有非常重要的作用。简要综述了当前工业生物过程系统集成的理论、方法和技术,并重点介绍了其在乳酸和葡萄糖酸钠工业生产过程中的应用。
工业生物过程;系统集成;乳酸;葡萄糖酸钠
大宗化学品是人类现代工业和文明的物质基础。中国是全球第一大化工产品生产国,其产业是国民经济的传统支柱产业。随着石化资源、能源与环境危机的日益加剧,可再生资源利用和工业生物技术应用生产生物基化学品逐渐成为人类社会、经济和环境可持续发展的保障。
工业生物过程是一个由上(菌种)、中(过程优化)、下(过程处理)游三个部分组成的集成系统。过程系统集成技术在提升生产效率、能源资源利用率、污染防治以及降低投资与操作费用等方面具有重要的作用。然而,由于生命系统的高度复杂性及工业生物过程的大规模性,实现工业生物过程的系统集成要涉及生物学、工程学等众多学科问题。如何从全局出发统筹安排,使资源、能源得到最高效和最经济的利用或转化,是实现过程全局、系统优化的关键。过去对于工业生物过程的认识多停留在时空分离状态下的孤立系统,例如生物过程参数的简易检测、单一层面细胞表型与环境的关系、生物过程的经验式放大等,这都使得研究者们难以把握工业生物过程中细胞代谢变化的本质以及体现在宏观水平上敏感参数的响应。针对上述问题,研究者们提出结合生物过程中信息流、物质流和能量流,集成开发生物过程生理代谢特性先进检测与分析装备体系[1-3],建立生物过程菌体生理特性微观代谢机制研究[4-6]、基于计算流体力学与细胞反应动力学整合的用于工业生物过程理性高效放大研究[7-8]、基于物质能量耦合的复杂工业生物过程多目标优化算法[9-10]及全生命周期分析研究的新思路、新方法和新技术,其研究进展已走在世界前列,为我国由“生物制造”迈向“生物智造”提供强有力的保障。通过上述研究技术平台,已在多个生物基化学品,特别是有机酸产品中实现了工业生物过程系统集成原理及新技术的开发和应用,并取得良好效果。接下来,将重点介绍有机酸产品,乳酸和葡萄糖酸钠工业生物过程的系统集成优化。
1 基于宏观和微观代谢分析的乳酸发酵全局优化
乳酸是一种天然存在的有机酸,并成为世界三大有机酸之一。乳酸的用途非常广泛,涉及食品、化妆品、医药、平台化学品等行业。聚乳酸(PLA)是一种典型的生物基塑料,它具有良好的生物相容性和全降解能力,因此能在自然界中实现碳经济循环,从而成为理想的绿色高分子材料,这就对全球乳酸市场提出了更大的要求[11-13]。目前全球90%以上的商业乳酸通过发酵法来进行生产。
对于乳酸发酵过程而言,最常见发酵模式为分批发酵,过程中不断补入中和剂将pH控制在合适范围,直至发酵过程中葡萄糖完全耗尽。影响乳酸分批发酵生产效率的因素主要有廉价营养物质的替代、中和剂的选择以及过程供氧水平的调控。不同氮源及其浓度的选取是提高乳酸生产浓度的有效手段,而且通过合适的廉价氮源来替代昂贵的氮源是实现乳酸经济生产的重要途径。目前的研究中广泛地应用食品废弃物、玉米浆、豆粉等廉价氮源来替代酵母粉、蛋白胨、牛肉膏等昂贵氮源[14-15]。中和剂的补入能够有效控制pH在合适的范围内,有利于微生物的生长和代谢,并降低乳酸以自由酸形式存在的含量,从而提高发酵效率。氢氧化钙、氢氧化钠、氢氧化铵、氢氧化钾、碳酸钙等都是乳酸发酵过程中最常使用的中和剂[16-19]。不同的中和剂对于乳酸发酵效率有着重要的影响,氢氧化钙被普遍认为较氢氧化钠和氢氧化铵更有利于菌体生长和生产,这一方面可能与氢氧化钙补入后造成的渗透压应激较低有关,另一方面也可能与乳酸钙作为微溶性物质,可缓和发酵液离子应激和自由酸应激有关[20-21]。虽然乳酸生产菌多为兼性厌氧微生物,但是研究表明在乳酸发酵过程中,供氧水平的控制对其生长和代谢有显著的影响[22]。高供氧能够在一定程度上促进菌体生长和乳酸生产,但是往往会伴随大量副产物的生成,因此控制过程中合适的供氧水平是实现高效生产的重要保证。需要指出的是,上述这些报道多侧重于单输入单输出的宏观研究模式,很少以细胞微观和宏观生理代谢特性为基础来认识发酵过程的变化。
华东理工大学以潜在工业生产菌拟干酪乳杆菌发酵生产L-乳酸过程为研究对象,从微耗氧发酵中氧代谢表征与控制难、发酵效率低等实际工业问题出发,重点考察不同氧代谢水平和环境高渗应激对细胞生长和代谢的影响,在全局认识相关生理特性和作用机制的基础上,优化整个发酵过程(图1)。首先,通过过程尾气质谱仪,首次将生理参数氧摄取速率(OUR)引入到微耗氧发酵过程中用以定量表征细胞氧代谢水平,从而克服了过去仅依靠操作参数(转速和通气量)以及环境参数(溶氧DO和氧化还原电位ORP)在微耗氧发酵氧代谢水平表征应用中的缺陷。同时通过宏观生理代谢分析,结合微观代谢物图谱、代谢流计算、关键酶活性测定等技术,解析了发酵过程中氧代谢的作用机制(图2),表明氧代谢水平在拟干酪乳杆菌生产乳酸过程中主要作用于丙酮酸节点,而且细胞在生长期和稳定期分别主要通过乙酰辅酶A节点和乙偶姻节点来平衡胞内还原力水平。此外,在上述氧代谢作用机制认识的基础上,开发两阶段OUR控制策略,使得L-乳酸产率较全程恒定OUR工艺提高了12.7%[23]。其次,通过宏观生理代谢特性和发酵液流变特性相结合的分析,首次发现中和剂作用于乳酸发酵的机制除生成产物造成的渗透压差异以及离子应激差异以外,还与不同中和剂发酵液影响气泡大小分布以及氧传递速率有关[24]。最后,针对高糖乳酸发酵后期乳酸生产显著抑制等问题,通过宏观和微观生理代谢特性以及过程工程控制分析,发现发酵后期环境高渗应激是限制高糖浓度乳酸高效生产的主要因素,而且存在三个关键渗透压水平影响细胞的生长和代谢。在此基础上开发了以渗透压保护剂和中和剂组合为基础的过程调控策略,前者使得阶段L-乳酸产率提高42.9%[25],而后者更是能大大缓解发酵后期环境渗透应激,从而缩短发酵时间一半以上,使得L-乳酸产率提高2.21倍[21]。
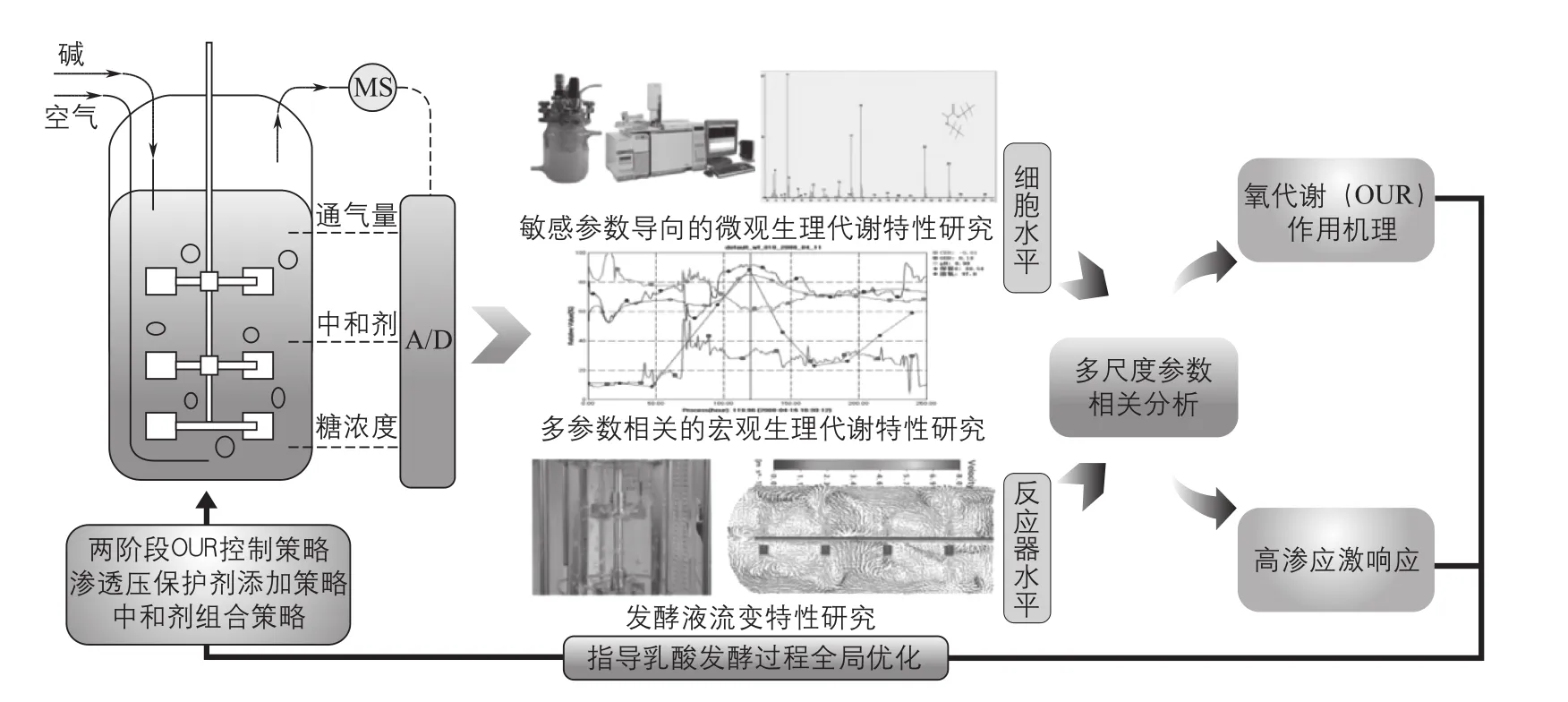
图1 基于宏观和微观代谢分析的乳酸发酵全局优化
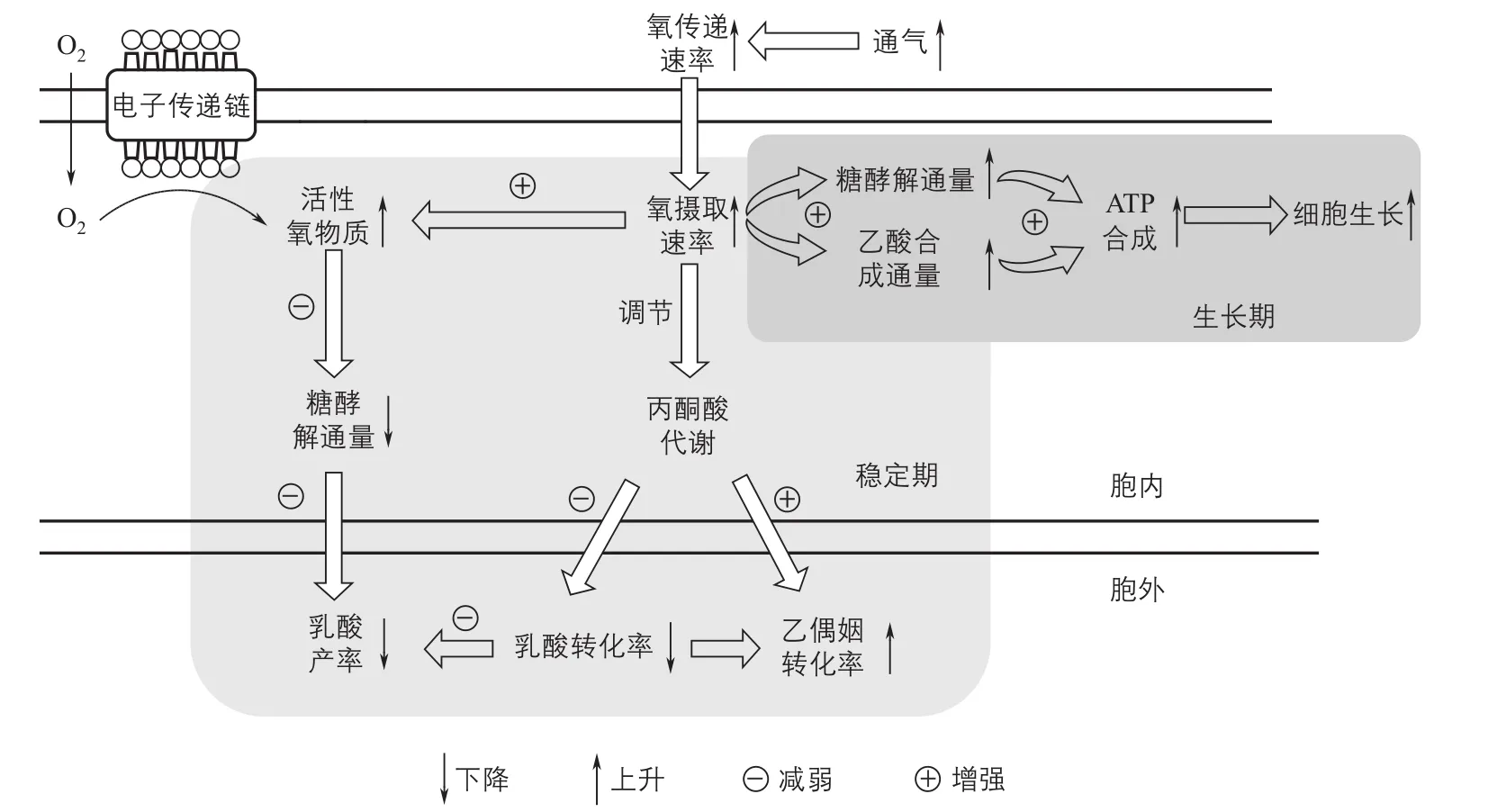
图2 拟干酪乳杆菌发酵乳酸过程中氧代谢作用机制
2 工业葡萄糖酸钠生产过程的系统集成与优化
葡萄糖酸钠作为一种葡萄糖酸衍生类盐类物质,广泛应用于食品、药品、清洁剂、建筑等行业中[26-28]。葡萄糖酸钠的生产方法主要有三种:催化氧化法、酶法以及微生物发酵法[29-31]。目前工业中典型的葡萄糖酸钠的生产方法是通过在黑曲霉深层发酵产葡萄糖酸的过程中不断加入中和剂NaOH来控制pH,从而在发酵液中形成葡萄糖酸钠。
在黑曲霉发酵生产葡萄糖酸钠过程中有两个关键物质:葡萄糖和氧气。葡萄糖和氧气都是葡萄糖酸生产的关键底物。每催化生成1mol的葡萄糖酸,就需要1mol葡萄糖和0.5mol氧气。因此实时、在线获取这两种物质的相关信息对整个发酵过程的优化具有非常重要的意义。但是目前对于葡萄糖的检测多为人工离线测定,这就对基于底物和产物浓度的过程调控策略提出了很大的挑战。另一方面,发酵液中氧气的梯度分布以及整个发酵设备的体积氧传递系数会显著影响整个发酵的氧气传递速率,从而作用于整个发酵过程效率。通气和搅拌转速作为影响氧气传递速率的关键操作参数经常被用于葡萄糖酸钠发酵的过程控制,从而提高生产效率[32-34]。但是上述基于操作参数调控的发酵过程优化有很大的局限性,往往受到反应器设备、操作环境等因素的影响,因此在适用性上很难尽如人意。此外,利用黑曲霉发酵葡萄糖酸钠是一个利用丝状真菌发酵生产的过程。发酵过程气液氧传递速率主要受以下四个方面影响:①发酵液以及菌体的物理化学性质,如发酵液的黏度、发酵液中各化学物质比例、菌体浓度与菌体形态等;②发酵罐的体积形状,如发酵罐的直径、高度、搅拌桨类型等;③发酵过程操作条件,如压力、转速、温度、体积、pH等;④菌体耗氧速率,其影响发酵液中的DO,影响发酵液中的氧浓度差[35-36]。通常情况下,丝状真菌生长从孢子萌发开始生成菌丝,菌丝之间相互缠绕会生成菌球,这使得丝状真菌发酵过程的氧传递过程更为复杂。球状菌形虽然能够降低发酵液的黏度,有利于气液传质,但是在菌球内部,特别是中心区域由于菌丝过于密集,会导致营养以及氧气扩散的困难,对发酵过程不利。而分散的菌丝虽然能够使细胞与发酵液中各营养物质的接触面积增加,有利于传氧[37]。总体来说,虽然发酵法生产葡萄糖酸钠在理论上和技术上都取得了很大的进展,但是还是以单一模块化的研究为主,同时针对工业葡萄糖酸钠生产过程的认识仍较为浅显,这也就进一步限制了实验室技术向工业生产转化的应用。
华东理工大学从先进传感器实时在线检测关键底物和产物出发,通过微观代谢调控机制的研究,结合宏观生理代特性和生物反应器流场特性分析以及葡萄糖酸钠发酵过程混合模型,建立基于生物过程物质能量耦合原理的工业生物过程的实时监控预报系统,并开发用于多目标优化的新算法,从而实现工业葡萄糖酸钠发酵过程的系统集成与优化(图3)。首先,利用傅里叶变换中红外光谱法结合衰减全反射(FT-MIR-ATR)分析技术,建立在线监测黑曲霉发酵过程中底物葡萄糖与产物葡萄糖酸钠浓度的方法[38]。此外,通过尾气质谱分析技术,实时在线检测葡萄糖酸钠发酵过程中关键生理参数OUR、二氧化碳释放速率(CER)和呼吸商(RQ)。这些检测技术的应用都为进一步开发以在线参数为基础的过程监测提供了有力保障,并建立了以在线OUR、CER和RQ为基础的实时发酵过程关键参数监控的方法,成功实现了在线定量监控葡萄糖酸钠转化率以及产率的目标[39]。其次,在上述在线参数监测的基础上,通过在50L发酵罐中重现工业生产工艺,发现了工业发酵的限制性因素主要包括培养基营养过剩以及供氧水平的不足。针对上述问题,通过宏观生理代谢特性分析以及微观代谢通量分析,开发了阶段性供氧新策略,从而使得分批发酵周期由34h缩短至19h,转化率也明显提升[40]。同时,以发酵过程菌体形态为切入点,在低菌浓发酵的条件下,控制分散状菌丝并不会引起发酵液黏度的升高,但是能够很大程度地提高发酵液中氧气与菌丝体的接触面积,从而提高整个发酵过程的供氧水平,促进生产效率,使得分批发酵周期由19h进一步缩短至15h[41]。再次,为了克服分批发酵过程菌体生长时间长、耗糖速率慢、辅助操作时间长等问题,通过开发带放工艺,在分批发酵后期放掉部分发酵液,加入新鲜培养液,从而使得生产能力提高了一倍。在此基础上,首次建立利用膜装置截留菌丝体使其回流至发酵罐中进行连续发酵的新工艺以及利用陶瓷膜装置建立细胞循环式膜反应器系统,并通过计算流体力学技术比较了普通反应器以及膜反应器的流场变化,确定了膜装置额外功率输入对膜反应器供氧水平的影响。此葡萄糖酸钠连续发酵新工艺成功实现了发酵周期达到240h以上,生产速率较优化后的分批发酵过程提高近3倍,转化率进一步提高5.4%,生产能力是分批发酵4倍的目标(图4)[42]。同时山东福洋生物技术有限公司已经形成了基于连续发酵的葡萄糖酸钠发酵新工艺和新装备,从而有效遏制了国外酶制剂公司在国内推广使用酶法生产葡萄糖酸钠时对于关键酶价格的控制和垄断。最后,一方面面对工业生物过程高度复杂性、不确定性、多层次、非结构化等特点,通过使用三层前馈神经网络对机理模型参数进行建模,同时使用改进的差分进化算法对神经网络参数进行优化,从而获得最优的过程模型,然后与发酵过程机理模型进行融合,最后得到葡萄糖酸钠发酵过程的混合模型。此过程混合模型可以很好地预测葡萄糖酸钠发酵过程中葡萄糖、葡萄糖酸钠以及菌体的浓度,因此可以作为葡萄糖酸钠发酵过程基础模型对过程进行控制、优化以及监控。另一方面,工业生物过程多目标优化问题复杂程度、过程特性各不相同,为了提高工业生物过程多目标优化算法的搜索效率和全局优化概率,通过提出参数自适应的多目标差分进化算法以及在此基础上进一步开发的变异策略和参数共同自适应的多目标差分进化算法,并将其应用于葡萄糖酸钠生产过程多目标优化,结果表明两种算法优化条件下的葡萄糖酸钠产量与试验结果非常接近,进一步显示了其在工业生物过程中应用的潜力[43-45]。
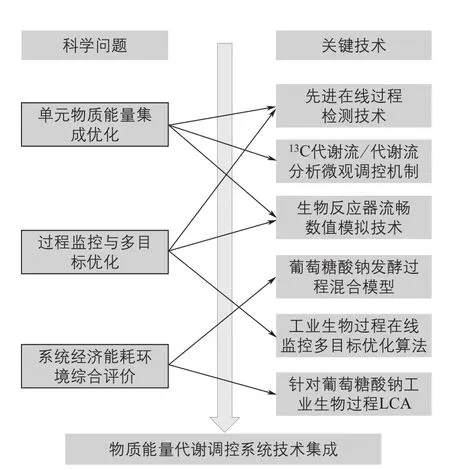
图3 工业葡萄糖酸钠生产过程的系统集成与优化
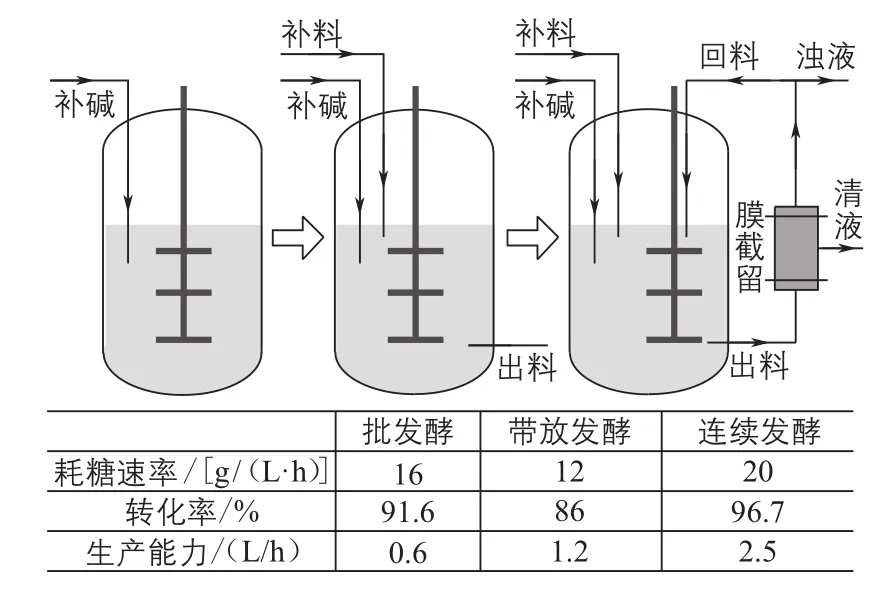
图4 不同生产模式下葡萄糖酸钠生产能力
3 总结与展望
工业生物过程系统集成研究中表现出时空变化特性及菌种细胞与环境非孤立系统的过程特征,如何解决包括生命科学在内的高度分支研究与全局优化的矛盾,在海量数据中寻找过程集成的关键参数是实现生物过程全局优化的重点。目前,针对工业生物过程先进在线传感技术的开发与应用、微生物发酵过程中细胞微观代谢特性研究,基于流场与微生物细胞生理特性结合的放大新策略开发,基于物质能量耦合的复杂工业生物过程多目标优化算法及全生命周期分析方面,均建立了相应的关键技术平台,并且已经在一部分有机酸产品实现了系统集成原理应用和技术开发,后续有望将其进一步扩展至其他产品,从而实现生物基化学品工业生产的过程系统集成。
[1] ZHAO H,PANG K,LIN W,et al. Optimization of the n-propanol concentration and feedback control strategy with electronic nose in erythromycin fermentation process[J]. Process Biochemistry,2016,51(2):195-203.
[2] LI L,WANG Z,CHEN X,et al. Optimization of polyhydroxyalkanoates fermentations with on-line capacitance measurement[J]. Bioresource Technology,2014,156(2):216-221.
[3] WANG T,LIU T,WANG Z,et al. A rapid and accurate quanti fi cation method for real-time dynamic analysis of cellular lipids during microalgal fermentation processes in Chlorella protothecoides with low field nuclear magnetic resonance[J]. Journal of Microbiological Methods,2016,124(3):13-20.
[4] NIE Y,HUANG M,LU J,et al. Impacts of high β-galactosidase expression on central metabolism of recombinant Pichia pastoris GS115 using glucose as sole carbon source via(13)C metabolic fl ux analysis[J]. Journal of Biotechnology,2014,187(3):124-134.
[5] LU H,LIU X,HUANG M,et al. Integrated isotope-assisted metabolomics and13C metabolic flux analysis reveals metabolic flux redistribution for high glucoamylase production by Aspergillus niger[J]. Microbial Cell Factories,2015,14(1):147-160.
[6] TANG W,DESHMUKH A T,HARINGA C,et al. A9-pool metabolic structured kinetic model describing days to seconds dynamics of growth and product formation by Penicillium chrysogenum[J].Biotechnology and Bioengineering,2017,114(8):1733-1743.
[7] YANG Y,XIA J,LI J,et al. A novel impeller configuration to improve fungal physiology performance and energy conservation for cephalosporin C production[J]. Journal of Biotechnology,2012,161(3):250-256.
[8] LIU Y,WANG Z,XIA J,et al. Application of Euler-Lagrange CFD for quantitative evaluating the effect of shear force on Carthamus tinctorius L. cell in a stirred tank bioreactor[J]. Biochemical Engineering Journal,2016,114(19):209-217.
[9] FAN Q,YAN X. Self-adaptive differential evolution algorithm with discrete mutation parameters and p-xylene oxidation reaction process optimization[J]. Expert Systems with Applications,2015,42(3):1551-1572.
[10] FAN Q,YAN X. Self-adaptive differential evolution algorithm with zoning evolution of control parameters and adaptive mutation strategies[J]. IEEE Transactions on Cybernetics,2016,46(1):219-232.
[11] DATTA R,HENRY M. Lactic acid:recent advances in products,processes and technologies-a review[J]. Journal of Chemical Technology and Biotechnology,2006,81(7):1119-1129.
[12] DATTA R,TSAI S P,BONSIGNORE P,et al. Technological and economic potential of poly(lactic acid) and lactic acid derivatives[J]. FEMS Microbiology Reviews,1995,16(2/3):221-231.
[13] GAO C,MA C,XU P. Biotechnological routes based on lactic acid production from biomass[J]. Biotechnology Advances,2011,29(6):930-939.
[14] RIVAS B,MOLDES A B,DOMUNGUEZ J M,et al. Development of culture media containing spent yeast cells of Debaryomyces hansenii and corn steep liquor for lactic acid production with Lactobacillus rhamnosus[J]. International Journal of Food Microbiology,2004,97(1):93-98.
[15] YAO W,WU X,ZHU J,et al. Utilization of protein extract from dairy manure as a nitrogen source by Rhizopus oryzae NRRL-395 for L-lactic acid production[J]. Bioresource Technology,2010,101(11):4132-4138.
[16] KARP S G,IGASHIYAMA A H,SIQUEIRE P F,et al. Application of the biore fi nery concept to produce L-lactic acid from the soybean vinasse at laboratory and pilot scale[J]. Bioresource Technology,2011,102(2):1765-1772.
[17] MOON S K,WEE Y J,CHOI G W. A novel lactic acid bacterium for the production of high purity L-lactic acid,Lactobacillus paracasei subsp paracasei CHB2121[J]. Journal of Bioscience and Bioengineering,2012,114(2):155-159.
[18] ROMERO-GARCIA S,HERNÁNDEZ-BUSTOS C,MERINO E,et al. Homolactic fermentation from glucose and cellobiose using Bacillus subtilis[J]. Microbial Cell Factories,2009,8(1):23-30.
[19] TASHIRO Y,KANEKO W,SUN Y,et al. Continuous D-lactic acid production by a novel thermotolerant Lactobacillus delbrueckii subsp. lactis QU 41[J]. Applied Microbiology and Biotechnology,2011,89(6):1741-1750.
[20] NAKANO S,UGWU C U,TOKIWA Y. Ef fi cient production of D-(-)-lactic acid from broken rice by Lactobacillus delbrueckii using Ca(OH)2as a neutralizing agent[J]. Bioresource Technology,2012,104(1):791-794.
[21] TIAN X,WANG Y,CHU J,et al. L-lactic acid production bene fi ts from reduction of enviromnetal osmotic stress through neutralizing agent combination[J]. Bioprocess and Biosystems Engineering,2014,37(9):1917-1923.
[22] QIN J,WANG X,ZHENG Z,et al. Production of L-lactic acid by a thermophilic Bacillus mutant using sodium hydroxide as neutralizing agent[J]. Bioresource Technology,2010,101(19):7570-7576.
[23] TIAN X,WANG Y,CHU J,et al. Improvement of L-lactic acid production with a two-step OUR control strategy[J]. Journal of Chemical Technology and Biotechnology,2016,91(9):2496-2502.
[24] TIAN X,WANG Y,CHU J,et al. Oxygen transfer efficiency and enviromental osmolarity response to neutralizing agents on L-lactic acid production efficiency by Lactobacillus paracasei[J]. Process Biochemistry,2014,49(12):2049-2054.
[25] TIAN X,WANG Y,CHU J,et al. Enhanced L-lactic acid production in Lactobacillus paracasei by exogenous proline addition based on comparative metabolic pro fi ling analysis[J]. Applied Microbiolog and Biotehcnology,2016,100(5):2301-2310.
[26] 饶华英. 葡萄糖酸内酯及其盐类的生产和应用[J]. 湖北化工,1998,10(3):47-49.
[27] RAMACHANDRAN S,FONTANILLE P,PANDEY A,et al.Gluconic acid:properties,applications and microbial production[J].Food Technology and Biotechnology,2006,44(2):185-195.
[28] SINGH O,KUMAR R. Biotechnological production of gluconic acid:future implications[J]. Applied Microbiology and Biotechnology,2007,75(4):713-722.
[29] 陈建初,徐润秋. 我国葡萄糖酸衍生物20年的发展[J]. 淀粉与淀粉糖,2008,20(4):6-14.
[30] ANASTASSIADIS S,MORGUNOV I G. Gluconic acid production[J]. Recent patents on biotechnology,2007,1(2):167-180.
[31] CHATTERJEE C,CHATTERJEE N P,FURTADO E D. Production of gluconate salts:US7267970[P]B2. 2004.
[32] KAPAT A,JUNG J,PARK Y. Enhancement of glucose oxidase production in batch cultivation of recombinant Saccharomyces cerevisiae:optimization of oxygen transfer condition[J]. Journal of Applied Microbiology,2001,90(2):216-222.
[33] SCHMID R D,KARUBE I. Biosensors and Bioelectronics[M]//REHM H J,REED G. Biotechnology. Weinheim,Germany:Verlag Chemie,c1988:337-338.
[34] LEE W H,SATO S,MUKATAKA S,et al. Studies on the production of gluconic acid by Aspergillus niger under high dissolved oxy-gen concentration[J]. Hakkokogaku Kaishi,1987,65(6):501-506.
[35] GARCIA-OCHOA F,GOMEZ E. Bioreactor scale-up and oxygen transfer rate in microbial processes:an overview[J]. Biotechnology Advances,2009,27(2):153-176.
[36] BODIZS L,TITICA M,FARIA N,et al. Oxygen control for an industrial pilot-scale fed-batch filamentous fungal fermentation[J].Journal of Process Control,2007,17(7):595-606.
[37] OKADA H,TSUNODA T,HIROSE Y,et al. Studies on oxygen transfer in submerged fermentations[J]. Agricultural and Biological Chemistry,1965,29(10):923-930.
[38] 杭海峰,史梦飞,庄英萍,等. 一种在线监测及优化黑曲霉发酵生产葡萄糖酸钠的方法:CN201710039712.8[P]. 2017-01-18.
[39] LU F,WANG Z,ZHAO W,et al. A simple novel approach for real-time monitoring of sodium gluconate production by on-line physiological parameters in batch fermentation by Aspergillus niger[J]. Bioresource Technology,2016,202(3):133-141.
[40] PING K,WANG Z,LU F,et al. Effect of oxygen supply on the intracellular fl ux distribution and a two-step OUR control strategy for enhancing the yield of sodium glucnate production by Aspergillus niger[J]. Journal of Chemical Technology and Biotechnology,2016,91(5):1443-1451.
[41] LU F,PING K,WEN L,et al. Enhancing gluconic acid production by controlling the morphology of Aspergillus niger in submerged fermentation[J]. Process Biochemistry,2015,50(9):142-1348.
[42] LU F,SU L,LI C,et al. High efficiency cell-recycle continuous sodium gluconate production by Aspergillus niger using on line physiological parameters association analysis to regulate feed rate rationally[J]. Bioresource Technology,2016,220(21):433-441.
[43] DONG Y,FAN Q,YAN X,et al. Development of a hybrid model for sodium gluconate fermentation by Aspergillus niger[J]. Journal of Chemical Technology and Biotechnology,2014,89(12):1875-1882.
[44] WANG X,YAN X,LU F,et al. Power series kinetic model based on generalized stoichiometric equations for microbial production of sodium gluconate[J]. Biochemical Engineering Journal,2016,113(9):30-36.
[45] DONG Y,YAN X,LU F,et al. Development and optimization of an unstructed kinetic model for sodium gluconate fermentation process[J]. Computers,Materials amp; Continua,2015,48(1):43-55.
Application of systematic integration of industrial bioprocess on organic aicd production
TIAN Xiwei1,2,LU Fei1,2,QIAN Jiangchao1,2,ZHUANG Yingping1,2,XIA Jianye1,2,CHU Ju1,2
1.State Key Laboratory of Bioreactor Engineering, East China University of Science Technology, Shanghai 200237, China 2.National Center of Bio-engineering amp; technology, East China University of Science Technology, Shanghai 200237, China
Biomass-based chemicals attract more and more attentions on human society, economy and environment. The industrial bioprocess is an integrated system of a highly complex life system and a large-scale engineering system, thus achieving systematic integration of industrial bioprocess plays an important role on improving production ef fi ciency and resource ultilization, as well as reduing energy consumption and waste discharge. This review summarized current threoy,method and technology of systematic integration of industrial bioprocess, then the applications on industrial lactate and sodium gluconate production were highlighted.
Industrial bioprocess; systematic integration; lactate; sodium gluconate
10.3969/j.issn.1674-0319.2017.06.011

庄英萍,博士,研究员,博导,教授。现任华东理工大学生物工程学院院长,国家生化工程技术研究中心(上海)主任,“863”生物和医药领域工业生物技术主题专家,中国微生物学会第十届理事会常务理事,生化过程模型化与控制专业委员会主任委员,上海市微生物学会副理事长。长期来主要从事发酵过程的优化与放大研究,在生物反应器工程国家重点实验室和工程中心研究团队中,形成了围绕生物过程优化与放大的理论、方法与装备,包括发酵过程生理状态参数在线多尺度相关分析、微观与宏观相结合优化、生理代谢特性与流程特性相结合的放大等关键技术,并在数十个品种的工业发酵产品中成功应用。近年获国家科技进步二等奖3项、发表SCI论文90余篇,获授权发明专利26项。E-mail:ypzhuang@ecust.edu.cn
田锡炜,男,博士后。主要从事过程组学方法调控和优化微生物发酵生产有机酸、氨基酸和抗生素的研究,以第一作者或共同作者在SCI期刊发表论文14篇。E-mail:xiweitian@ecust.edu.cn
国家重点基础研究发展计划(973计划)项目“工业生物过程系统集成原理”(2013CB733605)

