超高效液相色谱-四极杆-飞行时间质谱法快速检测发酵黑茶中黄曲霉毒素B1
姚 婷,王 丹,李 双,刘玉娟,孙秉康,汪 勇
(黄山学院 分析测试中心,安徽 黄山 245041)
超高效液相色谱-四极杆-飞行时间质谱法快速检测发酵黑茶中黄曲霉毒素B1
姚 婷*,王 丹,李 双,刘玉娟,孙秉康,汪 勇
(黄山学院 分析测试中心,安徽 黄山 245041)
以直接提取稀释结合黄曲霉毒素免疫亲和柱净化的方法,利用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF-MS),建立了发酵黑茶中黄曲霉毒素B1(AFB1)的快速分析方法。样品采用甲醇-水溶液(7∶3,体积比)提取,以HSS T3色谱柱(100 mm×2.1 mm,1.8 μm)进行色谱分离,通过正离子扫描,Full ms-dd-MS/MS模式进行分析。结果表明:33种发酵黑茶中的AFB1在一定范围内具有良好的线性关系,相关系数(r2)大于0.999,4种样品的加标回收率(n=4)为86.4%~98.0%,相对标准偏差(RSD)为0.3%~1.7%,检出限(LOD,S/N≥3)和定量下限(LOQ,S/N≥10)分别为0.06 μg/kg和0.19 μg/kg。结果显示33种样品中的AFB1含量均在合理范围内。该方法准确、快速、简单,适用于发酵黑茶中AFB1的检测。
超高效液相色谱-四极杆-飞行时间质谱;发酵黑茶;黄曲霉毒素B1;快速检测
黄曲霉毒素(Aflatoxin,AF)是一组由黄曲霉、寄生曲霉等真菌次生代谢所产生的具有毒性的化合物。目前已发现的黄曲霉毒素有20余种,常见的主要有黄曲霉毒素B1、B2、G1、G2和M1等,其中以黄曲霉毒素B1(AFB1,C17H12O6)毒性最强。AFB1对人体健康危害最大且在食品中分布最为广泛[1-3],主要存在于土壤、动植物和各种坚果中,花生和核桃中尤甚;大豆、稻谷、玉米、通心粉、调味品、牛奶、奶制品、食用油等制品中也经常发现AFB1。特别在热带和亚热带地区,食品中黄曲霉毒素的检出率较高。由于AFB1对动物和人类具有极强的致突变、免疫抑制性、肝毒性和致癌性,1993年AF被世界卫生组织的癌症研究机构划定为Ⅰ类致癌物[4-6]。因此,世界各国对食品中AFB1限量作出了严格的规定,欧盟98/53/EC指令中规定人类生活消费品中AFB1的限量为2 μg/kg,我国在GB 2761-2011中规定各类食品中AFB1的限量为0.5~20 μg/kg[7]。但茶叶中的AFB1未被列入日常检测项目,目前世界各国尚未对茶叶中AFB1的限量作出标准。
茶和茶文化起源于中国,黑茶是中国六大茶系之一,是利用菌发酵(双歧杆菌、葡萄糖酸杆菌等)的方式制成的一种后发酵茶,其制作原料一般较粗老。发酵中会产生一种俗名为“金花”的冠突散囊菌的有益菌,加之制造过程中往往堆积发酵时间较长,因而叶色油黑或黑褐,故称黑茶。黑茶的制作工艺一般包括杀青、揉捻、渥堆和干燥4道工序[8],因产区和工艺上的差别,又分为湖南黑茶、湖北老青茶、藏茶和滇桂黑茶。黑茶在发酵和仓储中存在高温、高湿等特殊性,所以制茶过程中的真菌毒素污染以及微生物的超标等问题备受关注。
目前黄曲霉毒素的检测方法主要有高效液相色谱法(HPLC)[9-10]、胶体金法[11]、荧光检测法[12-14]、高效液相色谱-串联质谱法(HPLC-MS/MS)[15-22]、超高效液相色谱-串联质谱法(UPLC-MS/MS)[23-24]等。HPLC-MS/MS的优势在于灵敏度高、准确可靠且高效快速,但检测中需使用荧光检测器,样品前处理过程繁琐,同时还需在柱前或柱后进行衍生,操作过于复杂;胶体金法属于快速检测方法,虽然该方法简单、快速,对实验人员与实验条件要求不高,但重现性和准确性相对较差。基于此,本文借助超高效液相色谱-四极杆-飞行时间质谱法(UPLC-Q-TOF-MS)[25-26]测定黑茶中AFB1的含量,并进行方法学验证。UPLC-Q-TOF-MS是分离科学中的一个全新类别,它借助于HPLC的理论及原理,涵盖了小颗粒填料、非常低系统体积及快速检测手段等全新技术,增加了分析的通量、灵敏度及色谱峰容量。与传统的检测方法相比,本方法样品前处理过程简单,大大缩短了样品前处理时间,减少了有机溶剂用量,且目标分析物无需衍生即可直接测定,能够显著提高结果准确性,具有准确、高效、灵敏等优点,为茶叶中AFB1的检测提供了新的技术选择。
1 实验部分
1.1 仪器、试剂及材料
超高效液相色谱仪串联四极杆飞行时间质谱仪(UPLC H-CLASS+QTOF G2-XS型,美国Waters公司);黄曲霉毒素免疫亲和柱(Pribolab公司,置于-20 ℃下保存);超声波清洗器(KH-500B型,昆山禾创超声仪器有限公司);粉碎机(04A型,云南捷豹机械设备有限公司);台式高速离心机(TG16-WS型,上海卢湘仪离心仪器有限公司);Milli-Q全自动超纯水制水机(美国Millipore公司);0.22、0.45 μm有机相微孔滤膜(德国Membrana公司);电子分析天平(感量0.000 1 g,上海实干实业有限公司);恒温磁力搅拌器(85-2型,巩义市予华仪器有限责任公司);氮吹仪(CM-24型,上海那艾精密仪器有限公司)。
甲醇(色谱纯,上海星可高纯溶剂有限公司,纯度≥99.90%);AFB1标准溶液(Pribolab公司,质量浓度为1 μg/mL,置于-20 ℃下保存,纯度≥98.00%);氯化钠(分析纯,国药集团化学试剂有限公司);甲醇(A454-4型质谱纯,美国Fisher Chemical公司,纯度≥99.99%);实验用水为超纯水(18.2 MΩ·cm);除Q-TOF-MS用醇为质谱纯,其余所用醇均为色谱纯。
实验中所用茶叶共33个品种,其中天尖茶2016、茯砖茶2016、千两茶2016、茯砖茶2013、天尖茶2011、天尖茶2015购自湖南省安化某超市;百两茶2012、27、46、63、康砖2012、茯砖2012、金尖2012、春尖2012、雅细2008、金尖2015(1)、金尖2015(2)购自四川省雅安市某超市;C-Q-0、41、51、61、青砖茶2010、传承2015、传承2012、传承2009、永巨川2015、铁盒巧克力、3、14-2、大昌川2014、洞庄茶号、壹号特制2014、小金沱购自湖北省咸宁市某超市。
1.2 实验条件
1.2.1超高效液相色谱条件色谱柱:HSS T3柱(100 mm×2.1 mm,1.8 μm);柱温:25 ℃;流速:0.4 mL/min;进样量:1 μL;流动相:A为水,B为甲醇;梯度洗脱程序:0~0.5 min,5%B;0.5~5 min,5%~65%B;5~7 min,65%B;7~7.5 min,65%~5%B;7.5~10 min,5%B。
1.2.2质谱条件电喷雾离子源(ESI):正离子模式;离子源温度:120 ℃;脱溶剂气(N2)温度:500 ℃,毛细管电压:3.0 kV;锥孔电压40 V;锥孔气(N2)流量:50 L/h,脱溶剂气体(N2)流量:900 L/h;氩气作为碰撞气,碰撞压力:0.05 MPa,碰撞能量:6 eV和30 eV;母离子为m/z313,子离子为m/z285;保留时间:6.16 min。
1.3 标准溶液配制
取200 μL质量浓度为1 μg/mL的AFB1标准溶液,用甲醇定容至1 mL,配成200 μg/L的标准溶液,按照稀释原理,将200 μg/L的标准溶液作为母液,分别配制100、50、20 μg/L的黄曲霉毒素标准液,再将100 μg/L的标准溶液作为母液,分别配制出10、5 μg/L及未添加黄曲霉毒素的标准液,现用现配。
1.4 样品处理
1.4.1提取先称取5 g经粉碎研细的茶叶样品于50 mL具塞锥形瓶中,加入25 mL甲醇-水(7∶3)和1 g氯化钠,摇匀,于磁力搅拌器中搅拌1 h,再用超声波清洗器超声15 min,取上层溶液于1 200 r/min离心10 min,定量滤纸过滤,移取5 mL过滤液加10 mL水稀释,于1 200 r/min离心10 min,取上清液经0.45 μm有机滤膜过滤至澄清。
1.4.2净化将免疫亲和柱连接于10 mL塑料注射器下,取10 mL样品提取液,以3 mL/min的流速通过黄曲霉毒素免疫亲和柱,再用10 mL水以6 mL/min的流速淋洗柱子2次,弃去全部流出液,并使2~3 L空气通过柱体,加入1 mL甲醇洗脱,流速为1 mL/min,收集全部洗脱液于尖底刻度试管中。
1.4.3定容将洗脱液于50 ℃下N2吹干,待洗脱液充分混合后,经0.22 μm有机滤膜过滤至澄清,供检测用。
1.5 基质效应实验
将不含AFB1的茶叶样品,按“1.4”的前处理方法处理后得到的溶液作为基质空白溶液,向其中加入一定浓度的AFB1标准溶液,经UPLC-MS分析后,比较其与相同浓度水平标准溶液(以甲醇溶液作为溶剂)的质谱响应情况。通过计算AFB1在基质溶液与标准溶液中峰面积的差异,来评价各类发酵黑茶的基质效应。若两者的峰面积之比在80%~120%之间,表明基质效应不明显,反之,基质效应明显。
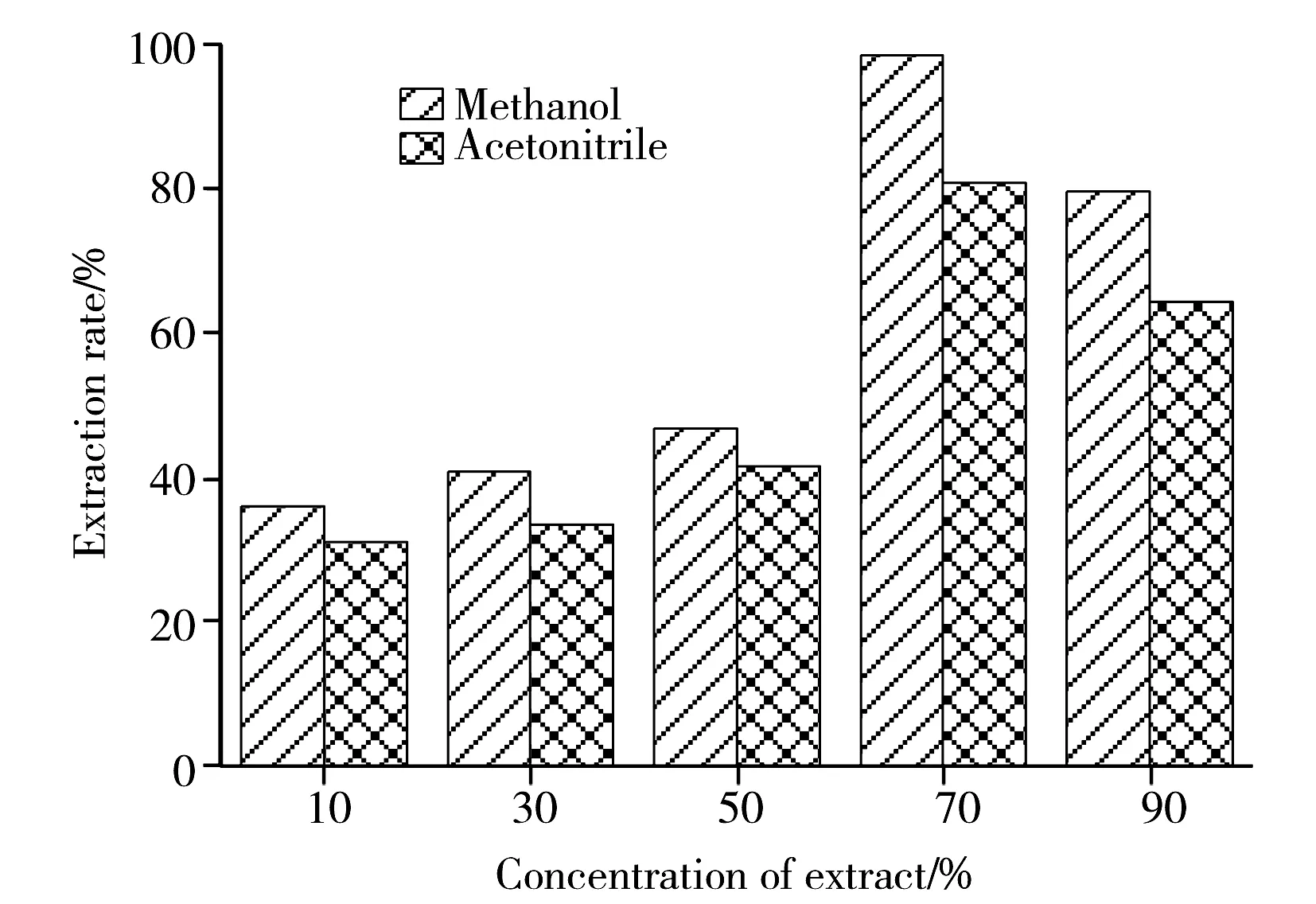
图1 不同浓度条件下AFB1的提取效果Fig.1 Extraction effect of AFB1 in different elution conditions
2 结果与讨论
2.1 样品提取剂的优化
大量的实验研究表明,真菌毒素的提取一般采用极性溶液,乙腈-水是被广泛使用的一种提取溶剂。本实验分别考察了不同体积比的乙腈-水溶液和甲醇-水溶液的提取效果,同时还比较了加入0、1、3、5 g氯化钠对AFB1提取的影响(图1)。结果表明,随着甲醇浓度的提高,AFB1的提取回收率也逐渐升高,当甲醇的浓度为70%,添加1 g氯化钠时,AFB1的提取回收率最高为 98.9%。因此,本实验采用甲醇-水(7∶3)作为提取剂,且向其中加入1 g氯化钠作为电解质。
2.2 检测条件优化
2.2.1超高效液相色谱条件对于液质联用的系统,流动相的选择不仅要考虑系统的洗脱能力,还需考虑各组分在质谱中的离子化效率,由于黄曲霉毒素易溶于甲醇和乙腈,本实验分别考察了甲醇-水(7∶3)和乙腈-水(7∶3)为流动相的分离效果。结果发现,虽然乙腈在液相中的洗脱效果比甲醇好,但其离子化程度明显受到抑制,离子丰度明显降低,导致灵敏度下降,说明乙腈的离子化效率低,故实验选择甲醇-水(7∶3)为流动相,以获得较好的色谱峰形。
由于茶叶样品基质比较复杂,为有效分离杂质峰与目标峰,分别考察了不同的洗脱条件。结果显示,当甲醇的起始比例大于30%时,杂质峰与目标峰不能彻底分离,进而影响目标峰的定量积分,因此实验采用“1.2.1”所述洗脱梯度,可使保留组分较快洗脱,从而避免影响下一个样品的测定。
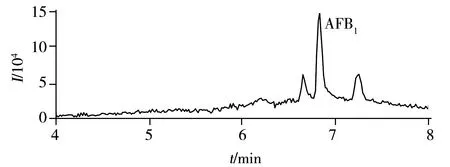
图2 AFB1标准溶液的总离子流色谱图Fig.2 Total ion chromatogram of AFB1
2.2.2质谱条件在“1.2”实验条件下,取200 μg/L的AFB1标准溶液进样1 μL,以Full ms-dd MS/MS模式进行UPLC-Q-TOF-MS分析,图2为AFB1的总离子流色谱图。由AFB1标准品的二级质谱图(图3)可知,强度最高的离子为m/z313,此离子为母离子(M-H)。其信号强度最高的子离子为m/z285,所以本实验确定AFB1的监测离子对为m/z313→285。通过优化MRM离子对的各参数,使子离子得到最大响应。当碰撞能为6 eV,能使母离子的信号强度达到最大,当碰撞能为30 eV时,能使子离子的信号强度达到最大,而当毛细管电压为1.5 kV,锥孔电压为20 V,信号强度达到最大,因此本实验同时选择6 eV和30 eV的碰撞能,毛细管电压为1.5 kV,锥孔电压为20 V。
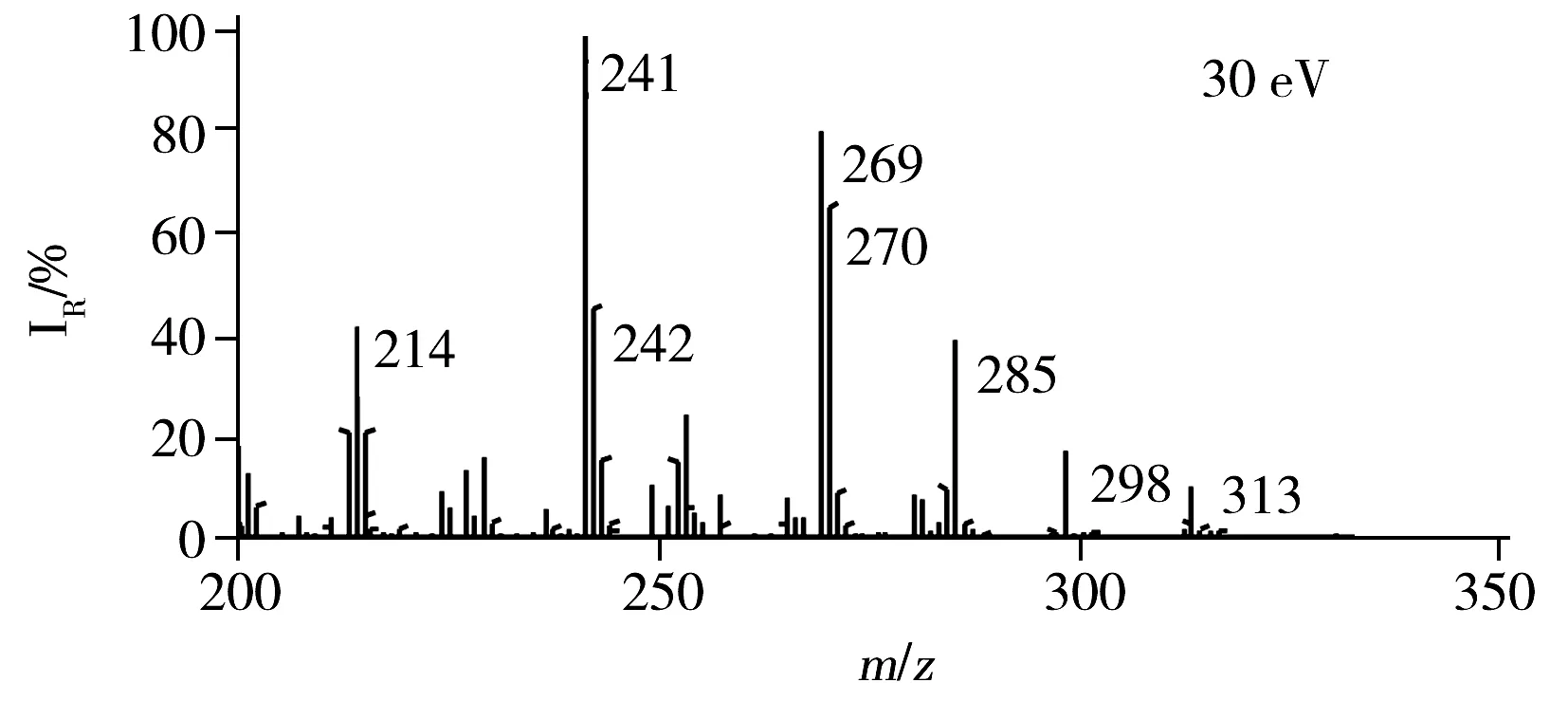
2.3 基质效应
由于本方法前处理采用直接提取稀释法,样品中会存在一定的基质效应干扰,减少基质效应对于获得准确的回收率尤为重要。本实验选取不含AFB1的4种茶叶作为空白基质,利用相同的前处理方法分别加入1、5、10、20、50 μg/L标准溶液,测定AFB1的峰面积(A)。再以甲醇为溶剂配制1、5、10、20、50 μg/L的标准溶液,测定峰面积(B)。按照基质效应ME(%)=B/A×100%,计算得AFB1的ME为82.17%~107.28%,表明黄曲霉毒素受基质效应的影响不大,基质抑制不明显。
2.4 准确度与精密度
在制备好的4个空白基质样品中分别添加10、20、50 μL质量浓度为1.00 μg/mL的AFB1标液(添加量相当于0.01、0.02、0.05 μg)。按照“1.4”方法进行处理,通过测定3个加标水平的AFB1加标样品计算回收率(n=4),结果列于表1。由表1可知,样品的加标回收率为86.4%~98.0%,相对标准偏差(RSD)均不大于4.7%,符合欧盟法规对于真菌毒素检测方法回收率和RSD的要求[27]。
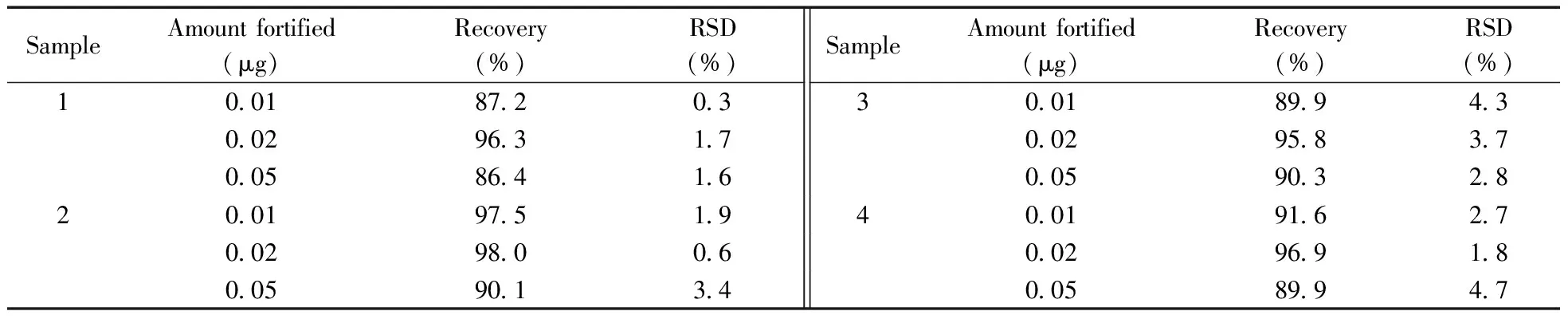
表1 空白样品中AFB1的回收率及相对标准偏差Table 1 Recoveries and relative standard deviations(RSD)for AFB1 in blank samples
2.5 标准曲线、检出限及定量下限
将按“1.3”方法配制的标准溶液在优化条件下进行分析,以AFB1的质量浓度(x,μg/L)为横坐标,定量离子的峰面积(y)为纵坐标绘制标准曲线。结果表明,AFB1在0~200 μg/L质量浓度范围内线性关系良好,相关系数(r2)为0.999 8,检出限(LOD,S/N≥3)和定量下限(LOQ,S/N≥10)分别为0.06 μg/kg和0.19 μg/kg。AFB1的LOQ低于我国和欧盟规定的粮食中真菌毒素限量[32],说明该方法具有良好的准确度和精密度,能满足日常监测需要。
2.6 实际茶叶样品中AFB1的检测
采用本文建立的方法,对市售的33种发酵黑茶中AFB1的含量进行检测,结果见表2。从表2可知,不同品种茶叶中AFB1的含量不同,2012年产的金尖、茯砖、春尖中AFB1含量分别为0.71、1.00、0.80 μg/kg;因年份、仓储时间的差异,相同茶叶中AFB1含量也不同,原则上年份越久,仓储时间越长,AFB1含量越高,如天尖2011、2015和2016中AFB1的含量分别为1.28、1.22、0.72 μg/kg,传承2009、2012和2015中AFB1的含量分别为1.05、0.75、0.64 μg/kg;相同年份不同厂家的茶叶中AFB1的含量也不同,如金尖2015中雅安茶厂(1)、蔡龙茶厂(2)中AFB1的含量分别为0.62、0.71 μg/kg。
此次所检测的33种茶叶中均检出AFB1,其中有6种茶叶(如天尖2011,1.28 μg/kg)的AFB1含量超过1.0 μg/kg,但所有茶叶样品均不超过欧盟在98/53/EC指令中规定人类生活消费品中AFB1的限量(2 μg/kg)。这批茶叶中的AFB1虽未超标,但测试结果表明,发酵黑茶在制作和储藏过程中会受到AFB1的污染,存在一定的食品安全隐患。
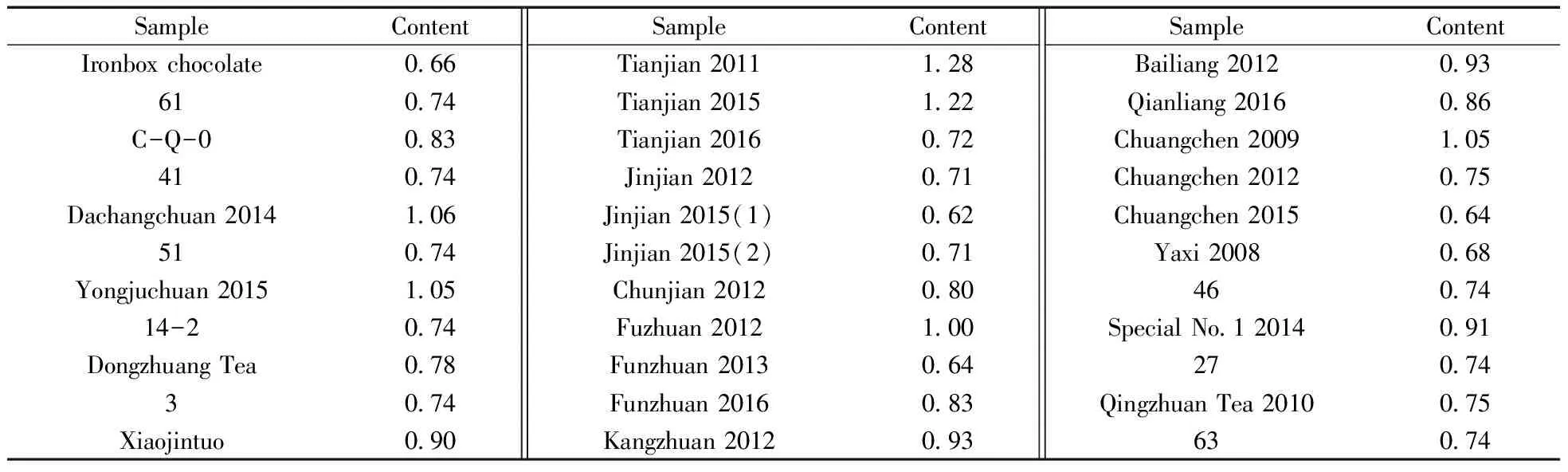
表2 33种茶叶中AFB1的含量(μg/kg)Table 2 Contents of AFB1 in 33 kinds of tea(μg/kg)
3 结 论
基于UPLC-Q-TOF-MS技术,通过优化样品提取条件、色谱以及质谱条件,建立了发酵黑茶中AFB1的快速分析方法。该方法具有快速、前处理方法简单和结果准确等优点,对于AFB1的检测具有很强的实用性,为快速筛查茶叶中AFB1含量以及推进我国茶叶中AFB1限量标准的制定提供了方法参考。
[1] Li S H,Ren D D,Xie Y F,Liu J,Yang Y T.J.FoodSafety&Quality(李少晖,任丹丹,谢云峰,刘佳,杨永坛.食品安全质量检测学报),2015,6(4):1107-1115.
[2] Yang L,Ji J,Li G H,Li W J,Chen Z L,Wang H Y.Trans.TianjinUniv.,2014,20(6):451-457.
[3] Wu Q H.StudyonComponentsofInhibitingProductionofAflatoxininTeaandRelatedCharacteristics.Xianyang:North West Agriculture and Forestry University(吴清华.茶叶中抑制黄曲霉毒素产生的组分及相关特性研究.咸阳:西北农林科技大学),2013.
[4] Hamidi A,Mirnejad R,Yahaghi E,Behnod V,Mirhosseini A,Amani S,Sattari S,Daian E K.AsianPac.J.TropBiomed.,2013,3(9):732-736.
[5] Sheng Y J,Sergei E,Mi T J,Zhang S X,Shen J Z,Wang Z H.Biomed.Environ.Sci.,2014,27(2):126-129.
[6] Yin Y N,Yan L Y,Jiang J H,Ma Z H.J.ZhejiangUniv.Sci.B,2008,9(10):787-792.
[7] GB 2761-2017.National Food Safety Standards Maximum Levels of Mycotoxins in Foods.National Standards of the People′s Republic of China(食品中真菌毒素限量.中国人民共和国国家标准).
[8] Wang Y C,Yuan H B,Jiang Y W.ChineseAgriculturalScienceBulletin(王银诚,袁海波,江用文.中国农学通报),2016,32(22):1194-199.
[9] Chen L,Wen J X,Lei Y,Zhang R.J.Instrum.Anal.(陈林,温家欣,雷毅,张荣.分析测试学报),2015,34(9):1008-1013.
[10] SN/T 3868-2014.Determination of AFB1,B2,G1,G2in Export Vegetable Oils by Immunoaffinity Column Cleanup HPLC.National Standards of the People′s Republic of China(出口植物油中AFB1、B2、G1、G2的检测——免疫亲和柱净化高效液相色谱法.中国人民共和国国家标准).
[11] NY/T 2550-2014.Determination of AFB1in Feeds——Colloidal Gold Method.National Standards of the People′s Republic of China(饲料中AFB1的测定 胶体金法.中国人民共和国国家标准).
[12] GB 5009.22-2016.Determination of Aflatoxin B and G Groups in Foods.National Standards of the People′s Republic of China(食品中黄曲霉毒素B族和G族的测定.中国人民共和国国家标准).
[13] NY/T 2549-2014.Determination of AFB1in Feeds——Immunoaffinity Fluorescence Method.National Standards of the People′s Republic of China(饲料中AFB1的测定 免疫亲和荧光光度法.中国人民共和国国家标准).
[14] NY/T 2548-2014.Determination of AFB1in Feeds by Time Resolved Fluorescence Immunochromatography.National Standards of the People′s Republic of China(饲料中AFB1的测定 时间分辨荧光免疫层析法.中国人民共和国国家标准).
[15] NY/T 2071-2011.Determination of Aflatoxins,Zearalenone and T-2 Toxins in Feeds by High Performance Liquid Chromatography Tandem Mass Spectrometry.National Standards of the People′s Republic of China(饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定 高效液相色谱-串联质谱法.中国人民共和国国家标准).
[16] Yang X L,Qiu F,Wei R W,Qin Y,Yang M H,Ouyang Z.Chin.J.Pharm.Anal.(杨小丽,仇峰,韦日伟,覃禹,杨美华,欧阳臻.药物分析杂志),2012,32(4):627-630.
[17] Mi J B,Bi Y G,Zhao K X,Li S J,Xu H,He J,Zheng W J.J.Instrum.Anal.(宓捷波,毕玉国,赵孔祥,李淑静,许泓,何佳,郑文杰.分析测试学报),2015,34(11):1227-1232.
[18] Luo H T,Huang X L,Wu H Q,Zhong Q L,Zhu Z X,Huang F,Lin X S,Xie M T,Ouyang G F.J.Instrum.Anal.(罗辉泰,黄晓兰,吴慧勤,钟巧莉,朱志鑫,黄芳,林晓珊,谢梦婷,欧阳钢锋.分析测试学报),2015,34(9):979-985.
[19] Li Y,Sheng Y G,Yi X H,Shi Y Y,Zhao S Z,Bao M,Lu J L,Deng X J.J.Instrum.Anal.(李优,盛永刚,伊雄海,时逸吟,赵善贞,包明,陆吉林,邓晓军.分析测试学报),2015,34(9):993-998.
[20] Xiao X F,Wang J L,Chen T,Liu T F,He J,Deng H Y,Yang J J.J.Instrum.Anal.(肖晓峰,王建玲,陈彤,刘艇飞,何军,邓弘毅,杨娟娟.分析测试学报),2015,34(9):1021-1026.
[21] Wang K,Wei Y J,He Y,Cao L L,Zuo S M.JournalofEnvironmentandHealth(王可,魏永巨,何叶,曹丽玲,左书梅.环境与健康杂志),2014,31(8):718-720.
[22] Zhao H J,Wang K,Yang W H,Yang C Y.JournalofTeaScience(赵浩军,王坤,杨卫花,杨朝义.茶业科学),2013,33(3):237-241.
[23] Ye M L,Nie J Y,Xu G F,Yan Z,Zheng L J,Li Z X.J.Instrum.Anal.(叶孟亮,聂继云,徐国锋,闫震,郑丽静,李志霞.分析测试学报),2015,34(11):1276-1280.
[24] Fu C H,Huang X X,Min S G.Chin.J.Anal.Lab.(付朝晖,黄雪祥,闵顺耕.分析试验室),2009,28(6):112-115.
[25] Xu L,Mu L H,Peng J,Liu W W,Tan X,Li Z L,Wang D X,Liu P.J.Chromatogr.B,2016,1026(7):36-42.
[26] Abed S M,Zhou X Q,Ali A H,Jin Q Z,Wang X G.JournalofFoodCompositionandAnalysis,2017,62(9):245-253.
[27] Commission Regulation(EU)No 519/2014 Amending(EC)No 401/2006 as Regards Methods of Sampling of Large Lots,Spices and Food Supplements,Performance Criteria for T-2,HT-2 Toxin and Citrinin and Screening Methods of Analysis.
Rapid Detection of Aflatoxin B1in Fermented Dark Tea by Ultra Performance Liquid Chromatography-Quadrupole Time-of-Flight Mass Spectrometry
YAO Ting*,WANG Dan,LI Shuang,LIU Yu-juan,SUN Bing-kang,WANG Yong
(Analysis and Testing Center,Huangshan University,Huangshan 245041,China)
An ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometric(UPLC-Q-TOF-MS) method with purification of aflatoxin immunoaffinity column was established for the determination of aflatoxin B1(AFB1) in fermented dark tea.The sample was extracted with methanol-water(7∶3,by volume),and separated with an HSS T3 column(100 mm×2.1 mm,1.8 μm),then scanned in positive ion scanning mode and analyzed in Full ms-dd-MS/MS mode.The results showed that there existed good linearities for aflatoxin B1in 33 kinds of fermented dark tea in corresponding concentration range,with their correlation coefficients all greater than 0.999.The recoveries were in the range of 86.4%-98.0%with the relative standard deviations(RSDs) of 0.3%-1.7%.The limits of detection(LODs,S/N≥3) and the limits of quantification(LOQs,S/N≥10) were 0.06 μg/kg and 0.19 μg/kg,respectively.This method was used to detect AFB1in 33 tea samples collected from the local markets,and negative results were obtained.The results showed that the contents of AFB1were within a reasonable range.This method was accurate,rapid and simple,and was suitable for the daily detection of AFB1.
ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry;fermented dark tea;aflatoxin B1;rapid detection
2017-07-11;
2017-07-25
安徽省高校自然科学研究项目(KJ2017A400,KJ2013B270);院科研启动项目(2016xkjq006);安徽省百万优秀青年人才支持计划重点项目(gxypzd2016305)
*
姚 婷,讲师,研究方向:化合物的分离分析鉴定与应用,Tel:0559-2546502,E-mail:yting@hus.edu.cn
10.3969/j.issn.1004-4957.2017.11.009
O657.7;R155.5
A
1004-4957(2017)11-1346-06

