离子液体-分散液液微萃取/高效液相色谱法用于猪肾脏中3种四环素类抗生素的检测
张 英,丁健桦,向虹霖,刘鹏飞
(东华理工大学 化学生物与材料科学学院,江西 南昌 330013)
离子液体-分散液液微萃取/高效液相色谱法用于猪肾脏中3种四环素类抗生素的检测
张 英,丁健桦*,向虹霖,刘鹏飞
(东华理工大学 化学生物与材料科学学院,江西 南昌 330013)
建立了分散液液微萃取(DLLME)技术进行样品前处理,高效液相色谱(HPLC)法测定猪肾脏中土霉素(OTC)、四环素(TC)、金霉素(CTC)3种四环素类抗生素(TCs)残留量的方法。考察了分散剂种类、离子液体用量、分散剂用量、样品溶液pH值、萃取时间、盐效应等因素对萃取效率的影响。优化后的实验条件为:以丙酮为分散剂,离子液体([BMIM]PF6)用量为50 μL,分散剂用量为140 μL,样品溶液pH值为3.0,萃取时间为15 min,不添加盐。该方法在0.1~10.0 mg/L范围内线性关系良好(r2≥0.999 5),土霉素、四环素和金霉素的相对标准偏差(RSD)为2.2%~3.1%,检出限(LOD)为54~93 μg/L,富集倍数为7.0~27.8,且样品的加标回收率达99.5%~101.1%。该法准确度和精密度均满足分析方法的要求,实现了对猪肾脏中土霉素、四环素、金霉素3种四环素类抗生素残留量的快速、绿色、灵敏和准确检测。
离子液体;分散液液微萃取;高效液相色谱;四环素类抗生素;猪肾脏
四环素类抗生素(TCs)是一类由放线菌产生的广谱抗生素,常用的有土霉素(OTC)、四环素(TC)、金霉素(CTC)及一些半合成衍生物如强力霉素等。TCs具有良好的抑菌性,能有效地治疗和预防疾病,还可作为生长促进剂被添加到饲料中,因此被广泛应用于畜牧养殖业[1-2]。但是抗生素使用不当或滥用,将导致动物体内抗生素残留量较高,其中大部分会随粪便、尿液等排泄物排出,如果将其排泄物作为有机肥施入农田,则会引发土壤、水体等一系列环境污染问题;同时,长期摄入含有抗生素的动物源性食品也将对人体健康造成危害[3]。目前抗生素滥用已成为人们关注的一个热点问题,而复杂体系中抗生素残留的灵敏、准确、可靠分析方法的研究和建立是抗生素滥用研究的前提和基础,显得非常迫切和重要。
高效液相色谱法(HPLC)是TCs残留量检测的一种常用分析方法,具有操作简便、快速、准确等特点,其重现性、稳定性、分离效果等均能满足产品的检验要求[4]。但由于大多数生物样品基质复杂,在HPLC测定前须进行样品前处理。传统的样品前处理技术(如液-液萃取等)存在有机溶液消耗大,易对环境造成二次污染,富集倍数低,难以满足痕量分析要求等不足[5]。分散液液微萃取(DLLME)则是一种新型的微萃取技术,具有操作简便、快速、成本低、富集效率高、有机溶剂用量少等优点[6-7]。传统DLLME使用的萃取剂多为高毒性的卤代烃,对环境存在一定的污染。而离子液体(IL)是一种新型的绿色溶剂,具有难挥发、高稳定、强极性和无污染等特性,代替常规有机溶剂作为萃取剂更为绿色环保,现已广泛应用于复杂样品的萃取分离分析[8-14]。IL-DLLME方法萃取过程耗时短,灵敏度高,易与其它检测仪器联用,是一种具有发展前途的环保型分离富集技术[15-18]。本文采用IL-DLLME技术结合HPLC法,建立了猪肾脏中OTC、TC、CTC 3种TCs的高效、灵敏的测定方法,为猪肾脏等动物组织中这3种TCs残留的检测提供了有效的参考。
1 实验部分
高效液相色谱仪(安捷伦1260,美国安捷伦公司);pH计(PHS-3C,仪电科学仪器公司);超声波清洗器(KQ5200DB,昆山市超声仪器有限公司);玻璃仪器气流烘干器(KQ-8,巩义市予华仪器有限责任公司);离心机(X-K400,江苏新康医疗器械有限公司);冰箱(海尔BCD-216SZ,海尔集团有限公司)。
盐酸土霉素(>96.5%)、盐酸四环素(>95.9%)、盐酸金霉素(>90.1%)标准品(中国食品药品检定研究院);甲醇、乙腈(色谱级,国药集团化学试剂有限公司);三氟乙酸(分析纯,国药集团化学试剂有限公司);[BMIM]PF6(>99%,兰州物理研究所);氢氧化钠、氯化钠、乙酸乙酯、乙醇、丙酮(分析纯,西陇化工股份有限公司);实验用水为二次蒸馏水。
新鲜猪肾脏样品购于学校附近菜市场。
1.2 实验原理与操作步骤
1.2.1实验原理在样品溶液中加入萃取剂,再加入合适的分散剂使萃取剂在样品溶液中均匀分散,从而增大萃取剂与样品溶液的接触面积。因各待测组分在样品溶液和萃取剂中的分配系数不同,导致超声萃取和离心后最终形成三相体系,最后用微量进样针取其萃取相进样分析[19]。
1.2.2操作步骤向样品溶液中加入一定量的萃取剂([BMIM]PF6)与分散剂(丙酮)的混合溶液,摇匀,此时呈分散剂/萃取剂/样品溶液三相体系的浑浊溶液,超声萃取15 min,待体系达到平衡后放入离心机中离心5 min使其分层,此时待测组分被萃取到下层的沉积相中,最后吸取一定量的沉积相溶液经HPLC进样分析。
基于图像技术的破碎卵石指标相关性对比分析…………………………………… 张苏花,高占须,郭庆林(5-279)
1.3 溶液的配制
标准溶液:分别称取OTC、TC、CTC各 5 mg,用水溶解并转移至10 mL棕色容量瓶中,定容,即得质量浓度各为500 mg/L的标准储备液。实验中所需的标准溶液均由该储备液适当稀释后配制。
三氟乙酸溶液:准确移取三氟乙酸0.765 mL,用水定容至100 mL容量瓶中,得到浓度为0.1 mol/L的三氟乙酸溶液。
氢氧化钠溶液:准确称取氢氧化钠固体0.4 g于烧杯中,用水溶解并定容至100 mL容量瓶中,得到浓度为0.1 mol/L的氢氧化钠溶液。
样品溶液:取新鲜猪肾脏样品,经绞肉机绞碎后准确称取5.000 0 g于50 mL烧杯中,依次加入2.5 mL浓度为0.1 mol/L的三氟乙酸溶液与12.5 mL乙腈,搅拌均匀后超声提取15 min,待过滤后用水定容至100 mL,置于冰箱备用。
1.4 色谱条件
色谱柱为C18柱(Ameritech,Dim.250 mm×4.6 mm);柱温为25 ℃;紫外检测波长为350 nm。流动相:A为乙腈,B为甲醇,C为0.02%三氟乙酸;流速为1.5 mL/min;梯度洗脱:0~5 min,85%~70%A,5%~10%B;5~22 min,70%~60%A,10%B。
2 结果与讨论
2.1 萃取条件的优化
取质量浓度为10.0 mg/L的TCs混合标准溶液,按照“1.2.2”萃取操作步骤和“1.4”色谱条件,分别考察了分散剂种类和用量、离子液体用量、样品溶液pH值、萃取时间和盐效应等因素对TCs萃取效率的影响。
2.1.1分散剂种类及用量的优化考察了甲醇、乙醇、乙腈、丙酮4种分散剂对萃取效率的影响,结果表明,以丙酮为分散剂时,离子液体的萃取效果最好,因此本文选择丙酮为最佳分散剂。
实验考察了分散剂丙酮的用量(60、80、100、120、140、160 μL)对萃取效率的影响。结果如图1A所示,随着分散剂用量在60~140 μL范围内逐渐增加,TCs的萃取效率总体呈增大趋势;当分散剂用量为140 μL时萃取效率最大,这是由于增加分散剂用量,能使萃取剂与样品溶液接触几率增加;而当分散剂用量大于140 μL时,TCs的萃取效率反而降低,可能是因为分散剂用量过多稀释了样品溶液,从而间接影响了萃取效率。因此本文选择最佳分散剂用量为140 μL。
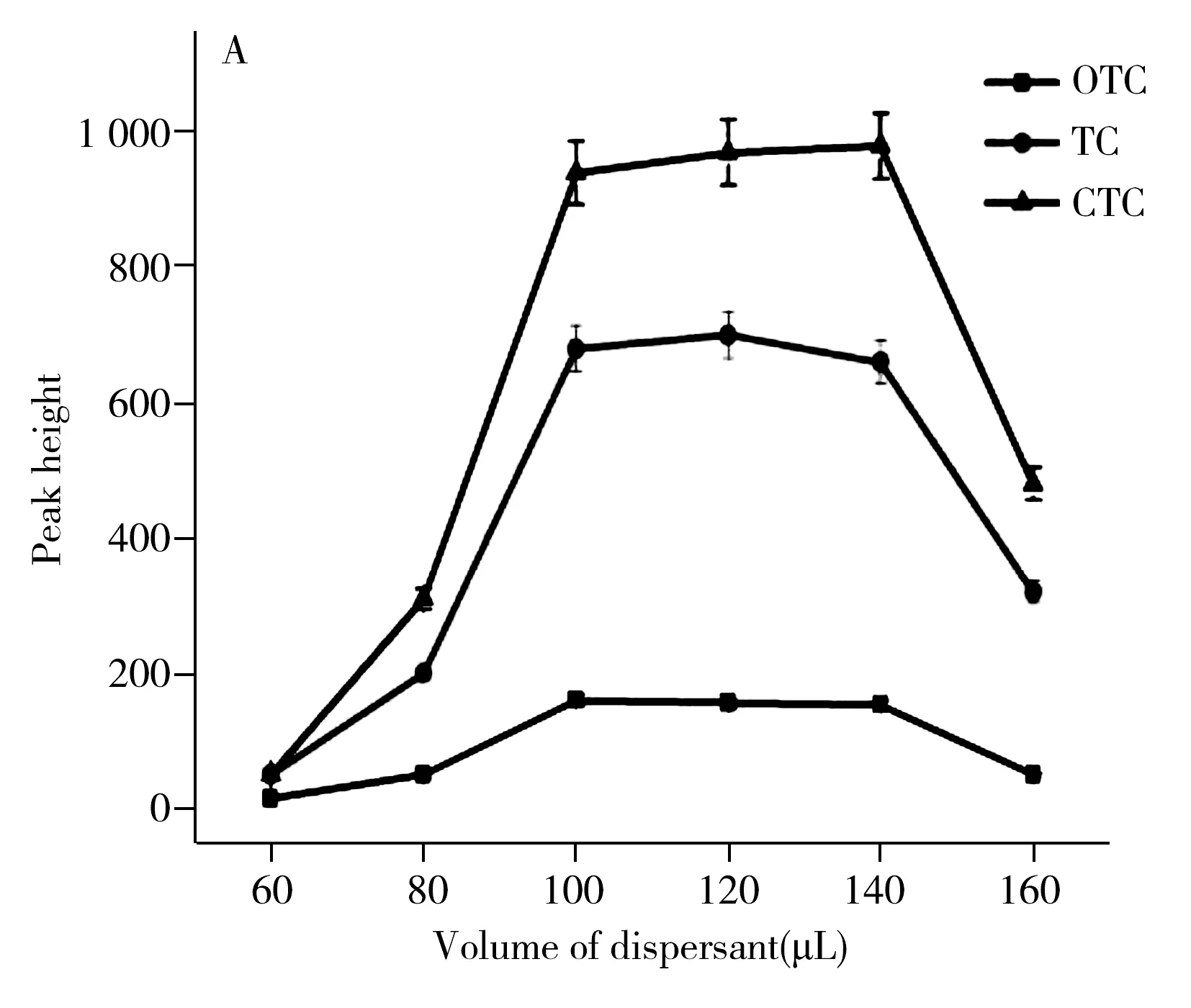
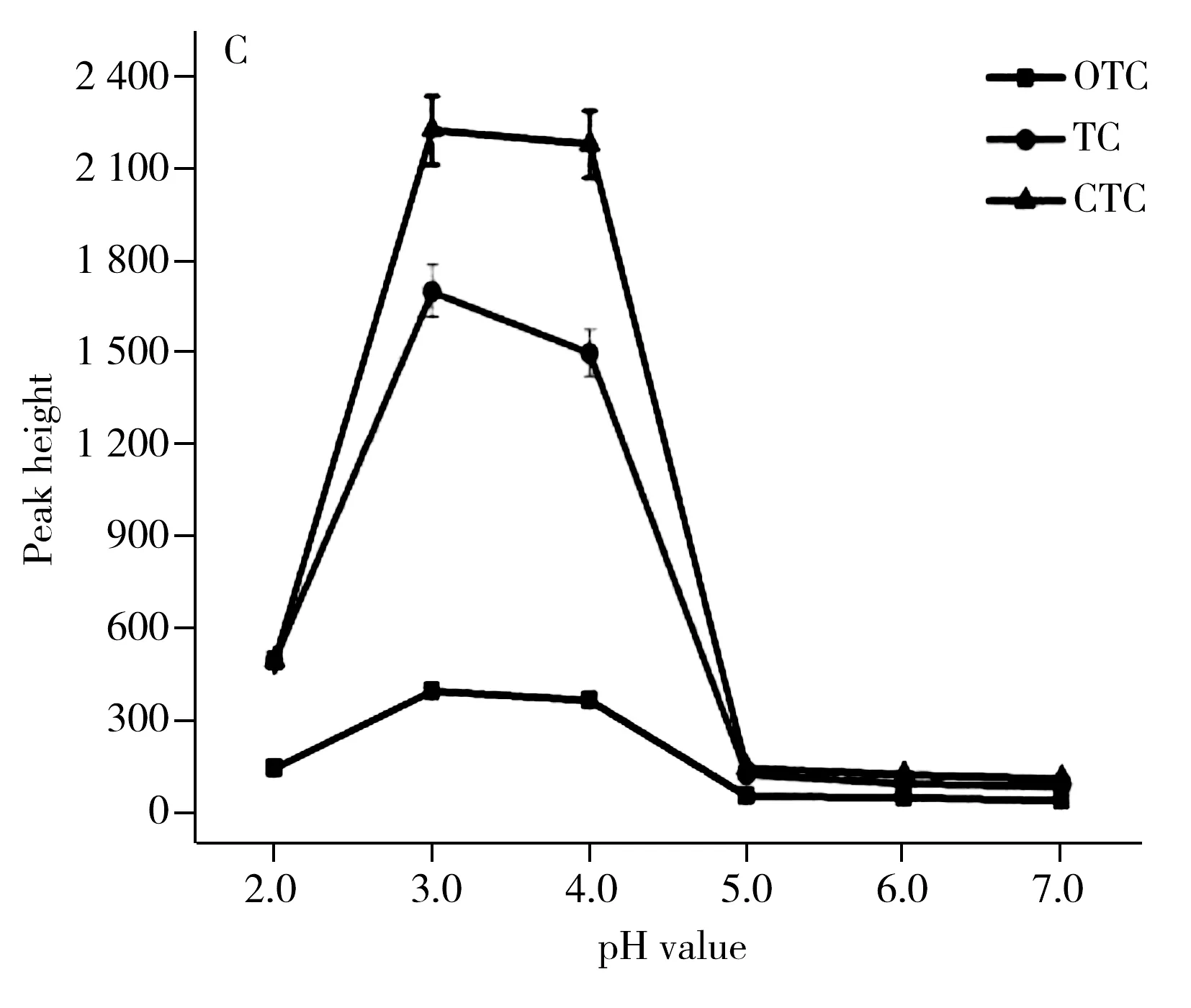
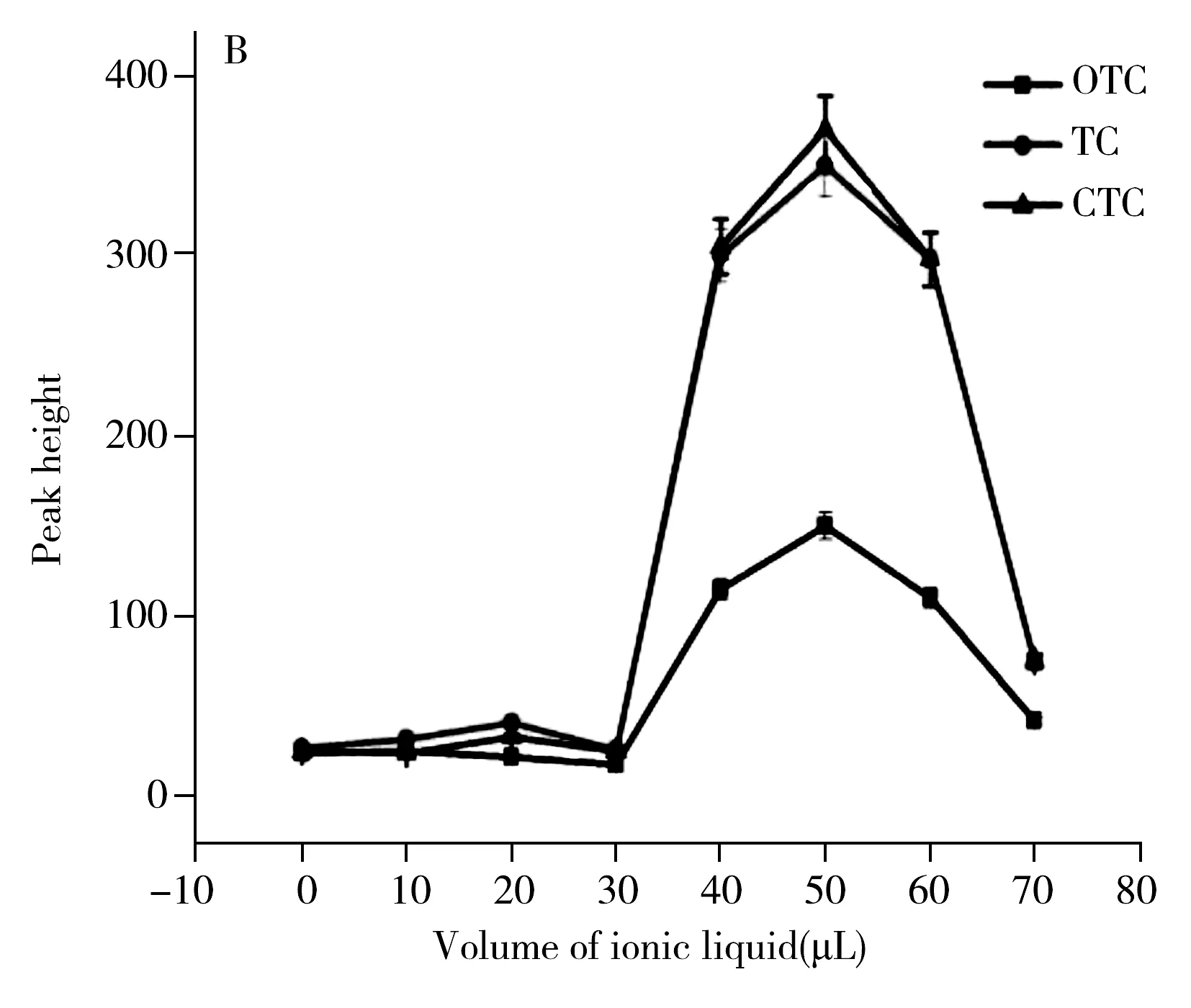

图1 不同萃取条件对TCs萃取效率的影响Fig.1 The effect of different conditions on TCs extraction efficiencyA.volume of dispersant,B.volume of ionic liquid,C.pH value,D.extraction time
2.1.2离子液体([BMIM]PF6)用量的优化以丙酮为分散剂,考察离子液体用量(0、10、20、30、40、50、60、70 μL)对萃取效率的影响。结果如图1B所示,萃取效率随着离子液体用量的增加而增大,但当离子液体用量高于50 μL时,萃取效率逐渐下降。这可能是因为加入的离子液体体积不足(低于50 μL)导致样品中TCs萃取不完全;而加入离子液体过多(高于50 μL)则会较大地稀释萃取的TCs,降低萃取效率。所以本文选择离子液体用量为50 μL。
2.1.3样品pH值的优化TCs在酸性与碱性条件下很不稳定,因此pH值对萃取效率的影响具有决定性。用0.1 mol/L三氟乙酸和氢氧化钠溶液将样品溶液pH值调至2.0、3.0、4.0、5.0、6.0、7.0,以丙酮为分散剂,考察样品pH值对萃取效率的影响。结果如图1C所示,pH 3.0时,萃取效率最高,故本文选择最佳样品pH值为3.0。
2.1.4萃取时间的优化传质的速率决定了体系达到平衡的时间。以丙酮为分散剂,考察了萃取时间(5、10、15、20、25 min)对萃取效率的影响。结果如图1D所示,萃取时间为15 min时,萃取效率最高,继续延长萃取时间,萃取效率反而降低。这是因为在DLLME过程中萃取一定时间(如15 min)后,随着萃取时间的继续增加,分散剂丙酮的挥发量增大,导致[BMIM]PF6萃取剂损失加剧。因此本文选择最佳萃取时间为15 min。
2.1.5样品盐浓度的优化分别加入不同量的NaCl(0、5%、10%、15%、20%、25%),考察样品盐浓度对萃取效率的影响。结果表明,萃取效率随着盐浓度的增加反而减小,可能是因为加入盐溶液后体系的离子强度增加,使得离子液体的溶解度增大,从而降低了萃取效率。因此本实验选择不加盐。
2.2 线性范围、精密度与检出限
移取适量3种TCs标准储备液,配制成质量浓度分别为0.1、0.2、0.5、1.0、2.0、5.0、10.0 mg/L的混合标准溶液,在优化条件下对不同浓度的混合标准溶液分别进行测定,以3种TCs的质量浓度(x,mg/L)对其峰面积(y)进行线性回归分析。对质量浓度为1.0 mg/L的TCs混合标准溶液,在优化的DLLME和HPLC条件下进行11次重复测定,经计算得3种TCs的相对标准偏差(RSD);当信噪比(S/N)为3时,根据公式LOD=3cσ/S(c为标准品的浓度,σ为标准偏差,S为净响应信号强度平均值)计算得3种TCs的检出限(LOD)。其线性范围、精密度、检出限见表1。由表1可见,本法线性关系良好,RSD不高于3.1%,LOD为54~93 μg/L,具有灵敏度高、重现性好的特点,能够用于TCs的灵敏检测。
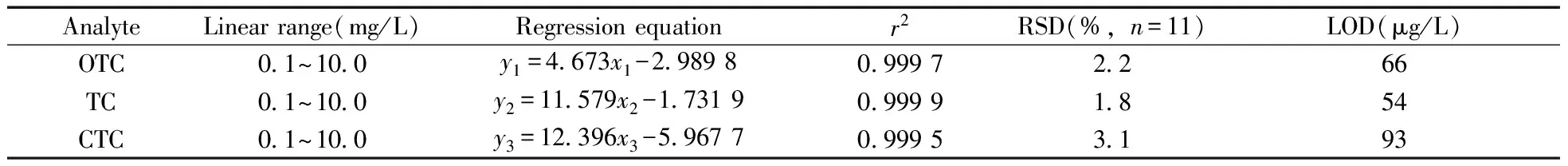
表1 3种TCs的线性方程、线性范围、精密度与检出限Table 1 Linear equations,linear ranges,RSDs and LODs of three TCs
2.3 富集倍数
富集倍数是指经IL-DLLME处理后待测物浓度与待测物原始浓度之比。取5 mg/L的TCs混合标准溶液,在优化色谱条件和萃取条件下,分别进行萃取前和萃取后的测定。结果表明,离子液体对TCs具有较好的富集作用,对OTC、TC和CTC的富集倍数分别为7.0、16.3、27.8倍。
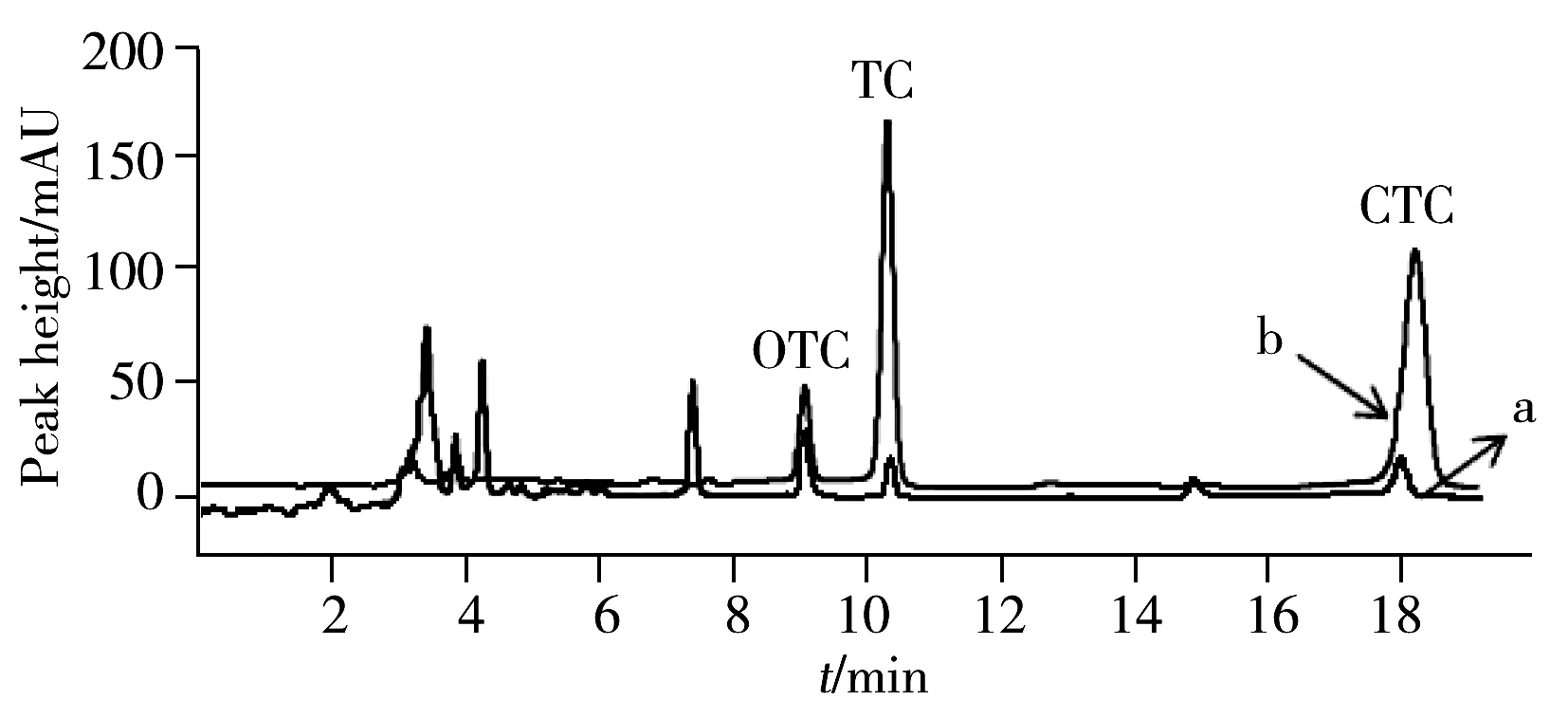
图2 猪肾脏样品中TCs萃取前后的色谱图Fig.2 Chromatograms of TCs in pig kidney sample before and after extractiona.before extraction;b.after extraction
2.4 实际样品分析
取1.5 mL的猪肾样品溶液3份,第1份直接进行HPLC分析,第2份采用优化的DLLME方法处理后再进行HPLC分析,第3份加入适量的3种TCs标准溶液后在优化的DLLME和HPLC条件下进行加标回收率实验。样品的分析结果见图2和表2。
从图2可以看出,TCs经DLLME萃取后富集效果明显,且可以消除一些杂质峰,具有一定的净化作用,有利于实际样品的分析检测。经计算,猪肾脏样品中OTC、TC和CTC的含量分别为3 440、1 004、1 003 μg/kg,与国家标准GB/T 5009.116-2003[20]方法对比,结果偏差小于5%。根据国内标准,TCs在动物源性食品中肾脏组织的最高残留限量为600 μg/kg[21],因此,本实验所采集的猪肾样品中TCs含量严重超标。

表2 实际样品检测结果Table 2 The detection results of actual samples
从表2可知,本方法所测3种抗生素的RSD为1.7%~2.9%,加标回收率达99.5%~101.1%,满足猪肾脏中3种抗生素的测定需求。
3 结 论
本文建立了猪肾脏中OTC、TC、CTC残留量的IL-DLLME/HPLC测定方法。结果表明,DLLME这种新型的样品前处理技术集萃取、富集、净化于一体,不仅简化了操作步骤、降低了实验成本,而且以离子液体代替常规有机溶剂作为萃取剂,使整个实验过程更为绿色环保,是一种有发展前景的环保型分离富集技术。本法的相对标准偏差(RSD)不高于3.1%,检出限(LOD)为54~93 μg/L,且样品的加标回收率达99.5%~101.1%,具有灵敏度高、精密度好、准确可靠等优点,可为其他复杂样品中性质相似的组分测定提供新的方法。
[1] Hu X G,Luo Y,Zhou Q X,Xu L.Chin.J.Anal.Chem.(胡献刚,罗义,周启星,徐琳.分析化学),2008,36(9):1162-1166.
[2] Zhao X Y,Li J,Lin Y F,Hu X Z,Wang P,Fu X F,Li J.J.Instrum.Anal.(赵晓亚,李娟,林雁飞,胡小钟,王鹏,付晓芳,李晶.分析测试学报),2009,28(10):1138-1142.
[3] Zhang X L,Zhang T,Dong L,Shi S X,Yang W L,Zhang L F,Zhou L,Huang Y R.J.Instrum.Anal.(张秀蓝,张烃,董亮,史双昕,杨文龙,张利飞,周丽,黄业茹.分析测试学报),2012,31(4):453-458.
[4] Li Y Y,Liu Y Y,Fan X,Cao Y N,Wang J J,Lu J S,Qu L L,Geng J F,Li H T.Chemistry(李艳艳,刘迎亚,范霄,曹英男,王佳佳,卢菊生,渠陆陆,耿俊峰,李海涛.化学通报),2016,79(3):213-219.
[5] Wang Y Y,Zhao G Y,Chang Q Y,Zang X H,Wang C,Wang Z.Chin.J.Anal.Chem.(王莹莹,赵广莹,常青云,臧晓欢,王春,王志.分析化学),2010,38(10):1517-1522.
[6] Berijani S,Assadi Y,Anbia M,Hosseini M R M,Aghaee E.J.Chromatogr.A,2006,1123(1):1-9.
[7] Melo A,Cunha S C,Mansilha C,Aguiar A,Pinho O,Ferreira I M P L V O.FoodChem.,2012,135(3):1071-1077.
[8] Zhou Q X,Bai H H,Xie G H,Xiao J.J.Chromatogr.A,2008,1188(2):148-153.
[9] Ren Y L,Wang B,Tian X Z,Zhao S,Wang J J.J.TetrahedronLett.,2015,(46):6452-6455.
[10] Ding J H,He H X,Lin H L,Zhang H,Qiu C F.Chin.J.Anal.Chem.(丁健桦,何海霞,林海禄,张慧,邱昌福.分析化学),2008,36(12):1662-1666.
[11] He D.J.Instrum.Anal.(何东.分析测试学报),2016,35(7):844-848.
[12] Xie H X,He L J,Wu Y,Lu K.Chin.J.Anal.Chem.(谢洪学,何丽君,伍艳,卢奎.分析化学),2007,35(2):187-190.
[13] Baghdadi M,Shemirani F.Anal.Chim.Acta,2008,613(1):56-63.
[14] Trujillo-Rodriguez M J,Rocio-Bautista P,Pino V,Afonso A M.Trac-TrendAnal.Chem.,2013,51:87-106.
[15] Zhou Q X,Zhang X G,Xiao J.J.Chromatogr.A,2009,1216(1):4361-4365.
[16] Shi Z Y.J.Environ.Monit.Chin.(史震宇.中国环境监测),2013,29(6):144-150.
[17] Deng B.J.Mod.Sci.Instrum.(邓勃.现代科学仪器),2010,27(3):123-130.
[18] Cao J P,Xie Q L,Zhou J M,Yi Z H.J.Instrum.Anal.(曹江平,解启龙,周继梅,易宗慧.分析测试学报),2015,34(5):616-624.
[19] Rezaee M,Assadi Y,Milani Hosseini M R,Aghaee E,Ahmadi F,Berijani S.J.Chromatogr.A,2006,1116(1/2):1-9.
[20] GB/T 5009.116-2003.Determination of Oxytetracyline,Tetracyline and Chlortetracycline Residues in Meat(HPLC).National Standards of the People′s Republic of China(畜、禽肉中土霉素、四环素、金霉素残留量的测定(高效液相色谱法).中华人民共和国国家标准).
[21] Department of Liverstock and Veterinary Medicine of the Ministry of Agriculture.Chin.J.Vet.Drug(农业部畜牧兽医局.中国兽药杂志),2003,37(4):15-20.
Determination of Three Tetracyclines in Pig Kidney by High Performance Liquid Chromatography with Ionic Liquid Dispersive Liquid-Liquid Microextraction
ZHANG Ying,DING Jian-hua*,XIANG Hong-lin,LIU Peng-fei
(College of Biology,Chemistry and Material Science,East China Institute of Technology,Nanchang 330013,China)
A method was established for the determination of three tetracycline antibiotics(TCs) residues such as oxytetracycline,tetracycline and chlortetracycline in pig kidney by high performance liquid chromatography(HPLC) coupled with dispersive liquid-liquid microextraction(DLLME).The influences of dispersant type,amount of ionic liquid,amount of dispersant,pH of sample solution,extraction time and effect of salts on extraction efficiency were investigated.The optimum experimental conditions were as follows:using acetone as the dispersant,a 50 μL ionic liquid([BMIM] PF6),a 140 μL dispersant,a pH 3.0 sample solution,a 15 min of extraction time and no salt.The results showed that this method provided a wide linearity in the range of 0.1-10.0 mg/L with correlation coefficients no less than 0.999 5.The relative standard deviations(RSDs) were 2.2%-3.1%for oxytetracycline,tetracycline and chlortetracycline.The detection limits(LOD) were in the range of 54-93 μg/L with the enrichment folds of 7.0-27.8,and the recoveries were 99.5%-101.1%.It was found that the accuracy and precision could meet the requirements for the rapid,green,sensitive and accurate detection of oxytetracycline,tetracycline and chlortetracycline residues in pig kidney.
ionic liquid(IL);dispersive liquid-liquid microextraction(DLLME);high performance liquid chromatography(HPLC);tetracycline antibiotics(TCs);pig kidney
2017-06-26;
2017-07-12
国家自然科学基金(21265002);江西省科级支撑计划项目(20151BBG70048)
*
丁健桦,博士,教授,研究方向:样品前处理技术和色谱分析,Tel:0791-83896550,E-mail:375520739@qq.com
10.3969/j.issn.1004-4957.2017.11.010
O657.7
A
1004-4957(2017)11-1352-05

