高温放线菌属研究进展
冯慧军,翟磊,程坤,于学健,姚粟
(中国食品发酵工业研究院,中国工业微生物菌种保藏管理中心,北京,100015)
高温放线菌属研究进展
冯慧军,翟磊,程坤,于学健,姚粟*
(中国食品发酵工业研究院,中国工业微生物菌种保藏管理中心,北京,100015)
回顾了高温放线菌属(Thermoactinomyces)的分类学地位变迁,阐述了不同分类特征对高温放线菌属分类变迁的影响,并简要概述了高温放线菌属的分类现状和功能性研究情况。
高温放线菌属;分类变迁;功能性研究
高温放线菌属由TSIKLINSKY于1899年首次发现[1]。该属菌株最适生长温度45~55 ℃,最适生长pH 7.0左右,好氧,化能异养型,革兰氏染色阳性,可产生大量的气生菌丝和基内菌丝,在气生菌丝和基内菌丝上着生有单个孢子,在自然界分布广泛,常见于霉变饲料、稻草、堆肥和白酒高温大曲等环境[2-4]。高温放线菌属菌株具有一定致病性,如普通高温放线菌(Thermoactinomycesvulgaris)可引起过敏性肺炎(Hypersensitivity pneumonities)[5],但作为一类分布广泛的嗜热微生物,高温放线菌属可代谢产生多种耐高温酶系,如α-淀粉酶(α-amylase)、丝氨酸蛋白酶(serine proteases)、脂肪酶(lipase)等[6],具有重要的工业应用价值。
高温放线菌属的分类学地位一直受到人们关注。根据可产生菌丝体结构的形态学特征,高温放线菌属应归在放线菌类群,但基于16S rDNA序列分析表明,高温放线菌属的系统进化更接近芽胞杆菌。被很多学者认为是介于细菌和放线菌之间的特殊类群,分类学地位一度处于混乱状态。2002年,李文均等人对当时高温放线菌属的分类地位研究做了有价值的探讨,指出高温放线菌属的分类地位应该综合其表型、基因型及多相分类结果来确定[7]。之后,人们综合高温放线菌属表型特征和基因型特征,重新确立了高温放线菌属的分类学地位,将其从放线菌类群划分到芽胞杆菌类群。本文主要综述了高温放线菌属的不同分类学特征对高温放线菌属及其所包含有效菌种分类地位变迁的影响,并简要概述了高温放线菌属的最新分类情况和功能性研究情况,以期为进一步研究高温放线菌属菌株提供参考。
1 不同分类特征对高温放线菌属分类地位的影响
1.1表型分类特征对高温放线菌属分类地位的影响
形态学特征是早期微生物分类的主要依据。高温放线菌属菌株因具有与一般放线菌类似的气生菌丝和基内菌丝结构的形态学特征,建属之初被归入放线菌类群。在随后的几十年间,依据这一形态学特征不断发现了其他新种,分别为嗜胨高温放线菌(Thermoactinomycespeptonophilus)(1971)、糖高温放线菌(Thermoactinomycessacchari)(1971)、双歧高温放线菌(Thermoactinomycesdichotomicus)(1973)、纯白高温放线菌(Thermoactinomycescandius)(1975)、中间型高温放线菌(Thermoactinomycesintermedius)(1980)、嗜温高温放线菌(Thermoactinomycesthalpophilus)(1980)、恶臭高温放线菌(Thermoactinomycesputidus)(1989)[8]。双歧高温放线菌(T.dichotomicus)是1964年作为Actinobifidadichotomica首次提出,在CROSS和 GOODFELLOW 1973年出版的《放线菌分类学》书中因其产生菌丝和孢子的形态学特征,将其划分到高温放线菌属[9]。
20世纪50年代末,以化学分类特征为基础的一些新的分类学方法开始在微生物分类中应用,如细胞壁氨基酸和糖组分测定、脂质成分测定和异戊烯甲基萘醌测定等[10-11]。1982年,COLLINS等人对当时高温放线菌属已发表的纯白高温放线菌(T.cescandius)、双歧高温放线菌(T.dichotomicus)、恶臭高温放线菌(T.putidus)、糖高温放线菌(T.sacchari)和嗜温高温放线菌(T.thalpophilus)的异戊烯甲基萘醌进行分析,发现纯白高温放线菌(T.cescandius)、双歧高温放线菌(T.dichotomicus)和糖高温放线菌(T.sacchari)的主要甲基萘醌为氢不饱和MK-7;恶臭高温放线菌(T.putidus)和嗜温高温放线菌(T.thalpophilus)的主要甲基萘醌为氢不饱和MK-9[12],而多数放线菌则以氢部分饱和的混合甲基萘醌为主,如马杜拉放线菌(Actinomadura)和链霉菌(Streptomyces)的甲基萘醌主要以氢部分饱和MK-9(H8)和MK-9(H6)为主,放线菌(Actinomyces)的甲基萘醌主要以氢部分饱和MK-10(H4)为主[13]。
除化学分类特征与一般放线菌有差异之外,其他一些证据也表明高温放线菌属菌株有别于一般的放线菌。1967年,MANACHINI等人对高温放线菌属菌株GC组成进行研究,发现高温放线菌属菌株的DNA G+C含量仅为50 mol%左右,远小于其他放线菌的60mol%~70 mol%[14]。1968年,CROSS T等人对普通高温放线菌的胞子结构和组成进行研究,发现高温放线菌属菌株的胞子含有吡啶二羧酸,且具有轮廓分明的芽胞衣、芽胞壳、外膜和内膜结构,与芽胞杆菌和梭菌的芽胞组成及结构类似[15]。上述结果使人们对仅根据形态特征确定的高温放线菌属的分类地位提出质疑。
1.2分子分类特征对高温放线菌属分类地位的影响
20世纪80年代,分子生物学得到快速发展,诸如DNA-DNA杂交和rDNA序列分析等技术被应用于微生物分类研究中[16]。1981年,STACKEBRANDT等人采用寡核苷酸编目(oligonucleotide sequencing)的方法首次对普通高温放线菌P12的16S rDNA部分序列进行分析,发现高温放线菌属的系统发育水平更接近芽胞杆菌属而不是链霉菌或其他放线菌属[17]。1993年,PARK等人通过对普通高温放线菌进行5S rRNA序列分析,同样发现高温放线菌属的系统进化地位更接近芽胞杆菌属[18]。
2000年,YOON等人利用16S rDNA序列分析和DNA-DNA杂交等方法对当时高温放线菌属已发表的8个有效种和部分无效种进行系统发育分析(图1),发现高温放线菌属与芽胞杆菌属的亲缘关系最近,并结合高温放线菌属的甲基萘醌类型、DNA G+C含量和胞子结构成分等特征提议将高温放线菌属放入芽胞杆菌科中[19]。同时发现,纯白高温放线菌(T.cescandius)与普通高温放线菌(T.vulgaris)具有相同的16S rDNA序列,且DNA-DNA杂交率高达92.8%,嗜温高温放线菌(T.thalpophilus)与糖高温放线菌(T.sacchari)具有相同的16S rDNA序列,DNA-DNA杂交率高达85.6%,因此认为纯白高温放线菌(T.cescandius)是普通高温放线菌(T.vulgaris)的同物异名,嗜温高温放线(T.thalpophilus)菌是糖高温放线菌(T.sacchari)的同物异名,遂将该属内的8个有效种修正到6个[20]。
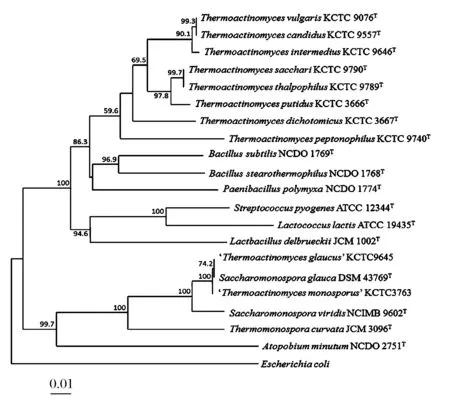
图1 基于16S rDNA序列构建的高温放线菌属各典型种及相关分类单元之间的系统发育树[19]Fig.1 Phylogenetic tree of the genus Thermoactinomyces and related taxon based on 16S rDNA gene sequences
2005年,YOON等人依据16S rDNA系统发育分析结果,并结合形态分类特征和包括甲基萘醌组成和脂肪酸组成的化学分类特征,对高温放线菌属的6个有效种进行重新划分[21]。其中,双歧高温放线菌(T. dichotomicus)的16S rDNA序列与高温放线菌属其他种的相似性相对较低,仅为90.1%~94.2%,在16S rDNA系统发育树上聚在独立于其他5个种的分支上,气生菌丝颜色显著不同于其他5个种,细胞的两个脂肪酸(iso-C16:0和iso-C17:0)在含量上也不同于其他5个种,因此被划分到黄色高温菌属(Thermoflavimicrobium),改名为双歧黄色高温菌(Thermoflavimicrobiumdichotomicus)。嗜胨高温放线菌(T.peptonophilus)的16S rDNA序列与其他种的序列相似性也相对较低,分别为90.1%~91.6%,在16S rDNA系统发育树上位于1个独立的分支上,其最适生长温度为35℃,与其他5个种嗜高温的特征明显不同,甲基萘醌种类也与其余5个种存在差异,因此被划分到清野氏菌属(Seinonella),改名为嗜胨清野氏菌(Seinonellapeptonophilus)。糖高温放线菌(T.sacchari)和恶臭高温放线菌(T.putidus)在16S rDNA系统发育树上聚在同1个分支上,细胞中主要甲基萘醌为MK-9,与其余4个种存在显著差别,因此被划分到莱斯氏属(Laceyella),分别改名为糖莱斯氏菌(Laceyellasacchari)和恶臭莱斯氏菌(Laceyellaputidus)。至此,高温放线菌属被分成4个属,即高温放线菌属(Thermoactinomyces)、莱斯氏属(Laceyella)、清野氏菌属(Seinonella)、黄色高温菌属(Thermoflavimicrobium)。而高温放线菌属所包含的有效种仅剩下普通高温放线菌(T.vulgaris)和中间型高温放线菌(T.intermedius)2个种。
2006年,MATSUO等人对高温放线菌属及其近缘菌属-莱斯氏属(Laceyella)、黄色高温菌属(Thermoflavimicrobium)、清野氏菌属(Seinonella)、直丝菌属(Planifilum)、海湖放线菌属(Mechercharimyces)的16S rDNA序列进行系统发育分析,发现这6个属在系统发育树上聚在独立于芽胞杆菌科的同一个分支上,并且这6个属菌株在形态学、生理生化特征上具有一定的相似性,从而提出高温放线菌科(Thermoactinomycetaceae)的概念,并将这6个属归入到高温放线菌科中,这一观点目前得到大多数研究者认同[22-23]。
2 高温放线菌属分类现状
近几年,一些新的高温放线属新种相继被发现,2014年,YAO S等人[24]在芝麻香型白酒高温大曲中发现一株新种,命名为大曲高温放线菌(Thermoactinomycesdaqus);2015年,WU H等人[25]在蘑菇堆肥中发现一株新种,命名为广西高温放线菌(Thermoactinomycesguangxiensis)。这2株高温放线菌新种均由我国科研人员发现,说明我国辽阔的地域是高温放线菌属新种资源挖掘的巨大宝库。
目前,高温放线菌属的分类地位被归在厚壁菌门(Firmicutes),芽胞杆菌纲(Bacilli),芽胞杆菌目(Bacillales),高温放线菌科(Thermoactinomycetaceae)下[26]。包括的有效菌种为普通高温放线菌(T.vulgaris)、中间型高温放线菌(T.intermedius)、大曲高温放线菌(T.daqus)和广西高温放线菌(T.guangxiensis)。
3 高温放线菌属菌种功能性研究
由于高温放线菌属菌株分布广、耐高温,具有潜在的、重要应用价值,其功能性研究一直受到人们的重视。关于高温放线菌属菌种的功能性研究主要集中在产酶和产其他活性物质这两方面。
3.1产酶研究
Akemi等人报道了普通高温放线菌R-47可产生2种类型的具有耐高温性质的α-淀粉酶,TVAI和TVAII[27]。TVAI是一种胞外淀粉酶,作用底物主要是大分子的淀粉和普鲁兰糖,同时可以水解γ-环糊精,但不能水解α和β环糊精。TVAII是一种胞内淀粉酶,可以有效水解低聚麦芽糊精,如α和β环糊精。由于一般的α淀粉酶不能水解普鲁兰糖和环糊精,因此普通高温放线菌产生的这两种α-淀粉酶在淀粉深加工行业上有重要的应用前景。Kleine等人研究发现普通高温放线菌可产生丝氨酸蛋白酶,除具有耐高温性质外,其利用的底物也较广,不仅能够降解可溶性蛋白,还能够降解一些不溶性蛋白,如弹性蛋白和胶原蛋白等[28]。WANG L等人在高温放线菌CDF中分离到一种具有较强的角蛋白水解活性的胞外丝氨酸蛋白酶,该酶对高温、碱、变性剂均具有较强耐受能力,且与商品化的洗涤剂兼容性好,在制革、羽毛废弃物处理、食品加工及洗涤添加剂等方面具有重要的应用前景[29]。KE等人研究了具有分解脂肪作用的普通高温放线菌菌株A31在高温堆肥中的应用,发现普通高温放线菌可产生较高的脱氢酶、多酚氧化酶和脲酶,会明显降低食物残渣中粗脂肪的含量,缩短堆肥的生产时间[30]。中间型高温放线菌生产的苯丙氨酸脱氢酶具有良好耐热性,在70 ℃处理1 h后仍然具有100%的活力,所生产的亮氨酸脱氢酶不仅具有很好的耐热性,还具有良好的光稳定特性,这使该菌产生的此酶更加适合于工业生产[31-32]。
3.2产其他活性物质
高温放线菌属菌株除了产酶丰富外,还发现具有产生物活性物质的功能,如普通高温放线菌可以产生高生物活性的吲哚乙酸(IAA),IAA可以促进植物根际生长,目前已有将IAA产生菌应用于农作物小麦和珍珠栗种植中,发现其可促进农作物的生长[33],这充分说明高温放线菌属菌株在促进农作物生长上也具有应用潜能。
3.3研究潜力评估
受分类学地位变迁的影响,高温放线菌属所包含有效菌种发生了很大的变化,关于高温放线菌属菌株的功能性研究主要集中在普通高温放线菌和中间型高温放线菌,且主要以产酶研究为主。而对于其他菌种,由于发现时间较短,对其功能性评价还处于起步阶段。值得注意的是,众多研究报道了高温放线菌属是高温大曲中的一类优势菌属[34-35],但关于其功能性鲜有报道,鉴于高温放线菌属菌种可以产生多种酶类,推测其在白酒酿造方面也具有潜在应用价值。
4 结语
高温放线菌属分类地位的确定历经了一个漫长的过程,由早期的依据形态学和生理学特征分类为主,到后来的依据细胞化学成分分类,再到20世纪80年代兴起的基于DNA扩增技术的分子分类和遗传学分析,直到现在的多相分类技术,分类方法日趋完善和精确。另外,在基因组学信息快速发展的今天,有效结合基因组信息来完善已有分类学方法也是分类学发展的一个趋势。目前,高温放线菌属中的大曲高温放线菌H-18(GeneBank 登录号JPST00000000)和普通高温放线菌 NRRL F5595(GeneBank 登录号LGKI00000000)已有基因组测序数据[36-37],对这些数据进行深入研究将有助于挖掘高温放线菌属的潜在应用价值及揭示其进化规律。
高温放线菌属从其建立至今已有100多年的历史,但到目前为止,相对于其他微生物而言,该类群发现的菌株还非常有限,新菌种资源挖掘潜力巨大。因此,开发有效的分离方法以及在已有菌种的基础上对所分离菌种进行快速鉴定都是挖掘新种资源的有效途径。同时,由于高温放线菌属菌株分布广,嗜高温,可产生多种耐热酶系,在工业及食品行业领域都具有重要的应用价值,对其功能性的进一步解析和开发也是其研究的一个重点。
[1] TSILINSKY. Sur les mucedinéés thermophiles[J]. Annales de linstitut Pasteur,1899,13,500-505.
[2] 徐丽华. 放线菌系统学[M]. 北京:科学出版社, 2007.
[3] 葛媛媛,姚粟,刘洋,等.芝麻香型白酒高温大曲嗜热细菌群落研究[J].食品与发酵工业,2012,38(11):16-19.
[4] 黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[5] 刘君,刘朔,刘丹,等.嗜热放线菌类群与中国农民肺发病的Meta分析[J].现代预防医学,2012,39(23):66-69.
[6] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011.
[7] 李文均,张忠泽,姜成林.高温放线菌属分类研究进展[J].微生物学报,2002,42 (6):759-763.
[8] VOS P D,GARRITY G M,JONES D,et al.Bergey’s manual of systematic bacteriology[M].2nd ed.Georgia:Springer,2009:434-449.
[9] CROSS T,GOOD F M.Taxonomy and classification of the actinomycetes[M].London: Academic Press,1973.
[10] JONES D, KRIEG N R,陈文新.细菌分类-v.血清学和化学分类[J].微生物学通报,1987(6):43-46.
[11] 张利平,陈冠华.放线菌化学分类学的现状及发展趋势[J].微生物学通报,1997,24(5):310-312.
[12] COLLINS M D,MACKILLOP G C,CROSS T.Menaquinone composition of members of the genusThermoactinomyces[J].Fems Microbiology Letters,1982,13(2):151-153.
[13] COLLINS M D,JONES D.Distribution of isoprenoid quinone structural types in bacteria and their taxonomic implication[J]. Microbiological Reviews,1981,45(45):316-354.
[14] CRAVERI R,MANACHINI P L,ARAGOZZINI F,et al.Amino acid composition of the cell-proteins from mesophilic,thermofacultative and thermophilic actinomycetes[J].Journal of General Microbiology,1973,74(1):201-204.
[15] CROSS T,WALKER P D,GOULD G W.Thermophilic actinomycetes producing resistant endospores.[J].Nature,1968, 220(5165):352-354.
[16] 惠文彦,张和平.基因组分析方法在微生物分类学中的应用[J].微生物学通报,2016,43(5):1 136-1 142.
[17] STACKEBRANDT E, WOESE C R. Towards a phylogeny of the actinomycetes and related organisms[J].Current Microbiology,1981, 5(4):197-202.
[18] PARK Y H,KIM E,YIM D G,et al.Suprageneric classification ofThermoactinomycesvulgarisby nucleot-ide sequencing of 5S ribosomal RNA[J].Zentralblatt Für Bakteriologie International Journal of Medical Microbiology,1993,278(4):469-478.
[19] YOON J H, PARK Y H.Phylogenetic analysis of the genusThermoactinomycesbased on 16S rDNA sequences[J].International Journal of Systematic and Evolutionary Microbiology,2000,50(3):1 081-1 086.
[20] YOON J H,SHIN Y K,PARK Y H.DNA-DNA relatedness among thermoactinomyces species:Thermoactinomycescandidusas a s ynonym ofThermoactinomycesvulgarisandThermoactinomycesthalpophilusas a synonym ofThermoactinomycessacchari[J].International Journal of Systematic and Evolutionary Microbiology,2000,50: 1 905-1 908.
[21] YOON J H,KIM I G,SHIN Y K.Proposal of the genusThermoactinomycessensu stricto and three new genera,Laceyella,ThermoavimicrobiumandSeinonellaon the basis of phenotypic,phylogenetic and chemotaxonomic analyses[J]. International Journal of Systematic and Evolutionary Microbiology,2005,55:395-400.
[22] YOSHIHIDE M,ATSUKO K,SATORU M.Mechercharimycesmesophilusgen.nov.,sp.nov.andMechercharimycesasporophorig-enenssp.nov.,antitumour substance-producing marine bacteria and description ofThermoactinomycetaceaefam.nov.[J]. International Journal of Systematic and Evolutionary Microbiology,2006,56:2 837-2 842.
[23] 鲜文东,明红,李文均.高温放线菌科最新研究进展小型综述[J].微生物学报,2015,55(1):1-11.
[24] YAO S,LIU Y,ZHANG M,et al.Thermoactinomycesdaqussp. nov. a thermophilic bacterium isolated from high-temperatureDaqu[J].International Journal of Systematic amp; Evolutionary Microbiology,2014,64(1):206-210.
[25] WU H,LIU B,PAN S.Thermoactinomycesguangxiensissp. nov. a thermophilic actinomycete isolated from mushroom compost[J].International Journal of Systematic amp; Evolutionary Microbiology,2015,65(9):2 859-2 864.
[26] 张燕新,吴莹,张迹.高温放线菌分类的研究进展[J].微生物学杂志,2007,27(1):64-68.
[27] ABE A,TONOZUKA T Y,KAMITORI S.Complex structures ofThermoactinomycesvulgarisR-47 alpha-Amylase 1 with Malto-oligosaccharides demonstrate the role of domain N acting as a starch-binding domain[J].Journal of Molecular Biology,2004, 335(3):811-822.
[28] KLEINE R.Properties of thermitase,a thermostable serine protease fromThermoactinomycesvulgaris[J].Acta Biologica Et Medica Germanica,1982,41(1):89-102.
[29] WANG L,CHENG G,REN Y,et al.Degradation of intact chicken feathers byThermoactinomycessp. CDF and characterization of its keratinolytic protease[J].Applied Microbiology amp; Biotechnology,2015,99(9):3 949-3 959.
[30] GUANG RUEIKE,CHAO MINGLAI, LIU YAYIN.Inoculation of food waste with the thermotolerant lipolytic actinomyceteThermoactinomycesvulgarisA31 and maturity evaluation of the compost[J].Bioresource Technology,2010,101(5):7 424-7 431.
[31] TATYANA A MURANOVA,SVETLANA E,SEDELNIKOVA.Crystallization and preliminary X-ray analysis of substrate complexes of leucine dehydrogenase fromthermoactinomycesintermedius[J].Biological Crystallography,2002,58(2-6):1 059-1 062.
[32] RONALD L,JEFFREY M,THOMAS L,et al.Synthesis of allysine ethylene acetal using phenylalanine dehydrogenase fromThermoactinomycesintermedius[J].Enzyme and Microbial Technology,2000,26(5-6):348-358.
[33] VIVEK K K,NELLIE L,VED P S. Screening and optimizatiom of IAA production in an obligateThermophile-thermoactinomycesvulgaris[J].Phytomorphology,2011,61(1-2): 9-16.
[34] 姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品发酵与工业,2012,38(6): 1-6.
[35] 梁晨,杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报,2017,44(2):384-393.
[36] YAO S,XU Y,XIN C,et al.Genome sequence ofThermoactinomycesdaqusH-18,a novel thermophilic species isolated from high-temperature Daqu[J].Genome Announcements,2014,3(1):e01 394.DOI:10.1128/genomeA.01394-14.
[37] JU K S,GAO J,DOROGHAZI J R,et al.Discovery of phosphonic acid natural products by mining the genomes of 10000actinomycetes[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(39):12 175-12 180.
TheresearchadvanceofgenusThermoactinomyces
FENG Hui-jun, ZHAI Lei, CHENG Kun, YU xue-jian, YAO Su*
(China National Research Institute of Food and Fermentation Industries, China Center of Industrial Culture Collection, Beijing 100015,China)
The change of taxonomic status ofThermoactinomyceswas reviewed herein. The effects of different taxonomic characteristics on the classification ofThermoactinomyceswere summarized. Classification status and functional research ofThermoactinomyceswere also briefly summarized.
Thermoactinomyces; change of taxonomic status; functional research
10.13995/j.cnki.11-1802/ts.015314
硕士研究生(姚粟教授级高级工程师为通讯作者,E-mail:milly@china-cicc.org)。
国家重点研发计划资助 (2016YFD0400502)
2017-07-26,改回日期:2017-08-20

