一种预测土壤中烟草黑胫病发病潜力的方法
方敦煌,肖炳光,童治军,曾建敏
(云南省烟草农业科学研究院,云南 昆明 650031)
一种预测土壤中烟草黑胫病发病潜力的方法
方敦煌,肖炳光,童治军,曾建敏
(云南省烟草农业科学研究院,云南 昆明 650031)
【目的】了解土壤带菌量、预测土壤黑胫病发病潜力,可为病害的精准防控、田间病圃的高效选择、不同抗性品种的科学布局提供依据。【方法】采用土壤稀释平板计数法、土壤假植病害调查2种方法预测土壤中烟草黑胫病的发病潜力,田间病害系统调查验证。【结果】土壤带菌量与病害的发生率密切相关,病原菌含量越高,发病越重、蔓延越快;随着时间的推移,初始发病率高,最终病害发生越严重,最终发病率是初始发病率的10~20倍;土壤带菌普遍存在,在所采集的土壤中均可分离获得,病原菌含量积累到一定程度就引发病害,1000个/g土壤带菌量为病害经济阈值,3~5次的假植病害调查可以准确地预测土壤烟草黑胫病的发病潜力。【结论】1000个/g土壤带菌量为烟草黑胫病的经济阈值,据此可以对土壤的病菌进行预警;假植病害调查可以准确地预测土壤烟草黑胫病的发病潜力,表明建立在环境—寄主—病原三角关系的假植预测病害方法是一种相对准确、低成本、简便易推广的病害预测方法。
烟草疫霉;土壤稀释平板计数法;土壤假植;病害调查;病害预测
【研究意义】烟草黑胫病是烟草疫霉(Phytophthoranicotianae) 引起的土传病害,自然条件下,以菌丝体、卵孢子及厚垣孢子在土壤中的植株残体上越冬[1]。集约化育苗基本可以控制苗期病害,大田是病害防治的主要场所[2-3]。土壤中烟草疫霉是否存在及其存在的数量是种植烟草后黑胫病发生、流行的关键因素[4]。因此,了解土壤带菌量、预测土壤黑胫病发病潜力,对病害的精准防控、田间病圃的高效选择、不同抗性品种的科学布局具有重要的意义。【前人研究进展】目前,从土壤中分离鉴定以及计数烟草疫霉菌的方法已有较多报道。如叶片诱饵法可以检测以游动孢子形式存在的疫霉菌,进行相对定量[5];土壤稀释平板法可以获得活菌株,定量土壤中的疫霉菌,加上PCR验证可更有效[6],但不能区别疫霉菌存在的形式;荧光定量PCR方法可以快捷地对疫霉菌进行鉴定及计数[7-8],但无法区分死细胞和活细胞,而且技术难度大、成本高,不能在生产上推广。生产上使用的是以中国烟草行业标准YC/T 341[9]为主的方法,但该方法时间跨度大,涉及整个生产季节,而且主要通过历年的发病情况结合气象条件进行预测,不涉及烟草疫霉菌的数量。【本研究切入点】土壤带菌量与黑胫病的发生关系密切,土壤带菌检测的研究较多[5-8],黑胫病的系统监测与预测也有些研究结果[9,19],但土壤带菌预警、预测土壤发病潜力未见报道。【拟解决的关键问题】本研究采用选择性培养基土壤稀释平板分离、结合PCR验证量化植烟土壤中的烟草疫霉,假植指示植物室内模拟测定黑胫病发生情况,再经过典型土壤黑胫病的系统调查,尝试建立一种预测土壤中烟草黑胫病发病潜力的方法,为病害的精准防控、田间病圃的高效选择、不同抗性品种的科学布局奠定基础。
1 材料与方法
1.1 植烟土壤的采集
预备种植烟草的土壤样品取自云南省抗烟草黑胫病改良株系待选试验点,分别是红塔区(简称H)研和基地、峨山县(简称E)小街由义、石林县(简称S)鹿阜路美邑和上赵、弥渡(简称M)新街西庄等5个点10块试验田块,共10个样品,按采样地点编号。五点取样,取样深度15~20 cm,每点取样1.0~1.5 kg,将大土块捏碎,合并、混匀,倒在干净的牛皮纸上摊成薄层,剔除石块、植物根茎、昆虫等杂物,阴干。
1.2 土壤稀释平板法分离与量化烟草疫霉
1.2.1 土壤前处理 将采集晾干的土壤研碎,过2 mm的土壤筛,收集备用。
1.2.2 选择性培养基 选择性培养基由20 %的V8琼脂培养基[10]添加多菌灵(10 μg/mL)、恶霉灵(50 μg/mL)、五氯硝基苯(25 μg/mL)、利福平(10 μg/mL)、氨苄青霉素(500 μg/mL)以及制霉菌素(25 μg/mL)等抗生素制成[11]。
1.2.3 土壤稀释平板法分离与量化 称取过筛后的土壤样品10 g,放入已灭菌的40 mL水琼脂(0.25 %)的三角瓶(250 mL)中,上下倒置几次后,置于漩涡振荡器上充分混匀,即成5-1土壤稀释液;吸取5-1土壤稀释液l mL,移入装有4 mL无菌水琼脂的试管中,充分混匀后,即成5-2土壤稀释液;同样再稀释1次,即成5-3土壤稀释液。所取样品,均按照上述方法5倍稀释,每个土样3 次重复。吸取5-2、5-3土壤稀释液各200 μl,涂布于选择性培养基平板上;每个样品每个稀释度涂5个平板,置于28 ℃恒温培养箱中培养48~72 h后,挑选菌落较易区分、菌落数在5~20个的平板,标记疑似菌落,记数[12],统计每克土样形成的疑似菌落数[6]。
1.2.4 疑似菌落的PCR验证及校正量化 挑取少量疑似烟草疫霉菌菌苔(10 mm×10 mm),按文献[11]的方法提取微量菌体DNA,采用特异性引物ITS8-1/ ITS8-2扩增[14]验证,每土样选取疑似菌落5~50个进行PCR验证,统计阳性结果的比例,校正定量各土样中的烟草疫霉。
1.3 土壤假植指示烟草后黑胫病发病测定
1.3.1 土壤前处理 每个土样取3.0~5.0 kg,辗碎成粒径为0.5~1.0 cm的土壤颗粒,剔除杂物,装入32 cm×45 cm×15 cm的筛筐内,将筛筐置于托盘中,在托盘中注入土壤厚度1/3~1/2的洁净水,湿润土壤2~3 d,以土壤潮湿、不粘连为宜。
1.3.2 指示烟草的假植培养 指示烟草采用易感病的烟草品种红花大金元,按常规漂浮育苗方式培育至5~6片真叶苗,挑选长势整齐的烟苗,拔出、剪除1/4~1/3的末端根际土,形成根创伤后,移栽至装有土壤样品的筛筐中,每筐烟苗数至少12株,重复3次。假植烟苗的筛筐置于盛水托盘中,托盘中水的深度为土壤厚度的1/3~1/2,干湿交替,维持土壤湿润,在25~28 ℃、相对湿度75 %以上、12 h光照12 h黑暗交替的人工气候室中培养。
1.3.3 病害调查 假植后第2~3 d观察发病情况,每7 d调查1次病情,共调查5次,烟草黑胫病以株为单位调查,以产生明显病斑至烟苗凋萎记作发病,以无病斑、烟苗直立、生长正常记作不发病,调查所有烟株,以发病率记录病情[15]。
1.4 代表土壤黑胫病的系统调查验证
从假植病害调查中的土样选取4个不同发病程度的作为代表土样,溯源田块,按烟草黑胫病预测预报调查规程要求种植感病烟草品种红花大金元进行系统观察[9],每7 d调查1次,以发病率统计病情[15]。至采收完毕,共调查17次,作调查时间-发病率曲线图,并采用EXCEL进行回归分析。
2 结果与分析
2.1 土壤稀释平板法分离与量化烟草疫霉
培养48~72 h后,不同来源的土样形成的菌落数明显不同。根据菌落形态、颜色以及菌丝形态,参照Stamps[16]、Hawksworth[17]等的疫霉分类资料,选取乳白色且呈绒状的菌落作为疑似菌落,PCR验证,统计阳性结果的比例,校正定量各土样中的烟草疫霉(表1)。不同来源土样PCR验证阳性结果的比例存在明显的差异,与文献[6,11]的结果一致,与土壤微生物类群,特别是与烟草疫霉同属不同种、腐霉等菌落形态相似的微生物种类干扰有关,但阳性比例仍然在80 %以上,这说明所用的培养基具有良好的选择性,考虑到土壤记数本身的差异,可以采用阳性比例平均值进行校正,也就是随机选取50~100个的疑似菌落进行PCR验证,以此阳性比例校正记数。从校正后土样烟草疫霉数量统计看,所有测定的土样均潜伏着烟草疫霉,但不同土样烟草疫霉的数量存在差异,cfu/g即每克土壤菌落形成单位数反映了土壤中烟草疫霉菌的种群密度,cfu/g 值越大,表明土壤中烟草疫霉菌的密度越大,一旦条件合适,密度越大,烟草黑胫病发生的风险就越高。
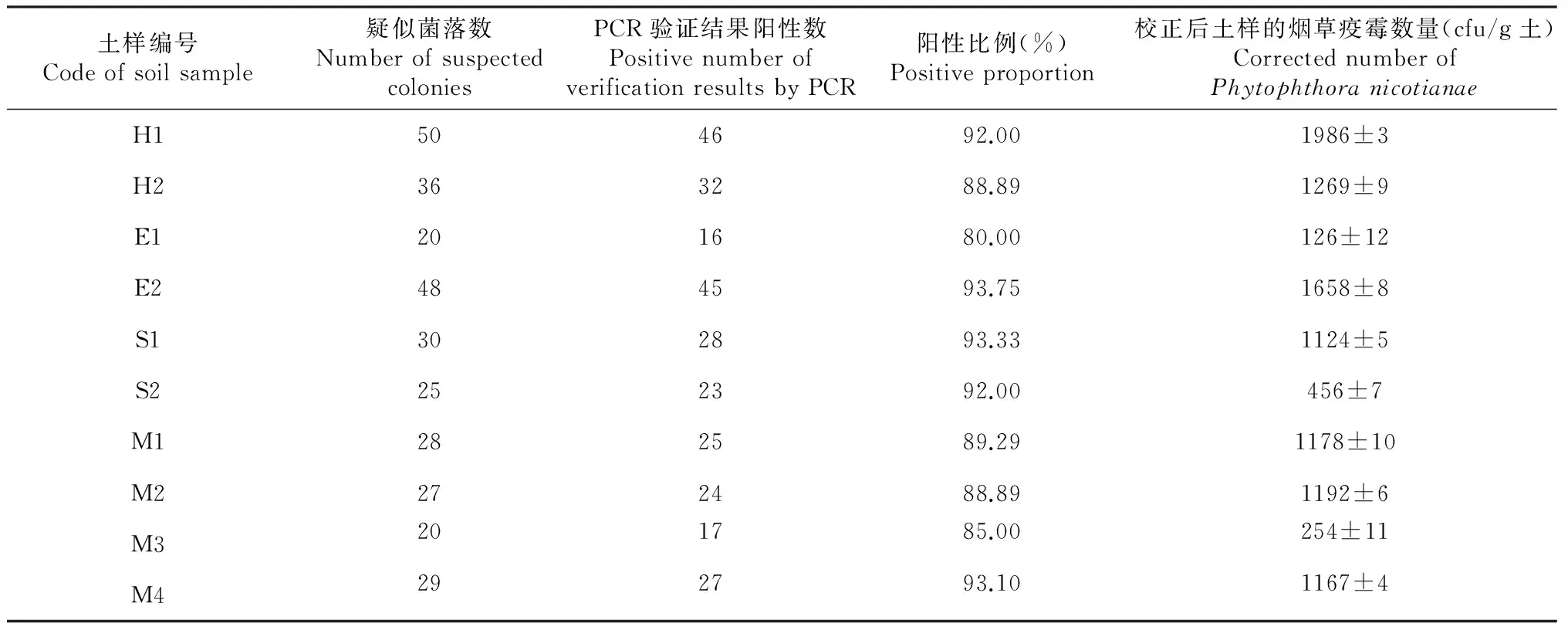
表1 疑似菌落PCR验证结果
2.2 土壤假植指示烟草黑胫病发生情况
土壤假植指示烟草黑胫病发生测定结果表明,10个土壤样品发病潜力差异明显,随时间推延,发病率有所上升,一直不发病的样品有2个,最后1次调查的发病率<10 %的样品有1个,发病率介于10 %~20 %(含10 %)的样品有4个,发病率≥20 %的样品有3个(表2)。对照土样烟草疫霉量化结果(表1)可以看出,土壤烟草疫霉含量与发病率显著相关,疫霉含量越高,发病越严重,发病潜力越大;不发病的2个土样,土壤烟草疫霉含量相对较低;最后1次调查的发病率>10 %的,土壤烟草疫霉含量均在1000 cfu/g以上。说明土壤烟草疫霉含量在1000 cfu/g以上存在较大的发病风险,发病潜力大。
对不同土样初始烟草疫霉数量(即表1中所示土样疫霉含量)与烟草发病初期(7 d时的调查结果)和后期(7 d后的调查结果)的发病程度之间进行相关性分析,7、14、21、28、35 d的相关系数r值分别为0.69、0.81、0.93、0.95、0.96,随着调查时间的推延,从中度相关渐渐上升为高度相关,表明黑胫病发生的时间早晚和发生程度由土壤中初侵染菌源数量决定,当菌量≥1000 cfu/g时发病较快较早,第5次调查的发病率在10 %以上。综合考虑文献[6,23]的研究结果和烟草黑胫病预测预报模型[18],可推出土壤烟草疫霉含量1000 cfu/g是病害经济阈值。
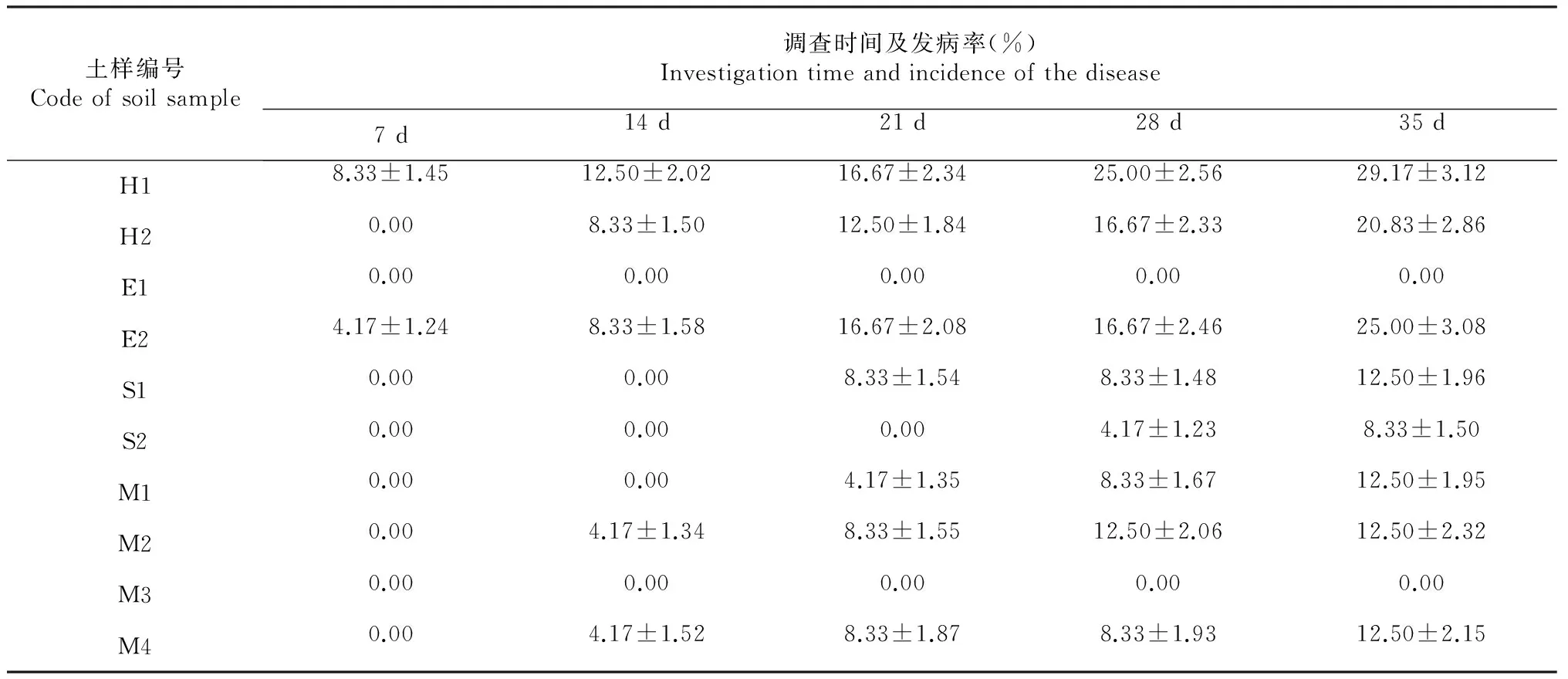
表2 土壤样品烟草黑胫病发病情况统计
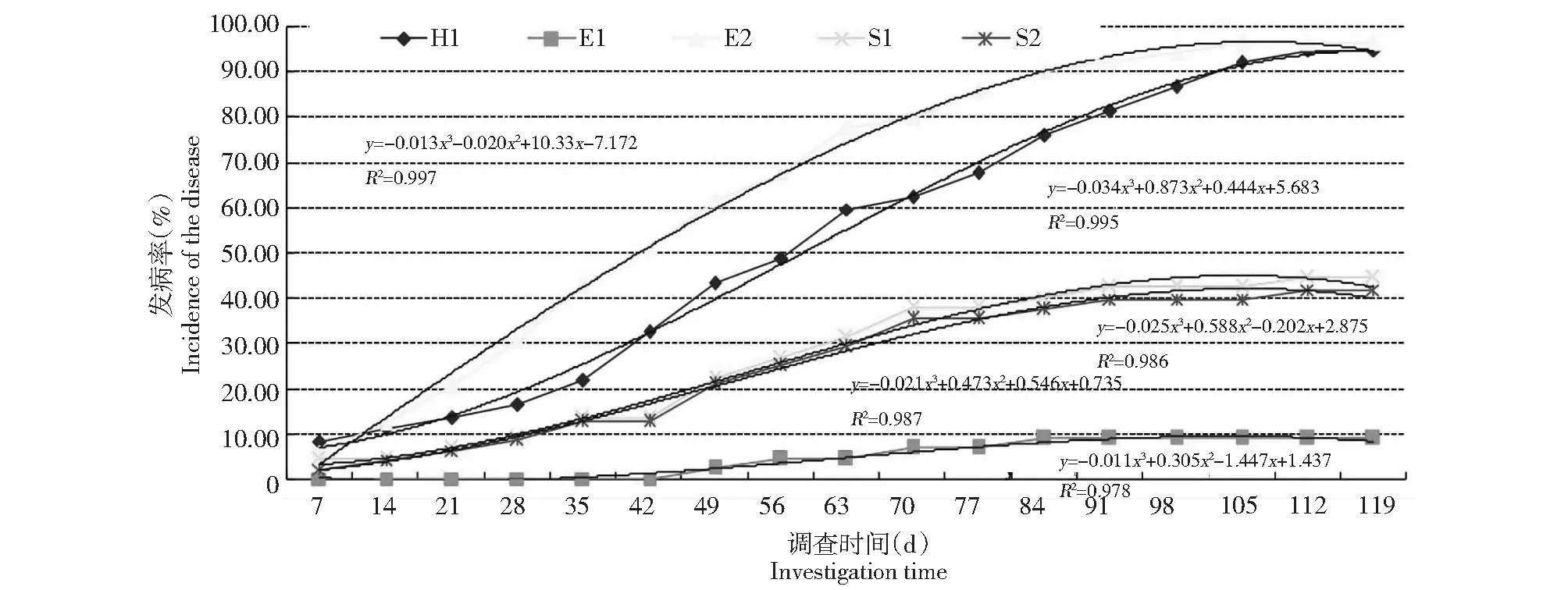
图1 代表土壤烟草黑胫病系统监测结果Fig.1 System monitoring incidence of the disease tobacco black shank in representative soil
2.3 代表土壤黑胫病的系统调查验证
代表土壤烟草黑胫病系统监测结果显示(图1),在不进行防治、温湿度适宜、不清除病株时,病害呈缓慢发展趋势,最终发病率可达初始发病率的10~20倍,初始发病率超过5 %,最终发病率可达90 %以上,与土壤假植病害调查结果趋势基本吻合。从土壤菌量来看,土壤菌量有一个累积过程,随着菌量的提升,发病率也逐步上升,即使初始菌量不足以发病,但当菌量累积到一定数量时仍会发病,如土样E1,这也再次证明土壤带菌是发病的重要前提条件,也证实假植指示烟草是一种较好预测土壤发病潜力的方法。
3 讨 论
在烟草黑胫病流行规律研究中发现,烟草黑胫病的发生与温度、湿度(或降雨)密切相关[19-20]。因此,在烟草黑胫病的预测预报中要将历年病害系统调查的数据与温度、湿度(或降雨)数据之间建立模型,通过温度、湿度(或降雨量)来预测预报病害的发生、发展[21]。这种预测预报注重病害三角关系[22]中环境与寄主的关系,而忽视了病菌与寄主的关系。随着土壤中烟草疫霉分离、定量技术[3]及荧光定量PCR技术[7-8,23]的发展,使得监测土壤中的烟草疫霉成为可能,相关疫霉的研究表明,土壤中的疫霉菌数量消长规律与田间疫病的流行规律一致[24-25]。研究发现土壤中病菌的数量决定病害发生的严重度,病菌含量越大,病害越重[5-6],本研究也证实了这一点。虽然本研究通过假植预测了病害的发生潜力,但土壤带菌量仅可作为病害的一种预警方法,而不能直接作为病害预测方法,实际应用要考虑温度、湿度(或降雨)等环境条件,才能对病害发生做出更准确地预测预报。
4 结 论
1000个/g土壤带菌量为烟草黑胫病的经济阈值,据此可以对土壤的病菌进行预警;假植病害调查可以准确地预测土壤烟草黑胫病的发病潜力,表明建立在环境—寄主—病原三角关系的假植预测病害方法是一种相对准确、低成本、简便易推广的病害预测方法。
[1]朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2002:21-36.
[2]端永明, 张廷金, 徐兴阳, 等. 土壤质地对青霉菌灭活菌丝体制剂诱导烤烟抗逆能力的影响[J]. 西南农业学报, 2014,27(6):2449-2454.
[3]周 黎, 潘元宏, 付亚丽, 等. 不同苗龄膜下移栽对烤烟生长发育及品质的影响[J]. 西南农业学报, 2015,28(4):1612-1616.
[4]Martin R R, James D, Levesque C A. Impacts of molecular diagnostic technologies on plant disease management[J].Annual Reviews Phytopathology, 2000, 38:207-239.
[5]罗文富, 杨艳丽, 张翠萍, 等. 土壤中烟草疫霉的分离与量化测定[J]. 中国烟草学报,1999, 5(4):29-31.
[6]王 晗, 严占勇, 张定贵, 等. 一种土壤中烟草疫霉菌的快速分离鉴定及计数方法[J]. 中国农学通报, 2012, 28(9):163-168.
[7]张成省, 阚光锋, 张玉芹, 等. 一种用于检测土壤中烟草黑胫病菌的方法[P]. 中国, 201110402300.9. 2011-12-07.
[8]潘明森, 王震铄, 方敦煌, 等. 土壤中黑胫病菌荧光定量PCR快速检测体系的建立及初步应用[J]. 江西农业大学学报,2015, 37(4):712-718.
[9]YC/T 341.3-2010. 烟草病害预测预报调查规程第3部分:黑胫病[S].
[10]郑小波. 疫霉菌及其研究技术[M]. 北京:中国农业出版社, 1997.
[11]Masago H M, Yoshikawa M, Nakamishi H. Selective inhibition ofPythiumspp. on a medium for direct isolation ofPhytophthoraspp. from soils and plants[J]. Phytopathology,1977(67):425-428.
[12]方中达. 植病研究方法[M]. 北京:中国农业出版社, 1998.
[13]Kenichiro S, Kana T, Tsutomu A. A simple method for a mini-preparation of fungal DNA[J]. Journal of General Plant Pathology, 2006(72): 348-350.
[14]张丽芳, 方敦煌, 赵兴能, 等. 3对引物快速鉴定烟草黑胫病菌的比较研究[J]. 云南农业大学学报, 2014, 29(2):161-166.
[15]GB/T23222-2008. 烟草病虫害分级及调查方法[S].
[16]Stamps D J, Waterhouse G M, Newhook F J. Revised tabular keyto the species ofPhytophthora[J]. Mycological Papers,1990(162):1-28.
[17]Hawksworth D L, Kirk P M, Sutton B C, et al. Ainsworth and Bisby’s dictionary of the fungi (8th-edition) [M]. CAB International, University Press, Cambridge, UK,1995.
[18]舒正义, 陈西凯, 曾 勇, 等. 川北地区烟草黑胫病流行规律及防治研究[J]. 西南大学学报, 1998, 20(3):243-245.
[19]Lucas G B. Disease of Tobacco[M].The Scarecrow Press, Inc, New York, NY. 1958:115-139.
[20]Shew H D. Compendium of Tobacco Diseases[M]. The American Phytopathological Society Press,St.Paul,MN. 1991:17-20.
[21]卢洪兴, 肖志凑. 烟草黑胫病与气象因素关系分析及其预测预报的探讨[J].烟草科技, 1990(3):37-39.
[22]Cooke B M,Jones D G, Kaye B.The Epidemiology of Plant Diseases [M].Springer, 2nd ed. 2006.
[23]桂意云,汪 淼,秦翠鲜,等.甘蔗各家族SPS基因表达特性分析[J].南方农业学报,2016, 4(2):174-179.
[24]Judelson H S, Blanco F A. The spores ofPhytophthora: weapons of the plant destroyer[J]. Nature Reviews Microbiology, 2005(3):47-58.
[25]黄凤莲,罗赫荣,朱宗源,等.辣椒疫霉菌在土壤中消长动态研究[J].湖南农业大学学报, 2001,27(4):306-308.
MethodofForecastingTobaccoBlackShankDiseaseinSoil
FANG Dun-huang, XIAO Bing-guang, TONG Zhi-jun, ZENG Jian-min
(Yunnan Academy of Tobacco Agricultural Sciences, Yunnan Kunming 650031, China)
【Objective】 Forecast of tobacco black shank was studied in order to prevent and control of diseases accurately, select field disease nursery efficiently, and lay out different resistant varieties scientifically. 【Method】Disease potentiality ofPhytophthoranicotianain the soil was calculated by soil dilution plate counting method and soil planting disease investigation method, and field disease system was used to inverstigate and validate the disease of tobacco black shank used temporary planting indicator tobacco in the representative soil of the field. 【Result】 Quantification ofPhytophthoranicotianain the soil and the incidence of the disease were closely related, and the higher the density of the pathogen was, the more seriously the disease occurred and expanded. As the time went on, the higher initial incidence disease was, the more seriously the successor disease occurred. And the final disease incidence was 10-20 times as many as the initial incidence.Phytophthoranicotianawidely existed in the soil, and it was isolated from all collected soil. When the accumulative density of the fungus was 1000 cfu/g soils, the disease occurred. Disease potentiality ofPhytophthoranicotianacould be accurately forecast incidence of the disease of tobacco black shank in soil by 3-5 times.【Conclusion】According to the disease threshold 1000 cfu/g soil, we could early warn the pathogenic bacterium in the soil. So in view of relationship between environment, host and pathogen, the method of disease prediction was a relatively accurate, low cost, simple and easy to promote by tobacco seedling transplanting soil.
Phytophthoranicotiana;Soil dilution planting;Soil temporary planting;Disease investigation;Disease forecasting
1001-4829(2017)10-2246-05
10.16213/j.cnki.scjas.2017.10.015
2016-03-17
中国烟草总公司科技计划项目(110201301006、2014TBB01、110201601027);中国烟草总公司云南省公司科技计划项目(2012YN05、2013YN01、2016YN23)
方敦煌(1967-),男,副研究员,博士,主要从事烟草病害及其防治研究,E-mail:fdhkm@sina.com。
S435.72
A
(责任编辑 王家银)

