秋水仙素对非洲菊单倍体加倍效果研究
单芹丽,王继华,李绅崇,瞿素萍,汪国鲜,杨春梅*,蒋海玉
(1.云南省农业科学院花卉研究所,国家观赏园艺工程技术研究中心,云南 昆明 650205;2.玉溪云星生物科技有限公司,云南 玉溪 652604;3. 云南省农业科学院农业经济信息研究所,云南 昆明 650205)
秋水仙素对非洲菊单倍体加倍效果研究
单芹丽1,2,王继华1,李绅崇1,瞿素萍1,汪国鲜1,2,杨春梅1,2*,蒋海玉3*
(1.云南省农业科学院花卉研究所,国家观赏园艺工程技术研究中心,云南 昆明 650205;2.玉溪云星生物科技有限公司,云南 玉溪 652604;3. 云南省农业科学院农业经济信息研究所,云南 昆明 650205)
【目的】研究非洲菊单倍体的加倍方法。【方法】采用秋水仙素不同处理方式、不同处理时间和浓度对非洲菊单倍体(2n=x=25)进行加倍效果研究。【结果】和单倍体相比,双单倍体(2n=2x=50)株型较大,叶片较宽,气孔保卫细胞叶绿体数较多。培养基添加秋水仙素法加倍效果最好,全株浸泡法次之,茎尖浸泡法最差。全株或茎尖在0.02 %的秋水仙素溶液中浸泡1 d,对单倍体植株无加倍效果;0.1 %的秋水仙素添加至增殖培养基处理7 d对植株造成的伤害最大,死亡率达80 %,但加倍率只有4 %。【结论】0.05 %的秋水仙素添加至增殖培养基处理4 d,非洲菊单倍体植株的加倍效果最好(42 %)。
非洲菊;单倍体;秋水仙素;加倍效果
【研究意义】非洲菊(GerberajamesoniiBolus)又名扶郎花,为世界五大切花之一。目前,生产中迫切需要耐低温、耐弱光、抗病虫害的优质、高产非洲菊新品种。然而,非洲菊属于典型的异花授粉植物[1],基因组高度杂合[2],并且部分品种自交不亲和[3],致使后代纯合体选育极度困难,影响了优良品种选育效率。通常情况下,要获得纯合的自交系,需进行多代(4~6代),甚至10代以上的自交,花费6~7年甚至8~9年的时间。单倍体植株经染色体加倍后,可快速成为纯合二倍体植株,提高育种效率[4]。同时,DH群体即加倍单倍体的特点是群体中的每一个系都是完全同质纯合, 所含信息量小, 无遗传变异, 是数量性状位点分析的良好群体[5]。【前人研究进展】云南省农业科学院花卉研究所自2007年起先后对非洲菊单倍体开展了相关研究[6-10],获得并保存了一批非洲菊单倍体株系。非洲菊单倍体加倍技术国外已有相关研究[11-12],但中国研究非洲菊单倍体起步较晚,还未见有关报道。【本研究切入点】单倍体的育性一般较低[13],影响了进一步的研究应用,一般需要加倍才能恢复育性。因此,研究非洲菊单倍体的加倍方法具有重要意义。【拟解决的关键问题】本试验以非洲菊品种胚珠诱导的单倍体株系为材料,以未经过化学药剂处理的植株为对照,研究秋水仙素处理方式、处理时间和处理浓度对非洲菊单倍体植株加倍效果的影响,为推进非洲菊单倍体植株在育种中的研究有效利用奠定基础。
1 材料与方法
1.1 材料
试验材料来自云南省农科院花卉研究所在玉溪的非洲菊育种资源圃,将非洲菊品种‘红极星’胚珠诱导培养获得的单倍体株系qH25(2n=x=25)的组培繁殖苗切成单株后,选用株高约为1 cm的植株备用。
1.2 试验设计
以未经过秋水仙素处理的非洲菊单倍体植株为对照,采用秋水仙素不同处理方式、不同处理时间和浓度对单倍体植株进行化学诱变处理。每个处理接种6瓶,每瓶5株。秋水仙素的处理浓度分别为0.02 %、0.05 %和0.1 %,处理时间分别为1、4和7 d,按如下3种方法进行处理。
全株浸泡法:将单株完全浸泡于浓度为0.02 %~0.1 %的秋水仙素溶液中,处理1~7 d,期间摇动多次,处理完毕后,用无菌水浸泡20 min后,漂洗3次,转入MS+BA 0.6 mg/L+NAA 0.1 mg/L,附加食用白糖30 g/L ,琼脂7g/L,pH 值5.5~5.8的繁殖培养基。
茎尖浸泡法:将灭菌后的药剂用无菌针管注入繁殖培养基瓶内,每瓶10 mL,然后放入培养室培养,处理1~7 d后用无菌水清洗3次,转入上述繁殖培养基。
培养基添加秋水仙素法:将单株接种在添加了秋水仙素浓度为0.02 %~0.1 %的上述繁殖培养基中,处理1~7 d后,没用无菌水漂洗,直接转入无秋水仙素的繁殖培养基。
1.3 培养方法及数据统计
各处理置于温度(22±2) ℃,光照强度40~50 μmol/m·s的培养室中,光照时间为10 h/d 。每30 d用相同的培养基转接1次(即30 d为1个继代周期)。处理植株培养30 d后,记录处理材料的死亡数量,采用目测方法观察剩余植株的受害情况。处理植株培养90 d后,以未处理的单倍体株系为对照,采用形态学特征、根尖染色体计数法和气孔保卫细胞叶绿体计数法对各处理进行倍性鉴定[10],以3种鉴定方法得到的加倍率平均值作为该处理的加倍率。死亡率(%)=死亡株数/处理总株数×100,加倍率(%)=变异株数/总株数×100。计算各处理植株死亡率和加倍率。
2 结果与分析
2.1 非洲菊倍性变异植株鉴定情况
以未处理的单倍体株系为对照,采用根尖染色体计数法、形态学特征和气孔保卫细胞叶绿体计数法对各处理植株进行倍性鉴定。经秋水仙素处理后,非洲菊单倍体株系的部分植株发生了变异,根尖染色体数目、组培苗形态特征和气孔保卫细胞叶绿体数目都发生了变化(图1~2):单倍体的染色体数为2n=x=25,变异株双单倍体的染色体数为2n=2x=50;和单倍体相比,双单倍体的株型较大,叶片较宽;双单倍体的气孔保卫细胞叶绿体数目比单倍体的气孔保卫细胞叶绿体数多。

A:单倍体2n=x=25;B:双单倍体2n=2x=50A: haploid 2n=x=25; B: double haploid 2n=2x=50图1 单倍体和双单倍体根尖染色体鉴定Fig.1 Identification of haploid and double haploid apical chromosome

A:单倍体和双单倍体株型;B:单倍体和双单倍体叶片;C:单倍体气孔保卫细胞及叶绿体;D:双单倍体气孔保卫及叶绿体A: Plant types of haploid and double haploid; B: Leaves of haploid and double haploid;C: Stomatal guard cells and its chloroplasts of haploid; D: Stomatal defense and its chloroplast of double haploid图2 单倍体和双单倍体植株形态特征、气孔保卫细胞和叶绿体Fig.2 The morphological characteristics, stomatal guard cells and its chloroplasts in haploid and double haploid
2.2 全株浸泡法的加倍效果
处理植株培养30 d后,用相同浓度的秋水仙素溶液浸泡全株,浸泡时间越长,单倍体植株受害越严重(表1),死亡率越高;相同的处理时间,秋水仙素浓度越大,单倍体植株受害也越严重,死亡率也越高。处理植株培养90 d后,由于受死亡株数的影响,浓度为0.05 %和0.1 %的秋水仙素溶液浸泡植株4 d的加倍率反而比浸泡时间为7 d的植株加倍率高。
2.3 茎尖浸泡法的加倍效果
将非洲菊组培繁殖苗切成单株后,茎尖浸泡于不同浓度的秋水仙素溶液中,处理植株培养30 d后,浓度为0.02 %的秋水仙素溶液浸泡植株1 ~7 d,均无死亡率(表2),但加倍率较低,甚至无加倍。浓度为0.1 %的秋水仙素浸泡植株茎尖7 d,植株受害最严重,死亡率最高,达46 %。处理植株培养90 d后,浓度为0.1 %的秋水仙素溶液浸泡植株茎尖4 d,加倍率最高,达15 %。
2.4 培养基添加秋水仙素法的加倍效果
将非洲菊组培繁殖苗切成单株后,接种在添加了秋水仙素浓度为0.02 %~0.1 %的繁殖培养基中,处理植株培养30 d后,浓度为0.02 %的秋水仙素处理1 d对植株无任何伤害(表3),无死亡率;浓度为0.1 %的秋水仙素处理7 d对植株伤害最严重,死亡率达80 %。处理植株培养90 d后,浓度为0.05 %的秋水仙素处理4 d,单倍体的加倍率最高,达42 %。

表1 全株浸泡法加倍效果

表2 茎尖浸泡法加倍效果
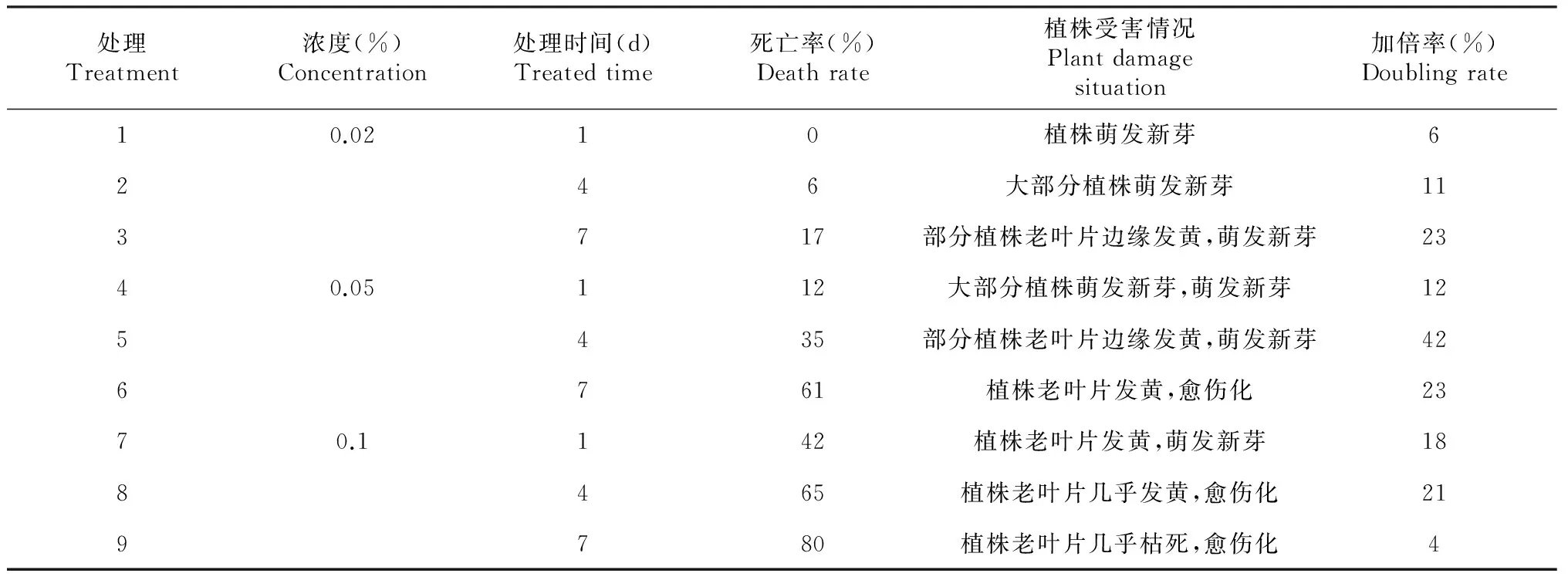
表3 培养基添加秋水仙素法加倍效果
3 讨 论
植物单倍体的染色体加倍的化学药剂大多为秋水仙素,不同作物秋水仙素诱变处理的方法一般都不同,对秋水仙素的耐受性也不同,倍性诱变效果也不同。姜龙等应用秋水仙素为诱变剂加倍甜玉米单倍体,用秋水仙素浸芽和针刺生长点对植株的伤害较严重,存活率低于50 %,浸种法处理效果最好,针刺生长点法次之[14]。赵翠荣等室温下以0. 20 %的秋水仙素浸根处理单倍体小麦3~4 h,期间持续通入空气并进行遮光处理的效果最佳,加倍率可达90 %[15]。张天翔等在离体培养条件下,以秋水仙素浸泡法和培养基添加秋水仙素法处理芦笋单倍体幼苗的茎尖,培养基添加法的诱变效果较好,在培养基中添加0.30 %秋水仙素处理7 d时,染色体加倍率可达82.50 %[16]。本研究采用培养基添加秋水仙素法、全株浸泡法和茎尖浸泡法,研究不同秋水仙素处理浓度和处理时间对非洲菊单倍体的倍性诱变效果,认为采用培养基添加秋水仙素法,0.05 %的秋水仙素处理非洲菊单倍体4 d,加倍率达42 %(表3)是非洲菊单倍体加倍的最佳方案。
秋水仙素浓度及处理时间是影响倍性诱变的关键因素。秋水仙素能够阻止细胞有丝分裂中纺锤体的形成,使分生细胞复制的染色体不能分向两极,导致新生细胞染色体加倍[16]。同时,秋水仙素对植株有毒害作用,抑制植株生长,甚至导致植株直接死亡。所以,最佳的秋水仙素浓度和处理时间,既要考虑加倍效果,也要考虑对植株的损害程度。本实验研究非洲菊单倍体的加倍效果时,充分考虑了上述因素,因此以变异株数占试验总株数的百分比,而不是以变异株数占倍性鉴定总株数的百分比来计算加倍率。为了降低倍性鉴定误差,试验同时采用形态学特征、根尖染色体计数法和气孔保卫细胞叶绿体计数法对各处理进行倍性鉴定,以3种鉴定方法得到的加倍率平均值作为该处理的加倍率,倍性鉴定结果更加可靠。
李涵等[17]以非洲菊‘阳光海岸’和‘白马王子’(2n=2x=50)品种为供试材料,秋水仙素处理浓度和处理时间分别为0.02 %、0.05 %、0.10 %和24、36、48 h,采用全株浸泡法对组培丛生芽进行加倍,0.10 %的秋水仙素处理24 h的倍性诱变率为2 %。本试验采用全株浸泡法对非洲菊单倍体(2n=x=25)进行倍性诱变,0.1 %的秋水仙素处理24 h的倍性诱变率为11 %(表1)。采用相同秋水仙素处理方法、处理浓度和处理时间,二者由于试验材料的倍性和基因型不同,诱变率存在较大差异,其原因还需进一步研究。
4 结 论
秋水仙素的处理浓度分别为0.02 %、0.05 %和0.1 %,处理时间分别为1、4和7 d,采用培养基添加秋水仙素法、全株浸泡法和茎尖浸泡法3种方法对非洲菊单倍体(2n=x=25)进行诱变处理。倍性鉴定结果表明,变异株双单倍体的染色体数为2n=2x=50,和单倍体相比,双单倍体株型较大,叶片较宽,气孔保卫细胞叶绿体数较多。培养基添加秋水仙素法加倍效果最好,全株浸泡法次之,茎尖浸泡法最差。0.05 %的秋水仙素添加至增殖培养基处理4d加倍效果最好,加倍率达42 %;0.02 %的秋水仙素溶液浸泡全株或茎尖1 d,对单倍体植株无加倍效果;0.1 %的秋水仙素添加至增殖培养基处理7 d,植株的死亡率达80 %,而加倍率仅为4 %。
[1]Leffring L. Flower production in gerbera: correlation between shoot, leaf and flower formation in Seedlings[J]. Scientia Horticulturea, 1973(1): 221-229.
[2]Singh S,Dhyani D,Karthigeyan S. Characterization of variability in F1 progeny of intervarietal cross of gerbera (GerberajamesoniiBolus ex. Hooker F) [J]. Journal of Ornamental Horticulture, 2009, 12(4):225-231.
[3]李绅崇,蒋亚莲,曹 桦. 切花非洲菊品种自交亲和性研究[J]. 现代园艺,2008(9): 44-46.
[4]张献龙,唐克轩. 植物生物技术[M]. 北京: 科学出版社,2004: 153-177.
[5]张树根, 蒋钟仁, 邢永萍, 等. 一个辣椒杂交种的加倍单倍体(DH)群体果实性状的遗传分析[J]. 园艺学报,2008,35(4): 515-520.
[6]王丽花,瞿素萍,杨秀梅, 等. 非洲菊未授粉胚珠的离体诱导和植株再生[J]. 植物生理学通讯, 2007, 43(6): 1089-1092.
[7]单芹丽,王继华,吴丽芳,等. 不同供体材料对非洲菊胚珠离体培养的影响[J]. 植物生理学报,2015, 51(7): 1151-1156.
[8]单芹丽,李绅崇,王继华,等. 基因型和预处理对非洲菊胚珠离体培养的影响[J]. 江西农业学报,2015, 27(7): 44-47.
[9]单芹丽,阮继伟,吴丽芳,等. 非洲菊单倍体植株的生长特性初报[J]. 江西农业学报,2016, 28(12): 13-17.
[10]王丽花,杨秀梅,吴学尉,等. 非洲菊大孢子再生植株倍性的快速鉴定方法[J]. 西南农业学报,2013, 22(1): 155-16.
[11]Tosca A, Pandolfi R, Citterio S, et al. Determination by flow cytometry of the chromosome doubling capacity of colchicine and oryzalin in gynogenetic haploids of Gerbera[J]. Plant Cell Rep, 1995, 14: 455-458.
[12]Miyoshi K, Asakura N. Callus induction, regeneration of haploid plants and chromosome doubling in ovule cultures of pot gerbera(Gerberajamesonii) [J]. Plant Cell Reports, 1996, 16: 1-5.
[13]边才苗.单倍体的来源与育性[J]. 生物学通报,2002,37(2):32.
[14]姜 龙,南 楠,王薪淇,等. 甜玉米单倍体诱导和加倍方法研究[J]. 西北农林科技大学学报,2016, 44(7): 95-100.
[15]赵翠荣,唐 清,王立峰,等. 秋水仙素及辅助处理对小麦×玉米单倍体加倍的影响[J]. 麦类作物学报,2014, 34(11): 1485-1489.
[16]张天翔,林宗铿,蔡坤秀,等. 芦笋单倍体染色体加倍技术研究[J].中国农学通报,2011, 27(13): 212-215.
[17]李 涵,鄢 波,张 婷,等. 切花非洲菊多倍体诱变初报[J]. 园艺学报,2009, 36(4): 605-610.
EffectofColchicineonGerberajamesoniiHaploidDoubling
SHAN Qin-li1,2, WANG Ji-hua1, LI Shen-chong1, QU Su-ping1, WANG Guo-xian1,2,YANG Chun-mei1,2*, JIANG Hai-yu3*
(1. Flower Research Institute, Yunnan Academy of Agricultural Sciences, National Engineering Research Center for Ornamental Horticulture, Yunnan Kunming 650205, China; 2. Yuxi Yunxing Biotechnology Co., Ltd., Yunnan Yuxi 652604, China;3. Agricultural Economics Information Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Kunming 650205, China)
【Objective】Doubling method ofGerberajamesoniihaploid was studied. 【Method】The doubling effect of colchicine onGerberajamesoniihaploid (2n=x=25) was studied by different treatments method, time and concentration. 【Result】The plant type of double haploid was larger than that of haploid, the leaf was wider, and the number of chloroplasts was higher in stomatal guard cells. Addition of colchicines into the culture medium gave the best doubling effect, the whole plant immersion method gave satisfactory results, stem tip soaking method has the worst double effect. The whole plant or stem tip was treated in 0.02 % colchicine liquid for 1 day did not cause damage to haploid plants, but no doubling effect, 0.1 % colchicine was added to the culture medium for 7 days to cause the greatest damage to the plant, and the mortality rate was 80 %, but the rate was only 4 %. 【Conclusion】0.05 % colchicine was added to the culture medium for 4 days, the doubling effect ofGerberajamesoniihaploid plants was the best (42 %).
Gerberajamesonii; Haploid; Colchicine; Doubling effect
1001-4829(2017)10-2230-05
10.16213/j.cnki.scjas.2017.10.012
2017-01-13
云南省科技厅技术创新暨产业发展专项资金项目(2015XB015);云南省科技厅科技人才引进与培养专项—科技领军人才培养(2016HA005);国家科技支撑计划项目(2015BAD10B00) ;云南省科技厅重大科技专项(2016ZA005)
单芹丽(1973-),女,云南祥云人,研究员,观赏园艺育种及种苗繁育技术研究,E-mail: shqli2008@126.com ,*为通讯作者:杨春梅,E-mail: 1577225885@qq.com,蒋海玉,E-mail: 1249087008@qq.com。
S682.1+1
A
(责任编辑 王家银)

