油菜MADS-box家族基因AGL11的克隆、表达及转化油菜的研究
熊 书,李彦杰,周大祥,3 *
(1.重庆三峡医药高等专科学校 基础医学部,重庆 万州 404120;2.重庆三峡学院 生命科学与工程学院,重庆 万州 404100;3.重庆大学 生命科学学院,重庆市基因功能与调控重点实验室,重庆 400300)
油菜MADS-box家族基因AGL11的克隆、表达及转化油菜的研究
熊 书1,李彦杰2,周大祥2,3 *
(1.重庆三峡医药高等专科学校 基础医学部,重庆 万州 404120;2.重庆三峡学院 生命科学与工程学院,重庆 万州 404100;3.重庆大学 生命科学学院,重庆市基因功能与调控重点实验室,重庆 400300)
【目的】本研究为油菜种子中油脂合成分子调控机理提供新的线索。【方法】通过定量PCR分析油菜AGL11基因的组织表达模式,同时构建AGL11的干扰载体。【结果】生物信息学分析发现油菜AGL11具有完整且典型的MADS-box保守结构域,蛋白整体形态呈现典型的DNA核酸结合结构,属于MADS-box家族转录调控因子,亲源关系与拟南芥AGL11蛋白最近。定量PCR研究发现,AGL11在油菜盛花期和果夹5DAP(盛花后5 d 的种子)表达量最高,实验成功构建了RNA干扰载体。【结论】AGL11基因在油菜种子发育和油脂积累过程中强烈表达,该基因可能在种子发育及油脂的合成中发挥着重要作用。RNA干扰载体的构建成功将为后续获得转基因油菜,观察转基因油菜胚的发育和种子油脂的积累,从而确定AGL11在油菜胚的发育及油脂的合成中发挥着重要作用。
油菜;MADS-box;AGL11;RNAi;油脂合成
【研究意义】MADS-box基因是植物中一类极为重要的转录调控因子,在调控生长发育和信号传导中发挥着重要的作用[1-3]。大量研究发现MADS-box家族基因AGLs参与植物花器官的发育[4-5],在果实的发育过程中也起着重要的作用[6-7]。影响种子发育的一些转录因子同时影响着种子中油脂的积累。LeafyCotyledon1,2(LEC1,LEC2),Fusca3(FUS3)和WRINKLEDl(WRI1)等基因都是种子发育过程中油脂等物质积累的关键调控因子。这些基因的突变、过量表达或异位表达都会对植物种子发育和油脂等物质的积累产生重要的影响。作为CCAAT-Box结合因子HAP3的亚基之一,LEC1控制植物胚胎发育过程中的各个方面,是胚胎发育进程中关键的调控因子。拟南芥LEC1基因的过量表达可影响其它种子发育相关的转录因子如FUS3和WRIl等基因的表达,致使脂肪酸合成关联基因的表达水平显著提高,最终导致种子中脂肪酸和油脂的含量增加[8]。WRI1编码一个AP2/EREB结构域蛋白,在亚麻荠中超表达WRI1基因,可以提高种子质量和油脂存储[9]。【前人研究进展】目前,AGLs调控植物油脂合成的研究较少,在拟南芥中,隶属于 MADS-box 家族的 AGL15 对胚的发育也具有重要调控作用,它可以直接调控 LEC2、ABI3 及 FUS3基因的表达,进而影响胚的发育[10]。GmSEP1属于 AGL2 /SEP 亚家族,GmSEP1 在大豆生殖器官花、荚和种子表达,在四轮花器官中有不同程度的表达,推测可能与大豆花器官特化和种子发育相关[11]。拟南芥基因 AGL66 和 AGL104 特异性调控花粉的成熟[12]。前期研究在油菜胚发育和油脂合成表达数据库中发现油菜AGL11基因在胚中表达较高,初步认为该基因可能与油脂合成有关。【本研究切入点】本实验通过克隆甘蓝型油菜(BrassicanapusL.)的AGL11基因,同时构建AGL11的干扰载体,为后续实验进一步确定AGL11通过控制油脂合成相关基因的表达,从而调节油脂的合成。【拟解决的关键问题】本研究结果为探索油菜种子中油脂合成的分子调控机理提供新的线索,通过基因工程手段提高油菜油脂含量,为改良油菜品质奠定基础。
1 材料与方法
1.1 供试材料
甘蓝型油菜Brassicanapuscv. Westar作为研究材料,实验所用的RNAi干扰质粒和农杆菌菌株GV3101由重庆大学基因工程中心提供。
1.2 试验方法
1.2.1 提取RNA与荧光定量PCR 以BnAGL11基因设计荧光定量PCR引物BnAGL11-F(5′-AACCGCAGTCCCGTTCTCTC-3′)和BnAGL11-R(5′-AGTCCATTTCTTCTTTTGCA-3′),引物由上海生工生物工程有限公司合成。利用Qiagen Plant RNA Kit试剂盒提取油菜各组织的RNA,利用Thermo Scientific First Strand cDNA Synthesis Kit试剂盒反转录获得cDNA,-80 ℃保存备用。荧光定量PCR利用TaKaRa公司SYBR Green Ⅰ试剂盒,在CFX96荧光定量PCR仪上进行,分析BnAGL11基因在油菜不同组织的表达情况。反应程序:95 ℃预变性20 s,95 ℃变性3 s,60 ℃退火30s,60 ℃延伸15 s,40个循环。每个样品重复3次,数据采用2—△△Ct法计算。
1.2.2 生物信息学分析 各种植物相关基因和氨基酸序列都来自NCBI数据库,蛋白结构域分析在http://pfam.wustl.edu/上进行。利用ClustalX2.1比对蛋白质序列,用MEGA 5构建进化树,利用SWISS MODEL(http://swiss model.expase.org)预测蛋白质的三维结构。
1.2.3 干扰载体构建 以油菜盛花期的花cDNA为模板,用BnAGL11的正向前后引物(For-BnAGL11-F:5′-CAATTACTTTGCTCATAACA-3′;For-BnA GL11-R:5′-CAATTACTTTGCTCATAACA-3′)扩增出正向基因片段For-BnAGL11,将此片段以及RNAi载体用XbaⅠ和SalⅠ酶切,纯化回收后连接到RNAi载体上,转化到大肠杆菌,酶切验证。反向前后引物(Rev-BnAGL11-F:5′-CAATTACTTTGCTCATAGCA-3′; Rev-BnAGL11-R:5′-ACCTTCGTTGTTTTTTGAA T-3′)操作同上。
1.3 数据分析
应用SPSS19.0统计软件对实验数据进行t检验,P<0.05表示具有显著性差异。
2 结果与分析
2.1 蛋白结构分析
图1表示,通过与拟南芥的AGL11蛋白结构比对分析,发现甘蓝型油菜的AGL11氨基酸序列与拟南芥同源性很高,二者都具有完整且典型的MADS-box保守结构域。大量研究发现MADS-box家族基因参与植物花器官的发育,在果实的发育过程中起着重要的作用,推测AGL11蛋白编码的基因属于MADS-box家族转录调控因子。

At表示拟南芥;Bn表示甘蓝型油菜图1 AGL11的氨基酸序列比对和同源性分析Fig.1 Amino acid sequence alignment and homology analysis of AGL11

图2 SWISS MODEL三维蛋白质结构预测Fig.2 SWISS MODEL three-dimensional protein structure prediction
2.2 蛋白质的三维结构预测
通过SWISS MODEL在线蛋白质三级结构分析,发现该蛋白具有1个α螺旋,2个β片层结构,还有一些不规则卷曲,其整体形态呈现典型的DNA核酸结合结构(图2),也进一步证明该基因编码的蛋白为1个转录因子,具有典型MADS-box保守结构域,属于MADS-box家族基因。
2.3 进化树分析
为了分析油菜BnAGL11蛋白和拟南芥AGL蛋白的遗传进化关系,用NCBI下载的蛋白序列,采用MEGA程序建立了系统发育树。从图3可以看出,BnAGL11蛋白与AtAGL11,AtAGL1,AtAGL5,AtSHP2蛋白组成一个小的亚家族,与AtAGL11蛋白亲源关系最近,也表明BnAGL11可能与AtAGL11在功能上可能有一定的相似性。
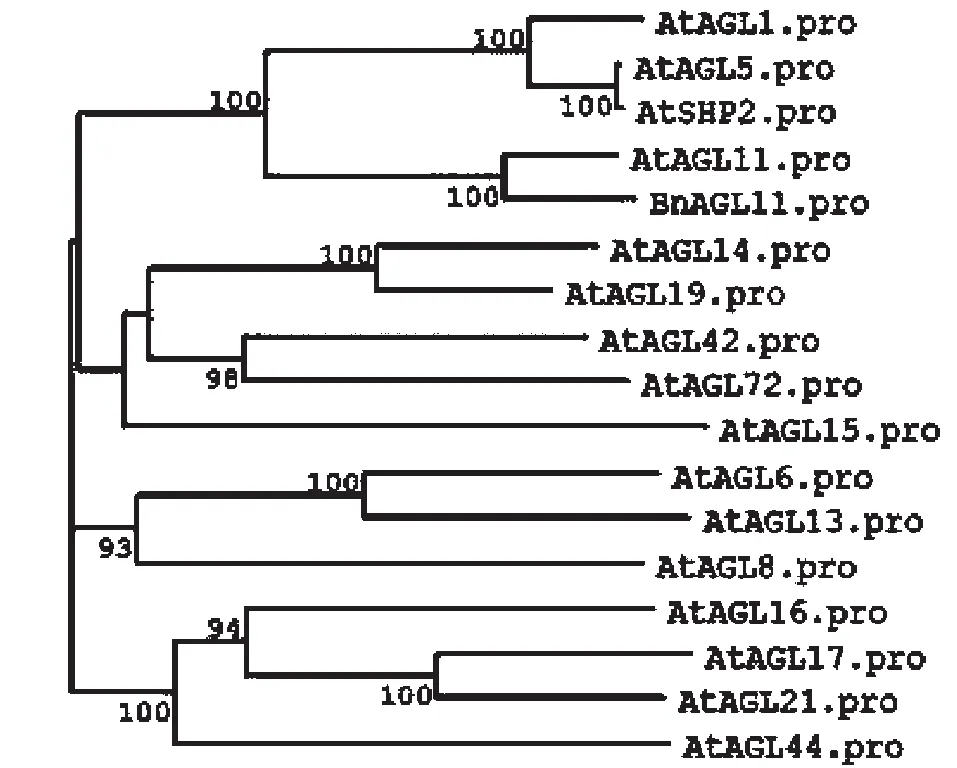
图3 BnAGL11的系统发育树Fig.3 Phylogenetic tree of BnAGL11
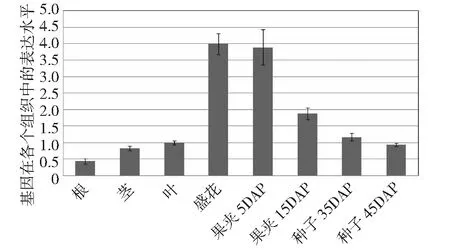
DAP表示盛花后几天的种子图4 甘蓝型油菜AGL11基因的组织表达模式分析Fig.4 Analysis of tissue expression patterns of BnAGL11 gene
2.4 定量PCR表达分析
由图4可知,AGL11在各个组织中均有表达,其中在盛花期表达量最高,在果夹5DAP时期表达量接近盛花期,随后逐渐降低,二者是其他组织表达量的2倍以上,油菜种子在DAP5和DAP15之间是胚迅速膨大、油脂快速的积累时期,定量PCR的结果说明AGL11在油菜胚的发育过程及其油脂的合成中可能具有重要的作用。
2.5 干扰载体构建及转化油菜
为了进一步验证AGL11在油菜胚的发育过程及其油脂的合成中可能具有重要的功能,采用RNAi干扰技术,降低AGL11基因在油菜中的表达,然后观察转基因油菜的表型。为了构建RNAi干扰载体,首先以AGL11基因cDNA为模板,扩增出了100 bp的干扰载体正向和反向片段(图5A),然后分别插入干扰载体中,获得重组质粒,进一步酶切验证插入片段大小,发现插入片段1000 bp(图5B),与预期一致,证明RNAi载体构建成功。随后将载体导入农杆菌GV310菌株中,采用农杆菌介导的叶盘法,用油菜下胚轴和子叶为受体,进行遗传转化,目前正在获得阳性抗性苗。随后将进一步获得转基因油菜植株,观察转基因油菜胚的发育和种子油脂的积累,确定AGL11在油菜胚的发育及油脂的合成中发挥着重要的作用。
3 讨 论
油菜是全球重要的经济作物,同时在我国的油料作物中排名第一,是优良植物蛋白和食用植物油的重要来源。统计显示,我国食用植物油使用量的35 %来自于菜籽油,而植物饼粕使用量的25 %来自于菜籽饼粕,增加油菜产油率和油脂品质改善始终是油菜育种的重要内容[13]。据统计,对油菜产油率而言,每提高1 %的油菜油脂含量,相当于增加2.5 %的菜籽产量。现在,我国主要油菜品种含有40 %左右平均油脂含量,而国外一般油菜品种达到了42 %~45 %,部分甘蓝型油菜品种油脂含量高达47 %。这必然会导致油菜种植业经济效益低下,打击农民种植油菜的积极性,制约了进一步扩大油菜种植面积和油菜业的发展。为此,进一步研究油菜油脂合成的分子调控机理,了解控制油脂合成的关键基因,为通过基因工程手段提高油菜油脂含量,改良油菜品质,提高油菜产业生产效益奠定基础。

图5 RNA干扰载体的构建Fig.5 Construction of RNAi vector
研究表明,过量表达或异位表达一些转录因子,可以对植物种子发育和油脂等物质的积累产生重要的影响。如拟南芥LEC1基因的过量表达可使脂肪酸合成关联基因的表达水平显著提高,最终导致种子中脂肪酸和油脂的含量增加[8]。在拟南芥中超量表达WRI1基因,显著提高了种子中油脂的含量(提高10 %~20 %),且不影响转基因植株的生长。实验表明,糖酵解和脂肪酸代谢进程的基因直接受到WRI1调控[14]。此基因的效应已在大田中得到证明,在玉米中超量表达WRI1,使玉米种子中油脂的含量增加了30 %[15]。研究发现,油菜Testa16在植物发育中扮演着多重角色,参与油菜胚胎发育和脂肪酸合成[16]。将大豆Dof类型的转录因子基因gmDof4和gmDof11转化到拟南芥中,可以提高转基因植株种子油脂含量[17]。
通过定量PCR研究证明AGL11基因在种子发育和油脂积累过程中表达强烈,表明该基因可能在这些发育过程中发挥着重要作用,后续实验通过获得抑制AGL11基因表达转基因油菜,并对转基因油菜进行胚分析和油脂含量测定,观察在转基因植株的种子和胚发育是否被强烈抑制,胚中脂肪酸含量是否显著降低,通过上述研究,明确了AGL11基因在控制油菜种子中脂肪酸合成中的作用。
[1]Saha G, Park J I, Jung H J, et al. Genome-wide identification and characterization of MADS-box family genes related to organ development and stress resistance inBrassicarapa[J]. Bmc Genomics, 2015, 16(1): 1-21.
[2]Guo X, Chen G, Cui B, et al. Solanum lycopersicum agamous-like MADS-box protein AGL15-like gene, SlMBP11, confers salt stress tolerance[J]. Molecular Breeding, 2016, 36(9): 1-15.
[3]Ludovico D, Martin M K. MADS reloaded: evolution of the AGAMOUS subfamily genes[J].New Phytologist, 2014, 201: 717-732.
[4]Wei X C, Wang L, Yu J, et al. Genome-wide identification and analysis of the MADS-box gene family in sesame[J].Gene, 2015, 569(1): 66-76.
[5]Sun L M, Zhang J Z, Hu C G, et al. Characterization and Expression Analysis of PtAGL24, a SHORT VEGETATIVE PHASE/AGAMOUS-LIKE 24 (SVP/AGL24)-Type MADS-Box Gene from Trifoliate Orange (PoncirustrifoliataL. Raf.)[J]. Frontiers in Plant Science, 2016, 721 (7): 23-28.
[6]Ocarez N, Mejía N. Suppression of the D-class MADS-box AGL11 gene triggers seedlessness in fleshy fruits[J]. Plant Cell Reports, 2016, 35(1): 239-254.
[7]Wells C E, Vendramin E, Tarodo S J, et al. A genome-wide analysis of MADS-box genes in peach [Prunuspersica(L.) Batsch][J].Bmc Plant Biology, 2015, 15(1): 1-15.
[8]Tan H, Yang X, Zhang F, et al. Enhanced seed oil production in canola by conditional expression ofBrassicanapusLEAFY COTYLEDON1 and LEC1-LIKE in developing seeds[J].Plant Physiology, 2011,156: 1577-1588.
[9]An D H, Michung S. Overexpression of Arabidopsis WRI1 enhanced seed mass and storage oil content inCamelinasativa[J].Plant Biotechnology Reports, 2015,9(3): 137-148.
[10]Zheng Y, Ren N, Wang H, et al. Global identification of targets of the Arabidopsis MADS domain protein AGAMOUS-Like15[J]. Plant Cell, 2009,21(9): 2563-2577.
[11]Huang F,Chi Y,Gai J,et al. Identification of transcription factors predominantly expressed in soybean flowers and characterization of GmSEP1 encoding a SEPALLATA1-like protein[J].Gene,2009,438: 40-48.
[12]Adamczyk B J,Fernandez D E. MIKC* MADS domain heterodimers are required for pollen maturation and tube growth in Arabidopsis[J].PlantPhysiol,2009,149: 1713-1723.
[13]王汉中. 我国油菜产业发展的历史回顾与展望[J]. 中国油料作物学报,2010,32:300-302.
[14]Maeo K, Tokuda T, Ayame A, et al. An AP2-type transcription factor WRINKLED1 ofArabidopsisthalianabinds to AW-box sequence conserved among proximal upstream regions of genes involved in fatty acid synthesis[J].Plant Journal, 2009, 60: 476-487.
[15]Shen B, Allen W B, Zheng P, et al. Expression of ZMLEC1 and ZMWRI1 increases seed oil production in maize[J].Plant Physiology, 2010, 153: 980-987.
[16]Deng Wei, Hen G, Peng F, et al.TransparentTesta16 plays multiple roles in plant development and is involved in fatty acid synthesis and embryo development inBrassicanapus[J]. Plant Physiology, 2012, 160: 978-989.
[17]Wang H W, Zhang B, Hao Y J, et al. The soybean Dof-type transcription factor genes, GmDof4 and GmDof11, enhance lipid content in the seeds of transgenic Arabidopsis plants[J]. Plant Journal, 2007, 52: 716-729.
CloningandExpressionandTransformationofMADS-boxFamilyGeneAGL11inBrassicanapus
XIONG Shu1, LI Yan-jie2, ZHOU Da-xaing2,3*
(1.Department of Basic Medicine, Chongqing Three Gorges Medical College, Chongqing Wanzhou 404120, China; 2.College of Life Science and Engineering, Chongqing Three Gorges University, Chonqqing Wanzhou 404100, China; 3.College of Life Science, Chongqing University, Chongqing Key Lab of Genetic Function and Regulation,Chongqing Wanzhou 400030, China)
【Objective】This study aimed to provide a new clue for the exploration of the molecular regulation mechanism of oil synthesis inBrassicanapusseed. 【Method】The tissue expression pattern ofAGL11 gene by qPCR was analyzed, and its RNA interference vector was constructed. 【Result】Bioinformatics analysis showed that AGL11 protein ofBrassicanapushad a complete and typical MADS-box conserved domain, the overall shape of protein showed typical DNA nucleic acid binding structure, the AGL11 belonged to the MADS-box family transcription factor, and its genetic relationship was the closest with AGL11 protein ofArabidopsis. The qPCR study found thatAGL11 gene expression was the highest in the flowering stage and fruit clamp 5DAP (5 days seed after flowering), and its RNA interference vector was successfully constructed in the experiment. 【Conclusion】TheAGL11 gene was strongly expressed in seed development and oil accumulation, which may play an important role in the seed development and the oil synthesis. The successful construction of RNA interference vector would be favourable to further obtain the transgenicBrassicanapus, observe the embryo development and seed oil accumulation of transgenicBrassicanapusand thus determine theAGL11 gene to play an important role in the embryo development and oil synthesis.
Brassicanapus; MADS-box;AGL11; RNAi; Oil synthesis
1001-4829(2017)10-2174-05
10.16213/j.cnki.scjas.2017.10.003
2016-11-10
重庆市教委科学技术研究项目(KJ1502601);重庆市自然科学基金(cstc2016jcyjA2132);重庆市教育委员会项目(KJ1401001)
熊 书(1987-),女,讲师,硕士,主要从事分子生物学研究;*为通讯作者:周大祥(1979-),男,副教授,博士,主要从事分子生物学研究,E-mail:dqzhou79@163.com。
Q945.79
A
(责任编辑 陈 虹)

