脱细胞基质补片修复大鼠腹壁缺损时耐受感染能力的实验研究
李玥 廖芝伟 黄琦 周远航 汤睿 董建
·论 著·(实验研究)
脱细胞基质补片修复大鼠腹壁缺损时耐受感染能力的实验研究
李玥 廖芝伟 黄琦 周远航 汤睿 董建
目的探讨脱细胞异体真皮基质组织补片在污染或感染环境下一期修补大鼠腹壁缺损时耐受感染的能力。方法60只SD雄性大鼠,随机分为清洁(A组)、污染(B组)、感染组(C组)3组,每组20只,另设空白对照组1只,采用切除全部腹壁肌肉的方式制备腹壁缺损模型,清洁组直接用补片修复缺损;用大肠稀释液涂抹补片、腹壁切口制备污染模型,后一期修补缺损;大肠纵向切开0.3 cm形成肠瘘制备感染模型,然后以脱细胞基质补片一期修复腹壁缺损。术后7 d、14 d各组分别处死一半大鼠,观察切口愈合情况、补片感染情况并取补片及周围组织进行病理检查。结果A组、B组实验大鼠均无死亡,C组术后1周内死亡4只,均因肠瘘导致弥漫性腹膜炎,腹腔大量积液死亡。术后7 d污染、感染组切口感染率显著高于清洁组(P=0.004);术后14 d各组切口愈合情况差异无统计学意义。组织学观察显示术后7 d污染组炎性反应明显较清洁、污染组严重,而在纤维增生、新生血管形成等方面差异无统计学意义。结论从耐受感染的角度考虑,脱细胞异体真皮基质组织补片可用于一期修补污染或感染状态下腹壁缺损,该补片具有较强的耐受感染能力,其内在机制可能与炎性细胞容易进入补片及早期新生血管形成有关。
污染; 感染; 腹壁缺损; 脱细胞基质
污染或感染状态下腹壁缺损的修复是外科领域的难题,临床病种多见,如腹壁、腹膜后巨大肿瘤联合消化道脏器切除后腹壁缺损的修复,开放性腹壁损伤伴有污染或感染时腹壁缺损的修复,腹壁疝手术中分离粘连时肠管破损,补片修复后发生补片相关感染等情况时,如何选材、修复存在诸多争议。在污染或感染状态下的腹壁缺损修复时,传统的观念是先清创、引流,以后二期修补,但随着外科材料和外科理念的进步,清创后一期修复成为可能[1-3]。生物补片是目前进行一期修复的首选材料,然而目前生物补片应用的病例数尚不多、随访时间短,对于复杂性腹壁缺损的修补效果并不满意[4]。本研究通过建立大鼠腹壁污染及感染型腹壁缺损的动物模型,并应用脱细胞异体真皮基质组织补片进行一期修复缺损,为污染或感染状态下腹壁缺损的一期修复提供理论基础及实验依据。
材料与方法
一、实验材料
1. 实验动物 成年雄性大鼠61只,体重190~205 g,平均201 g,由复旦大学药学院动物实验中心提供。实验动物由复旦大学药学院动物实验中心按实验室标准条件喂养(清洁环境、温度20℃、相对湿度50%~60%、每日12 h白昼和12 h黑夜)。
2. 材料 生物补片为脱细胞异体真皮基质组织补片(由北京清源伟业生物组织工程科技有限公司制造)。
二、方法
1.实验目的 建立清洁、污染、感染三组大鼠腹壁缺损模型,应用脱细胞异体真皮基质组织补片一期修复腹壁缺损,检验修补效果及其机体内的感染耐受性,通过对照研究,比较清洁、污染、感染状态下生物补片修补效果,并通过病理学检查,明确其在机体感染组织中的生理学变化。
2.实验分组 将61只入组实验大鼠由1~61编号并记录,根据腹部缺损模型分为3组:清洁组(A组)、污染组(B组)、感染组(C组),每组20只,分别编号为A1~A20、B1~B20、C1~C20。清洁组指腹壁缺损无消化液等污染者,本研究切除腹壁肌肉后直接行补片修补制备清洁组模型;污染组指腹壁缺损有消化液污染者,本研究用大肠液稀释后涂抹腹壁缺损周围组织与补片制备污染模型;感染组指伤口已感染者,本研究将大鼠肠管部分切开引起急性腹膜炎制备污染模型。各组大鼠在体重、术前体温等各方面差异无统计学意义。另设空白对照大鼠(不作任何手术处理)一只。
3.实验方法 手术按照A1、B1、C1,A2、B2、C2……A20、B20、C20的次序进行。脱细胞异体真皮基质组织补片预先裁剪成大小1.5 cm×1.5 cm的正方形,并浸泡在生理盐水中备用。术前大鼠禁食、禁水12 h,水合氯醛1.5~2 ml大鼠腹腔注射麻醉,术中根据麻醉效果加量。麻醉生效后,将大鼠仰卧固定在手术板上,剃毛刀剔除腹壁手术野发毛,聚维酮碘(碘伏)消毒,铺无菌洞巾。取中腹部正中切口,分离皮肤与肌肉之间的间隙,于下腹正中切除1.5 cm×1.5 cm腹壁(包括腹膜、肌肉、筋膜组织)制成腹壁缺损。清洁组直接用1.5 cm×1.5 cm生物补片修补缺损;污染组抽取1 ml大肠液和1 ml生理盐水稀释后涂抹于切口周围腹壁及补片,后一期修补缺损;感染组纵行切开大肠壁3 mm制备肠瘘腹腔感染模型,并用肠液涂抹于切口周围腹壁及补片,然后用生物补片一期修复腹壁缺损。采用桥接方法置入生物补片,因补片具备一定的伸展性,补片与腹壁缺损边缘腹壁重叠约0.2 cm,以1号丝线固定于腹壁缺损处肌肉边缘,间断缝合共8针。皮肤间断缝合3针。术后动物单笼饲养,观察动物每日活动及进食情况,检测动物体温、体重,分别观察切口愈合情况,有无腹壁隆起、腹壁疝发生。术后7 d、14 d分别由各组随机抽取一半实验大鼠,眼角取血化验大鼠白细胞计数(WBC)、C反应蛋白(CRP)等指标,再次手术解剖观察补片与腹腔粘连情况,切取补片及其周围约0.5 cm的腹壁组织进行组织学观察及免疫组化检测,术后颈椎脱臼处死。
4.观察指标 ①一般情况:有无实验大鼠死亡、进食情况、体温、体重变化,有无腹壁疝发生。②伤口愈合情况,术后7 d、14 d观察伤口愈合情况,分为三级:甲级愈合,无红肿渗出,无溃破;乙级愈合,伤口红肿,少量分泌物,无溃破;丙级愈合,大量分泌物,溃破。③取补片及其周围部分腹壁组织,HE染色光镜下观察补片植入后局部病理反应情况,免疫组化CD31染色观察新生血管生成情况。运用半定量评分系统[5](表1)对补片周围组织的纤维增生、周围炎症反应和新生血管情况进行评估。各项指标的观察根据双盲原则,由未参与手术的第三者来评估记录。
三、统计学处理
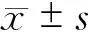
结 果
一、术后一般情况
术后5、6 h大鼠恢复进食进水,术后早期大鼠活动受限,排便正常,无麻醉过量死亡。清洁组及污染组术后无死亡,空白对照大鼠存活,感染组有4只大鼠死亡。其中1只于术后当天死亡,2只于术后第1天死亡,1只于术后第3天死亡,解剖发现死亡原因均为腹腔大量积液(粪汁样腹膜炎)。三组存活的大鼠分别为A组20只、B组20只、C组16只,存活大鼠腹壁缺损均得到完整修补,各组均未出现腹部膨隆、腹壁疝。三组大鼠术后平均体温变化、WBC、CRP等均差异无统计学意义(P>0.05),各组大鼠体重变化差异无统计学意义(P>0.05)。
二、伤口愈合情况
术后7 d及14 d各组伤口愈合情况见表2。术后7 d三组间切口愈合情况有显著差异,P=0.02,但是由于最小期望值为2.29,而且有6个格点的期望值小于5,此结果不可信。将乙级和丙级愈合合并后进一步统计分析发现,三组间甲级愈合率有显著差异,清洁组伤口甲级愈合率显著高于污染组及感染组(图1)(P=0.004)。术后14 d污染组及感染组的伤口均自行愈合(图2),三组切口愈合情况差异无统计学意义(P=0.54)。
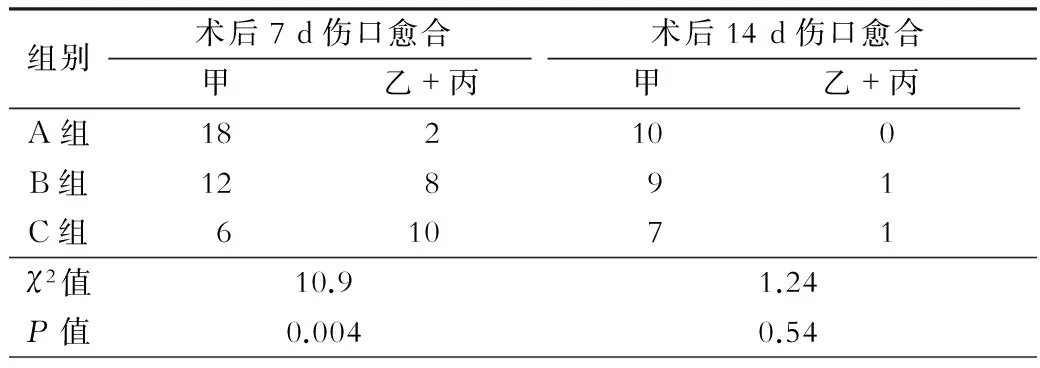
表2 各组术后7 d及14 d切口愈合情况(只)
三、病理学观察结果
术后7 d及14 d分别解剖观察并行病理组织学检查,三组大鼠补片周围组织纤维增生、炎症反应和新生血管半定量评分统计结果见表3。术后7 d清洁组补片周围组织少量炎性细胞浸润,炎症反应较轻,污染和感染组炎症反应较重,甚至有局部小脓肿形成(图3);至术后14 d各组炎症反应差异无统计学意义(表3)。术后各组在纤维增生、新生血管生成(图4)方面差异均无统计学意义(表3)。
讨 论
污染或感染状态下腹壁缺损的修复是外科领域的难题,生物相容性良好的聚丙烯、聚酯、聚四氟乙烯以及防粘连复合材料等高分子合成补片的问世,使巨大腹壁缺损的一期修复成为可能,并且显著降低了术后复发率[6]。但在手术区域处于污染或感染状态时,选用上述修复材料则可能发生感染、窦道、肠瘘等并发症,术后感染是污染和感染腹壁缺损一期修补手术失败的重要原因之一,提高修补材料耐受感染的能力成为手术成功的关键之一。

表1 组织学评分标准
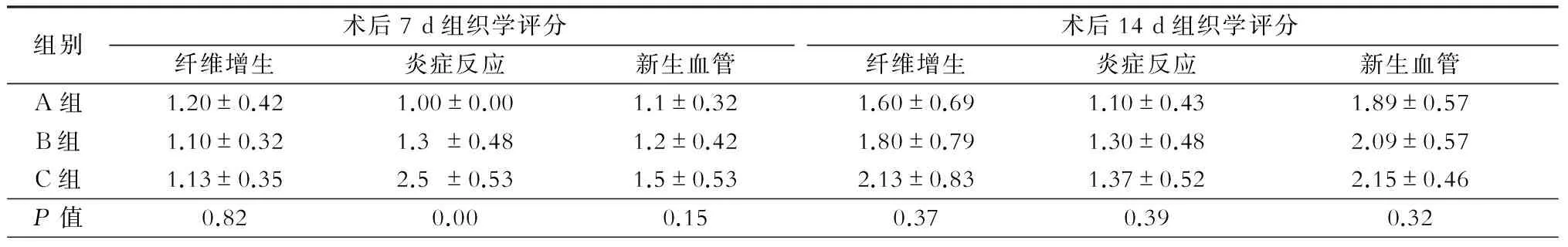
表3 各组术后7 d及14 d组织学评分情况(分)
脱细胞基质生物补片[7-8]是人尸源性或动物组织经脱细胞、消毒杀菌、化学交联等处理形成的脱细胞基质,含有结构性和功能性蛋白的生物补片植入人体后,作为支架诱导修补部位细胞和组织长入,补片自身逐渐完全被吸收,并最终被人体新生组织代替。与不可吸收高分子材料补片相比,生物补片生物相容性好且最终可吸收不留异物,理论上可以改善组织对污染和感染的耐受力。为进一步验证脱细胞基质补片耐受感染能力,本研究采用北京清源伟业生物科技工程有限公司生产的瑞诺脱细胞组织补片一期修复污染和感染状态下大鼠腹壁缺损,与清洁状态腹壁缺损作对照,比较清洁与污染或感染状态下切口愈合情况,并通过病理学检查,进一步探讨生物补片耐受感染的可能机制。
实验结果除感染组有4只大鼠因肠瘘腹腔感染死亡外,其余各组实验动物伤口均良好愈合,无腹壁疝发生,术后7 d污染+感染组切口感染率显著高于清洁组,但无严重溃烂流脓等现象,无需去除补片,至术后14 d,污染+感染组89%的大鼠达到切口甲级愈合,与清洁组无显著差异。病理组织学检查发现,术后7 d污染、感染组切口及补片周围出现大量的炎性细胞浸润,甚至出现局部微脓肿,清洁组炎症反应较轻,各组间炎症反应有显著差异,而在纤维增生和新生血管形成等方面无明显差异。通过组织学检查进一步证实术后7 d污染、感染组腹壁感染的存在,而到了术后14 d腹壁感染已经自行好转,各组间炎症反应并无显著差异,切口基本达到甲级愈合标准,说明脱细胞基质生物补片能够耐受腹壁感染,而不影响最终愈合。
关于脱细胞基质耐受感染的机制,我们认为与其自身特质密切相关。该补片将取自同种异体的片状或膜状组织通过生物学和化学的方法处理,完全脱除各种可被宿主识别为外来成分的细胞,而完整地保留了细胞外基质成分和三维框架结构,植入后,可诱导宿主细胞迁徙、黏附、分裂和增殖,利用宿主自身的细胞逐渐完成组织重建和血管再生,宿主细胞分泌的胶原最终替代脱细胞基质(ACTM),从而完成对组织缺损的修复和重建[9]。本研究证明,在术后7 d时补片内就有新生血管生成,至术后14 d已经有中等量的新生血管形成,快速的血管化过程可增强抗感染特性。杨硕等[10]研究发现,具有微孔结构的补片,新生血管更容易长入,炎性细胞游走更为广泛,成纤维细胞聚集更为明显,可以尽快于感染灶周围形成抗菌环境,局部感染造成的炎症刺激因子更容易被清除,这与本实验研究的结果相符。
本研究证实,从耐受感染的角度考虑,脱细胞基质具有明显的优势,可以在腹壁污染或感染情况下提供有效的修补,为污染或感染状态下腹壁缺损的一期修复提供了更好的选择。临床中一些学者已经开始将脱细胞基质用于复杂性、感染性腹壁缺损的治疗,并取得了较满意的效果。但是,污染和感染腹壁缺损的修复是一个比较复杂的问题,术后远期腹壁膨出就是另一个临床中遇到的棘手问题[11],其远期治疗效果有待临床进一步验证。
(本文图1~4见封四)
1 张小桥,张国卫,孟庆东,等.生物补片一期修复污染状态下的腹壁疝和腹壁缺损.国际外科学杂志,2011,38:584-587.DOI:10.3760/cma.j.issn.1673-4203.2011.09.004
2 姚京,田文,李佳.三种复合补片在污染环境下修补大鼠腹壁缺损的比较研究.中国修复重建外科杂志,2011,25:116-119.
3 OrlandoC, GersonA, Nancy M, et al.Initial experience with the use of porcine acellular dermal matrix (Strattice) for abdominal wall reinforcement after transverse rectus abdominis myocutaneous flap breast reconstruction.Ann Plast Surg,2012,68:265-270.DOI:10.1097/SAP.0b013e31822af89d.
4 陈革,唐健雄,黄磊,等.生物补片在治疗感染和污染腹壁缺损方面的体会(附34例病例).中华疝和腹壁外科杂志:电子版,2011,5:389-393. DOI:10.3877 /cma.j.issn.1674-392X.2011.04.002.
5 郑亚杰,田文,丁国飞,等.污染环境下新型复合补片和生物补片修补犬腹壁缺损的比较研究.军医进修学院学报,2012,33:634-637.
6 郭盛旗.人工材料聚丙烯补片在修补腹壁切口疝中的应用. 中国组织工程研究与临床康复,2010,14:8881-8884.
7 徐祥,吕大伦.脱细胞真皮基质临床研究及应用进展.临床医学工程,2014,21:396-398. DOI:10.3969/j.issn.1674-4659.2014.03.0396.
8 刘飞德,李基业,姚胜,等.脱细胞真皮基质修补腹股沟疝.中国组织工程研究与临床康复,2011,15:4743-4746.
9 Ge L,Zheng S, Wei H.Comparison of histological structure and biocompatibility between human acellular dermal matrix(ADM) and porcine ADM.Burns,2009,35:46-50.DOI: 10.1016/j.burns.2008.05.007.
10杨硕,申英末,钟杏霞,等.感染型猪腹壁切口疝模型的建立和聚丙烯复合脱细胞基质材料新型补片耐受感染能力的实验研究.中华疝和腹壁外科杂志:电子版,2017,8:403-408.DOI:10.3877/cma.j.issn.1674-392X.2014.05.002.
11Beale EW, Hoxworth RE, Livingston EH, et al. The role of biologic mesh in abdominal wall reconstruction: a systematic review of the current literature. Am J Surg,2012,204:510-517. DOI: 10.1016/j.amjsurg.2012.03.009.
Experimentalassessmentoftheresistanceofacellulartissuematrixmeshagainstinfectionforinfectedorcontaminatedabdominalwalldefectinrats
LiYue*,LiaoZhiwei,HuangQi,ZhouYuanhang,TangRui,DongJian.
*DepartmentofGeneralSurgery,BaoshanBranchofHuashanHospital,FudanUniversity,Shanghai200431,China
LiaoZhiwei,Email:rhyylzw@hotmail.com
ObjectiveTo investigate the resistance of human acellular tissue matrix mesh against infection for infected or contaminated abdominal wall defect in rats.MethodsA total of 61 rats were randomly divided into clean group (group A,n=20), contaminated group (group B,n=20) and infected group (group C,n=20). All rats underwent total abdominal wall muscle resection to make the abdominal wall defect model. Additionally, in group B, we used Escherichia coli intestinal juice to contaminate the abdominal wall and patches, and in group C, the colon was incised longitudinally for 0.3 cm to establish infected model. The abdominal defect was then closed with acellular tissue matrix. The healing process of abdominal incision, and the mesh infection state were observed on the day 7 and day 14 after operation, and the specimens were obtained for pathological examination.ResultsFour rats died during the first 7 days from diffused peritonitis in group C, and no deaths occurred in group A and group B. Seven days after operation, the wound infection rate was significantly higher in groups B and C than in group A (P=0.004), but on the day 14, there was no statistically significant difference among three groups. Pathological examination suggested that the score of inflammatory reaction was higher in group C 7 days after operation, and the scores of proliferating fibroblasts and revascularization showed no significant difference among three groups.ConclusionsIn terms of the resistance against infection, the acellular tissue matrix mesh was feasible for primary closure of contaminated and infected abdominal wall defects. The potential mechanism may include superior inflammatory cell migration and rapid neovascularization.
Contamination; Infection; Abdominal defect; Acellular tissue matrix
上海市宝山区科委基金项目(2012-E-28)
200431 上海,复旦大学附属华山北院宝山分院普外科(李玥、廖芝伟、黄琦、周远航、董建);同济大学附属东方医院疝与腹壁外科(汤睿)
廖芝伟,Email:rhyylzw@hotmail.com
R657.3
A
10.3969/j.issn.1003-5591.2017.05.020
2017-02-18)

