力与炎症因子对牙周膜细胞破骨调控因子表达的影响
张华菁,李盛楠,徐晓南,张 丁
1中国医学科学院 北京协和医学院 北京协和医院口腔科,北京 100730 2山东省烟台市口腔医院正畸科,山东烟台 264000
·论著·
力与炎症因子对牙周膜细胞破骨调控因子表达的影响
张华菁1,2,李盛楠1,徐晓南1,张 丁1
1中国医学科学院 北京协和医学院 北京协和医院口腔科,北京 1007302山东省烟台市口腔医院正畸科,山东烟台 264000
目的观察力信号和炎症因子在牙周膜细胞向破骨细胞分化过程中对功能蛋白表达的影响。方法收集因正畸治疗需要拔除的无龋前磨牙,体外培养人牙周膜细胞,分别对其施加5%基底型变量的周期性牵张力和白细胞介素(IL)- 1β、- 6、- 23和肿瘤坏死因子(TNF)α等炎症因子刺激,Western blot检测施加刺激0、2、4、8、12、24 h后骨代谢相关调控因子骨保护素(OPG)和细胞因子κB受体激动剂配体(RANKL)的蛋白表达情况。结果炎症因子对牙周膜细胞破骨向因子表达有促进作用,而周期性牵张力能够抑制破骨调控因子的表达,两者共同作用时破骨向因子呈现高表达状态。结论炎症因子对破骨向调控因子有促进作用,而周期性牵张力抑制破骨的作用无法抵消这一过程。
人牙周膜细胞;力信号;炎症因子;破骨调控因子
牙周膜细胞能够感受力学刺激,在正畸力的作用下,分泌多种细胞因子和生长因子,这些力学信号转化而来的生物信号可进一步传递给骨细胞、成骨细胞、破骨细胞前体,引起骨形成或者骨吸收。骨吸收主要由破骨细胞完成,破骨细胞是由造血系统的单核巨噬细胞融合而成,目前已知影响成骨和破骨活动的细胞因子都是通过 骨保护素(osteoprotegerin,OPG)和细胞因子κB受体激动剂配体(receptor activated nuclear factor κB ligand,RANKL)这一对蛋白来影响破骨细胞生成,进而影响骨代谢。RANKL能与破骨细胞上的细胞因子κB受体激动剂受体(receptor activated nuclear factor κB,RANK)结合,激活破骨细胞的骨吸收作用;OPG则能够竞争性结合RANKL,阻断RANKL与RANK的结合,从而抑制破骨细胞的破骨过程。因此OPG/RANKL的比值越大即意味着破骨功能受到抑制,比值越小破骨作用越活跃。力与炎症对牙周组织的成骨和破骨作用是相反的,但两者同时存在的效果及力是否可以抵消炎症因子对牙周骨组织的破坏作用目前尚不清楚。本研究通过对炎症环境中人牙周膜细胞(human periodontal ligament cell,hPDLC)施加周期性牵张力,观察了其在不同时间内破骨相关信号因子的表达情况,以期探索牙周炎对正畸治疗的影响。
材料和方法
hPDLC的制备采用常规组织块法进行原代培养,取新鲜离体牙,刮取根中2/3牙周膜组织,置于装有培养液的培养瓶中,在5% CO2、37 ℃孵箱中培养。7~10 d后细胞贴壁,漂洗去除残留组织,培养、传代、留取待用。实验用hPDLC取自2014年3月至6月在北京协和医院口腔科接受拔牙矫治的13名16~30岁正畸患者拔除的20颗健康前磨牙。本研究经北京协和医院伦理委员会批准,所有患者均签署知情同意书。
hPDLC的传代和培养采用α-MEM培养基(Thermo Scientific,美国),内加10%FBS(Invitrogen,美国)和1%双抗(Invitrogen,美国)培养,待细胞长满瓶底80%~90%时即可传代。最终应用于实验的细胞代数为4~7代。
细胞基底拉伸膜的准备配制聚二甲基硅氧烷(polydimethylsiloxane,PDMS)胶(Sylfard184,Dowcorning),将制成的PDMS膜进行亲水化处理后,hPDLC按每条2.5×105个接种于PDMS膜。
hPDLCs形态学观察在Leica倒置相差显微镜(Leica,德国)下(200×)观察hPDLC、传代细胞及复苏细胞的生长情况和形态特征。
周期性牵张力体外细胞加载实验系统采用周期性拉力法对细胞加载机械力。当hPDLC在PDMS基底膜上生长至75%~85%融合时,平整无张力地固定于加力装置两端夹槽间。在培养槽内加培养基至没过PDMS膜,盖防护盖。装置移入37 ℃、5%CO2饱和湿度培养箱(图1)。对细胞施加基底变形量为5%、周期为3 min/cycle的牵张力0、2、4、8、12、24 h,每个时间点各重复3次。对照组细胞种于相同规格的PDMS膜上置于培养箱中不施加任何力。
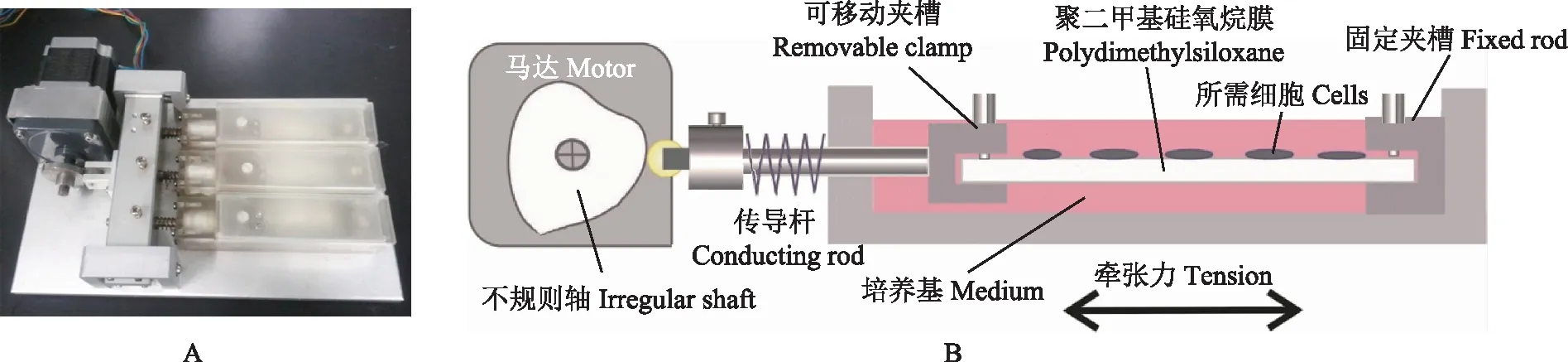
图1 体外细胞周期性牵张力加载实验系统(A)及其示意图(B)
Fig1Invitrocell periodic tension load test system(A)and its schematic diagram(B)
炎症因子刺激PDMS膜上细胞长满至80%左右时更换新培养液,分别加入含有10 ng/ml肿瘤坏死因子(tumor necrosis factor,TNF)-α、10 ng/ml白细胞介素(interleukin,IL)- 1β、20 ng/ml IL- 6和20 ng/ml IL- 23的α-MEM培养基对hPDLC进行刺激。
Westernblot法检测蛋白浓度将刺激后的hPDLC在预冷的PBS中清洗3次,采用细胞裂解液试剂盒提取各组细胞总蛋白并使用BCA定量法检测蛋白浓度,按照BCA法所测得的蛋白浓度将蛋白抽提液配成相同的蛋白浓度,混合1×SDS Loading buffer,95 ℃加热5 min,制备蛋白样品冷却后备用。配制10%分离胶、5%浓缩胶和1×SDS-PAGE电泳缓冲液,将冷却的蛋白样品上样电泳,电压60 V,约30 min后溴酚蓝进入分离胶,调整电压至110V,继续电泳约1 h。在转移电泳槽(200 mA,2 h)将电泳胶的蛋白转移至PVDF膜上。PVDF膜置于封闭液(康为世纪,中国)中,摇床上室温孵育1 h,封闭后分别孵育一抗[Tubulin鼠单抗-辣根过氧化物酶(horseradish peroxidase,HRP)(康为世纪,中国):1∶8000;Anti-OPG antibody(Abcam,美国):1∶1000;Anti-RANKL antibody(Abcam,美国):1∶250],4 ℃过夜,一抗孵育结束TBST清洗3次,放于含有1∶10 000辣根过氧化酶标记的IgG的封闭液中,室温下轻摇孵育2 h。TBST洗脱二抗,将漂洗好的PVDF膜置于暗盒的薄膜间,将混合好的ECL液均匀滴加于干净的PVDF膜上,3 min后吸去混合液,覆盖感光胶片,在暗盒中曝光。采用Image-Pro Plus分析软件对目的蛋白和内参蛋白条带进行灰度分析,计算目的蛋白灰度值与内参灰度值之间的比值。
统计学处理采用SPSS 19.0统计软件,实验重复3次,所有实验数据均以均数±标准差表示,组间均数比较采用单因素方差分析,组间相关性比较采用Spearman相关分析,P<0.05为差异有统计学意义。
结 果
hPDLC的形态学观察体外培养的hPDLC贴壁生长,实验所用3~7代细胞形态正常,生长速度稳定,细胞基本呈梭形,胞浆均匀,胞体丰满,胞核近圆形,细胞与细胞间有突触相互联系(图2)。
炎症因子能够增强hPDLC破骨向调控因子的表达分别采用含10 ng/ml TNF-α、10 ng/ml IL- 1β、20 ng/ml IL- 6、20 ng/ml IL- 23的培养基对hPDLC进行刺激,Western blot检测结果显示,在TNF-α作用下,OPG蛋白的表达在8 h开始有显著性下降,而RANKL则稳定上升;IL- 1β作用使OPG表达在4 h的高峰期后显著下降,RANKL表达在4 h出现小高峰,之后恢复平稳,但OPG/RANKL的比值在4 h后持续降低;IL- 6的作用使得OPG表达表现为初期上升,4 h开始持续下降,至24 h时明显低于起始水平,RANKL则表现为稳定的高水平表达;IL- 23可使OPG的表达整体呈现下降趋势,RANKL表达变化不明显,OPG/RANKL比值表现为平稳下降状态(图3)。
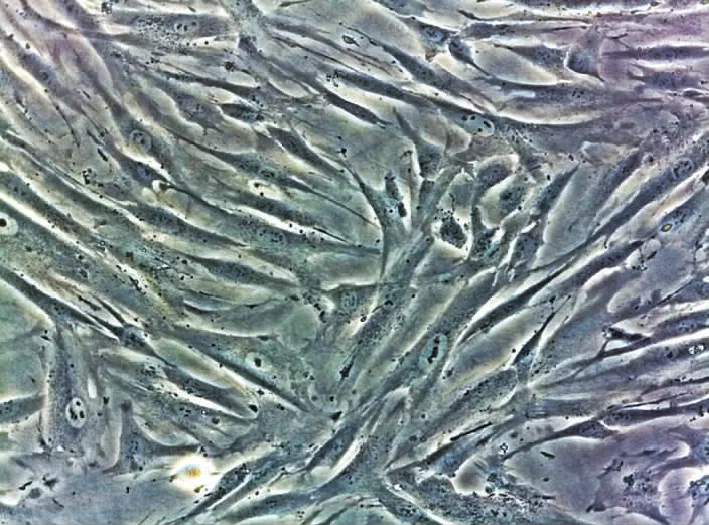
图2 倒置相差显微镜下人牙周膜细胞形态(×200)
Fig2 Magnification of human periodontal ligament cells under the inverted phase contrast microscope(×200)
机械负载能够抑制hPDLC的破骨向调控因子表达对hPDLC施加基底形变5%的持续周期性牵张力,在0、2、4、8、12、24 h节点分别检测OPG、RANKL的表达情况,结果显示两种蛋白均在加力后的表达明显高于对照组(P均<0.05)。OPG在2 h起即开始稳定高表达,至12 h有小幅度回落,24 h时仍明显高于0 h水平;RANKL表达在2 h时高表达,之后呈现下降趋势,至12、24 h低于0 h水平;OPG/RANKL值总体呈上升趋势,且高于不加力的对照组(图4)。
机械负载与炎症因子共同作用对hPDLC破骨向调控因子表达的影响在使用含有10 ng/ml TNF-α、10 ng/ml IL- 1β、20 ng/ml IL- 6、20 ng/ml IL- 23的培养基对hPDLC进行刺激的同时,对其施加基底形变5%的持续周期性牵张力,在相同的时间点对OPG、RANKL蛋白表达进行检测。结果显示,TNF-α组OPG蛋白的表达受到明显抑制;RANKL表达变化不明显;OPG/RANKL比值持续下降,整体趋势与不加力组差异无统计学意义(P>0.05)。IL- 1β组OPG在2 h的小高峰后持续低水平表达;RANKL表达水平先呈降低趋势,4 h后缓慢升高;OPG/RANKL比值小幅度持续降低,与不加力组情况基本符合。IL- 6组OPG表达在明显下降后有小幅度波动,整体仍呈现下降趋势;RANKL表达则一路走高;OPG/RANKL比值在低水平小幅波动。IL- 23组OPG表达逐渐下降;RANKL表达小幅度升高;二者比值出现明显的下降趋势,与不加力组表现一致(图5)。

TNF-α:肿瘤坏死因子-α;IL:白细胞介素;OPG:骨保护素;RANKL:细胞因子κB受体激动剂配体;与0 h比较,aP<0.05;与空白对照组比较,bP<0.05
TNF-α:tumor necrosis factor-α;IL:interleukin;OPG:osteoprotegerin;RANKL:receptor activated nuclear factor κB ligand;aP<0.05 compared with 0 h;bP<0.05 compared with blank control group
A.OPG;B.RANKL;C.OPG/RANKL
图3 不同炎症因子作用下破骨相关调控因子表达随时间变化趋势
Fig3 Change of the expressions of osteoclastogenesis regulators under the action of different inflammatory factors
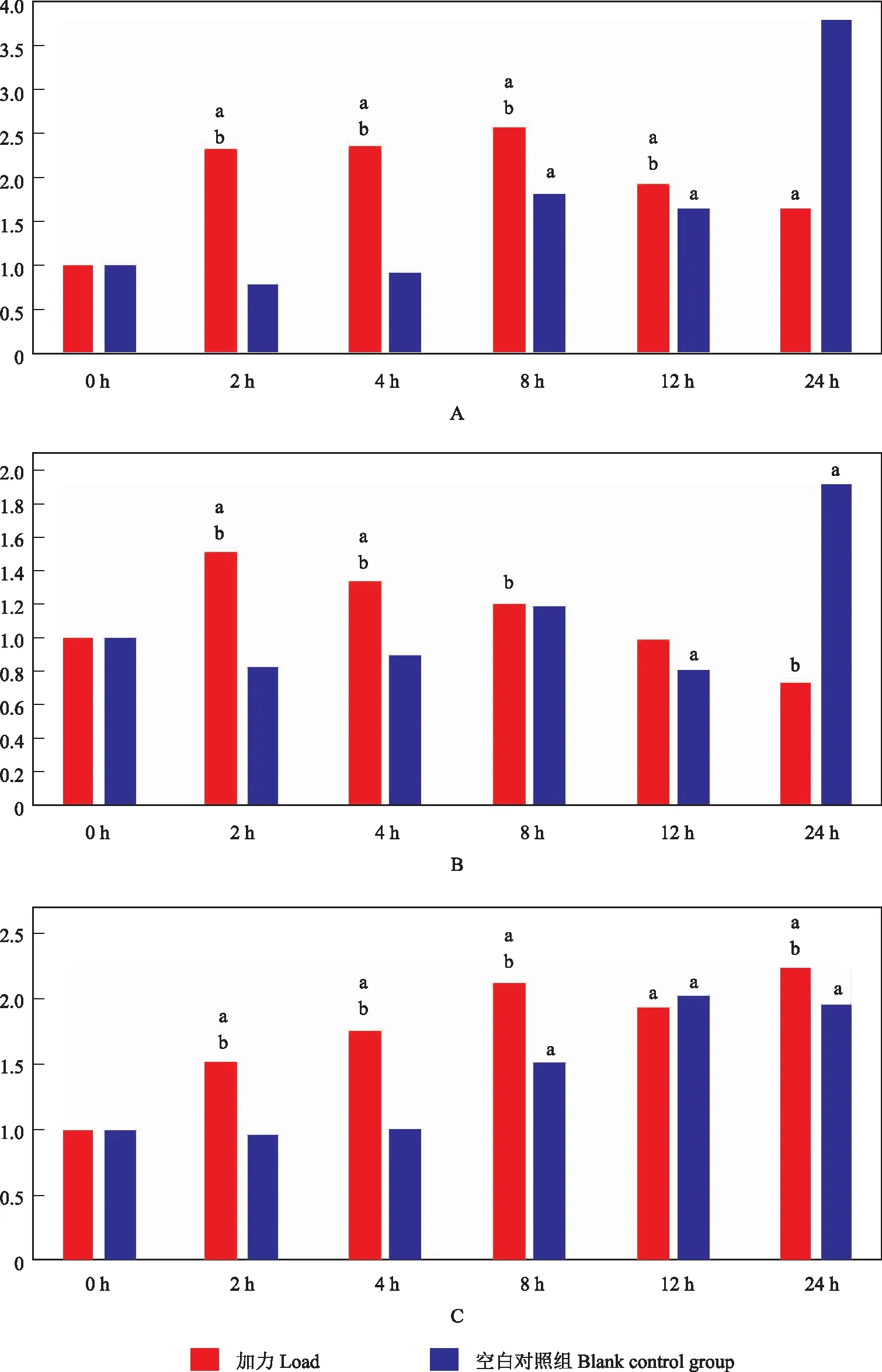
与0 h比较,aP<0.05;与空白对照组比较,bP<0.05
aP<0.05 compared with 0 h;bP<0.05 compared with blank control group
A.OPG;B.RANKL;C.OPG/RANKL
图4 周期性牵张力作用下破骨相关调控因子表达随时间变化趋势
Fig4 Change of osteoclastogenesis regulators under the action of cyclic-tension force
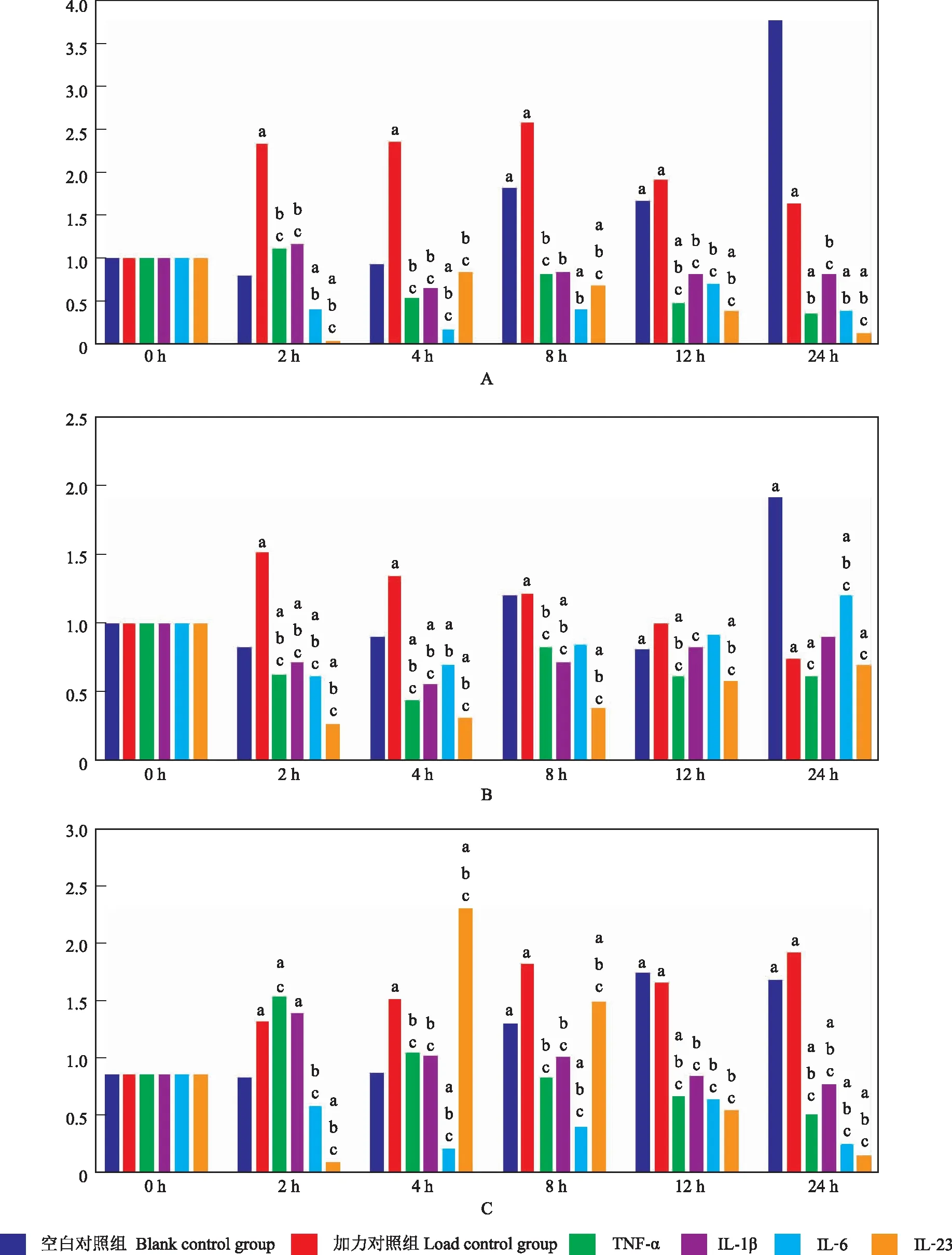
与0 h比较,aP<0.05;与空白对照组比较,bP<0.05;与加力对照组比较,cP<0.05
aP<0.05 compared with 0 h;bP<0.05 compared with blank control group;cP<0.05 compared with load control group
A.OPG;B.RANKL;C.OPG/RANKL
图5 力与炎症因子共同作用下破骨相关调控因子表达随时间的变化趋势
Fig5 Change of the expressions of osteoclastogenesis regulators under the action of cyclic-tension force and inflammatory factors
讨 论
OPG和RANKL对破骨细胞生成起决定性作用[1- 6]。RANKL与其受体RANK的结合能够促进破骨前体细胞增殖并使其活化未成熟的破骨细胞。骨保护素OPG能竞争性结合RANKL,阻断RANKL与RANK的结合,因此又被称为破骨细胞生成抑制因子,对破骨作用起负调节作用。组织中OPG/RANKL的比值升高即意味着破骨作用减弱,骨丧失减少。
以往研究显示,在类风湿性关节炎(rheumatoid arthritis,RA)中,炎症因子作为主要因素能够加强破骨,导致骨量丧失[7]。TNF-α可影响间充质干细胞(mesenchymal stem cell,MSCs)的成骨分化;RA患者或动物的MSCs成骨分化能力降低[8]。此外,IL- 1和TNF-α能够抑制骨髓来源MSCs的成脂分化[9]。牙周膜干细胞具有明显的组织再生潜能,炎症微环境并不能影响干细胞标记物的表达和干细胞数目,但炎症环境中的牙周膜干细胞却表现出比正常环境下干细胞更低的多能分化潜能和更高的增殖潜能,这表明慢性炎症微环境所产生的多种细胞因子能够通过多种调节机制来控制干细胞命运和特征。研究发现,IL- 1β、IL- 6和TNF-α的存在能够对正常骨形成的分化和增殖方面产生深远影响[10]。因为IL- 1β、IL- 6和TNF-α是主要的炎症因子,其对来自健康牙周膜的MSCs增殖和功能具有本质影响。IL- 23是IL- 12家族中的一员,该家族的细胞因子具有很多相同的生物学功能[11]。IL- 23的来源包括多种类型的抗原呈递细胞,如活化的树突状细胞、单核细胞、巨噬细胞及基质成纤维细胞[12- 16]。最近有研究表明,人类IL- 23水平的升高与几种炎性疾病有关,包括炎性肠疾病、牛皮癣、RA及牙周炎[17- 18]。RA曾被认为是一个显示牙槽骨破坏的经典模型,利用基因敲除的小鼠实验模型已证实IL- 23在RA的发病机制中发挥核心作用[19]。IL- 23可通过促进Th17细胞存活和维持以及刺激中性粒细胞产生IL- 17,刺激髓样细胞和RA滑膜成纤维细胞产生IL- 1β、TNF- α和IL- 6来介导慢性炎症,这种细胞因子在可能依赖Th1和TH17细胞之间平衡的疾病发展和炎症过程中起到直接的作用。也有实验证明,成纤维细胞对IL- 23应答所产生的RANKL引起破骨细胞前体细胞向破骨细胞的分化[20]。有人研究了炎症因子刺激后牙周膜细胞中β-catenin的表达变化,结果提示炎症因子能够促进β-catenin分泌,并通过β-catenin的累积抑制牙周膜干细胞的成骨分化,促进其增殖作用[21]。另外,内源性的糖皮质激素信号是Wnt通路的上游信号,炎症因子可以减少内源性的糖皮质激素信号,通过干扰Wnt信号通路来影响成骨细胞的分化和功能。本研究结果显示,在炎症因子TNF-α、IL- 1β、IL- 6和IL- 23存在的情况下,破骨抑制调控因子OPG的表达受到抑制,而RANKL表达显著升高,与以往研究结果一致。推测炎症因子TNF-α一方面通过刺激T细胞产生巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)[22],M-CSF作用于成骨细胞或者其他细胞使其分泌RANKL,RANKL的增加促进了破骨细胞的分化和成熟[23];另一方面TNF-α可直接作用于破骨细胞前体细胞,刺激破骨细胞的生成[24- 25]。与TNF-α不同,IL- 1β不能直接促进破骨细胞前体细胞的分化,其主要作用是延长破骨细胞寿命,从而增加其吸收骨的能力。此外,TNF-α通过抑制TGFβ进而抑制BMPs和Smad信号,抑制早期进入成骨细胞谱系的基质定型和后期的成骨细胞分化。
机械负载对于hPDLC的破骨抑制作用已经在本课题组以往的研究中得以证实[26]。单纯力的作用可以抑制牙周膜细胞向破骨细胞分化;周期性牵张力可改变破骨细胞相关蛋白OPG、RANKL的产生,有利于诱导破骨细胞生成。早期即有研究证实,在正畸加力过程中受拉力侧OPG表达明显增加而RANKL表达则受到抑制[5- 6]。本课题组以往研究表明,间隙连接蛋白Cx43参与了周期性拉力刺激下牙周膜细胞中OPG和RANKL的表达,周期性牵张力能够刺激Cx43表达增加,随着Cx43的表达增加,RANKL表达量开始逐渐下降[6]。与此一致的是,本研究结果显示,5%周期性牵张力可以使OPG的表达有大幅度提高,RANKL的表达在初期的应激性增长之后开始出现下降趋势。在力与炎症因子同时存在的条件下,炎症因子发挥主要作用,在炎症因子的刺激下,周期性牵张力原本的促成骨作用并不能得以体现,机械负载对于破骨因子的抑制作用不足以改变炎症因子带来的促破骨作用。
Cbfa1是间充质细胞向成骨细胞分化的特异性转录因子[27],本课题组以往研究结果显示,机械作用能够升高Cbfa1的mRNA和蛋白表达水平[5]。以上研究提示hPDLC在机械力作用下向破骨细胞分化受到抑制,并且通过NF-κB通路对炎性因子基因表达进行调控。
机械负载与炎症因子同时存在的情况,本研究结果与以往研究有相当的差异。在钙信号方面的研究显示低强度牵张力可以起到类似抗炎的作用[28- 30]。也有直接证据证明在炎性因子存在的情况下,力值大小可以改变炎性因子对局部骨改建的调节方向。本研究结果则显示,低强度(5%)牵张力对成骨的促进作用并不能抵消炎症因子的破骨作用。提示牙周炎患者在有正畸治疗需求时,必须先接受牙周治疗,在炎症得以控制,牙周状况稳定的条件下,才能开始考虑进行正畸治疗。这与临床上一贯的治疗原则相符。根据以上研究,炎症因子主要通过刺激T细胞分泌M-CSF,M-CSF刺激成骨细胞等多种细胞释放RANKL,RANKL与破骨细胞前体细胞表面的RANK受体结合激活NF-κB通路,促进破骨细胞生成和活化其功能,从而表现出破骨向作用;低强度牵张力则通过去除内源性IL- 1β等对破骨相关因子的促进作用,降低破骨相关因子的蛋白表达,刺激MSCs来源的hPDLC向破骨方向分化。由此我们推测,牵张力对破骨方向的抑制程度有限,在炎症微环境中,低强度牵张力所产生的抑制破骨作用微不足道,不足以与外源性炎症因子所导致的促破骨作用相抗衡。因此,炎症因子对破骨向调控因子有促进作用,而周期性牵张力的作用无法抵消这一过程。
综上,本研究结果显示,在临床中力与牙周炎症同时存在时,牙周骨组织的改建更倾向于炎症因子的作用而表现骨丧失。
[1] Gluhak-Heinrich J,Gu S,Pavlin D,et al. Mechanical loading stimulates expression of connexin 43 in alveolar bone cells in the tooth movement model [J].Cell Commun Adhes,2006,13(1- 2):115- 125. doi:10.1080/15419060600634619.
[2] Garlet TP,Coelho U,Repeke CE,et al. Differential expression of osteoblast and osteoclast chemmoatractants in compression and tension sides during orthodontic movement [J].Cytokine,2008,42(3):330- 335. doi:10.1016/j.cyto. 2008. 03.003.
[3] Han XL,Meng Y,Kang N,et al. Expression of osteocalcin during surgically assisted rapid orthodontic tooth movement in beagle dogs [J].J Oral Maxillofac Surg,2008,66(12):2467- 2475. doi:10.1016/j.joms.2008.06.087.
[4] Walker CG,Ito Y,Dangaria S,et al. RANKL,osteopontin,and osteoclast homeostasis in a hyperocclusion mouse model [J].Eur J Oral Sci,2008,116(4):312-318. doi:10.1111/j.1600- 0722.2008.00545.x.
[5] Yang YQ,Li XT,Rabie AB,et al. Human periodontal ligament cells express osteoblastic phenotypes under intermittent force loadinginvitro[J].Front Biosci,2006,11(1):776- 781.
[6] 李盛楠,霍波,张丁. 定量观察力值对人牙周膜细胞骨改建相关细胞因子表达的影响[J].中华口腔正畸学杂志,2015,22(2):100- 103. doi:10.3760/cma.j.issn. 1674- 5760.2015.02.009.
[7] Pope RM,Shahrara S. Possible roles of IL- 12-family cytokines in rheumatoid arthritis[J].Nat Rev Rheumatol,2013,9(4):252- 256. doi:10.1038/nrrheum.2012.170.
[8] Kotake S,Nanke Y. Effect of TNFα on osteoblastogenesis from mesenchymal stem cells[J].Biochim Biophys Acta,2014,1840(3):1209- 1213. doi:10.1016/j.bbagen. 2013.12.013.
[9] Zhu L,Wu Y,Wei H,et al.Up-regulation of IL- 23 p19 expression in human periodontal ligament fibroblasts by IL- 1b via concurrent activation of the NF-κB and MAPKs/AP- 1 pathways[J].Cytokine,2012,60(1):171- 178. doi:10.1016/j.cyto.2012.05.016.
[10] Liu W,Konermann A,Guo T,et al.Canonical Wnt signaling differently modulates osteogenic differentiation of mesenchymal stem cells derived from bone marrow and from periodontal ligament under inflammatory conditions[J].Biochim Biophys Acta,2014,1840(3):1125- 1134. doi:10.1016/j.bbagen.2013.11.003.
[11] Hunter CA. New IL-12-family members:IL-23 and IL-27,cytokines with divergent functions[J].Nat Rev Immunol,2005,5(7):521- 531. doi:10.1038/nri1648.
[12] Carmody RJ,Ruan Q,Liou HC,et al. Essential roles of c-Rel in TLR-induced IL- 23 p19 gene expression in dendritic cells[J].J Immunol,2007,178(1):186- 191.
[13] Dobreva ZG,Stanilova SA,Miteva LD. Differences in the inducible gene expression and protein production of IL-12 p40,IL- 12 p70 and IL- 23:involvement of p38 and JNK kinase pathways[J].Cytokine,2008,43(1):76- 82. doi:10.1016/j.cyto.2008.04.003.
[14] Kim HR,Cho ML,Kim KW,et al. Up-regulation of IL- 23 p19 expression in rheumatoid arthritis synovial fibroblasts by IL- 17 through PI3-kinase-,NF-kappaB-and p38 MAPK-dependent signaling pathways[J].Rheumatology(Oxford),2007,46(1):57- 64. doi:10.1093/rheumatology/kel159.
[15] Yang CS,Song CH,Lee JS,et al. Intracellular network of phosphatidylinositol 3-kinase,mammalian target of the rapamycin/70 kDa ribosomal S6 kinase 1,and mitogen-activated protein kinases pathways for regulating mycobacteria-induced IL- 23 expression in human macrophages[J].Cell Microbiol,2006,8(7):1158- 1171. doi:10.1111/j.1462- 5822.2006.00699.x.
[16] Zhang Z,Andoh A,Yasui H,et al. Interleukin-1beta and tumor necrosis factor-alpha upregulate interleukin- 23 subunit p19 gene expression in human colonic subepithelialmyofibroblasts[J].Int J Mol Med,2005,15(1):79- 83.
[17] Duvallet E,Semerano L,Assier E,et al. Interleukin- 23:a key cytokine in inflammatory diseases[J].Ann Med,2011,43(7):503- 511. doi:10.3109/07853890.2011.577093.
[18] Ohyama H,Kato-Kogoe N,Kuhara A,et al. The involvement of IL- 23 and the Th17 pathway in periodontitis[J].J Dent Res,2009,88(7):633- 638. doi:10.1177/0022034509339889.
[19] Murphy CA,Langrish CL,Chen Y,et al. Divergent pro-and anti-inflammatory roles for IL- 23 and IL- 12 in joint autoimmune inflammation[J].J Exp Med,2003,198(12):1951- 1957. doi:10.1084/jem.20030896.
[20] Li X,Kim KW,Cho ML,et al. IL-23 induces receptor activator of NF-κB ligand expression in fibroblast-like synoviocytes via STAT3 and NF-κB signal pathways[J].Immunol Lett,2010,127(2):100- 107. doi:10.1016/j.imlet.2009.10.012.
[21] Liu N,Shi S,Deng M,et al. High levels of β-cateninsignaling reduce osteogenic differentiation of stem cells in inflammatory microenvironments through inhibition of the noncanonical Wnt Pathway[J].J Bone Miner Res,2011,26(9):2082- 2095. doi:10.1016/j.imlet.2009.10.012.
[22] Lam J,Takeshita S,Barker JE,et al. TNF-alpha induces osteoclastogenesis by direct stimulation of macrophages exposed to permissive levels of RANK ligand[J].J Clin Invest,2000,106(12):1481- 1488. doi:10.1172/JCI11176.
[23] Boyle WJ,Simonet WS,Lacey DL. Osteoclast differentiation and activation[J].Nature,2003,423(6937):337- 342. doi:10.1038/nature01658.
[24] Kobayashi K,Takahashi N,Jimi E,et al. Tumor necrosis factor alpha stimulates osteoclast differentiation by a mechanism independent of the ODF/RANKL-RANK interaction[J].J Exp Med,2000,191(2):275- 286.
[25] Azuma Y,Kaji K,Katogi R,et al. Tumor necrosis factor-alpha induces differentiation of and bone resorption by osteoclasts[J].J Biol Chem,2000,275(7):4858- 4864.
[26] Li P,Liu C,Hu M,et al.Fluid flow-induced calcium response in osteoclasts:signaling pathways[J].Ann Biomed Eng,2014,42(6):1250- 1260. doi:10.1007/s10439- 014- 0984- x.
[27] Ducy P. Cbfa1:a molecular switch in osteoblast biology[J].Dev Dyn,2000,219(4):461- 471.
[28] Wong BR,Josien R,Choi Y. TRANCE is a TNF family member that regulates dendritic cell and osteoclast function [J].J Leukoc Biol,1999,65(2):715- 724.
[29] Huo B,Lu XL,Hung CT,et al.Fluid flow induced calcium response in bone cell network [J].Cell Mol Bioeng,2008,1(1):58- 66.
[30] Huo B,Lu XL,Costa KD,et al. An ATP-dependent mechanism mediates intercellular calcium signaling in bone cell network under single cell nanoindentation [J].Cell Calcium,2010,47(3):234- 241. doi:10.1016/j.ceca.2009.12.005.
EffectsofForceandInflammatoryFactorsontheExpressionsofOsteogenesisRegulatorsinHumanPeriodontalLigamentCells
ZHANG Huajing1,2,LI Shengnan1,XU Xiaonan1,ZHANG Ding1
1Department of Stomatology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China2Department of Orthodontic,Yantai Stomatological Hospital,Yantai,Shandong 264000,China
ZHANG Ding Tel:010- 69151740,E-mail:dingz77@sina.com
ObjectiveTo observe the effects of force signals and inflammatory cytokines on the expressions of functional proteins during the differentiation of periodontal ligament cells(PDLCs) into osteoclasts.MethodsThe caries-free premolars that needed to be removed for orthodontic treatment were collected,human periodontal ligament cells were culturedinvitro.Human PDLCs were exposed to inflammatory cytokines including interleukin(IL)- 1β,- 6,- 23,and tumor necrosis factor alpha(TNF-α). Cyclicmechanical tension with a maximum 5% elongation for different durations(0,2,4,8,12,and 24 hours) were applied. Then the expressions of signaling molecules related to osteoclastogenesis(OPG) and receptor activated nuclear factor κB ligand(RANKL) were determined at protein levels by Western blotting.ResultsInflammatory cytokines improved the expressions of osteoclastgenesis regulators in hPDLCs,while cyclic-tension force reduced their expressions. However,the combined effect of inflammatory cytokines and cyclic-tension force resulted in high expressions of osteoclastgenesis regulators.ConclusionInflammatory cytokines can promote the expressions of the osteoclastgenic factors,which can not be offset by cyclic-tension force.
human periodontal ligament cell;force signal;inflammatory cytokines;osteoclastgenetic
国家自然科学基金(31371389)Supported by the National Natural Sciences Foundation of China(31371389)
张 丁 电话:010- 69151740,电子邮件:dingz77@sina.com
R78
A
1000- 503X(2017)05- 0602- 09
10.3881/j.issn.1000- 503X.2017.05.002
ActaAcadMedSin,2017,39(5):602-610
2016- 07- 07)

