大鼠脊髓神经元缺氧复氧损伤中钙敏感受体对其凋亡的影响及意义
何 炜,孙继芾,蒋润宇,张志坚,陈 谦,黄永辉
1江苏大学附属医院骨科,江苏镇江 212001 2江苏大学医学院基础与临床医学研究中心,江苏镇江 212013
·论著·
大鼠脊髓神经元缺氧复氧损伤中钙敏感受体对其凋亡的影响及意义
何 炜1,孙继芾1,蒋润宇1,张志坚2,陈 谦2,黄永辉1
1江苏大学附属医院骨科,江苏镇江 2120012江苏大学医学院基础与临床医学研究中心,江苏镇江 212013
目的探究大鼠脊髓神经元缺氧复氧损伤中钙敏感受体对其凋亡的影响及意义。方法将新生SD大鼠脊髓神经元随机分为正常对照组、缺氧复氧组、激动剂(GdCl3)组和抑制剂(NPS- 2390)组4组。采用95%氮气通入置有细胞培养板的密闭通气盒中15 min,37 ℃培养箱内培养1 h,再用含2%B27、10%胎牛血清的Neurobasol-A液培养细胞24 h复制缺氧复氧模型。应用免疫荧光技术鉴定脊髓神经元并观察钙敏感受体的表达定位,Western blot法检测各组钙敏感受体及凋亡相关蛋白Caspase- 3、Bax、Bcl- 2的表达水平,激光共聚焦显微镜测定细胞内游离钙的变化,Tunel法观察各组细胞凋亡情况。结果缺氧复氧组的钙敏感受体(t=5.462,P=0.006)、细胞内游离钙(t=8.573,P=0.001)、细胞凋亡(t=4.899,P=0.008)、Caspase- 3(t=5.118,P=0.007)和Bax(t=10.930,P=0.001)表达水平均明显高于对照组,激动剂组的钙敏感受体(t=4.975,P=0.008)、细胞内游离钙(t=4.899,P=0.008)、细胞凋亡(t=7.746,P=0.002)、Caspase- 3(t=4.776,P=0.009)和Bax(t=5.281,P=0.006)表达水平均明显高于缺氧复氧组,抑制剂组的钙敏感受体(t=3.674,P=0.021)、细胞内游离钙(t=3.846,P=0.018)、细胞凋亡(t=4.281,P=0.013)、Caspase- 3(t=3.521,P=0.024)和Bax(t=3.473,P=0.026)表达水平均明显低于缺氧复氧组;缺氧复氧组的Bcl- 2表达水平明显低于对照组(t=6.242,P=0.003),激动剂组明显低于缺氧复氧组(t=3.028,P=0.004),抑制剂组明显高于缺氧复氧组(t=2.840,P=0.047)。结论在缺氧复氧损伤过程中,钙敏感受体表达增多,细胞内游离钙增加,脊髓神经元凋亡增多。
缺氧复氧;钙敏感受体;凋亡;脊髓神经元
脊髓缺血再灌注损伤是指在短时间脊髓血供中断,一定时间内恢复血供,在原有缺血性损害基础上发生更严重的损伤[1]。钙超载是引起缺血再灌注损伤的主要机制。钙离子在正常生理情况下是脊髓神经元的重要信号分子,调节其诸多功能,而在缺血再灌注损伤中,钙离子在胞内积聚,往往导致脊髓神经元损伤甚至死亡[2]。关于诱发脊髓神经元中钙超载的研究目前甚少,其中Wang等[3]已证实钙敏感受体(calcium-sensing receptor,CaSR)能介导心肌细胞内钙浓度的升高,引起钙超载,最终导致细胞凋亡[4]。本研究通过体外培养脊髓神经元,模拟缺氧/复氧损伤模型,检测大鼠脊髓神经元中是否存在CaSR及其表达水平,探究CaSR表达增多是否诱发钙超载并引起神经元的凋亡,为进一步研究脊髓缺血再灌注损伤的发生机制提供依据。
材料和方法
材料出生1 d的新生SD大鼠由江苏大学动物中心提供[动物许可证号:SYXK(苏)2008- 0024];Neurobasal-A培养基、DMEM/F12、无糖DMEM、胎牛血清、胰蛋白酶、B27添加剂(美国Gibco公司),神经丝蛋白抗体NF200、Caspase- 3、Bax、Bcl- 2、羊抗兔二抗、羊抗鼠二抗、Cy3-羊抗兔二抗(武汉博士德生物科技),CaSR(英国Abcam公司),CaSR激动剂三氯化钆(GdCl3,上海紫一试剂厂),CaSR抑制剂NPS- 2390(美国Tocris公司),荧光染料Hoechst33258(碧云天生物公司);Tunel试剂盒(凯基生物),多聚赖氨酸、钙离子荧光探针(Fluo- 3/AM)(美国Sigma公司)。
新生大鼠脊髓神经元的培养在无菌条件下分离出新生1 d的SD大鼠脊髓,剥离脊膜和血管组织,剪碎后用0.125%的胰蛋白酶溶液37 ℃消化20 min,随后弃去消化液置于培养液(DMEM/F12+10%胎牛血清+2 mmol/L谷氨酰胺+100 U/ml氨苄西林+100 U/ml链霉素)中,再用巴式管吹打后用筛网制成细胞悬液,以6×105/ml的密度接种于预先用0.1 mg/ml多聚赖氨酸包被的6孔培养板。最后置于37 ℃、5%CO2饱和湿度的培养箱中培养。12 h后,将培养液更换为含有2%B27和10%胎牛血清的Neurobasal-A培养液(100 U/ml氨苄西林+100 U/ml链霉素)。细胞培养7~8 d后用于实验。
免疫荧光法鉴定神经元并观察CaSR的表达定位将培养板中的细胞用PBS轻微冲洗,4%多聚甲醛固定30 min,PBS洗3遍;1%Triton X- 100室温通透30 min,PBS洗3遍;滴加1%山羊血清(BSA)37 ℃封闭60 min;分别用神经丝蛋白(NF200)、CaSR抗体(1∶100)4 ℃孵育过夜;PBS洗3遍,荧光二抗(1∶200)湿盒中避光37 ℃孵育2 h,PBS洗3遍;Hoechst33258(1∶5000)避光孵育30 min,PBS洗3遍后用甘油封片,在荧光显微镜下采集图像。
细胞缺氧复氧模型的建立用无糖DMEM培养液替换正常培养液,置于密闭通气盒中,通入95%氮气15 min后,37 ℃培养箱内培养1 h,之后用正常培养液培养24 h后处理。
细胞分组将培养的神经元随机分成4组:(1)对照组:细胞不经任何处理;(2)缺氧复氧组:为缺血缺氧模型神经元;(3)激动剂组:复氧刚开始时加入400 μmol/L GdCl3;(4)抑制剂组:复氧刚开始时加入25 μmol/L NPS- 2390。
Westernblot检测CaSR、Caspase-3、Bax、Bcl-2蛋白的表达生长良好的神经元分组施加因素后去除培养液,用PBS洗3次,刮取细胞移入Eppendorf管并加入全细胞裂解液,冰上孵育10 min,4 ℃条件下12 000 r/min离心15 min,取上清。采用考马斯亮蓝法测定蛋白定量值。随后取30 μg蛋白样品于10% SDS-PAGE凝胶上分离蛋白质(80 V/30 min,120 V/60 min);使用Bio-Rad的标准湿式转膜装置,将蛋白转至PVDF膜上(350 mA,4 ℃转膜2 h);脱脂奶粉(TBST5%稀释)室温封闭1 h;分别用CaSR(1∶600),Caspase- 3、Bax、Bcl- 2(1∶300)4 ℃孵育过夜,洗膜后二抗(1∶8000)室温孵育1 h,TBST洗3次,最后曝光显色。
激光共聚焦检测细胞内游离钙浓度将分组处理后的细胞用PBS轻微冲洗,加入Fluo- 3/AM(10 μmol/L),37 ℃恒温箱中避光孵育60 min,PBS冲洗。在激光共聚焦显微镜下扫描细胞内荧光强度,激发波长为488 nm,探测波长为520 nm。分别取10个细胞记录其均值。
Tunel法检测细胞凋亡分组处理后的细胞用PBS轻微冲洗,4%多聚甲醛固定30min,PBS洗3次;1%TritonX- 100室温通透30min,PBS洗3次;滴加3%H2O2封闭液,室温封闭60min,PBS洗3次;每个样本滴加50μl标记预混液,37 ℃避光反应90min,PBS洗3次;DAB染色液室温显色10min,PBS洗3次;加入1%盐酸甲醇溶液分化5s,立即用蒸馏水冲洗;分别用70%、85%、95%、无水乙醇洗5min;晾干后加上中性甘油,光学显微镜下观察。
统计学处理采用SPSS17.0统计软件,数据以均数±标准差表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
脊髓神经元的鉴定及CaSR表达定位神经丝蛋白免疫荧光染色结果显示,脊髓神经元胞体及突起呈阳性染色。CaSR在脊髓神经元中表达,分布于神经元的胞质和突起部(图1)。

图1 神经丝蛋白(NF200)荧光染色(A)及钙敏感受体的表达定位(B)
Fig1 Fluorescent staining of neurofilament(NF200)(A)and expression and localization of calcium-sensing receptor(B)
CaSR的表达情况Western blot检测结果显示,正常脊髓神经元中有CaSR表达。对照组、缺氧复氧组、激动剂组和抑制剂组的CaSR表达水平分别为0.1733±0.0285、0.3867±0.0318、0.6133±0.0339和0.2612±0.0219,其中,缺氧复氧组明显高于对照组(t=5.462,P=0.006),激动剂组明显高于缺氧复氧组(t=4.975,P=0.008);抑制剂组明显低于缺氧复氧组(t=3.674,P=0.021)(图2)。
细胞内游离钙水平对照组、缺氧复氧组、激动剂组和抑制剂组的细胞内游离钙水平分别为256.3±57.7、633.3±33.3、1021.0±61.6和474.4±24.4,其中,缺氧复氧组明显高于对照组(t=8.573,P=0.001),激动剂组明显高于缺氧复氧组(t=4.899,P=0.008),抑制剂组明显低于缺氧复氧组(t=3.846,P=0.018)(图3)。

Mr:相对分子质量;A/R:缺氧复氧
Mr:relative molecular mass;A/R:anoxia/reoxygenation
图2 Western blotting检测各组钙敏感受体的表达
Fig2 Expression of calcium-sensing receptor in each group detected by Western blotting
细胞凋亡情况细胞Tunel染色后,凋亡细胞呈棕褐色。对照组、缺氧复氧组、激动剂组和抑制剂组的细胞凋亡水平分别为10.33±2.96、28.33±1.67、46.68±1.68和18.38±1.62,其中,缺氧复氧组的凋亡细胞明显多于对照组(t=4.899,P=0.008),激动剂组明显多于缺氧复氧组(t=7.746,P=0.002),抑制剂组明显低于缺氧复氧组(t=4.281,P=0.013)(图4)。
凋亡相关蛋白Caspase-3、Bax、Bcl-2的表达情况Western blot检测结果显示,对照组、缺氧复氧组、激动剂组和抑制剂组的Caspase- 3剪切体表达水平分别为0.8412±0.0551、1.2610±0.0608、1.6800±0.0635和1.0070±0.0384,Bax表达水平分别为0.8233±0.0694、1.8100±0.0577、2.3670±0.0882和1.3120±0.1312,其中,缺氧复氧组Caspase- 3剪切体(t=5.118,P=0.007)和Bax(t=10.930,P=0.001)的表达均明显高于对照组,激动剂组的Caspase- 3剪切体(t=4.776,P=0.009)和Bax(t=5.281,P=0.006)的表达均明显高于缺氧复氧组,抑制剂组的Caspase- 3剪切体(t=3.521,P=0.024)和Bax(t=3.473,P=0.026)的表达明显低于缺氧复氧组。对照组、缺氧复氧组、激动剂组和抑制剂组的Bcl- 2水平分别为2.5330±0.1764、1.5400±0.1778、1.0200±0.1850和1.9530±0.1633,其中,缺氧复氧组明显低于对照组(t=6.242,P=0.003),激动剂组明显低于缺氧复氧组(t=3.028,P=0.004),抑制剂组明显高于缺氧复氧组(t=2.840,P=0.047)(图5)。

图3 激光共聚焦检测细胞内游离钙浓度
Fig3 Measurement of the concentration of intracellular calcium by laser confocal scanning microscopy
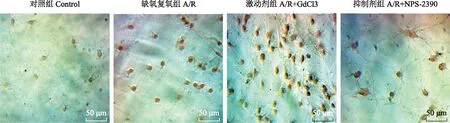
图4 脊髓神经元Tunel染色
Fig4 Tunel staining of spinal cord neurons
讨 论
CaSR属G蛋白耦联受体超家族 C家族成员。自1993年Brown等[5]从牛甲状旁腺细胞首次克隆出以来,其在生物体中的作用越来越受到人们的重视。研究表明,CaSR 具有维持和调节细胞内钙离子和其他矿物离子体内平衡的作用,同时也参与细胞分泌、增殖、分化、趋化、凋亡、基因表达、维持膜电位、离子通道开关、衰老等过程的调控[6- 7]。CaSR除广泛分布于调节细胞内钙稳态的组织中,如甲状腺、甲状旁腺、肾脏、胃肠道、骨组织等,在其他器官组织如血管平滑肌、神经系统、胰腺、骨髓、脑垂体及乳腺等中也有表达[8- 9]。本研究采用Western blot法检测了不同组别CaSR表达水平,结果显示,缺氧复氧组和激动剂组CaSR的表达明显高于对照组,提示脊髓神经元缺氧复氧过程中CaSR的表达增加。
脊髓缺血再灌注损伤的具体机制尚不清楚,但钙离子超载、氧自由基介导的脂质过氧化反应、兴奋性氨基酸、前列腺素等因素在脊髓损伤机制中起重要的作用已得到公认[10]。一般认为,钙超载在脊髓缺血再灌注损伤中发挥关键作用。细胞内钙超载引起的瀑布样效应是神经细胞损伤的共同通路[11]。2003年,Wang等[3]首次证实在大鼠心肌组织中有CaSR的表达,CaSR能通过G蛋白-PLC-IP3信号转导途径,引起肌浆网内钙离子释放增加,导致细胞内游离钙增加,造成细胞凋亡[4]。本研究采用激光共聚焦测定细胞内游离钙浓度,结果显示脊髓神经元的缺氧复氧组和激动剂组钙离子的荧光强度明显高于对照组,存在明显的钙超载现象。由此推测在脊髓神经元的缺氧复氧损伤过程中,CaSR的激活可能介导了细胞内游离钙的升高,引发细胞内钙超载。

图5 凋亡相关蛋白的表达
Fig5 Expressions of apoptosis-related proteins
Caspase家族是细胞凋亡的启动者和最后的执行者。研究表明,Caspase- 3是Caspase级联“瀑布”下游最关键的凋亡执行蛋白酶。受凋亡刺激因素(缺血、细胞内钙超载等)作用后激活,引起细胞形态的变化,最终导致细胞凋亡[12- 13]。Bcl- 2家族是凋亡的重要调控基因。在细胞内Bax和Bcl- 2的蛋白浓度处于动态平衡之中。当细胞受到死亡刺激时,基因表达的调节类型发生改变,结果是Bax的增加或Bcl- 2的减少,从而激活凋亡[14- 16]。本研究检测了各组Caspase- 3、Bax、Bcl- 2的蛋白表达水平,结果显示,缺氧复氧组的Caspase- 3、Bax表达较对照组均明显增加,Bcl- 2表达明显降低。与缺氧复氧组比较,激动剂组的Caspase- 3和Bax表达明显上调,Bcl- 2表达明显下调;而抑制剂组的Bcl- 2表达明显上调,Caspase- 3和Bax表达明显下调。由此推断在脊髓神经元缺氧复氧损伤过程中,CaSR的激活介导了细胞内钙的升高,从而引发细胞内钙超载,进而造成凋亡相关蛋白的变化,最终导致细胞凋亡的发生。
综上,本研究结果显示,在脊髓神经元缺氧复氧过程中,CaSR的表达增高,可能破坏了细胞内钙稳态,造成细胞内的钙超载,从而引起凋亡相关蛋白表达增多,经过一系列的信号转导,最终引起细胞凋亡。但引起脊髓神经元缺氧复氧损伤的具体机制以及信号转导途径错综复杂,有待于更进一步的研究。
[1] Temiz C,Solmaz I,Tehli O,et al. The effects of splenectomy on lipid peroxidation and neuronal loss in experimental spinal cord ischemia/reperfusion injury[J].Turk Neurosurg,2013,23(1):67- 74. doi:10.5137/1019- 5149.JTN. 6825- 12.1.
[2] Sen I,Joshi DC,Joshi PG,et al. NMDA and non-NMDA receptor-mediated differential Ca2+load and greater vulnerability of motor neurons in spinal cord cultures[J].Neurochem Int,2008,52(1- 2):247- 255. doi:10.1016/j.neuint.2007.06.028.
[3] Wang R,Xu C,Zhao W,et al. Calcium and polyamine regulated calcium-sensing receptors in cardiac tissues[J].Eur J Biochem,2003,270(12):2680- 2688.
[4] Vazquez-Martinez O,Canedo-Merino R,Diaz-Munoz M,et al. Biochemical characterization,distribution and phylogenetic analysis of Drosophila melanogaster ryanodine and IP3 receptors,and thapsigargin-sensitive Ca2+ATPase[J].J Cell Sci,2003,116(Pt 12):2483- 2494.doi:10.1242/jcs.00455.
[5] Brown EM,Gamba G,Riccardi D,et al. Cloning and characterization of an extracellular Ca(2+)-sensing receptor from bovine parathyroid[J].Nature,1993,366(6455):575- 580. doi:10.1038/366575a0.
[6] Qu YY,Hui J,Wang LM,et al. Reduced expression of the extracellular calcium-sensing receptor(CaSR) is associated with activation of the renin-angiotensin system(RAS) to promote vascular remodeling in the pathogenesis of essential hypertension[J].PLoS One,2016,11(7):e0157456. doi:10.1371/journal. pone.0157456.
[7] Grant MP,Cavanaugh A,Breitwieser GE. 14- 3- 3 proteins buffer intracellular calcium sensing receptors to constrain signaling[J].PLoS One,2015,10(8):e0136702. doi:10. 1371/journal.pone.0136702.
[8] Kim W,Takyar FM,Swan K,et al. Calcium-sensing receptor(CaSR) promotes breast cancer by stimulating intracrine actions of parathyroid hormone-related protein[J].Cancer Res,2016,76(18)5348- 5360. doi:10.1158/0008- 5472.CAN- 15- 2614.
[9] Di Tomo P,Pipino C,Lanuti P,et al. Calcium sensing receptor expression in ovine amniotic fluid mesenchymal stem cells and the potential role of R- 568 during osteogenic differentiation[J].PLoS One,2013,8(9):e73816. doi:10.1371/journal. pone.0073816.
[10] Guven M,Akman T,Yener AU,et al. The neuroprotective effect of kefir on spinal cord ischemia/reperfusion injury in rats[J].J Korean Neurosurg Soc,2015,57(5):335- 341. doi:10.3340/jkns.2015.57.5.335.
[11] Szydlowska K,Tymianski M. Calcium,ischemia and excitotoxicity[J].Cell calcium,2010,47(2):122- 129. doi:10. 1016/j.ceca.2010.01.003.
[12] Leite AF,Bernardo VG,Buexm LA,et al. Immunoexpression of cleaved caspase- 3 shows lower apoptotic area indices in lip carcinomas than in intraoral cancer[J].J Appl Oral Sci,2016,24(4):359- 365. doi:10.1590/1678- 77572016- 0156.
[13] Efuet ET,Ding XP,Cartwright C,et al. Huachansu mediates cell death in non-Hodgkin’s lymphoma by induction of caspase- 3 and inhibition of MAP kinase[J].Int J Oncol,2015,47(2):592- 600. doi:10.3892/ijo.2015.3044.
[14] Liang S,Sun K,Wang Y,et al. Role of Cyt-C/caspases- 9,3,Bax/Bcl- 2 and the FAS death receptor pathway in apoptosis induced by zinc oxide nanoparticles in human aortic endothelial cells and the protective effect by alpha-lipoic acid[J].Chem Biol Interact,2016,258:40- 51. doi:10.1016/j.cbi.2016.08.013.
[15] Li FH,Yu HT,Xiao L,et al. Response of BAX,Bcl- 2 proteins,and SIRT1/PGC- 1alpha mRNA expression to 8-week treadmill running in the aging rat skeletal muscle[J].Adv Exp Med Biol,2016,923:283- 289. doi:10.1007/978- 3- 319- 38810- 6_38.
[16] Guerrero AD,Welschhans RL,Chen M,et al. Cleavage of anti-apoptotic Bcl- 2 family members after TCR stimulation contributes to the decision between T cell activation and apoptosis[J].J Immunol,2013,190(1):168- 173. doi:10.4049/jimmunol. 1201610.
EffectofCalcium-sensingReceptorontheApoptosisofRatSpinalCordNeuronsinAnoxia/ReoxygenationInjuryandItsSignificance
HE Wei1,SUN Jifu1,JIANG Runyu1,ZHANG Zhijian2,CHEN Qian2,HUANG Yonghui1
1Department of Orthopaedics,Affiliated Hospital of Jiangsu University,Zhenjiang,Jiangsu 212001,China2Basic and Clinic Medical Research Center,School of Medicine,Jiangsu University,Zhenjiang,Jiangsu 212013,China
HUANG Yonghui Tel:0511- 85082251,E-mail:huangyh8855@163.com
ObjectiveTo investigate the effect and significance of calcium-sensing receptor (CaSR) on the apoptosis of rat spinal cord neurons in anoxia/reoxygenation(A/R) injury.MethodsThe spinal cells were in ischemia and hypoxia environment for 1 h and in normal environment for 24 h to establish a model of A/R. After spinal A/R model was established,the spinal cells were divided into four groups randomly:the control group,A/R group,A/R+GdCl3 group,and A/R+NPS- 2390 group. The expression of CaSR in each group was detected by immunofluorescence and Western blotting. The concentration of intracellular calcium was measured by laser confocal scanning microscopy. The expressions of Caspase- 3,Bax,and Bcl- 2 were detected by using Western blotting. The apoptotic rate of spinal cells was detected by Tunel assay.ResultsCompared to the control group, there was a significant increase in the level of CaSR (t=5.462,P=0.006), the concentration of intracellular calcium (t=8.573,P=0.001), the apoptotic rate (t=4.899,P=0.008), Caspase- 3 (t=5.118,P=0.007), and Bax (t=10.930,P=0.001) in A/R group. Compared to the A/R group, there was a significant increase in the level of CaSR (t=4.975,P=0.008),the concentration of intracellular calcium (t=4.899,P=0.008), the apoptotic rate (t=7.746,P=0.002), Caspase- 3 (t=4.776,P=0.009), and Bax (t=5.281,P=0.006) in A/R+GdCl3 group. Compared to the A/R group, there was a significant decrease in the level of CaSR (t=3.674,P=0.021), the concentration of intracellular calcium (t=3.846,P=0.018), the apoptotic rate (t=4.281,P=0.013), Caspase- 3 (t=3.521,P=0.024), and Bax(t=3.473,P=0.026) in A/R+NPS- 2390 group. However, compared to the control group, there was a significant decrease in the level of Bcl- 2 (t=6.242,P=0.003) in A/R group. Compared to the A/R group, there was a significant decrease in the level of Bcl- 2(t=3.028,P=0.004) in A/R+GdCl3 group. Compared to the A/R group, there was a significant increase in the level of Bcl- 2 (t=2.840,P=0.047) in A/R+NPS- 2390 group.ConclusionDuring the process of A/R injury in rat spinal cord neurons,the expression of calcium sensing receptor increases,along with increase in intracellular calcium and spinal neuron apoptosis.
anoxia/reoxygenation;calcium-sensing receptor;apoptosis;spinal cord neurons
黄永辉 电话:0511- 85082251,电子邮件:huangyh8855@163.com
R364.1
A
1000- 503X(2017)05- 0623- 06
10.3881/j.issn.1000- 503X.2017.05.005
ActaAcadMedSin,2017,39(5):623-628
2016- 08- 26)

