超声光散射成像与PET-CT联合应用在乳腺癌诊断中的价值
王红燕,靳晓娜,姜玉新,朱朝晖,徐 颖,朱庆莉,戴 晴,李建初,李 方,孙 强
中国医学科学院 北京协和医学院 北京协和医院 1超声医学科 2核医学科 3乳腺外科,北京 100730
·论著·
超声光散射成像与PET-CT联合应用在乳腺癌诊断中的价值
王红燕1,靳晓娜2,姜玉新1,朱朝晖2,徐 颖3,朱庆莉1,戴 晴1,李建初1,李 方2,孙 强3
中国医学科学院 北京协和医学院 北京协和医院1超声医学科2核医学科3乳腺外科,北京 100730
目的探讨超声光散射成像(DOT) 与PET-CT联合应用在乳腺诊断中的价值。方法对38例患者的40个病灶分别进行DOT和PET-CT检查,与病理结果对照,对比分析DOT及PET-CT在乳腺癌超声诊断中的敏感性、特异性、准确性、阳性预测值、阴性预测值。结果DOT对乳腺癌诊断的敏感性为78.26%,特异性为76.47%,准确性为77.50%,阳性预测值为72.22%,阴性预测值为81.81%。PET-CT对乳腺癌诊断的敏感性为86.96%,特异性为82.35%,准确性为85.00%,阳性预测值为86.96%,阴性预测值为82.35%。联合应用DOT和PET-CT的敏感性为86.96%,特异性为94.12%,准确性为90.00%,阳性预测值为95.23%,阴性预测值84.21%。结论DOT 和PET-CT 检查均为有效的诊断方法,联合应用DOT 和PET-CT 可以提高乳腺癌的诊断效能,提高诊断特异性、阳性预测值及准确性,减少不必要的活检,对临床治疗方案的选择及患者的预后具有重要意义。
超声光散射成像;PET-CT;乳腺癌
乳腺癌是全球女性发病率最高的恶性肿瘤,发病率逐年增高,且发病年龄呈低龄化,严重威胁女性健康,其早诊、早治对预后极为重要。目前应用于临床的常规影像学检查方法主要是通过解剖结构、形态分析对病变进行判断,而功能成像可获得更进一步的诊断信息。PET-CT是通过CT提供可疑病变部位,并在此基础上收集病灶的葡萄糖代谢信息;超声光散射成像(diffused optical tomography,DOT)是将声学技术与光学技术相结合的一种新的乳腺成像技术,通过超声提供可疑病变部位,并在此基础上收集病灶的血红蛋白含量光学信息;两者均是将结构成像与功能成像相融合,从而对乳腺病变达到定位和定性诊断。
恶性肿瘤耗氧量及葡萄糖代谢较正常组织增多,因此需要更多的新生毛细血管来转运葡萄糖和氧,随着肿瘤血流灌注增多,肿瘤内部血红蛋白浓度增多。18F-FDG PET-CT可通过检测葡萄糖的高摄取检出肿瘤病灶,DOT作为无创的新技术,其所测得的血红蛋白浓度若与PET-CT有良好的相关性,将有望为肿瘤的早期诊断搭建新的平台[1- 2]。肿瘤代谢是受多种因素影响的,低氧引起葡萄糖代谢增加,18F-FDG PET-CT摄取增加,然而,一些非乏氧的肿瘤也表现为高葡萄糖代谢,慢性缺氧能引起葡萄糖代谢减低。因此,单独应用PET-CT监测肿瘤乏氧从而诊断肿瘤并不可靠。研究显示,DOT通过测量血红蛋白浓度,与组织乏氧情况建立关联性,有益于肿瘤的诊断[1- 6]。本研究比较了DOT与PET-CT鉴别乳腺良恶性病变的临床可行性,评估了血红蛋白含量(total hemoglobin concentration,THC)、葡萄糖代谢等多种影像参数的联合应用在乳腺癌诊断中的应用价值,以期为今后的临床应用提供参考。
对象和方法
对象2014年2月至12月在北京协和医院行乳腺病变切除活检术的女性患者38例,共40个乳腺病灶。所有患者均经病理证实,平均年龄(41±12)岁(27~61岁),临床体检和/或钼靶X线检查疑似乳腺癌。患者术前在我院先行DOT检查,再行PET-CT检查,检查前未做过活检及放化疗。本研究经北京协和医院伦理委员会批准,检查医生向患者作出详细解释和说明后均获得患者知情同意。
DOT检查采用OPTIMUS Ⅱ型乳腺诊断仪(新奥博为,中国),由超声诊断装置(Terason T3000,线阵探头频率7~12 MHz,Teratech,美国)和光散射断层成像系统组成的双模式成像系统。先常规超声定位病灶位置,常规超声诊断采用北美放射学会的乳腺影像学和报告数据系统(The Breast Imaging and Reporting Data System,BI-RADS) 诊断分类[7]。然后进行患侧乳腺光学扫描:选取病变部位最大切面作为水平切面进行光学扫面,再将探头旋转90°进行垂直切面光学扫描;保存图像后,在对侧乳腺与患侧病变镜面对称部位进行光学扫描。在两个病灶切面勾勒感兴趣区(region of interest,ROI) 进行光学重建,得出光学特征参数、THC 和光吸收图像。
PET-CT检查PET-CT仪为西门子公司Biograph 64 TruePoint TrueV 型。北京协和医院自行生产18F-FDG,放化纯>98%。患者按5.55 MBq (0.15 mCi) /kg体质量静脉注射18F-FDG。患者禁食4 h以上,血糖低于6.4 mmol/L,注药后闭目安静休息40~60 min,排尿后行PET-CT 扫描。采用设备本身优化的条件进行图像采集和重建,检查范围为由患者头顶至大腿根部。获得的图像转入西门子公司MMWP工作站进行阅读和分析。图像分析由3位有经验的医师共同阅片,视觉观察18F-FDG异常摄取部位和形态学变化。由同一名医师用统一标准测量病变大小,勾画ROI,并测量病灶的最大标准摄取值(maximum standard uptake value,SUVmax)。
统计学处理采用SPSS 10.0统计软件,以病理诊断为金标准分别统计DOT及PET-CT的敏感性、特异性、准确性、假阳性、假阴性、阳性及阴性预测值。比较两种技术的ROC曲线下面积(area under curve,AUC),将病理学检查结果作为金标准,绘制ROC曲线,根据ROC曲线分析,敏感性与特异性之和最大时的数值被规定为最佳阈值。各测量参数间的相关性采用线性(Pearson)相关或Spearman秩相关分析。P<0.05为差异有统计学意义。
结 果
病理类型38例患者40个乳腺病灶中,17个(42.5 %)为良性,包括:纤维腺瘤8个(20.0%),腺病5个(12.5%),导管内乳头状瘤2个(5.0%),乳腺炎2个(5.0%);23个(57.5 %)为恶性,包括:浸润性导管癌20个(50.0%),导管内癌1个(2.5%),浸润性小叶癌2个(5.0%)。良性病变平均直径为(2.4±1.6)cm(1.1~7.0 cm),恶性病变平均直径为(2.8±1.3) cm (0.8~5.6 cm)。
DOT诊断效能良性组的THC均值为(134.5±60.39)μmol/ L,明显低于恶性组的(202.2±68.59)μmol/ L(t=3.126,P=0.0036)。ROC曲线分析结果显示,THC对乳腺良恶性肿瘤具有良好的鉴别作用(AUC=0.7755)。根据ROC 曲线分析,敏感性与特异性之和最大时的数值被规定为最佳阈值,因此选取THC>147 μmol/L作为诊断恶性的参考值,结果显示DOT对乳腺癌诊断的敏感性为78.26%,特异性为76.47%,准确性为77.50%,阳性预测值为72.22%,阴性预测值为81.81%。
PET-CT诊断效能良性组的SUV均值为1.829±1.543,明显低于恶性组的5.370±3.168 (t=4.131,P=0.0002)。ROC 曲线分析结果显示,SUV 对乳腺良恶性肿瘤具有良好的鉴别作用(AUC=0.8560)。根据ROC 曲线分析,敏感性与特异性之和最大时的数值被规定为最佳阈值,因此选取SUV>2.1 作为诊断恶性的参考值,结果显示PET-CT对乳腺癌诊断的敏感性为86.96%,特异性为82.35%,准确性为85.00%,阳性预测值为86.96%,阴性预测值为82.35%。
DOT与PET-CT联合诊断效能将DOT中THC>147 μmol/L、PET-CT中SUV>2.1作为诊断恶性的标准,两者联合应用诊断乳腺癌的敏感性为86.96%,特异性为94.12%,准确性为90.00%,阳性预测值为95.23%,阴性预测值84.21%。23个乳腺癌原发灶中,DOT假阴性病灶4个,包括:中分化浸润性导管癌2个(直径分别为1.9和2.0 cm),低分化浸润性导管癌1个(直径1.5 cm),低分化浸润性小叶癌1个(直径3.0 cm);PET-CT假阴性病灶3个,包括:浸润性导管癌1个(直径0.8 cm),浸润性小叶癌1个(直径1.2 cm),导管内癌1个(2.2 cm)。DOT假阳性病灶5个,包括:纤维腺瘤2个(直径1.8和2.0 cm),导管内乳头状瘤2个(直径1.3和1.5 cm),急性乳腺炎1个(直径1.0 cm);PET-CT假阳性病灶3个,包括:导管内乳头状瘤1个(直径0.9 cm),肉芽肿性乳腺炎1个(直径4.8 cm),硬化性腺病(直径1.5 cm)。图1为左乳腺病、部分导管上皮细胞增生患者,超声示左乳下象限见实性结节,1.5 cm×0.5 cm,形态不规则,边界清,彩色多普勒周边可见少许血流信号;DOT显像该结节的THC值为95 μmol/ L;PET-CT显像示左乳下象限见放射性摄取稍增高结节,大小为1.6 cm×0.6 cm,SUV为1.6,左乳代谢增高结节,考虑良性病变可能。图2为浸润性导管癌患者,
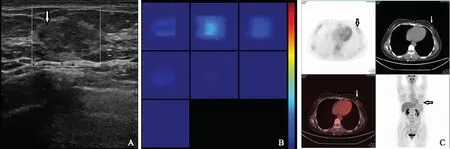
DOT:超声光散射成像
DOT:diffused optical tomography
A.超声;B.DOT;C.PET-CT
A.ultrasound;B.DOT;C.PET-CT
图1 患者,女,40岁,病理诊断左乳腺病,部分导管上皮细胞增生(箭头)
Fig1 Pathology of a 40-year-old female patient showed left breast adenosis with partial hyperplasia in the catheter epithelium(arrow)
超声检查示左乳外上象限见低回声,1.5 cm×1.3 cm,形态不规则,边界不清,CDFI周边可见较丰富的动脉血流。DOT显像示该结节的THC为179 μmol/ L。PET-CT示左乳外上象限见一放射性摄取增高结节,大小约1.3 cm,SUV平均为5.4,最高为9.1;左腋下见数个放射性摄取增高结节,部分融合成团,大小0.8~2.0 cm,SUV为1.3~6.0;胸骨左侧内乳淋巴结区可见两个放射性摄取增高结节,大小均约为0.8 cm,SUV分别为2.5和2.8;诊断意见为左乳外上象限代谢增高灶,考虑恶性病变,伴左腋下及内乳淋巴结转移。
SUVmax与THC的相关性线性相关分析结果显示,SUVmax与THC显著相关(r=0.4793,P=0.0036)。
讨 论
肿瘤的生长和转移均依赖于肿瘤内血管的生长,恶性肿瘤刺激血管生长因子产生新生的毛细血管,并随肿块生长血管数量不断增加,血红蛋白含量也因此增多。DOT融合了超声波和光子成像技术的优势,可检测乳腺肿块组织的THC。以往研究证实,DOT可用于鉴别乳腺良恶性病灶[8- 9],对乳腺癌的诊断灵敏性为83%~96%,特异性为65%~67%,准确性为75%~76%[10- 11]。本研究结果显示,良性组的THC明显低于恶性组,以THC>147 μmol/ L为诊断恶性的临界值,DOT对乳腺癌诊断的敏感性为78.26%,特异性为76.47%,准确性为77.50%,阳性预测值为72.22%,阴性预测值为81.81%。本研究中有4例假阴性病例,病理类型为浸润性导管癌及浸润性小叶癌,分析原因可能与病灶本身的低血流灌注及肿瘤的异质性有关[12- 13]。5例假阳性病例病理类型为纤维腺瘤、乳腺炎、导管内乳头状瘤。Weinstein等[14]研究认为,少部分纤维腺瘤血红蛋白含量高与血管增多和高灌注相关。炎性病灶也经常表现为乏氧,乏氧可以诱导促新生血管生长因子增多,最终促进血管生成[15],因此炎症也可表现为高血红蛋白含量。本研究中2个导管内乳头状瘤也表现为高血红蛋白含量,有研究表明某些导管内乳头状瘤在超声造影上也表现为高增强,血管明显增多[16- 17]。
与正常的乳腺组织相比,乳腺癌的病理生理改变表现为血流灌注和血管通透性增强,新生血管生成,葡萄糖、氨基酸和核苷酸代谢加强,细胞的增殖力加强和诱导凋亡增强,这些变化为乳腺癌的PET功能成像提供可能[18- 19]。PET-CT将PET人体功能成像与CT解剖结构成像的同机图像融合,使肿瘤复杂的分子代射变化与解剖结构的准确定位相结合,为肿瘤的准确诊断和明确分期提供了更精确的影像信息。以往文献报道显示,18F-FDG PET对原发性乳腺癌的诊断灵敏性为80%~96%,特异性为83%~100%[20- 22]。本研究中PET-CT对乳腺癌的诊断敏感性为86.96%,特异性为81.25%,与以往文献报道相似。本研究中假阴性病例有3例,病理类型分别为导管内原位癌、浸润性小叶癌及浸润性导管癌,病灶直径为0.8~2.2 cm。研究显示,影响PET敏感性的主要因素包括肿瘤的病理类型、病灶大小、系统的灵敏性和空间分辨率以及部分容积效应。其局限性表现在对较小的病灶敏感性不足。对于<1 cm 以及病理低级别的病灶,PET-CT的敏感性分别为 66.7%和61.3%,PET-CT技术上的分辨率是5~ 10 mm,因此病灶太小可能导致FDG显像假阴性。而对于导管内原位癌敏感性只有50%,浸润性导管癌摄取FDG的水平高于浸润性小叶癌。本组假阳性病例有3例,病理类型分别是导管内乳头状瘤、肉芽肿性乳腺炎和硬化性腺病。因为一些非乏氧的良性肿瘤也可以表现为高葡萄糖代谢,使PET-CT产生假阳性病例。
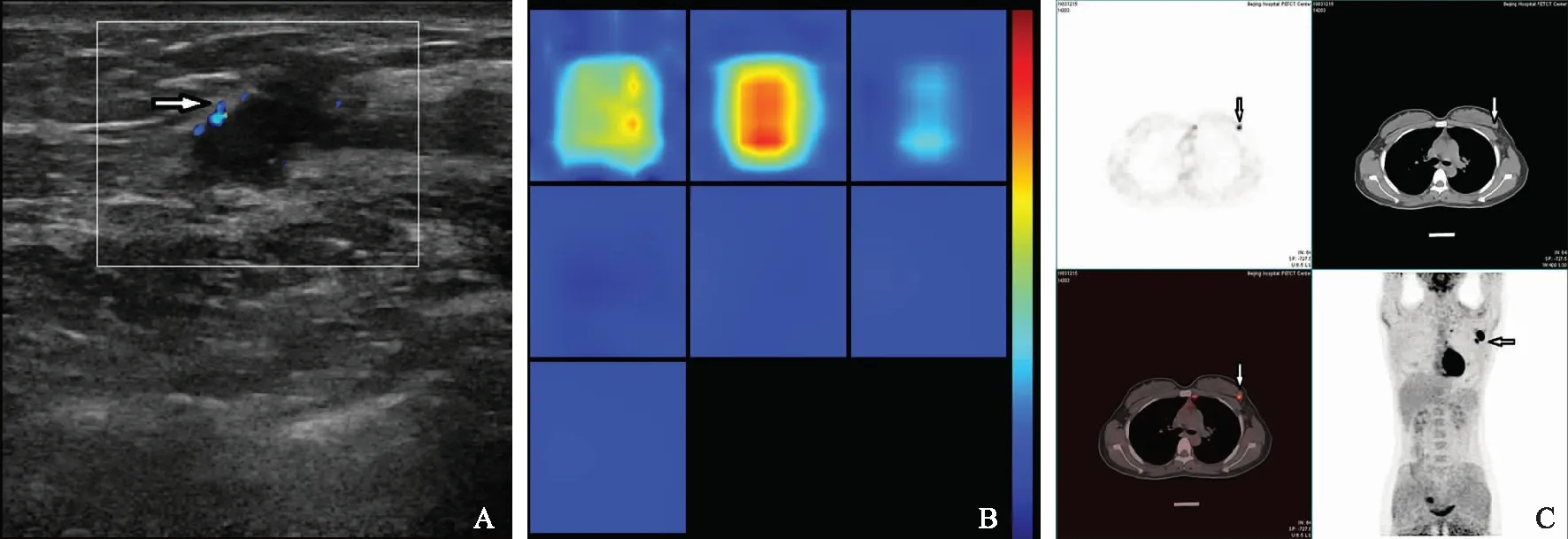
A.超声;B.DOT;C.PET-CT
A.ultrasound;B.DOT;C.PET-CT
图2 患者,女,28岁,病理为1.5 cm的浸润性导管癌(箭头)
Fig2 Pathology of a 28-year-old female patient showed an invasive ductal carcinoma (sized 1.5 cm)(arrow)
乳腺癌的生长代谢是多步骤、多种因素参与的,包括葡萄糖代谢、乏氧、组织重构、血管生成等。多模态的诊断能够提高肿瘤的检出并促进分子影像的发展[19]。将DOT测得的THC及PET-CT测得的葡萄糖代谢等多种影像参数联合应用诊断乳腺癌,其特异性、准确性、和阳性预测值有望显著提高,假阳性率明显降低,从而减少不必要的活检。本研究结果也证实了这一点,两者联合应用诊断乳腺癌的敏感性为86.96%,特异性为94.12%,准确性为90.00%,阳性预测值为95.23%,阴性预测值84.21%。
理论上,乳腺癌细胞代谢旺盛,恶性肿瘤耗氧量及葡萄糖代谢的增加,刺激其内部产生更多的新生毛细血管来转运葡萄糖和氧,从而促进肿瘤的生长和增殖,新生血管的增多伴随血红蛋白浓度的增高。本研究结果显示,18F-FDG的摄取与THC呈显著正相关,提示DOT 有望用于乳腺癌疗效的监测,今后尚需进一步研究来加以证实。
[1] Konecky SD,Choe R,Corlu A,et al. Comparison of diffuse optical tomography of human breast with whole-body and breast-only positron emission tomography[J].Med Phys,2008,35(2):446- 455.doi:10.1118/1.2826560.
[2] Moeller BJ,Cao Y,Vujaskovic Z,et al. The relationship between hypoxia and angiogenesis[J].Semin Radiat Oncol,2004,14(3):215- 221.doi:10.1016/j.semradonc.2004.04.005.
[3] Vaupel P,Hockel M.Blood supply,oxygenation status and metabolic micromilieu of breast cancers:characterization and therapeutic relevance[J].Int J Oncol,2000,17(5):869- 879.doi:10.3892/ijo.17.5.869.
[4] HÖckel M,Vaupel P.Tumor hypoxia:definitions and current clinical,biologic,and molecular aspects[J].J Natl Cancer Inst,2001,93(4):266- 276.
[5] Blagosklonny MV.Hypoxia-inducible factor:Achilles’heel of antiangiogenic cancer therapy (review)[J].Int J Oncol,2001,19(2):257- 262.doi:10.3892/ijo.19.2.257.
[6] Denny WA.Prospects for hypoxia-activated anticancer drugs[J].Curr Med Chem Anticancer Agents,2004,4(5):395- 399.
[7] Mendelson EB,Böhm-Vélez M,Berg WA,et al. ACR BI-RADS® Ultrasound.ACR BI-RADS® Atlas,Breast Imaging Reporting and Data System[M].Reston:American College of Radiology,2013.
[8] Zhu Q,Hegde PU,Ricci A Jr,et al. Early-stage invasive breast cancers:potential role of optical tomography with US localization in assisting diagnosis[J].Radiology,2010,256(2):367- 378.doi:10.1148/radiol.10091237.
[9] Ueda S,Nakamiya N,Matsuura K,et al. Optical imaging of tumor vascularity associated with proliferation and glucose metabolism in early breast cancer:clinical application of total hemoglobin measurements in the breast[J].BMC Cancer,2013,13:514.doi:10.1186/1471- 2407- 13- 514.
[10] Zhi W,Gu X,Qin J,et al. Solid breast lesions:clinical experience with US-guided diffuse optical tomography combined with conventional US[J].Radiology,2012,265(2):371- 378.doi:10.1148/radiol.12120086.
[11] You SS,Jiang YX,Zhu QL,et al. US-guided diffused optical tomography:a promising functional imaging technique in breast lesions[J].Eur Radiol,2010,20(2):309- 317.doi:10.1007/s00330- 009- 1551-y.
[12] Mankoff DA,Dunnwald LK,Gralow JR,et al. Blood flow and metabolism in locally advanced breast cancer:relationship to response to therapy[J].J Nucl Med,2002,43(4):500- 509.
[13] Jain RK.Haemodynamic and transport barriers to the treatment of solid tumours[J].Int J Radiat Biol,1991,60(1- 2):85- 100.
[14] Weinstein D,Strano S,Cohen P,et al. Breast fibroadenoma:mapping of pathophysiologic features with three-time-point,contrast-enhanced MR imaging-pilot study[J].Radiology,1999,210(1):233-240.doi:10.1148/radiology.210.1.r99ja18233.
[15] Walsh DA,Pearson CI.Angiogenesis in the pathogenesis of inflammatory joint and lung diseases[J].Arthritis Res,2001,3(3):147- 153.doi:10.1186/ar292.
[16] Jiang YX,Liu H,Liu JB,et al. Breast tumor size assessment:comparison of conventional ultrasound and contrast-enhanced ultrasound[J].Ultrasound Med Biol,2007,33(12):1873- 1881.doi:10.1016/j.ultrasmedbio.2007.06.002.
[17] Liu H,Jiang YX,Liu JB,et al. Evaluation of breast lesions with contrast-enhanced ultrasound using the microvascular imaging technique:initial observations[J].Breast,2008,17(5):532- 539.doi:10.1016/j.breast.2008.04.004.
[18] Mahner S,Schirrmacher S,Brenner W,et al. Comparison between positron emission tomography using 2-fluoro- 2-deoxy-D-glucose,conventionalimaging and computed tomography for staging of breast cancer[J].Ann Oncol,2008,19(7):1249- 1254.doi:10.1093/annonc/mdn057.
[19] Garofalakis A,Dubois A,Thézé B,et al. Fusion of [(18)F]FDG PET with fluorescence diffuse optical tomography to improve validation of probes and tumor imaging[J].Mol Imaging Biol,2013,15(3):316- 325.doi:10.1007/s11307- 012- 0581-z.
[20] Choi YJ,Shin YD,Kang YH,et al. The effects of preoperative (18)F-FDG PET/CT in breast cancer patients in comparison to the conventional imaging study[J].J Breast Cancer,2012,15(4):441- 448.doi:10.4048/jbc.2012.15.4.441.
[21] Herranz M,Ruibal A.Optical imaging in breast cancer diagnosis:the next evolution[J].J Oncol,2012,2012:863747.doi:10.1155/2012/863747.
[22] Lavayssière R,Cabée AE,Filmont JE.Positron emission tomography (PET) and breast cancer in clinical practice[J].Eur J Radiol,2009,69(1):50- 58.doi:10.1016/j.ejrad.2008.07.039.
ClinicalValuesofCombinedDiffusedOpticalTomographyandPET-CTintheDiagnosisofBreastCancer
WANG Hongyan1,JIN Xiaona2,JIANG Yuxin1,ZHU Zhaohui2,XU Ying3,ZHU Qingli1,DAI Qing1,LI Jianchu1,LI Fang2,SUN Qiang3
1Department of Ultrasound,2Department of Nuclear Medicine,3Department of Breast Surgery, PUMC Hospital,CAMS and PUMC,Beijing 100730,China
JIANG Yuxin Tel:010- 69155491,E-mail:yuxinjiangxh@163.com
ObjectiveTo investigate the clinical values of combined diffused optical tomography (DOT) combined positron emission tomography-computed tomography (PET-CT) in the diagnosis of breast cancer.MethodsWe performed DOT and PET-CT examinations in 38 patients with 40 lesions and compared these images with the pathological results to analyze the sensitivity,specificity,accuracy,positive predictive value,and negative predictive value of these two techniques and their combination.ResultsThe sensitivity,specificity,accuracy,positive predictive value,and negative predictive value in diagnosing breast cancer were 78.26%,76.47%,77.50%,72.22%,and 81.81% for DOT,86.96%,82.35%,85.00%,86.96%,and 82.35% for PET-CT,and 86.96%,94.12%,90.00%,95.23%,and 84.21% for the combination of PET-CT and DOT.ConclusionsDOT and PET-CT are both effective diagnostic methods for breast cancer.Combined DOT and PET-CT can improve the diagnostic efficacy in terms of specificity,positive predictive value,and accuracy.
diffused optical tomography;PET-CT;breast cancer
国家自然科学基金(81601517、81371557)Supported by the National Natural Sciences Foundation of China (81601517,81371557)
姜玉新 电话:010- 69155491,电子邮件:yuxinjiangxh@163.com
R445
A
1000- 503X(2017)05- 0682- 06
10.3881/j.issn.1000- 503X.2017.05.014
ActaAcadMedSin,2017,39(5):682-687
2017- 01- 11)

