甲强龙在骨髓间充质干细胞治疗大鼠脊髓损伤中的作用及对肿瘤坏死因子-α和白细胞介素- 1β表达的影响
杨新明,成垚昱,张振梁,康 聪
河北北方学院附属第一医院 1骨科 2研究生院,河北张家口 075000
·论著·
甲强龙在骨髓间充质干细胞治疗大鼠脊髓损伤中的作用及对肿瘤坏死因子-α和白细胞介素- 1β表达的影响
杨新明1,成垚昱2,张振梁2,康 聪2
河北北方学院附属第一医院1骨科2研究生院,河北张家口 075000
目的探讨甲强龙(MP)在骨髓间充质干细胞(BMSCs)治疗大鼠脊髓损伤(SCI)中的作用及对局部肿瘤坏死因子(TNF)-α和白细胞介素(IL)- 1β表达变化的影响。方法采用改良Allen法制备40只T10脊髓损伤雄性大鼠模型,随机数字表法随机分为对照组、MP组、BMSCs组和MP+BMSCs组4组,每组10只。按上述分组分别在脊髓损伤后立即尾静脉缓慢推注30 mg/kg MP和/或在脊髓损伤后2 h于脊髓损伤部位注射全贴壁法培养并以BrdU标记的BMSCs。术后1、7、14 d,采用BBB运动评分法评价大鼠后肢运动功能恢复。14 d后处死各组大鼠并取出脊髓样本,分别进行TNF-α、IL- 1β免疫组织化学染色和Tunel染色,各组统计视野内TNF-α、IL- 1β表达阳性细胞数并检测细胞凋亡率;采用BrdU单染观察BMSCs组和MP+BMSCs组中BrdU阳性率。结果术后1 d,各组BBB评分差异无统计学意义(χ2=1.0756,P=0.7829)。术后7 d,各组大鼠双后肢运动功能较前明显恢复,其中MP组(χ2=8.3265,P=0.0325)和BMSCs组(χ2=14.1166,P=0.0036)的BBB评分明显高于对照组;MP+BMSCs组的BBB评分明显高于MP组(χ2=17.7186,P=0.0002)和BMSCs组(χ2=15.8110,P=0.0024)。术后14 d,各组大鼠双后肢运动功能明显恢复,MP+BMSCs组BBB评分明显高于MP组(χ2=24.7259,P<0.0001)和BMSCs组(χ2=25.6014,P<0.0001),MP组(χ2=13.5060,P=0.0062)和BMSCs组(χ2=8.9613,P=0.0299)的BBB评分明显高于对照组。术后14 d,对照组、MP组、BMSCs组和MP+BMSCs组的细胞凋亡率分别为(48.47±5.70)%、(31.95±3.58)%、(41.39±2.33)%和(23.48±2.69)%,其中,MP组(q=14.84,P<0.0001)和BMSCs组(q=6.716,P= 0.0002)明显低于对照组,MP+BMSCs组明显低于MP组(q=7.332,P=0.0001)和BMSCs组(q=15.460,P<0.0001)。术后14 d,免疫组织化学染色结果显示,MP组(q=14.710,P<0.0001;q=6.710,P<0.0001)和BMSCs组(q=6.502,P=0.0001;q=2.849,P=0.0514)的TNF-α及IL- 1β阳性细胞数均明显低于对照组,MP组(q=5.573,P=0.0004;q=4.596,P=0.0025)和BMSCs组(q=13.780,P<0.0001;q=8.456,P<0.0001)的TNF-α及IL- 1β阳性细胞数明显高于MP+BMSCs组。术后14 d,BrdU染色结果显示,BMSCs组的BrdU阳性率为(6.600±0.3399)%,明显低于MP+BMSCs组的(9.300±0.5175)%(t=4.361,P=0.0004)。结论MP可明显提高BMSCs移植治疗SCI的大鼠后肢运动功能恢复,二者可协同降低局部TNF-α和IL- 1β表达水平,并且MP有效提升了移植BMSCs的存活。
脊髓损伤;甲强龙;骨髓间充质干细胞;肿瘤坏死因子-α;白细胞介素-1β;BrdU染色
脊髓损伤(spinal cord injury,SCI)是脊柱椎体骨折中一种常见而严重的合并伤,其有效治疗一直是医学界中的一个难题。完全性SCI可导致患者损伤脊髓节段下的躯体及相应支配肢体的感觉、运动丧失,内部脏器功能失调,致残率极高,临床疗效差,并发症多,不仅给个人身体及心理带来痛苦,而且增加了家庭和社会的经济负担。目前针对其治疗尚无有效措施,如何有效修复受损脊髓已成为全世界共同关注的课题。自骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)研究以来,科学家们发现其在组织修复再生、器官功能恢复等方面作用显著[1- 3],而且能分泌多种生长因子,如脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)修复受损脊髓组织,促进神经元存活和神经纤维延长,重建神经环路,阻止神经元胞体萎缩,加快SCI修复[4]。BDNF独特的修复损伤组织能力显示了强大的科学研究及临床应用价值,但实验研究发现其治疗SCI时应用效能很低。甲强龙(methylprednisolone,MP)是目前公认神经功能保护药物,也是迄今为止应用最为广泛的治疗急性SCI药物,被美国食品药品管理局最早认可并批准应于治疗急性SCI[5]。研究显示,MP能有效保护急性SCI后神经结构且疗效确切[5- 7]。本研究评估了MP在BMSCs治疗大鼠SCI中的作用及对局部肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)- 1β表达变化的影响,以期在治疗SCI方法上探索新的思路。
材料和方法
实验动物4周龄雄性SD大鼠2只,体质量分别为80和100 g;8周龄健康成年SPF级雄性SD大鼠40只,体质量220~250 g,由河北北方学院动物实验中心提供[许可证号:SCXK(军) 2012- 0004]。分笼颗粒饲料饲养,自由饮水。
主要试剂和仪器低糖DMEM培养液、胎牛血清、胰蛋白酶、0.02%EDTA(美国Gibco公司),大鼠单克隆抗体(CD34-ECD、CD45-PE、CD29-FITC、CD90-FITC)(美国BD公司);BrdU试剂、BrdU小鼠抗人单克隆抗体(美国Sigma公司),DAB显色系统、TNF-α一抗兔抗鼠抗体、TNF-α二抗羊抗兔抗体、兔抗大鼠白细胞介素1β(武汉博士德生物技术有限公司),MP(美国辉瑞公司)。倒置相差显微镜、激光扫描共聚焦显微镜、石蜡切片机、组织包埋机、组织脱水机(德国莱卡),流式细胞仪(美国Bioscience公司)。
大鼠SCI模型的制备大鼠术前禁食水12 h,将配置好的10%水合氯醛按30 mg/100 g标准腹腔注射麻醉,脊髓定位以T10中心,运用改良Allen法造成T10节段损伤。造模成功标志:大鼠立即出现一过性鼠尾痉挛性摆动及双下肢连续性抽动,T10节段出现硬脊膜血肿。术后立即予以腹腔注射生理盐水4 ml/只,常规人工排尿,每日2~3次,辅助恢复自主膀胱,青霉素2×105U,肌肉注射预防感染,连用3 d。
BMSCs的培养、鉴定、标记和移植取4周龄雄性SD大鼠2只,脱颈处死,在无菌条件下分离并完整剪下双侧股骨和胫骨采集骨髓液,经过滤过后接种于细胞培养皿,并标记为原代,在环境为5%CO2、37℃的细胞培养箱中培养。将原代细胞接种于培养皿中,分别于24、48、72 h更换培养液1次,以后2~3 d换液1次。采用全骨髓贴壁法来培养BMSCs,取传代3~4代的 BMSCs,通过流式细胞学分析鉴定BMSCs纯度>95%(以CD29、CD90>90%,CD34、CD45<2%为标准)。鉴定成功后换液放入倒置相差显微镜下仔细观察细胞形态及生长情况(图1),再将BrdU溶液稀释为3 μg/ml的细胞标记液备用,取生长状态良好、融合至50%左右的P3- 4代,倒掉培养皿内的培养液,PBS溶液清洗2次后在每个培养皿内加入上述细胞标记液10 ml,继续培养48 h,标记完毕后,调节BMSCs浓度达到1×106/ml,备用移植。
分组及处理采用随机数字表法将40只雄性SD大鼠随机分为4组,每组10只,具体为:(1)对照组:不予以特殊处理;(2)MP组:SCI后立即经尾静脉缓慢推注30 mg/kg MP,15 min内推完;(3)BMSCs组:SCI 2 h后,用微量注射管将1 μl标记的BMSCs悬液缓慢注入损伤节段脊髓,部位选择血肿中心及偏近远端各1.0 mm,深度为1.0 mm,留置微量注射管3 min[4];(4)MP+BMSCs组:为MP组与BMSCs组方案的叠加。本研究经河北北方学院实验动物伦理委员会批准,所有实验操作均符合动物伦理学要求。
大鼠后肢运动功能的评价采用Basso-Beattie-Bresnahan(BBB)运动评分,在造模后第1、7、14天评价各组大鼠后肢运动功能情况,具体为:BBB 评分范围从0~21分,0分表示无自发的后肢运动,21分表示正常后肢运动[8]。由两名非专业人士双盲检测和评分,评分取两人均值。
取材造模14 d完成BBB评分后,在规定时间内处死各组大鼠,固定、取材,取出脊髓组织以损伤节段及上下各0.5 cm 为准,继续在浓度4%多聚甲醛4℃条件下固定24 h。标本经梯度脱水、浸蜡、石蜡包埋,连续切片制成切片厚度为5 μm切片,每只大鼠25张,Tunel染色,TNF-α、IL- 1β免疫组织化学染色和BrdU染色各组5张,剩余备用。
Tunel细胞凋亡率的测定按试剂盒说明进行Tunel染色,在显微镜下观察视野凋亡细胞。判定标准:细胞核中含有棕黄色颗粒即为阳性凋亡细胞,正常细胞为淡蓝色。计算阳性细胞率=阳性细胞数/总细胞数×100%。
免疫组织化学染色检测脊髓TNF-α、IL-1β表达的阳性细胞数在100×高倍镜下随机选取5个固定、无重复视野,统计视野内TNF-α、IL- 1β表达阳性细胞数(以胞浆着色为主,胞浆呈棕黄色或棕褐色颗粒),结果以5个视野阳性细胞总数表示。
BrdU染色按BrdU试剂盒说明进行染色后显微镜观察染色结果并拍照。阳性结果为细胞胞核被染成棕褐色而胞浆被染成蓝色。高倍显微镜下观察随机选取5个视野,计算BrdU阳性率并求均值:BrdU阳性率=阳性细胞数/总细胞数×100%。
统计学处理采用 SPSS 17.0 统计软件,实验结果以均数±标准差表示,组间比较采用独立样本t检验;单个时间点组间两两比较采用SNK-q检验;等级资料比较采用秩和检验,秩和检验两两比较用Nemenyi检验;P<0.05为差异有统计学意义。
结 果
BMSCs细胞的培养情况原代细胞胞体呈圆形或多边形,散布排列;第3代BMSCs(7 d)可见呈族状分布的梭形细胞聚集,形成大小不一的集落;第3代BMSCs(14 d)可见在形态学上更加趋于一致,为排列更加有序的梭形细胞呈旋祸状排列(图1)。
造模情况术后1 d内各组大鼠都出现不同程度的血尿。由于血尿、泌尿系感染及肠梗阻等原因,术后对照组、MP组、BMSCs组和MP+BMSCs组分别死亡大鼠3、2、2、2只,死亡大鼠均补齐数量。
大鼠后肢运动功能恢复情况术后1 d,各组BBB评分差异无统计学意义(χ2=1.0756,P=0.7829)。术后7 d,各组大鼠双后肢运动功能较前明显恢复,其中MP组(χ2=8.3265,P=0.0325)和BMSCs组(χ2=14.1166,P=0.0036)的BBB评分明显高于对照组;
MP+BMSCs组的BBB评分明显高于MP组(χ2=17.7186,P=0.0002)和BMSCs组(χ2=15.8110,P=0.0024)。术后14 d,各组大鼠双后肢运动功能明显恢复,MP+BMSCs组BBB评分明显高于MP组(χ2=24.7259,P<0.0001)和BMSCs组(χ2=25.6014,P<0.0001),MP组(χ2=13.5060,P=0.0062)和BMSCs组(χ2=8.9613,P=0.0299)的BBB评分明显高于对照组(表1)。
Tunel细胞凋亡率术后14 d,Tunel染色视野中可见大量褐色的凋亡细胞,对照组、MP组、BMSCs组和MP+BMSCs组的细胞凋亡率分别为(48.47±5.70)%、(31.95±3.58)%、(41.39±2.33)%和(23.48±2.69)%,其中,MP组(q=14.84,P<0.0001)和BMSCs组(q=6.716,P= 0.0002)明显低于对照组,MP+BMSCs组明显低于MP组(q=7.332,P=0.0001)和BMSCs组(q=15.46,P<0.0001)(图2、表2)。

表 1 各组大鼠术后BBB运动功能秩和评分的比较(n=10)Table 1 Comparison of Basso-Beattie-Bresnahan rank scores among all groups(n=10)
MP:甲强龙;BMSCs:骨髓间充质干细胞;与对照组比较,aP<0.05;与MP组比较,bP<0.05;与BMSCs组比较,cP<0.05
MP:methylprednisolone;BMSCs:bone marrow mesenchymal stem cell;aP<0.05 compared with control group;bP<0.05 compared with MP group;cP<0.05 compared with BMSCs group

BMSCs:骨髓间充质干细胞
BMSCs:bone marrow mesenchymal stem cells
A.原代BMSCs;B.第3代BMSCs(7 d);C.第3代BMSCs(14 d)
A.BMSCs at primary passage;B.BMSCs at the 3 rd passage (day 7);C.BMSCs at the 3 rd passage (day 14)
图1 培养的BMSCs细胞的形态
Fig1 Morphology of BMSCs in culture
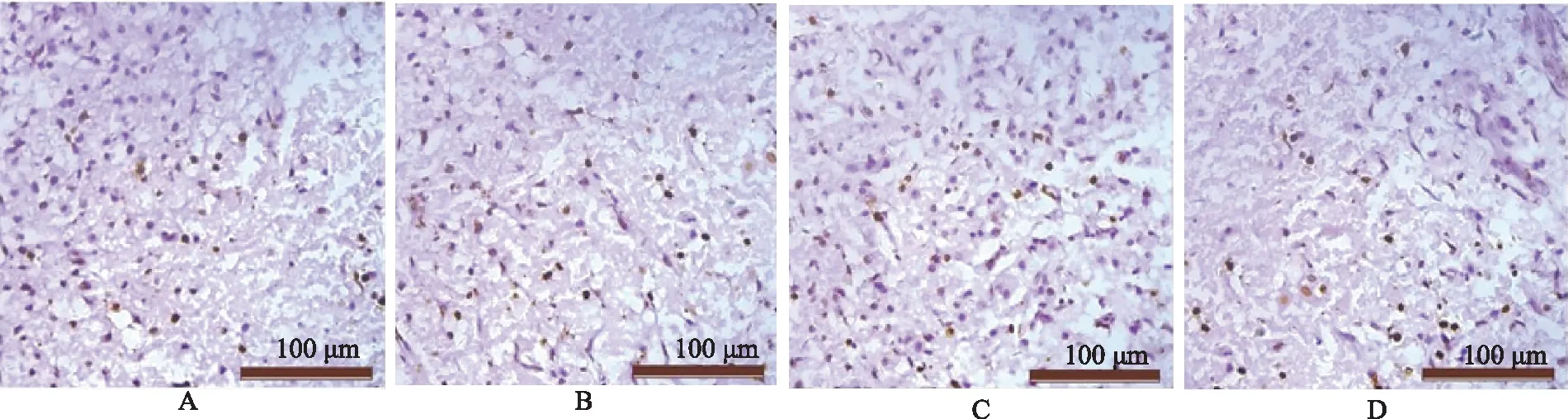
A.对照组;B.MP组;C.BMSCs组;D.MP+BMSCs组
A.control group;B.MP group;C.BMSCs group;D.MP+BMSCs group
图2 Tunel染色结果
Fig2 Results of Tunel staining
脊髓TNF-α、IL-1β表达阳性细胞数术后14 d,脊髓切片TNF-α、IL- 1β免疫组织化学染色结果显示,各组均可见不同程度阳性细胞胞浆呈棕黄色或棕褐色,MP组、BMSCs组和MP+BMSCs组TNF-α和IL- 1β阳性细胞数均有不同程度减少(图3、4)。MP组(q=14.71,P<0.0001;q=6.710,P<0.0001)和BMSCs组(q=6.502,P=0.0001;q=2.849,P=0.0514)的TNF-α及IL- 1β阳性细胞数均明显低于对照组,MP组(q=5.573,P=0.0004;q=4.596,P=0.0025)和BMSCs组(q=13.780,P<0.0001;q=8.456,P<0.0001)的TNF-α及IL- 1β阳性细胞数明显高于MP+BMSCs组(表2)。
BrdU单染结果术后14 d,BMSCs组和MP+BMSCs组脊髓切片行BrdU单染,结果显示在脊髓损伤区内均可见胞核呈棕色染色的阳性细胞;BMSCs组的BrdU阳性率为(6.6000±0.3399)%,明显低于MP+BMSCs组的(9.3000±0.5175)%(t=4.361,P=0.0004)。

A.对照组;B.MP组;C.BMSCs组;D.MP+BMSCs组
A.control group;B.MP group;C.BMSCs group;D.MP+BMSCs group
图3 脊髓组织肿瘤坏死因子-α免疫组织化学染色结果
Fig3 Results of immunohistochemical staining of tumor necrosis fator-α

A.对照组;B.MP组;C.BMSCs组;D.MP+BMSCs组
A.control group;B.MP group;C.BMSCs group;D.MP+BMSCs group
图4 脊髓组织白细胞介素- 1β免疫组织化学染色结果
Fig4 Results of immunohistochemical staining of interleukin- 1β

表 2 术后14 d各组大鼠TNF-α和IL- 1β阳性细胞数及细胞凋亡率的比较(-±s,n=10)Table 2 Comparison of positive cells and apoptotic rates of TNF-α and IL- 1β among all groups 14 days after operation(-±s,n=10)
TNF-α:肿瘤坏死因子-α;IL- 1β:白细胞介素- 1β;与对照组比较,aP<0.05;与MP组比较,bP<0.05;与BMSCs组比较,cP<0.05
TNF-α:tumor necrosis factor-α;IL- 1β:interleukin- 1β;aP<0.05 compared with control group;bP<0.05 compared with MP group;cP<0.05 compared with BMSCs group
讨 论
SCI按病理过程分为原发性损伤和继发性损伤,前者是外界暴力作用的瞬间对脊髓组织直接破坏,即刻引起神经细胞损伤;后者则主要源于脊髓损伤后局部组织结构发生脂质过氧化反应、炎性反应及自由基等一系列病理生理变化[9- 10],继而导致神经功能持续减退、恶化,通常原发性损伤无法干预,而继发性损伤是可控的。研究表明,SCI后的继发性损伤是多种因素作用下发生的神经细胞程序化死亡,在诸如氧化应激、炎性因子、钙超载、兴奋性毒性等影响因素中,炎症反应被认为不仅作用于神经细胞,而且可以加重或诱导其他有害因素的发生发展[10]。这些因素的综合效应引发的瀑布反应可加重相应部位的继发性损伤。
已有研究表明,BMSCs具有多向分化潜能,通过局部移植治疗SCI,自身迁移至受损部位,可以填补脊髓损伤后导致的囊性空洞及裂隙,防治或减轻脊髓损伤区域因瘢痕填充而导致的神经功能的永久性丧失,通过直接分化成神经元细胞而促进损伤脊髓的修复[11- 12]。此外,BMSCs本身是一种支持细胞,可调控并减弱Toll样受体- 4(toll-like receptors- 4,TLR- 4)介导的信号通路传导,降低炎症因子的释放而发挥抗炎和神经保护作用[2]。然而,随着BMSCs研究深入,研究发现BMSCs的迁移有细胞数目饱和性,对脊髓功能恢复不能达到理想效果[13]。从BMSCs治疗SCI的角度来看,如何有效使BMSCs在脊髓损伤区域中发挥作用是需要解决的问题。
尽管BMSCs具有一定抗炎、抗凋亡作用,但其本身也极易受到各种有害因素的影响,尤其是SCI后炎性级联反应产生大量具有神经毒性作用的细胞因子,不仅引起神经细胞的凋亡、坏死,髓鞘的变性等组织结构改变,阻碍了神经功能恢复,而且干扰移植BMSCs种植、迁移[10],如何使BMSCs在脊髓损伤区域中发挥更大的作用是脊髓更好恢复的关键之一[9]。为了避免BMSCs浓度及计量过大造次脊髓的二次损伤,本研究中依据常规BMSCs局部注射方法[4],BMSCs局部注射浓度为1×106/ml,剂量1 μl。
MP强大的抗炎作用能控制脊髓的伤后炎症反应,是目前临床上治疗急性SCI的首选药物[14]。大量研究证实,MP可明显降低TNF-α水平,减弱 TNF-α 诱导的炎性级联反应,通过细胞核信号传导途径下调caspase- 3等凋亡基因表达,并且强大的抗氧化作用可抑制急性SCI后机体在应激状态下产生具有凋亡效应的含氧化合物,进一步减少神经细胞凋亡[15]。SCI早期运用大剂量MP能极大减轻脊髓组织水肿,保护受损脊髓形态结构及轮廓。尽管尚未有研究表明BMSCs上存在MP受体,但通过减轻局部炎症,调节多种趋化因子受体,不仅阻碍神经细胞的凋亡程序启动,挽救尚存神经元,保护受损脊髓[16- 17],同时也通过改善SCI后局部微环境,而减少BMSCs凋亡,进而使其发挥替代、转化的作用。
研究表明上述治疗方法均能有效减少SCI后的炎症反应并减少神经细胞的调亡,但单一手段并不能真正提高疗效,上述两种手段的联合应用可以针对不同靶点进行有效干预,从而发挥叠加或协同作用,已经成为当前SCI治疗的新思路。
急性SCI后,继发性炎症反应最开始通过TLR- 4信号通路促进TNF-α、IL- 1β的表达[18]。TNF-α被认为是炎症过程中重要启动因子,介导炎症反应的之间枢纽,能够调控其他细胞因子的产生,在机体遭受损伤和炎症过程中具有重要的作用,同时在局部炎症放大中具有重要意义[19- 20]。IL- 1β被认为可能参与了诱导神经元、少突胶质细胞和星形细胞的凋亡并造成继发性损伤[21- 22]。本研究以TNF-α、IL- 1β作为炎症反应的观测指标,能够较为客观地反映出炎症反应的变化。结果显示,术后14 d,MP组、BMSCs组和MP+BMSCs组的TNF-α和IL- 1β表达均较对照组明显减少,MP+BMSCs组的TNF-α和IL- 1β表达同样较MP组和BMSCs组明显减少,MP组则明显少于BMSCs组,说明BMSCs及MP对损伤脊髓组织炎症反应都有一定抑制作用,且MP强于BMSCs。本研究还发现,BBB评分在术后7、14 d观察时间段MP组和BMSCs组均明显高于对照组,而MP+BMSCs组明显高于其他3组,肯定了MP与BMSCs分别单独运用均能有效地提高神经功能恢复,也进一步说明MP在协同BMSCs治疗SCI中,能有效共同促进脊髓运动功能恢复。这与其他研究发现MP在羊胚胎间充质干细胞[23]、大鼠胎盘间充质干细胞[7]中有效提高SCI后的神经功能恢复结果相吻合。
急性SCI后,早期炎性反应较重,机体启动凋亡程序后,引起体内相关病理生理的改变,当BMSCs移植于受损脊髓后,有效存活的移植细胞数目远低于预期效果。而早期MP大剂量使用在阻挡损伤区域扩大、防止神经细胞凋亡上发挥积极作用[24]。不仅防止残存运动神经元大量坏死丢失,而且恢复了脊髓组织的微环境,阻断了炎性因子诱导移植BMSCs凋亡,使BMSCs释放神经营养因子,协助脊髓组织再生。本研究结果显示,MP提高了BMSCs存活数,MP+BMSCs组BrdU阳性细胞在移植区域存活的数量明显多于BMSCs组。Tan等[13]研究亦证实,阻断IL- 6信号转导途径可明显提高BMSCs的存活率,再次证实MP在干细胞移植治疗SCI中发挥着不可小觑作用。
综上,本研究结果显示,MP可明显提高BMSCs移植治疗SCI的大鼠后肢运动功能恢复,二者可协同降低局部TNF-α和IL- 1β表达水平,并且MP可有效提升移植BMSCs的存活,但MP在BMSCs治疗SCI相关作用中的分子生物学机制及MP是否有助于BMSCs向神经细胞分化仍有待进一步探索。
[1] Tetzlaff W,Okon EB,Karimi-Abdolrezaee S,et al. A systematic review of cellular transplantation therapies for spinal cord injury[J].J Neurotrauma,2011,28(8):1611- 1682. doi:10.1089/neu.2009.1177.
[2] Han D,Wu C,Xiong Q,et al. Anti-inflammatory mechanism of bone marrow mesenchymal stem cell transplantation in rat model of spinal cord injury[J].Cell Biochem Biophys,2015,71(3):1341- 1347.doi:10.1007/s12013- 014- 0354- 1.
[3] Wright KT,El Masri W,Osman A,et al. Concise review:bone marrow for the treatment of spinal cord injury:mechanisms and clinical applications[J].Stem cells,2011,29(2):169- 178.doi:10.1002/stem.570.
[4] Novikova LN,Brohlin M,Kingham PJ,et al. Neuroprotective and growth-promoting effects of bone marrow stromal cells after cervical spinal cord injury in adult rats[J].Cytotherapy,2011,13(7):873- 887.doi:10.3109/14653249.2011. 574116.
[5] Bowers CA,Kundu B,Rosenbluth J,et al. Patients with spinal cord injuries favor administration of methylprednisolone[J].PLoS One,2016,11(1):e0145991.doi:10.1371/journal. pone.0145991.
[6] Hall ED.Methylprednisolone for the treatment of patients with acute spinal cord injuries:a propensity score-matched cohort study from a Canadian multi-center spinal cord injury registry[J].J Neurotrauma,2016,33(10):972- 974.doi:10. 1089/neu.2016.4473.
[7] Tan JW,Wang KY,Liao GJ,et al. Neuroprotective effect of methylprednisolone combined with placenta-derived mesenchymal stem cell in rabbit model of spinal cord injury[J].Int J Clin Exp Pathol,2015,8(8):8976- 8982.
[8] Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1- 21.doi:10.1089/neu. 1995. 12.1.
[9] Moghaddam A,Child C,Bruckner T,et al. Posttraumatic inflammation as a key to neuroregeneration after traumatic spinal cord injury[J].IJMS,2015,16(4):7900- 7916.doi:10.3390/ijms16047900.
[10] Norenberg MD,Smith J,Marcillo A.The pathology of human spinal cord injury:defining the problems[J].J Neurotrauma,2004,21(4):429- 440.doi:10.1089/089771504323004575.
[11] Hu Y,Zhang Y,Tian K,et al. Effects of nerve growth factor and basic fibroblast growth factor dual gene modification on rat bone marrow mesenchymal stem cell differentiation into neuron-like cellsinvitro[J].Mol Med Rep,2016,13(1):49- 58.doi:10.3892/mmr.2015.4553.
[12] Zeng R,Wang LW,Hu ZB,et al. Differentiation of human bone marrow mesenchymal stem cells into neuron-like cellsinvitro[J].Spine,2011,36(13):997-1005.doi:10. 1097/BRS.0b013e3181eab764.
[13] Tan Y,Uchida K,Nakajima H,et al. Blockade of interleukin 6 signaling improves the survival rate of transplanted bone marrow stromal cells and increases locomotor function in mice with spinal cord injury[J].J Neuropathol Exp Neurol,2013,72(10):980- 993.doi:10.1097/NEN.0b013e3182a79de9.
[14] Hurlbert RJ,Hadley MN,Walters BC,et al. Pharmacological therapy for acute spinal cord injury[J].Neurosurgery,2013,72(Supp2):93- 105.doi:10.1227/NEU.0b013e31827765c6.
[15] Merola A,O’Brien MF,Castro BA,et al. Histologic characterization of acute spinal cord injury treated with intravenous methylprednisolone[J].J Orthop Trauma,2002,16(3):155- 161.doi:10.1097/00005131- 200203000- 00003.
[16] 黄颖,王辉,张春强,等.大剂量甲泼尼龙对脊髓损伤早期基因表达谱的影响[J].中国修复重建外科杂志[J],2011,25(3):327- 333.
[17] Walsh KA,Weant KA,Cook AM.Potential benefits of high-dose methylprednisolone in acute spinal cord injuries[J].Orthopedics,2010,33(4):249- 252.doi:10.3928/01477447- 20100225- 15.
[18] Impellizzeri D,Ahmad A,Di Paola R,et al. Role of Toll like receptor 4 signaling pathway in the secondary damage induced by experimental spinal cord injury[J].Immunobiology,2015,220(9):1039- 1049.doi:10.1016/j.imbio.2015. 05. 013.
[19] Wang CX,Nuttin B,Heremans H,et al. Production of tumor necrosis factor in spinal cord following traumatic injury in rats[J].J Neuroimmunol,1996,69(1- 2):151- 156.doi:10.1016/0165- 5728(96)00080-x.
[20] Yune TY,Chang MJ,Kim SJ,et al. Increased production of tumor necrosis factor-alpha induces apoptosis after traumatic spinal cord injury in rats[J].J Neurotrauma,2003,20(2):207- 219.doi:10.1089/08977150360547116.
[21] Boato F,Rosenberger K,Nelissen S,et al. Absence of IL- 1beta positively affects neurological outcome,lesion development and axonal plasticity after spinal cord injury[J].J Neuroinflammation,2013,10(1):6.doi:10.1186/1742- 2094- 10- 6.
[22] Zeng X,Zeng YS,Ma YH,et al. Bone marrow mesenchymal stem cells in a three-dimensional gelatin sponge scaffold attenuate inflammation,promote angiogenesis,and reduce cavity formation in experimental spinal cord injury[J].Cell Transplant,2011,20(11):1881- 1899.doi:10.3727/0963689
11x566181.
[23] Gao S,Ding J,Xiao HJ,et al. Anti-inflammatory and anti-apoptotic effect of combined treatment with methylprednisolone and amniotic membrane mesenchymal stem cells after spinal cord injury in rats[J].Neurochem Res,2014,39(8):1544- 1552.doi:10.1007/s11064- 014- 1344- 9.
[24] Vaquero J,Zurita M,Oya S,et al. Early administration of methylprednisolone decreases apoptotic cell death after spinal cord injury[J].Histol Histopathol,2006,21(10):1091- 1102.doi:10.14670/HH- 21.1091.
RoleofMethylprednisoloneinTreatmentofSpinalCordInjuredwithBoneMarrowMesenchymalStemCellsTransplantationinRatsandItsEffectontheExpressionsofTumorNecrosisFactor-αandInterleukin- 1β
YANG Xinming1,CHENG Yaoyu2,ZHANG Zhenliang2,KANG Cong2
1Department of Orthopedics,2Graduate School,First Affiliated Hospital,Hebei North University,Zhangjiakou,Hebei 075000,China
YANG Xinming Tel:0313- 8046926,E-mail:yxm1120@sohu.com
ObjectiveTo investigate the role of methylprednisolone (MP) in treatment of spinal cord injured (SCI) with bone marrow mesenchymal stem cells (BMSCs) transplantation in rats and its effect on the expressions of tumor necrosis factor-α(TNF-α) and interleukin- 1β(IL- 1β) at the local tissues.MethodsForty male Sprague-Dawley(SD) rats were used to establish the models of SCI according to the modified Allen’s contusion method and then divided into four groups (n=10 in each group) by using random numbers table:MP group,BMSCs group,BMSCs+MP group,and control group.MP was intravenously administrated immediately after SCI.BMSCs labeled by 5-bromo- 2-deoxyuridine(BrdU)were transplanted into the injured sites of spinal cord after two hours of SCI.On the 1 st,7 th,and 14th days after SCI,when functional outcome measurements were evaluated by the Basso-Beattie-Bresnahan (BBB) score.On the 14th day after treatment,the spine cord tissues were harvested for the TNF-α/IL- 1β immunohistochemistry,and Tunel staining method was used to detect cell apoptosis rate.BrdU-positive BMSCs were examined in BMSCs group and BMSCs+MP group.ResultsFunctional recovery of hind limb in MP+BMSCs group was the best among the four group.On the 1 st day after injury,the BBB scores showed no significant difference among four group(χ2=1.0756,P=0.7829).On the 7th and 14th day,the BBB score of MP+BMSCs group was significantly higher than MP group (χ2=17.7186,P=0.0002;χ2= 24.7259,P<0.0001) and BMSCs group (χ2=15.8110,P=0.0024;χ2=25.6014,P<0.0001),respectively.The BBB score of the control group was significantly lower than MP group (χ2=8.3265,P=0.0325;χ2=13.5060,P=0.0062) and BMSCs group (χ2=14.1166,P=0.0036;χ2=8.9613,P=0.0299),respectively.On the 14th day,immunohistochemical staining presented that the TNF-α and IL- 1β-positive cells in MP+BMSCs group were significantly lower than MP group (q=5.573,P=0.0004;q=4.596,P=0.0025) and BMSCs group (q=13.780,P<0.0001;q=8.456,P<0.0001),and control group was significantly higher than MP group (q=14.710,P<0.0001;q=6.710,P<0.0001) and BMSCs group (q=6.502,P=0.0001;q=2.849,P=0.0514).Tunel staining showed the apoptotic rate of spinal cord cells in four group were (48.47±5.70)%,(31.95±3.58)%,(41.39±2.33)%,and (23.48±2.69)%.The number of apoptotic cells in MP+BMSCs group was least in four groups;compared with the control group,the apoptotic rate significantly decreased in MP group (q=14.840,P<0.0001) and BMSCs group (q=6.716,P=0.0002);compared with the MP+BMSCs group,the apoptotic rate was significantly increased in the MP group (q=7.332,P=0.0001) and BMSCs group (q=15.460,P<0.0001). BrdU staining revealed BrdU-positive rate in MP+BMSCs group [(9.3000±0.5175)%] was significantly higher than that in BMSCs group [(6.6000±0.3399)%](t=4.361,P=0.0004).ConclusionMP can improve the function of the hind limbs of SCI rats treated with BMSCs transplantation and lower the expressions of TNF-α and IL- 1β in injured tissue.
spinal cord injury;methylprednisolone;bone marrow mesenchymal stem cell;tumor necrosis factor-α;interleukin- 1β;BrdU stain
河北省卫生厅医学科学研究重点项目计划(20110176)和河北北方学院创新人才培育基金项目(CXRC1322)Support by the Key Project for Medical Science Research of Hebei Province Health Department(20110176)and the Innovative Talents Cultivation Foundation of Hebei North University(CXRC1322)
杨新明 电话:0313- 8046926,电子邮件:yxm1120@sohu.com
R318.5
A
1000- 503X(2017)05- 0615- 08
10.3881/j.issn.1000- 503X.2017.05.004
ActaAcadMedSin,2017,39(5):615-622
2016- 09- 26)

