LINC00963靶向miR-525-5p调控LPS诱导的牙周膜细胞损伤的机制研究
喻茂文 柳建磊 汤洪波 陈建军 莫邦竹
长链非编码RNA(long noncoding RNA,lncRNA)通过调节微小RNA(MicroRNA,miRNA)在牙周炎的发展中发挥调节作用[2-3]。LINC00963是一种在癌症病理进展中具有重要作用的lncRNA[4],被认为是细胞凋亡的调节因子。研究表明,LINC00963在急性肾损伤小鼠和细胞模型中高表达,敲低其表达可靶向miR-128-3p减轻急性肾损伤[5]。LINC00963在慢性肾衰竭小鼠模型中高表达,干扰其表达可抑制慢性肾衰竭造成的氧化应激[6]。MiR-525-5p在心肌梗死中下调表达[7]。miR-525-5p在脑缺血再灌注损伤中下调表达,敲低其表达可诱导细胞凋亡,增加脑梗死面积[8]。可见LINC00963和miR-525-5p可以影响细胞损伤过程,但二者在酯多糖(lipopolysaccharide, LPS)诱导的牙周膜细胞损伤中的表达及其对LPS诱导的牙周膜细胞损伤的影响尚未可知。本研究构建了LPS刺激的人牙周膜细胞作为细胞模型,考察LINC00963和miR-525-5p对此模型中细胞凋亡和炎症因子表达的影响,并进行LINC00963的机制探索。
1 材料与方法
1.1 材料
LipofectamineTM2000、增强化学发光(enhanced chemiluminescence,ECL)试剂底物(Invitrogen,美国); PrimeScript RT试剂盒、SYBR Master Mix试剂盒(Takara,日本); miScript Reverse Transcription试剂盒、miScript SYBR Green PCR试剂盒(Qiagen,德国); si-NC、si-LINC00963、miR-NC、miR-525-5p、anti-miR-NC、anti-miR-525-5p(上海GenePharma);Annexin V-FITC/PI凋亡试剂盒(南京KeyGen); TNF-α和IL-1βELISA试剂盒(Abcam,美国)。
1.2 细胞分离培养
收集在本院进行正畸的健康志愿者离体牙,研究获得参与者的知情同意,经医院伦理批准通过。将牙周膜组织从牙根表面轻轻刮下,根据先前的报道[9]分离人牙周膜细胞(human periodontal ligament cells, hPDLCs),将其接种到含有10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基中生长,并保持在5% CO2和37 ℃的环境。
1.3 细胞处理与分组
取第2~3 代牙周膜细胞分为Con组(对照)、LPS组(10 μg/mL LPS诱导牙周膜细胞24 h)、LPS+si-NC组(LPS+转染si-NC)、LPS+si-LINC00963组(LPS+转染si-LINC00963)、LPS+miR-NC组(LPS+转染miR-NC)、LPS+miR-525-5p组(LPS+转染miR-525-5p)、LPS+si-LINC00963+anti-miR-NC组(LPS+转染si-LINC00963+anti-miR-NC)、LPS+si-LINC00963+anti-miR-525-5p组(LPS+转染si-LINC00963+anti-miR-525-5p)。根据制造商Invitrogen的操作规程,当牙周膜细胞达到70%~80%融合时,使用LipofectamineTM2000进行转染。转染24 h后,进行10 μg/mL LPS诱导,持续24 h。
1.4 RT-qPCR检测LINC00963和miR-525-5p表达
将Con组、LPS组和各实验组中的牙周膜细胞加入Trizol试剂提取总RNA。检测LINC00963表达时,根据说明,使用PrimeScript RT试剂盒用10 μL逆转录系统将总RNA逆转录为cDNA。qPCR实验是使用SYBR Master Mix试剂盒在ABI 7900HT定量PCR系统进行的。检测miR-525-5p表达时,根据说明,使用miScript Reverse Transcription试剂盒制备cDNA,miScript SYBR Green PCR试剂盒进行qPCR。将GAPDH和U6用作内参,采用2-ΔΔCt法计算LINC00963和miR-525-5p水平。引物如下(5′-3′):LINC00963 F:GGTAAATCGAGGCCCAGAGAT,R:ACGTGGATGACAGCGTGTGA。GAPDH F:AGTCCACTGGCGTCTTCA,R:GAG-TCCTTCCACGATACCAA。miR-525-5p F:GTCGTATCCAGTGCGTGTCGTG,R:GCGAGCACAGAATTAATAC-GACTCAC。U6 F:CTCGCTTCGGCAGCACA,R:AACG-CTTCACGAATTTGCGT。
1.5 ELISA检测炎症因子TNF-α和IL-1β水平
使用ELISA试剂盒测定Con组、LPS组和各实验组中的牙周膜细胞上清液中TNF-α和IL-1β水平。
1.6 流式细胞术检测细胞凋亡
使用Annexin V-FITC/PI凋亡试剂盒于流式细胞仪分析不同组的牙周膜细胞凋亡率(%)。
1.7 Western blot检测B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达
将Con组、LPS组和各实验组中牙周膜细胞于RIPA裂解缓冲液在冰上反应30 min。使用Bio-Rad电泳仪,SDS-PAGE(10%凝胶)分析含有20 μg总蛋白的样品,并转膜。将膜与抗Bcl-2、Bax和GAPDH(对照)抗体(均为1∶1 000)在4 ℃过夜,并与山羊抗兔IgG-辣根过氧化物酶二抗在室温下孵育1 h。随后将膜与ECL溶液孵育进行成像分析。
1.8 双荧光素酶报告实验
构建含有miR-525-5p结合位点的LINC00963野生型(WT)和突变型(MUT)荧光素酶报告质粒,命名为WT-LINC00963和MUT-LINC00963。随后,将两个质粒分别与miR-NC或miR-525-5p共转染到牙周膜细胞中,转染48 h后收集细胞,利用双荧光素酶报告检测系统检测相关荧光素酶活性。
1.9 统计学分析
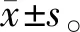
2 结 果
2.1 LINC00963和miR-525-5p在LPS诱导的牙周膜细胞损伤中的表达
LPS诱导牙周膜细胞后,LPS组LINC00963表达水平约为Con组的2.74 倍,miR-525-5p表达水平约为Con组的0.35倍(P<0.05)(图 1)。
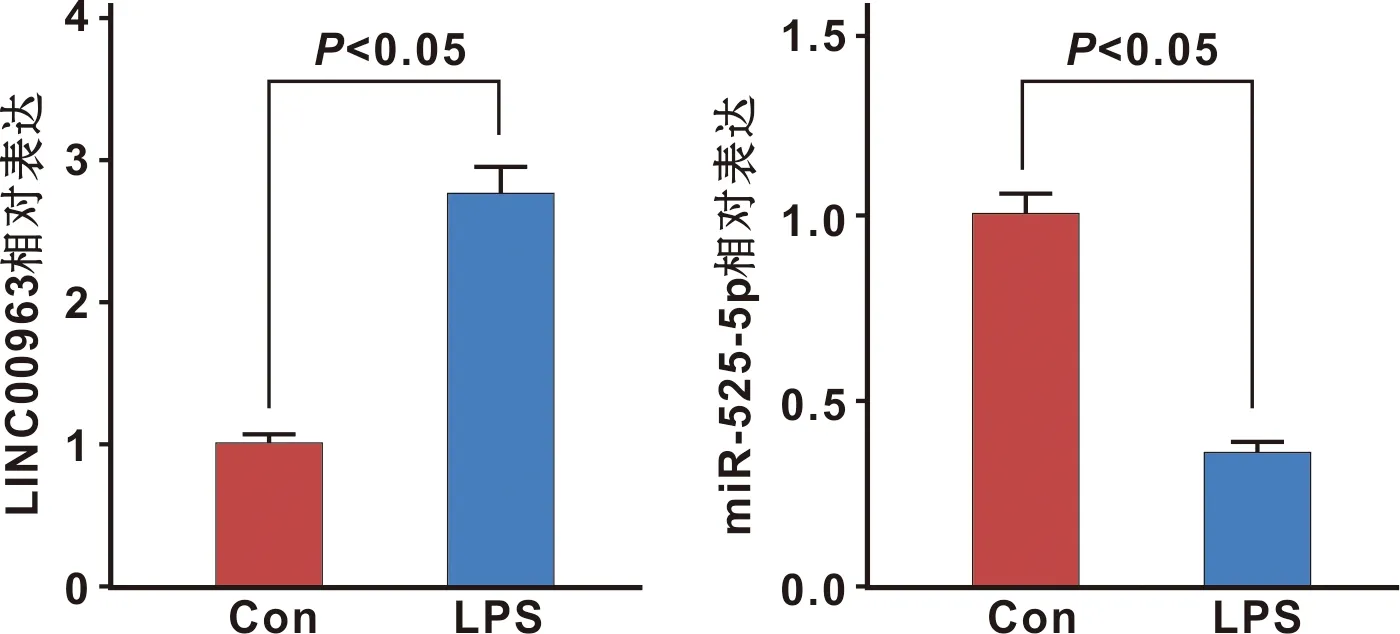
图 1 LINC00963和miR-525-5p在LPS诱导的牙周膜细胞损伤中的表达
2.2 干扰LINC00963表达对LPS诱导的牙周膜细胞炎症因子表达的影响
LPS组牙周膜细胞中LINC00963表达水平、TNF-α和IL-1β水平分别比Con组增加了约1.88、1.80和2.33 倍(P<0.05),干扰LINC00963表达后,LPS+si-LINC00963组牙周膜细胞中LINC00963表达水平、TNF-α和IL-1β水平比LPS+si-NC组减少了约0.47、 0.57和0.48 倍(P<0.05)(图 2)。
图 2 干扰LINC00963表达对LPS诱导的牙周膜细胞炎症因子表达的影响
2.3 干扰LINC00963表达对LPS诱导的牙周膜细胞凋亡的影响
LPS组牙周膜细胞凋亡率、Bcl-2、Bax蛋白水平分别是Con组的约3.68、0.39和4.83 倍(P<0.05),干扰LINC00963表达后,LPS+si-LINC00963组牙周膜细胞凋亡率、Bcl-2、Bax蛋白水平是LPS+si-NC 组的约0.41、2.5和0.34 倍(P<0.05)(图 3)。

图 3 干扰LINC00963表达对LPS诱导的牙周膜细胞凋亡的影响
2.4 LINC00963靶向调控miR-525-5p的表达
StarBase软件对LINC00963与miR-525-5p靶向结合位点预测结果见图 4A。 miR-NC组WT-LINC00963和MUT-LINC00963的荧光素酶活性分别为1.02±0.05、1.00±0.06,miR-525-5p组WT-LINC00963和MUT-LINC00963的荧光素酶活性分别为0.62±0.04、1.03±0.07,WT-LINC00963的荧光素酶活性在miR-NC组和miR-525-5p组之间差异有统计学意义(P<0.05),MUT-LINC00963的荧光素酶活性在miR-NC组和miR-525-5p组之间差异无统计学意义(P>0.05, 图 4B)。miR-525-5p表达水平在pcDNA-LINC00963组(0.33±0.03)显著低于pcDNA组(1.00±0.05)(P<0.05), si-LINC00963组(2.71±0.21)却显著高于si-NC组(0.98±0.07)(P<0.05)(图 4C)。
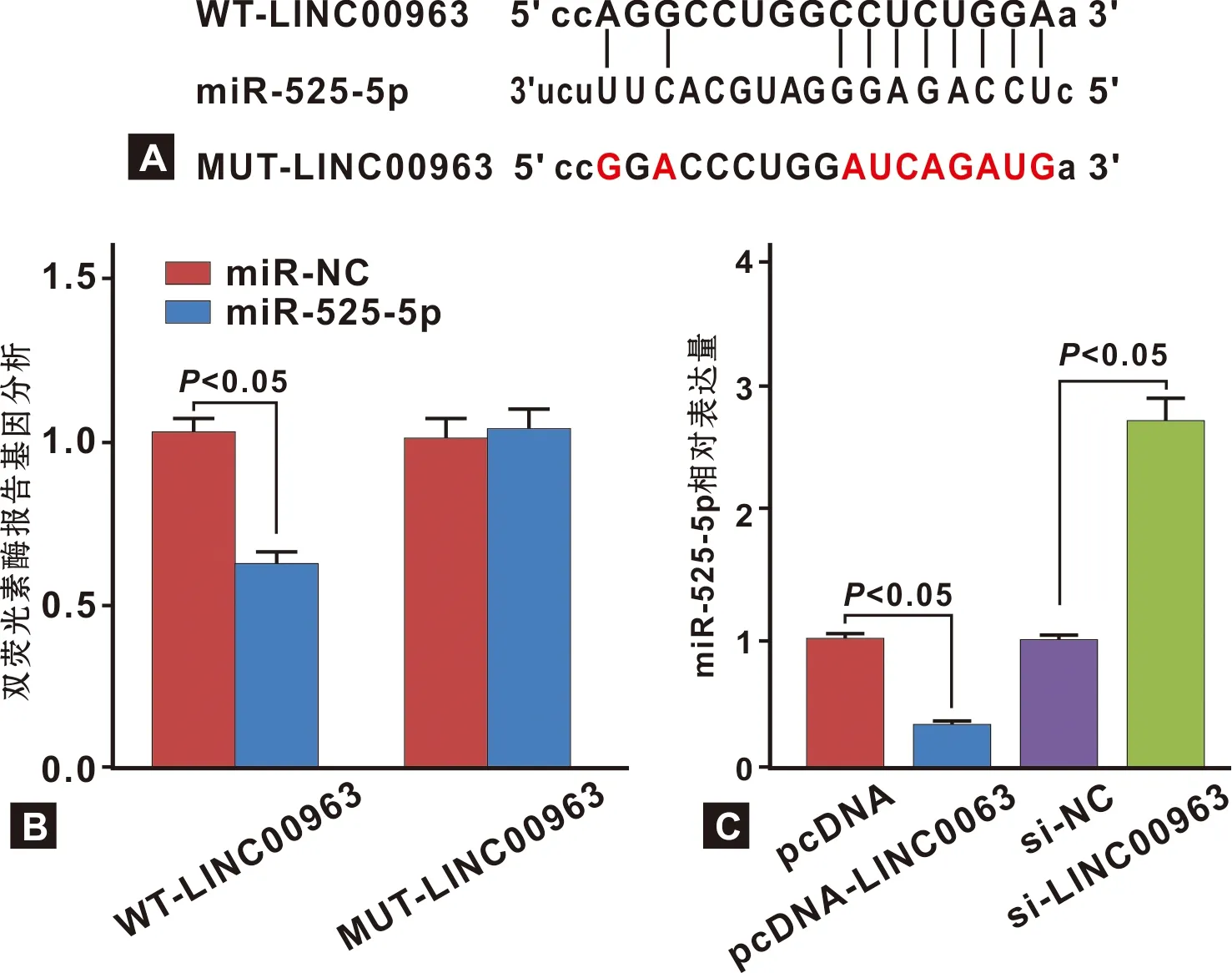
图 4 LINC00963靶向调控miR-525-5p的表达
2.5 miR-525-5p过表达对LPS诱导牙周膜细胞损伤影响
miR-525-5p过表达后,LPS+miR-525-5p组牙周膜细胞中miR-525-5p表达水平是LPS+miR-NC组的约3.01 倍,TNF-α、IL-1β水平、凋亡率和Bax蛋白水平分别比LPS+miR-NC组减少了约0.25、0.30、0.53、 0.59 倍,Bcl-2蛋白水平比LPS+miR-NC组增加了约1.18 倍(P<0.05)(图 5)。
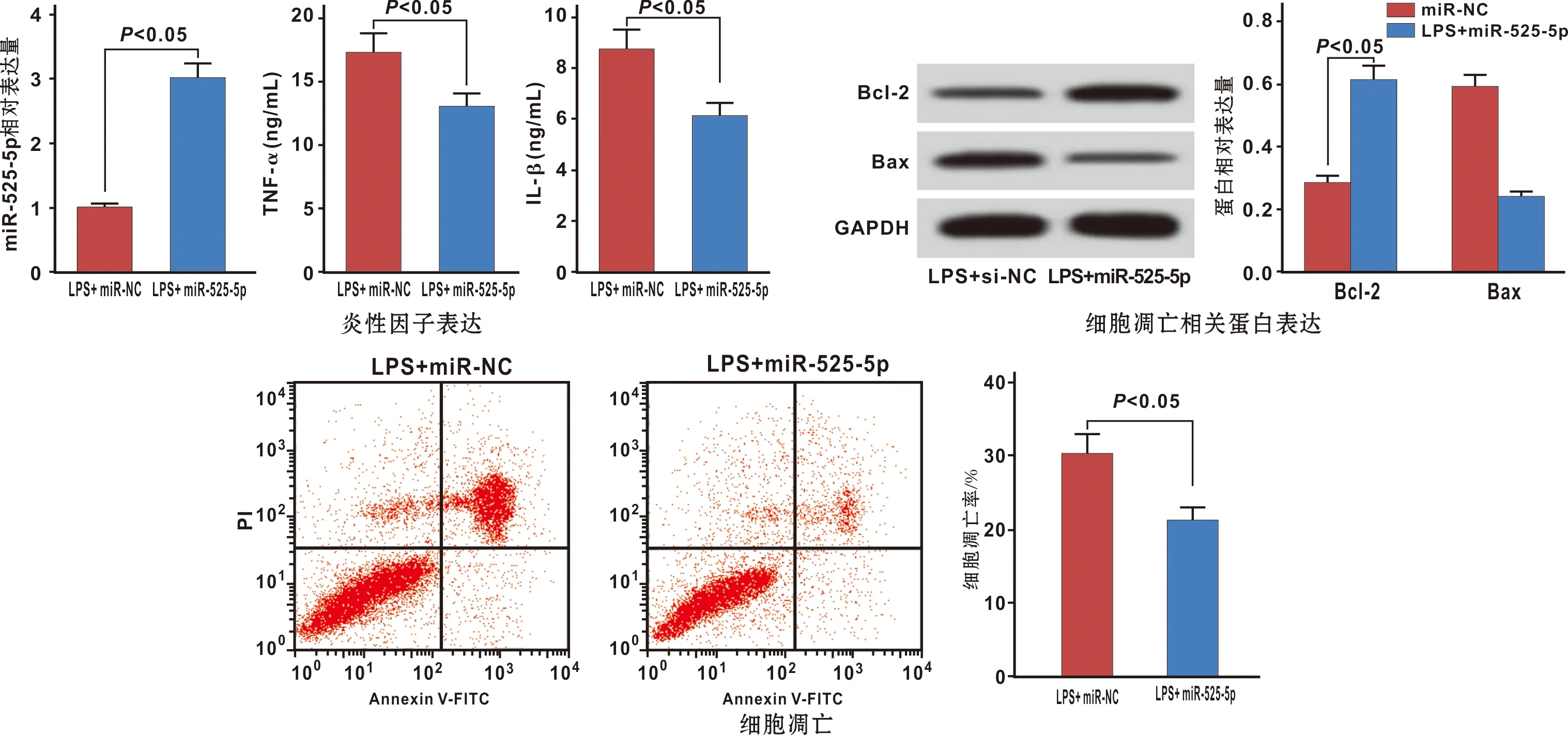
图 5 miR-525-5p过表达对LPS诱导的牙周膜细胞损伤的影响
2.6 下调miR-525-5p表达逆转了干扰LINC00963表达对LPS诱导的牙周膜细胞损伤的作用
同时下调miR-525-5p和干扰LINC00963表达后,LPS+si-LINC00963+anti-miR-525-5p组牙周膜细胞中miR-525-5p表达水平低于LPS+si-LINC00963+anti-miR-NC组,TNF-α、IL-1β水平、凋亡率和Bax蛋白水平高于LPS+si-LINC00963+anti-miR-NC组,Bcl-2蛋白水平低于LPS+si-LINC00963+anti-miR-NC组(P<0.05)(图 6)。

图 6 下调miR-525-5p表达逆转了干扰LINC00963表达对LPS诱导的牙周膜细胞损伤的作用
3 讨 论
LPS也称为内毒素,是炎症反应的有效激活剂,导致炎症因子如IL-1β, IL-6, IL-8和TNF-α等炎症因子的过度产生[10-11]。本研究同样利用LPS诱导牙周膜细胞损伤,检测到了LINC00963的上调。在乳腺癌[12]、骨肉瘤[13]、胃癌[14]等癌症中, LINC00963通过调节肿瘤细胞的生长、凋亡、转移、分化等过程促进癌症的恶性进展。此外,根据Xie等[5]的研究结果,在缺氧诱导的HK-2细胞模型和缺血再灌注诱导的急性肾损伤大鼠模型中,LINC00963的表达均增加。本研究发现干扰LINC00963表达可通过抑制促凋亡蛋白Bax表达、促进抗凋亡蛋白Bcl-2表达来减少LPS诱导的牙周膜细胞凋亡。促炎因子TNF-α和IL-1β是牙周炎中炎性损伤的重要调节剂[15]。本研究表明,干扰LINC00963表达抑制了炎症因子TNF-α、IL-1β的表达。通过检测这些指标,本研究发现,干扰LINC00963表达可降低炎症因子TNF-α、IL-1β的表达和细胞凋亡,从而在牙周炎中起保护作用,这与Chen等[6]报道的si-LINC00963减少慢性肾功能衰竭大鼠模型中TNF-α、IL-6及细胞凋亡率、Bax和增加Bcl-2的结果相类似。
大多数lncRNA主要靶向miRNA以发挥其功能[16]。本研究中,miR-525-5p是牙周膜细胞中LINC00963的直接靶标。miR-525-5p作为一种肿瘤抑制因子,被确定在胶质瘤[17]、宫颈癌[18]中表达下调。最近的研究表明, miR-525-5p减轻了Ang-II处理的心肌细胞的肥大反应[19]。但miR-525-5p在牙周炎中的功能仍然未知。本实验中,牙周膜细胞中的miR-525-5p被LPS下调,miR-525-5p过表达通过抑制细胞凋亡和炎症因子TNF-α、 IL-1β表达,在LPS诱导的牙周膜细胞中显示出有益作用。此外,下调miR-525-5p后,干扰LINC00963表达对LPS诱导的牙周膜细胞损伤的保护作用被逆转,这表明下调miR-525-5p可以反向增加被si-LINC00963减少的LPS损伤牙周膜细胞的凋亡和炎症因子表达,也表明LINC00963通过靶向LINC00963实现对LPS诱导的牙周膜细胞损伤的调节作用。
总之,本研究首次发现,在LPS诱导的牙周膜细胞中,LINC00963表达增加,干扰LINC00963表达抑制LPS诱导的牙周膜细胞凋亡和炎症因子表达,可能与靶向miR-525-5p有关。本研究结果表明,LINC00963和miR-525-5p可能成为治疗牙周炎的新靶标。

