PRDX4在口腔鳞状细胞癌中的表达及其临床意义
王丽梅 李国平 陈余朋 郑珂
口腔鳞状细胞癌(oral squamous cell carcinomas, OSCC)是一种致命的疾病,由于肿瘤侵袭性、颈部淋巴结转移和最终的血行转移导致不良的预后[1-2]。尽管在诊断和治疗策略方面取得了很大进展,但由于肿瘤复发和转移, 50% OSCC患者仍在5 年内死亡,因而OSCC诊断与治疗的关键还在于探索出更加有效的预后相关因子[3-4]。
过氧化物还原素(peroxiredoxins,PRDXs)由6 个小的抗氧化同工酶(PRDX1-6)组成,属于氧化还原家族蛋白,其广泛分布在人体各组织中[5]。在这6 类PRDXs中,只有PRDX4位于内质网中,参与调节过氧化物酶活性和氧化还原的过程[5-6]。由细胞内氧化还原平衡的破坏所引起的氧化应激,与肿瘤干细胞的生存和增殖密切相关,已有研究表明其表达失调促进多种肿瘤的发生发展5,7]。现有关于PRDX4在OSCC中的相关研究尚少,与各临床病理参数之间的相关关系也并不明确。为了进一步验证PRDX4在口腔鳞状细胞癌发生发展中的作用,本研究通过免疫组化检测108 例OSCC病例标本中PRDX4的表达及与上皮间质转化相关蛋白E-cad及Vimentin表达,分析PRDX4表达与各临床病理因素及预后的关系及其与E-cad及Vimentin表达的相关性,探讨其可能机制,为OSCC治疗和预后评估提供潜在标记物。
1 资料与方法
1.1 病例选择
纳入2012 年1 月~2016 年12 月在福建医科大学附属第一医院口腔颌面头颈外科手术的108 例 OSCC 患者。
纳入标准: (1)原发于口腔的鳞状细胞癌且术前未接受放射治疗或化学治疗; (2)切除组织包括肿瘤组织及其周围正常组织; (3)手术包括行原发灶切除及颈淋巴结清扫; (4)具有完整的临床及病理资料。
排除标准: (1)术前接受过放射治疗或化学治疗的口腔鳞状细胞癌病例; (2)手术仅行原发灶切除而未进行颈淋巴结清扫; (3)继发累及口腔的鳞状细胞癌; (4)病例临床及病理资料不全。 肿瘤的组织病理分级采用世界卫生组织(WHO,2016)推荐的标准,临床分期根据 AJCC第八版pTNM分期标准进行分期。随访用电话及门诊电子病历系统随访,确诊之日为随访开始时间,终止事件因肿瘤而死亡,排除非肿瘤的相关死亡。
1.2 组织芯片的制作
每例病例均由病理医师选择两处代表性肿瘤组织区域及一处对照正常组织区域,使用打孔器在供体蜡块的相应位置进行穿刺取样。然后,将穿刺所得的微圆柱形结构植入预先制备的受体蜡块的阵列孔中。
1.3 免疫组织化学
抗体使用以下浓度:PRDX4抗体(184167, 1∶1 000,Abcam,英国);E-cad(MX020,1∶300)、vimentin(福州迈新V9,1∶1 000),操作步骤严格按试剂盒说明进行。
1.4 结果判定
PRDX4及Vimentin染色以细胞浆出现黄色或棕黄色颗粒为阳性; E-cad染色以胞膜出现黄色或棕黄色为阳性。采取二次计分法:每例标本随机选取5 个高倍视野(×400)计数阳性细胞所占肿瘤细胞数的百分比计分,阳性细胞数<5%为0 分;阳性细胞数5%~30%为1 分;阳性细胞数31%~60%为2 分;阳性细胞数>60%为3 分。染色强度计分: 0 分为无色, 1 分为淡黄色, 2 分为棕黄色, 3 分为棕褐色。用染色强度得分和染色百分比得分的乘积作为判断标准, 0~3 分为阴性(-), 3~6 分为弱阳性(+), >6 分为强阳性(++)。
1.5 统计学分析
采用SPSS 23.0统计进行数据分析。运用秩和检验分析癌组织、癌旁正常组织中PRDX4的表达情况,运用非参数检验及多元Logistic有序回归分析PRDX4表达与OSCC病理特征的关系,利用Spearman相关性分析对PRDX4与E-cad、Vimentin之间相关关系进行分析,Kaplan-Meier方法对患者随访的生存情况进行分析。
2 结 果
2.1 OSCC中PRDX4的表达及其与临床病理的关系
通过免疫组织化学检测 PRDX4在108 对OSCC及正常组织中的表达情况,结果显示在口腔鳞状细胞癌组织种PRDX4表达阳性率为68.5%(74/108),癌旁正常口腔上皮样本中PRDX4表达阳性率为4.6%(5/108),PRDX4在口腔癌组织中高表达(P<0.001)(表 1)。PRDX4的表达与肿瘤组织分化程度、淋巴结转移情况及神经侵犯情况有关(P<0.05);与患者的性别、年龄、TNM分期及淋巴间质及脉管癌栓无关(P>0.05)(图 1, 表 2)。通过进一步Logistic回归分析,发现肿瘤分化程度低(低分化vs高分化,OR=6.579,P=0.002)、有淋巴结转移(OR=2.375,P=0.039)是PRDX4高表达的独立危险因素 (表 3)。

表 1 口腔鳞状细胞癌组织及癌旁正常组织中PRDX4的表达
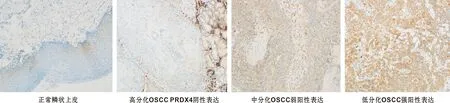
图 1 PRDX4在正常鳞状上皮及不同分化程度的口腔鳞状细胞癌中表达情况(IHC, ×200)

表 2 口腔癌中PRDX4的表达与临床病理参数的相关性
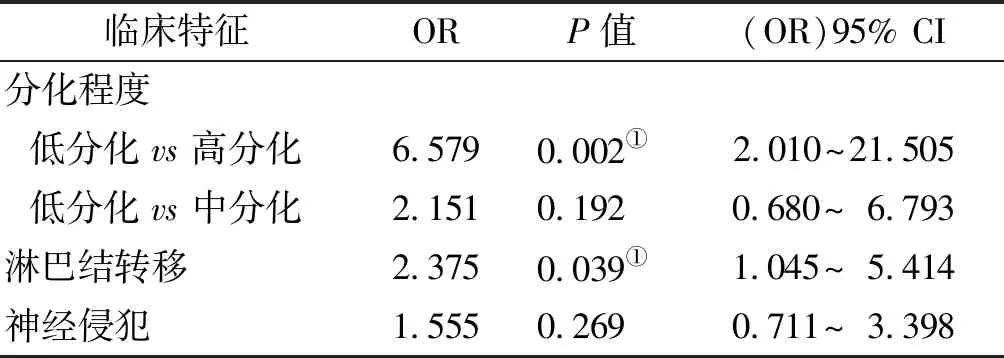
表 3 影响PRDX4表达的多元Logistic回归分析
2.2 OSCC中PRDX4与E-cad和Vimentin表达的关系
分析OSCC肿瘤组织中PRDX4、E-cad及Vimentin的表达情况(图 2),统计学分析结果显示:PRDX4与Vimentin的表达呈正相关(r=0.313,P=0.001),与E-cad的表达呈负相关(r=-0.327,P=0.001)。

图 2 PRDX4、 Vimentin及E-cad的表达(IHC, ×200)
2.3 OSCC患者PRDX4的表达与预后的关系
Kaplan Meier生存分析结果显示PRDX4的表达与OSCC患者总体生存时间显著相关,PRDX4高表达组(强阳性组)总体生存时间显著低于低表达组(阴性或弱阳性)(Log Rankχ2=9.936,P=0.002)(图 3)。

图 3 不同PRDX4表达水平OSCC患者总生存率的K-M分析
3 讨 论
口腔癌是全球第六大最常见的癌症,每年约超过30 万新增病例,其中OSCC约占口腔癌的90%[8]。OSCC对患者的生活质量有极大影响,同时也危及着患者的生命,其中高淋巴结转移率是造成OSCC预后不良的主要因素之一[6,9]。
PRDX4是一种主要的抗氧化剂,越来越多的证据表明它在多种肿瘤侵袭和转移中的作用。在乳腺癌和结肠癌中,PRDX4的升高与远处转移相关[10-11]。在前列腺癌中,PRDX4的高表达与肿瘤分期的增加相关[12]。在对该院口腔颌面头颈手术108 例OSCC患者的研究中,结果证实了PRDX4在OSCC组织中的表达水平明显高于癌旁正常组织。这与既往PRDX4在前列腺癌、结肠癌、乳腺癌中表达升高究结论相似,提示PRDX4可能参与多种肿瘤包括口腔鳞状细胞癌的发生[5]。本研究还发现PRDX4表达与肿瘤分化程度、淋巴结转移及神经侵犯相关,提示PDRX4可能参与OSCC肿瘤的进展;在生存分析曲线中显示,PRDX4高表达患者的预后较低表达者差,提示PRDX4可能作为OSCC的预后预测因素;结果与于玢玢等[9]报道一致。
本研究进一步通过Logistic回归分析多因素与PRDX4表达关系,发现肿瘤淋巴结转移及分化程度低是影响PRDX4的表达的独立危险因素。Capilla等[13]报道了淋巴结转移是导致OSCC患者死亡的主要因素之一。但是根据组织病理学检查在临床淋巴结检测阴性的OSCC患者中,实际淋巴结转移的发生率为34%[6]。故对于活检标本PRDX4表达较高的OSCC患者,术前影像学评估淋巴结转移扫描应更全面,有助于更准确的临床评估及预后预测。
有报道表明,PRDX4可通过上皮-间充质转换(EMT)参与调控肿瘤的进展[7,14]。EMT的分子特征是E-cad下调,Vimentin、N-cadherin等上调[15]。E-cad是一种维持上皮细胞与细胞间稳定接触的跨膜糖蛋白,E-cad低表达与预后密切相关,也促进各种上皮癌的侵袭和转移[16-18]。Vimentin是诱导EMT过程的重要间叶标记[19]。为了进一步探讨PRDX4与EMT的关系,本课题研究了PRDX4与E-cad及Vimentin表达之间的关系,结果显示,在OSCC中PRDX4的表达与E-cad的表达呈负相关,即随着PRDX4的表达水平升高,E-cad的表达水平明显下降;PRDX4的表达与Vimentin的表达呈正相关,即随着PRDX4表达水平的上升,Vimentin的表达水平明显升高,由此表明PRDX4的过表达可能与EMT相关,通过促进肿瘤侵袭及转移参与了OSCC的发生发展。
综上所述,本研究证实PRDX4在OSCC组织中高表达,且其的表达水平与OSCC的分化程度、淋巴结转移情况及生存时间呈现相关性,随着PRDX4的表达水平的增高,OSCC分化越差、越容易发生淋巴结转移,生存期越短,其可能作为判断 OSCC 患者预后的标志物并且是OSCC治疗的潜在靶标,PRDX4与Vimentin的表达呈正相关,而与E-cad的表达呈负相关,表明PRDX4可能通过EMT促进OSCC的发生发展。但在探讨PRDX4在OSCC发生发展中的机制方面,本实验仅研究了其与E-cad及Vimentin之间的相关关系,还有待进一步深入研究。

