基于OPG/RANKL途径青蒿琥酯对牙周炎大鼠牙槽骨吸收的影响及抑炎作用研究
陈晨 陈栋 陆珂 王茜
青蒿琥酯(artesunate,Art)是青蒿素的水溶性衍生物,具有抗细菌、抗真菌、抗炎及抗癌等多种药理作用,且有研究证实其可阻断破骨细胞生成、活化,从而预防大鼠骨质疏松及抑制骨质破坏[1]。本研究通过建立牙周炎大鼠模型,观察Art对其牙槽骨吸收的影响及抑炎作用,并探讨可能机制。
1 材料与方法
1.1 实验动物
80 只SPF级SD雄性大鼠,8 周龄,体质量(320±20) g(北京科宇动物养殖中心),[生产许可证号:SCXK(京)2019-0008]。
1.2 主要试剂及仪器
Art(南京道斯夫生物科技有限公司);标准菌混合悬液(上海远慕生物科技有限公司);前列腺素E2(prostaglandin E2,PGE2)、白介素-6(interleukin-6,IL-6)ELISA试剂盒(上海双赢生物科技有限公司);兔抗大鼠骨保护蛋白(osteoprotegerin,OPG)、细胞核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)一抗(LifeSpan公司,美国)。
Viva CT40 Micro-CT(SCANCO Medical AG公司,瑞士);BX51显微镜(Olympus株式会社,日本)。
1.3 构建牙周炎大鼠模型[2]
腹腔注射麻醉大鼠,撑开上、下切牙,用3.0丝线(直径0.2 mm)结扎线分别结扎两侧上颌第1、2磨牙牙颈部,且使结扎线尽量深入牙龈沟中,同时于牙龈沟中接种4 种标准菌混合悬液(浓度109CFU/mL)。建模成功标准:结扎8 周后,牙龈位置红肿、探诊出血,且形成深牙周袋。
1.4 分组及干预
80 只大鼠随机抽取15 只在牙龈沟相同位置注射等量生理盐水,设为对照组。其余65 只建模,成功60 只,随机分为模型组、Art低、中、高剂量组,各15 只。建模成功后,Art低、中、高剂量组腹腔注射Art生理盐水溶液5 mL,剂量为10、30、60 mg/kg[3]。对照组、模型组腹腔注射等体积生理盐水。1 次/d,连续4 周。
1.5 牙周指数检测
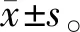
1.6 检测血清炎症因子水平
末次干预后禁食12 h,麻醉取腹主动脉血5 mL,离心取上清,根据ELISA试剂盒说明书要求,酶标仪测定波长450 nm处吸光度值,按照标准曲线计算PGE2、IL-6水平。
1.7 观察牙槽骨吸收情况
取血后每组随机挑选5 只脱颈处死,40%中性甲醛固定上槽牙、上颌骨、牙周组织及牙组织,24 h后修正标本,保留磨牙区段颌骨、牙周组织,采用Micro-CT进行三维CT拍摄测量釉牙骨质界至牙槽嵴顶的距离(cemento-enamel junction-aleolar crest,CEJ-AC),光镜下观察牙槽骨吸收情况。
1.8 HE染色观察牙周组织病理变化
从每组剩余大鼠中随机挑选5 只脱颈处死,取上颌骨,用40%中性甲醛溶液固定48 h,流水冲洗24 h,在10%的EDTA脱钙液中脱钙8 周,修整后常规包埋,切成5 μm连续薄片(顺第一磨牙近远中方向)。取切片,常规HE染色,光镜拍照观察牙周组织病理变化。
1.9 Western blot检测牙周组织OPG、RANKL表达
处死每组剩余的5 只大鼠,以病灶牙为中心(对照组取对应位置),上下各取5 mm×5 mm的牙周组织标本,研磨器充分研磨,裂解后离心,BCA试剂盒测定、定量总蛋白。取40 μg待测样品,与上样缓冲液混匀,金属浴5 min,离心取上清,电泳,转膜,封闭液室温封闭2 h,TBST清洗,加入兔抗大鼠OPG、RANKL一抗(1∶500),4 ℃摇床孵育过夜,TBST清洗,加入二抗(1∶2 000),室温孵育2 h,TBST清洗,ECL发光液显色,暗室内曝光,凝胶成像系统扫描并分析,以OPG、RANKL/内参GAPDH条带灰度值表示蛋白表达量。
1.10 统计学处理
2 结 果
2.1 PLI、SBI、PD
与对照组比较,模型组PLI、SBI、PD均升高(P<0.05);与模型组比较,Art低剂量组PLI、SBI、PD均降低(P<0.05),且为剂量依赖性(表 1)。

表 1 各组大鼠PLI、SBI、PD比较
2.2 血清炎症因子水平
与对照组比较,模型组血清PGE2、IL-6水平均升高(P<0.05);与模型组比较,Art低剂量组血清PGE2、IL-6水平均降低(P<0.05),为剂量依赖性(表 2)。

表 2 各组大鼠血清炎症因子水平比较
2.3 CEJ-AC
与对照组比较,模型组CEJ-AC延长(P<0.05);与模型组比较,Art低剂量组CEJ-AC缩短(P<0.05),且表现为剂量依赖性(表 3、图 1)。
2.4 牙周组织病理学改变
HE染色显示,对照组下方牙周膜及牙龈纤维排列紧密、结构完整,牙龈上皮紧密附着在釉牙骨质界复层鳞状上皮,未观察到牙槽骨吸收;模型组龈沟内上皮糜烂,结合上皮向牙根方向增殖,牙周袋形成,附着丧失,牙龈上皮屏障结构损伤,可观察到牙槽骨中骨吸收形成的陷窝,牙槽嵴顶与釉牙骨质界之间的距离延长;Art低、中、高剂量组附着水平提高,牙槽嵴顶高度增加,牙槽骨吸收及破坏程度有所降低,且表现为剂量依赖性(图 2)。

表 3 各组大鼠CEJ-AC比较

图 1 大鼠牙槽骨Micro-CT图

图 2 牙周组织病理学改变(HE, ×200)
2.5 牙周组织OPG、RANKL蛋白表达
与对照组比较,模型组牙周组织OPG蛋白表达量降低(P<0.05),RANKL蛋白表达量升高(P<0.05);与模型组比较,Art低剂量组牙周组织OPG蛋白表达量升高(P<0.05),RANKL蛋白表达量降低(P<0.05),且表现为剂量依赖性(表 4、图 3)。

表 4 大鼠牙周组织OPG、RANKL蛋白表达比较

图 3 大鼠牙周组织OPG、RANKL蛋白表达
3 讨 论
目前关于牙周炎的发病机制尚在探索阶段,多认为与膜型基质金属蛋白酶降解胶原、内源性β葡萄糖醛酸苷酶溶酶酸性水解酶、白细胞介素介导炎性反应与免疫应答等有关[4]。有观点认为[5-6],牙周组织损伤的原因是机体为清除病原引发的强烈免疫反应所导致的炎性损伤,通过抗炎治疗以减轻牙周组织损伤及牙槽骨吸收是牙周炎治疗的新思路。
本研究显示,经Art干预后大鼠PLI、SBI、PD、CEJ-AC及血清PGE2、IL-6水平均降低,且呈剂量依赖性,提示Art可减轻大鼠炎症反应,抑制牙槽骨吸收。Art衍生自中药青蒿提取物青蒿素,最初常用于抗疟疾治疗,亦具有调节骨代谢的作用。Huang等[7]采用Art处理小鼠单核/巨噬细胞RAW 264.7,结果发现其可增强该细胞活力,抑制TRACP阳性细胞和骨细胞陷窝形成活性,并降低破骨细胞生成相关标志物表达量。此外,Zeng等[8]研究发现,在革兰氏阴性菌引起的慢性感染性疾病中,如骨髓炎、化脓性关节炎和牙周炎,破骨细胞的活性随着炎症的升高而增强,扰乱骨稳态并导致骨质溶解,而Art是治疗革兰氏阴性菌感染或RANKL非依赖性通路炎症引起的骨质流失的重要选择。
RANKL通过结合位于破骨前体细胞膜上的RANK,诱导破骨细胞分化并减少其凋亡,而OPG作为RANKL的诱饵受体,可与RANK竞争性结合,从而阻断RANK与RANKL的相互作用,抑制破骨细胞分化,减少骨吸收[9]。有研究发现[10],牙周炎大鼠模型RANKL、RANKL/OPG显著升高,而OPG蛋白水平显著降低,对症干预后有所改善,且大鼠牙槽骨吸收、修复及重建随之改善,提示OPG、RANKL参与该病发生及转归。本研究显示,与对照组比较,模型组牙周组织OPG蛋白表达量降低,RANKL蛋白表达量升高,经Art干预后OPG蛋白表达量升高,RANKL蛋白表达量降低,且呈剂量依赖性,提示增加OPG蛋白表达,减少RANKL蛋白表达可能是Art对牙周炎的治疗作用机制之一。
综上所述,Art可抑制牙周炎大鼠牙槽骨吸收,减轻炎症反应,可能通过增加OPG蛋白表达,减少RANKL蛋白表达发挥作用。

