磁共振波谱联合荧光素钠导航显微手术切除幕上高级别胶质瘤的随访结果和临床意义
田海龙,祖玉良,何 伟,张宁宁,王益华,郭振涛,王超超,姜 彬,殷 鑫,王志刚
山东大学齐鲁医院神经外科,山东青岛 266000
·论著·
磁共振波谱联合荧光素钠导航显微手术切除幕上高级别胶质瘤的随访结果和临床意义
田海龙,祖玉良,何 伟,张宁宁,王益华,郭振涛,王超超,姜 彬,殷 鑫,王志刚
山东大学齐鲁医院神经外科,山东青岛 266000
目的评估磁共振波谱分析(MRS)结合荧光素钠(FL)导航切除位于幕上的高级别胶质瘤(HGG)的临床效果。方法回顾性分析2013年8月至2015年11月在山东大学齐鲁医院经手术病理确诊的72例幕上HGG(WHO Ⅲ~Ⅳ级)患者的临床资料,分为MRS联合术中FL导航组(观察组,n=43)和显微外科手术组(对照组,n=29)两组。所有患者术前及术后第24~48 h均行MRI增强检查,比较两组患者的肿瘤切除程度。术后均行同步放化疗,采用Karnofsky(KPS) 评分评价患者术后6个月的生存质量,观察患者术后1年的生存率和肿瘤无进展生存时间(PFS)。结果观察组患者的肿瘤完全切除(GTR)率显著高于对照组(72.09%比51.72%;χ2=23.88,P=0.001),观察组中WHO Ⅳ级患者的肿瘤GTR率显著高于WHO Ⅲ级(92.86%比62.07%;χ2=6.06,P=0.042)。观察组术后6个月的KPS评分显著高于对照组(μ=2.34,P=0.021)。平均随访(16.4±2.4)个月(8~21个月),观察组和对照组患者的1年生存率(74.07%比77.50%;χ2=4.90,P=0.165)和PFS[(13.2±1.2)个月比(12.7±2.0)个月;χ2=7.26,P=0.067]差异均无统计学意义。两组中WHO Ⅳ级患者的1年生存率(71.43%比72.54%;χ2=5.33,P=0.089)差异无统计学意义;观察组WHO Ⅳ级患者的PFS明显高于对照组[(14.2±0.3)个月比(10.0±1.1)个月;χ2=11.03,P=0.031]。两组中WHO Ⅲ级患者的1年生存率(75.86%比72.22%;χ2=3.78,P=0.250)和PFS[(13.7±1.4)个月比(12.4±0.8)个月;χ2=4.85,P=0.083]差异均无统计学意义。结论MRS联合术中FL导航技术能在保护神经功能前提下提高幕上HGG切除率,改善患者生存质量,目前没有发现延长肿瘤生存期的证据,但随样本量和随访时间增加,可能会观察到不同的预后指标。
高级别胶质瘤;磁共振波谱;荧光素钠;随访
高级别胶质瘤(high-grade gliomas,HGG)(WHO Ⅲ~Ⅳ级)主要发生于幕上,患者的生存期与肿瘤切除范围显著相关。但是,界定肿瘤组织边缘,对广泛浸润的HGG进行手术全切是相当困难的。神经导航、术中 MRI和超声波成像可在一定程度提高手术效果,但目前缺乏随机对照研究证据的支持[1- 4]。荧光素钠(sodium fluorescein,FL)通过开放的血脑屏障使肿瘤染色,在特殊激发光照射下肿瘤组织产生荧光,有助于区分正常脑组织、水肿及肿瘤组织,指导术者在术中较清楚地分辨瘤脑边界[1,3]。磁共振波谱技术(magnetic resonance spectroscopy,MRS)可以通过反映胶质瘤生化代谢异常的信息,发挥肿瘤定位的优势。本研究回顾性分析了2013年8月至2015年11月在山东大学齐鲁医院(青岛)经手术病理确诊的幕上HGG患者的临床资料,评估了MRS与FL技术优势联合指导幕上HGG手术治疗的临床应用价值。
资料和方法
资料来源收集 2013年8月至2015年11月在山东大学齐鲁医院(青岛)经手术病理确诊的幕上HGG且获得随访患者的临床资料。纳入标准:(1)幕上胶质瘤;(2)病理确诊为HGG;(3)首次颅内肿瘤手术;(4)手术前后MR增强扫描;(5)MRS联合FL导航或直接进行显微外科手术;(6)术后辅助同步放化疗。排除标准:(1)小脑或脑干胶质瘤;(2)低级别胶质瘤(WHO Ⅰ~Ⅱ级)或大脑胶质瘤病;(3)肿瘤复发;(4)术后不能耐受或拒绝放化疗;(5)拒绝或无法行磁共振检查;(6)未经病理证实;(7)卡氏功能状态评分(karnofsky scale,KPS)≤60 者;(8)肝、肾功能不全者;(9)胶质瘤脑脊液播散;(10)其他脏器有活动性恶性肿瘤病史者。
MRI平扫/增强扫描采用Siemens Sonata 3.0T超导型MR成像系统,参数如下:TSE-T1WI(TR:2000 ms,TE/TI:20/800 ms)、TSE-T2WI(TR/TE:2365/107 ms)、T2-FLAIR(TR:11 000 ms,IR:2800 ms,TE:125 ms)、DWI(b=1000),层厚/层间距:6 mm/1 mm,FOV=210 mm×210 mm,重建矩阵=384×384。增强扫描应用T1WI横断位、矢状位、冠状位扫描(钆喷丁酸葡甲胺,Gd-DTPA,0.1 mmol/kg)。MRI诊断标准包括:(1)肿瘤累及多个脑叶,形态不规则,信号不均匀;(2)囊变坏死,瘤内出血;(3)水肿和占位征象明显;(4)假“栅栏”征及“流空效应”。
术前MRS检查采用二维点分辨波谱分析法(two-dimensional point resolved spectral analysis,2D-PRESS)技术,具体参数:TR:2000 ms,TE:144 ms,翻转角90°,选择性水激发水抑制技术(水抑制带宽140 Hz,水抑制率>96%,二次激发角300,半高全宽32 Hz)。视野120 mm ×120 mm~140 mm×140 mm,NSA=1,重建矩阵512×512,成像时间286 s。Spetro View数据后处理,增强后横断面T1WI上定位感兴趣区(region of interest,ROI)层面位于肿瘤的实质、强化边缘区和周围水肿组织(对照区为对侧正常脑组织),测定N-乙酰天冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine and phosphocreatine,Cr)、胆碱(choline-containing compounds,Cho)的峰下面积,计算Cho/Cr、Cho/NAA、NAA/Cr的比值。
FL导航显微外科手术FL皮试:0.5 ml的20%FL注射液(3 ml∶600 mg,广州白云山明兴制药生产,国药准字号H44023400)稀释至3%,由深静脉推注5 ml,监测生命体征及有无皮疹发生;无异常者将FL稀释至1.0%~1.5%,以3 mg/kg静脉推注。手术麻醉采用气管插管及静脉复合全麻。常规开颅,掀起骨瓣后暴露肿瘤(推注后60~75 min)。手术室灯光调暗以达到最佳的荧光效果,在激发状态下,通过安装了YELLOW 560 nm滤光片的Pentero 900手术显微镜(Carl Zeiss Meditec,Oberkochen,Germany)观察到肿瘤及瘤周水肿组织可呈现强荧光显影区(明黄色)、弱荧光显影区(浅黄色)或无荧光显影。荧光可保持3~4 h,然后自行消退。肿瘤切除后,白光条件下进行硬膜和切口缝合,术后ICU监测至少 12 h。24~48 h内进行术后MRI增强检查。
术后治疗术后常规给予三维适形放疗联用替莫唑胺(temozolomide,TMZ)同步化疗。肿瘤大体靶区(gross tumor volume,GTV)包括整个肿瘤手术切缘并外推2.0~2.5 cm,总量达60 Gy/32~35f,6~7周;联合TMZ同步化学治疗,剂量75 mg/(m2·d)。放射治疗结束后口服TMZ,剂量为150~200 mg/(m2·d),连续5 d,间隔22~23 d为1周期,连续4~6周期。
临床和影像学随访放化疗结束后4周进行临床和影像学随访,之后每2个月进行1次,随访截止时间2016年4月30日。评估包括使用容量序列法[1],对比增强前后MRI结果,根据RANO标准[2,5],肿瘤进展定义为出现体积超过0.175 cm3的新的肿瘤病变,或者残余肿瘤体积增加。
术后6个月生存质量评价采用KPS评分标准评价患者术后6个月生存质量。KPS常用来表示患者的技能状态,是评价日常生活和工作能力的基础指标,91~100分患者处于适应正常生活的功能状态;81~90分为生活自理级(非依赖级);60~80分为生活半自理级(半依赖级);60分以下为生活需要别人帮助级(依赖级)。
生存分析记录生存时间(手术之日开始计算,到死亡日期或最后一次随访时间),绘制生存曲线;复发患者记录开始治疗时间至复发的间隔时间,经MRI增强扫描或再次手术后病理诊断肿瘤复发。比较两组1年生存率、肿瘤无进展生存时间(progression-free survival,PFS)。
统计学处理采用SPSS 18.0统计软件,计量资料以均数±标准差表示;患者一般资料的组间比较采用t检验;肿瘤全切(gross total resection,GTR)的比较、肿瘤实质ROI层面与肿瘤边界和瘤周水肿ROI层面荧光强度的比较采用χ2检验;肿瘤实质NAA、Cho峰度及 Cho/NAA比值与荧光强度的比较采用单因素方差分析;生存质量采用秩和检验(Wilcoxon两样本比较法);术后患者1年的生存时间和PFS采用生存分析检验;P≤0.05为差异有统计学意义。
结 果
一般情况共有72例患者纳入本研究,术前及术后第24~48 h均行增强MRI检查。其中,MRS联合FL导航组43例(观察组),包括男27例,女16例;平均年龄(48.3±2.8)岁(28~74岁);非依赖级、半依赖级和依赖级患者人数分别为28、12、3例;WHO Ⅲ、Ⅳ级分别为29、14例;术前平均肿瘤体积(22.01±2.80)cm3(2.31~112.52 cm3);运动及语言功能区受累9例。常规显微外科手术29例(对照组),包括男18例,女11例;平均年龄(44.5±3.6)岁(32~70岁);非依赖级、半依赖级和依赖级患者人数分别为19、9、1例;WHO Ⅲ、Ⅳ级分别为18、11例;术前平均肿瘤体积(30.26±4.0)cm3(5.72~99.39 cm3),运动及语言功能区受累5例。两组患者在性别(χ2=5.31,P=0.054)、年龄(t=0.85,P=0.330)、KPS评分(χ2=5.01,P=0.109)、病理分级(χ2=0.10,P=0.491)、术前肿瘤体积(t=2.90,P=0.082)和功能区受累(t=0.15,P=0.914)等方面差异均无统计学意义。
MRS检查结果观察组43例患者中,37例诊断为HGG,表现为病变区域NAA峰明显降低,Cho明显增高;肿瘤实质、边界和瘤周水肿的Cho/NAA 和 Cho/Cr 平均比值较对照区显著升高。3例诊断为原发颅内淋巴瘤,余3例,其中1例为低级别胶质瘤(WHOⅠ~Ⅱ级),2例为颅内转移瘤。
观察组肿瘤ROI层面与术中荧光强度的比较结果观察组肿瘤实质区域荧光强度明显高于肿瘤边界和瘤周水肿(χ2=13.09,P=0.024)(表1)。强荧光肿瘤实质中,NAA峰度明显低于弱荧光和无荧光肿瘤实质(F=5.870,P=0.010),Cho峰度(F=4.460,P=0.014)和Cho/NAA(F=6.910,P=0.006)明显高于弱荧光和无荧光肿瘤实质(表2)。

表 1 观察组中43例HGG 感兴趣区层面与荧光强度的比较Table 1 Comparison between the region of interest and fluorescence intensity level in observation group
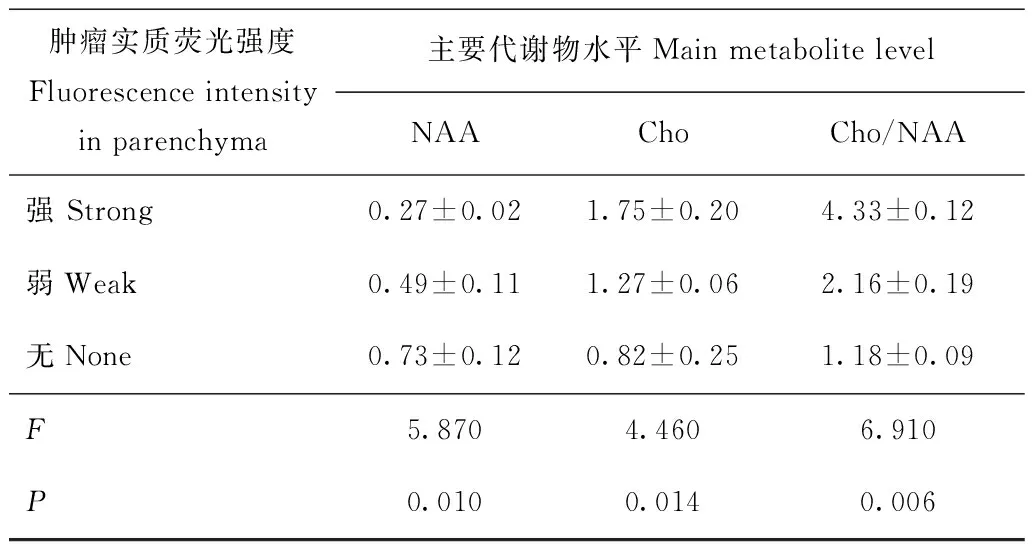
表 2 观察组43例肿瘤实质NAA、Cho峰度及 Cho/NAA 比值与荧光强度的比较Table 2 Comparison between the kurtosis of NAA and Cho
NAA:N-乙酰天冬氨酸;Cho:胆碱
NAA:N-acetylaspartate;Cho:choline-containing compounds
两组切除程度的比较术后第24~48 h采用增强MRI评价切除程度(extend of resection,EOR),结果显示:观察组43例患者中,31例(72.09%)为GTR;12例为非GTR病例,其中,3例累及深部基底节区,4例累及运动功能区,4例累及语言功能区,1例术中大出血;平均肿瘤切除比例为(89.61±1.26)%(82.80%~96.17%)。对照组29例患者中,15例(51.72%)为GTR;14 例为非GTR,其中,3例累及深部基底节区,3例累及运动、语言功能区,2例术中大出血;平均肿瘤切除比例为(73.77±3.42)%(65.88%~87.54%)。观察组的GTR率显著高于对照组(χ2=23.88,P=0.001)。观察组中,WHO Ⅳ级患者的GTR率显著高于WHO Ⅲ级(92.86%比62.07%;χ2=6.06,P=0.042)。
两组生存质量比较观察组43例患者中,3例在术后6个月内肿瘤复发死亡;其余40例患者中,KPS正常和非依赖级32例,半依赖级6例,依赖级2例。对照组29例患者中,3例在术后6个月内肿瘤复发死亡;其余26例患者中,KPS正常和非依赖级8例,半依赖级7例,依赖级11例;观察组患者术后6个月的KPS评分显著高于对照组(μ=2.34,P=0.021)。
随访结果平均随访(16.4±2.4)个月(8~21个月)。观察组43例患者中,3例分别于术后第8、10、10个月失访(WHO Ⅲ级2例,WHO Ⅳ级1例);其余40例患者中,5例于术后6个月内复发,6例于术后7~12个月内复发(4例为肿瘤未全切病例);1年内复发的11例患者,分别于术后第4、5、6、7、9、11、12、12、12、14和16个月因肿瘤复发死亡(WHO Ⅲ级7例,WHO Ⅳ级4例);平均PFS为(13.2±1.2)个月。对照组29例患者中,2例WHO Ⅲ级于术后第7、11个月失访;其余27例患者中,4例于术后6个月内复发,5例于术后7~12个月内复发(3例为肿瘤未全切病例);1年内复发的8例患者,分别于术后第4、6、7、9、11、11、13、15个月因肿瘤复发死亡(WHO Ⅲ级5例,WHO Ⅳ级3例);平均PFS(12.7±2.0)个月。观察组和对照组患者的1年生存率(74.07%比77.50%;χ2=4.90,P=0.165)和PFS[(13.2±1.2)个月比(12.7±2.0)个月,χ2=7.26,P=0.067]差异均无统计学意义。两组中WHO Ⅳ级患者的1年生存率(71.43%比72.73%;χ2=5.33,P=0.089)差异无统计学意义;观察组WHO Ⅳ级患者的PFS明显高于对照组[(14.2±0.3)个月比(10.0±1.1)个月,χ2=11.03,P=0.031]。两组中WHO Ⅲ级患者的1年生存率(75.86%比72.22%;χ2=3.78,P=0.250)和PFS差异均无统计学意义[(13.7±1.4)个月比(12.4±0.8)个月;χ2=4.85,P=0.083]。
讨 论
为了改善胶质瘤,特别是HGG患者预后,神经外科医生一直在探索能够提高肿瘤切除程度的安全手段,术中肿瘤荧光显影是研究者们热衷的领域之一。俗称为“蓝荧光”的5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA),在随机试验中证明有助于提高肿瘤全切率和PFS。但是,价格昂贵、使用不便利等缺点一定程度上限制了该技术的临床应用。相比较而言,作为一种荧光染料,FL广泛用于视网膜血管造影等眼科检查和治疗,并且容易渗透到血脑屏障受损的脑组织和相应的病变区域,常规剂量(8~10 mg/kg)毒性很低,价格只有5-ALA的1/40左右[1,3- 4]。1999年,Kuroiwa 等[6- 7]提出采用装配不同滤光镜手术显微镜的想法并使用FL 进行荧光引导的胶质瘤切除手术。FL通过被破坏的血脑屏障进入肿瘤细胞内,使肿瘤组织及肿瘤浸润的部分在荧光显微镜下呈现特定的荧光影像,从而定位胶质瘤并区分边界[1,5- 6]。
本课题组以往研究发现,不同荧光强度肿瘤区域的分子病理表达及MRS代谢物水平存在差异,FL标记下实施GBM手术治疗,需重视术前MRS提供的代谢信息[8- 9]。本研究结果显示,不同荧光强度的肿瘤实质中,NAA和Cho峰度不同,Cho/NAA不同;而不同荧光强度的瘤周水肿中,NAA和Cho峰度无差异,Cho/NAA无差异。进一步提示:(1)GBM的血脑屏障破坏与NAA、Cho等主要代谢物的代谢水平之间可能存在一致性关系;(2)MRS能通过反映胶质瘤生化代谢异常的信息,更好发挥FL定位肿瘤的优势。
本研究术中根据荧光染色强度,结合MRI强化边界及MRS定位的ROI等影像学信息,分辨和切除肿瘤。肿瘤切除过程中,脑叶塌陷造成的脑移位可能导致影像与肿瘤空间位置的差异,为减少肿瘤代谢边界和荧光边界的偏倚,手术切除程度仍以荧光染色强度为主,并以白光下肿瘤与正常脑组织质地的差异为参考。术中注射低剂量的 FL(3~4 mg/kg)足以在YELLOW 560 nm滤光镜下对肿瘤组织进行观察,在手术过程中能得以保持且没有亮度降低或褪色[1,3,8- 10]。术前MRS联合术中FL可显著提高肿瘤切除程度(GTR:观察组72.09%比对照组52.07%),包括累及功能区的肿瘤(观察组:5例全切/4例未全切比对照组:2例全切/3例未全切)。后续将加大累及功能区的HGG病例样本量,为FL引导胶质瘤切除手术提供更加确切的临床应用依据。在肿瘤负荷显著减少的同时,患者术后6个月的生存质量得以显著提高。
越来越多的研究肯定FL导航能够提高胶质瘤全切率,但是否能明显延长HGG的生存时间目前缺乏大样本研究证据支持,多数学者对此持审慎态度[1- 4,8- 12]。Shinoda等[4]针对32例HGG进行大剂量FL(20 mg/kg)引导下显微外科手术,结果显示FL 组中肿瘤GTR为 84.4%,非FL组则为30.1%,虽然手术切除程度不一,但是预后并无差别。Elena 等[11]针对20例HGG的前瞻性Ⅱ阶段临床试验(FLUOGLIO)中,使用5~10 mg/kg的FL引导肿瘤切除,虽然该组术后6个月的PFS超过70%,但作者认为10个月的中位随访期太短,仍然不足以对长期结果做出明确结论。本研究亦没有发现联合FL能明显改善HGG 1年生存率和PFS的证据,受随访时间限制,没有观察到2、3年生存率等更加长期的生存指标,后续将以此作为研究目标。
本研究中,观察组中WHO Ⅳ级患者PFS较对照组中WHO Ⅳ级患者明显提高,WHO Ⅲ级患者的PFS组间比较未发现明显差异,而且两组共72例患者中,WHO Ⅳ级肿瘤仅25例(观察组14例,对照组11例)。由此推测:入组病例的病理级别可能影响生存分析结果。前期研究成果之一可作为推测的依据:WHO Ⅳ级胶质瘤不同的荧光显影边界中,Ki- 67表达程度不同[8]。Ki- 67指数是评估肿瘤增生及侵袭性的实用指标,与胶质瘤病理级别呈正相关[12- 13]。侵袭性增强意味着对正常血脑屏障破坏加剧,更利于FL对肿瘤组织及其浸润部分的荧光显影和对肿瘤的界定[1- 3,14- 15]。结合观察组中的病理级别进行GTR比较发现:WHO Ⅳ级肿瘤显著高于WHO Ⅲ级肿瘤,提示随着样本量扩大和根据病理级别分组的细化,MRS联合FL术中导航治疗WHO Ⅲ和WHO Ⅳ级胶质瘤的长期随访结果可能会出现差别。
综上,本研究结果显示,MRS联合术中FL导航技术能在保护神经功能前提下提高肿瘤切除率,改善患者生存质量,目前没有发现延长幕上HGG总生存率的证据,推测随着样本量和随访时间增加,可能会观察到不同的预后结果。
[1] Acerbi F,Broggi M,Eoli M,et al. Fluorescein-guided surgery for grade Ⅳ gliomas with a dedicated filter on the surgical micro scope:preliminary results in 12 cases[J].Acta Neurochir(Wien),2013,155(7):1277- 1286.doi:10.1007/s00701- 013- 1734- 9.
[2] Wen PY,Macdonald DR,Reardon DA,et al. Updated response assessment criteria for high-grade gliomas:response assessment in neuro-oncology working group[J].J Clin Oncol,2010,28(11):1963- 1972.doi:10.1200/JCO.2009.26.3541.
[3] Kuroiwa T,Kajimoto Y,Ohta T. Development of a fluorescein operative microscope for use during malignant glioma surgery:a technical note and preliminary report[J].Surg Neurol,1998,50(1):41- 49.
[4] Shinoda J,Yano H,Yoshimura S,et al. Fluorescence-guided resection of glioblastoma multiforme by using high-dose fluorescein sodium.Technical note[J].J Neurosurg,2003,99(3):597- 603.doi:10.3171/jns.2003.99.3.0597.
[5] Vogelbaum MA,Jost S,Aghi MK,et al. Application of novel response/progression measures for surgically delivered therapies for gliomas:Response Assessment in Neuro-Oncology(RANO) Working Group[J].Neurosurgery,2012,70(1):234- 243.doi:10.1227/NEU.0b013e318223f5a7.
[6] Kuroiwa T,Kajimoto Y,Ohta T,et al. Development of a fluorescein operative microscope for use during maligant glioma surgery:a technical note and preliminary report[J].Surg Neurol,1999,50(1):41- 49.
[7] Kuroiwa T,Kajimoto Y,Ohta T,et al. Comparison between operative findings on maligant glioma by a fluorescein surgical microscopy and histological findings[J].Neurol Res,1999,21(1):130- 134.
[8] 田海龙,何伟,姜慧峰,等. 荧光导航下切除胶质母细胞瘤及分子病理的表达意义[J].中国微侵袭神经外科杂志,2016,21(5):241- 244. doi:10.11850/j.issn.1009- 122X.2016.06.004.
[9] 田海龙,祖玉良,王超超,等. 术前氢质子磁共振波谱主要代谢物水平与术中胶质母细胞瘤荧光强度的比较研究[J].中国医学科学院学报,2017,39(4):511- 517. doi:10.3881/j.issn.1000- 503X.2017.04.009.
[11] Elena A,Claudio C,Carlo B,et al. Is florescein-guided technique able to help in resection of high-grade gliomas[J].J Neurosurg Focus,2014,36(2):E5. doi:10.3171/2013.11.FOCUS13487.
[12] Ahmed S,Rashed H,Hegazy A,et al. Prognostic value of ALDH1,EZH2 and Ki- 67 in astrocytic gliomas[J].Turk Patoloji Derg,2016,32(2):70- 81.doi:10.5146/tjpath.2015.01344.
[13] Qu DW,Liu Y,Wang L,et al. Glial cell line-derived neurotrophic factor promotes proliferation of neuroglioma cells by up-regulation of cyclins PCNA and Ki- 67[J].Eur Rev Med Pharmacol Sci,2015,19(11):2070- 2075.
[14] 董宇,张东智,汪立刚,等.在恶性胶质瘤1H-MRS中与荧光强度相关性的研究[J].齐齐哈尔医学院学报,2011,32(24):3945- 3947.
[15] Acerbi F,Cavallo C,Broggi M,et al. Fluorescein-guided surgery for malignant gliomas:a review[J].Neurosurg Rev,2014,37(4):547- 557.doi:10.1016/j.pdpdt.2014. 08.001.
Follow-upResultsandClinicalSignificanceofMagneticResonanceSpectroscopyCombinedwithFluorescenceMicroscopyinResectionofHighGradeSupra-tentoriaGliomas
TIAN Hailong,ZU Yuliang,HE Wei,ZHANG Ningning,WANG Yihua,GUO Zhentao,WANG Chaochao,JIANG Bin,YIN Xin,WANG Zhigang
Department of Neurosurgery,Qilu Hospital,Shandong University,Qingdao,Shandong 266000,China
WANG Zhigang Tel/Fax:0532- 66850752,E-mail:wzg1110@126.com
ObjectiveTo investigate the clinical effectiveness of magnetic resonance spectroscopy (MRS) combined with sodium fluorescein(FL) in the treatment of high grade gliomas(HGG).MethodsFrom August 2013 to 2015 November,the clinical data of 72 supratentorial HGG(WHO grade Ⅲ-Ⅳ) patients who had
surgical treatment in our hospital were retrospectively studied,among whom 43 cases received MRS combined with intra-perative FL navigation(observation group),and 29 cases only received conventional surgery(control group). Post-operative radiotherapy and chemotherapy were applied for more than 3 months. Routine enhanced MRI were performed 24- 48 hours after the operation to investigate the extent of tumor resection. Six months after the operation,the quality of life of patients was evaluated by using the Karnofsky score,and 1-year postoperative survival rate and progression-free survival(PFS) were observed.ResultsPostoperative MRI showed that the rate of gross total resection(GTR) in observation group was significantly higher than that in control group(72.09%vs.51.72%;χ2=23.88,P=0.001),and the GTR rate of WHO grade Ⅳ tumors was significantly higher than that of WHO grade Ⅲ tumors in observation group(92.86%vs.62.07%;χ2=6.06,P=0.042). The postoperative Karnofsky score in the observation group was significantly higher than that in control group(μ=2.34,P=0.021). The mean time of follow-up was(16.4±2.4) months(8- 21 months) and there was no statistical significant difference between observation group and control group in 1-year survival rate(74.07%vs.77.50%;χ2=4.90,P=0.165) and PFS [(13.2±1.2) monthsvs.(12.7±2.0) months;χ2=7.26,P=0.067]. In observation group,the PFS of WHO grade Ⅳ patients was significantly higher than that in control group [(14.2±0.3) monthsvs.(10.0±1.1) months;χ2=11.03,P=0.031]. There was also no statistical significant difference between WHO grade Ⅳ tumors in two groups in terms of 1-year survival rate(71.43%vs.72.54%;χ2=5.33,P=0.089),and there was no statistical significant difference between WHO grade Ⅲ tumors in two groups in 1-year survival rate(75.86%vs. 72.22%;χ2=3.78,P=0.250) and in PFS [(13.7±1.4) monthsvs.(12.4±0.8) months;χ2=4.85,P=0.083].ConclusionsMRS combined with intraoperative FL navigation technology can improve the resection rate and improve survival quality of patients,and there is no evidence that MRS combined with intraoperative FL navigation prolong the overall survival of patients with high-grade gliomas. Different outcome may be found with longer follow-up and increased simple size.
high grade gliomas;magnetic resonance spectroscopy;sodium fluorescein;follow up
青岛市科技惠民专项计划(17- 3- 3- 36-nsh)和山东大学齐鲁医院(青岛)科研启动基金(QDKY2015LH01、QDKY2016QN08)Supported by the Special Research Foundation of “Science and Technology Benefit People in Qingdao”(17- 3- 3- 36-nsh) and the Research Foundation from Qilu Hospital(Qingdao) in Shandong University(QDKY2015LH01,QDKY2016QN08)
王志刚 电话/传真:0532- 66850752,电子邮件:wzg1110@126.com
R616.2
A
1000- 503X(2017)05- 0643- 06
10.3881/j.issn.1000- 503X.2017.05.008
ActaAcadMedSin,2017,39(5):643-648
2016- 06- 23)

