新型口服抗凝药防治急性静脉血栓栓塞症的研究进展
汪志超,方 宏
·前沿进展·
新型口服抗凝药防治急性静脉血栓栓塞症的研究进展
汪志超,方 宏
急性静脉血栓栓塞症(AVTE)发病率较高,是临床常见的三大致死性血管疾病之一。抗凝治疗是防治AVTE的重要措施,传统抗凝药物包括肠外抗凝药物(如普通肝素及低分子肝素等)和维生素K拮抗剂,但其临床应用受限。近年来,新型口服抗凝药(NOACs)防治AVTE的有效性和安全性成为临床研究热点之一。本文对NOACs在AVTE治疗中的作用、NOACs的分类及其临床推荐方案、特殊情况下NOACs的应用、NOACs的实验室定性和定量分析、逆转NOACs相关性出血药物方面的最新研究进展进行综述。
抗凝药;急性静脉血栓栓塞症;综述
汪志超,方宏.新型口服抗凝药防治急性静脉血栓栓塞症的研究进展[J].实用心脑肺血管病杂志,2017,25(9):7-12.[www.syxnf.net]
WANG Z C,FANG H.Progress on novel oral anticoagulant in the prevention and treatment of acute venous thromboembolism[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(9):7-12.
静脉血栓栓塞症(venous thromboembolism,VTE)包括深静脉血栓形成和肺血栓栓塞症,是具有多种危险因素的潜在致死性疾病。VTE发病后5~10 d属于急性阶段,该阶段患者存在病情恶化、血流动力学改变、死亡等风险[1],如不及时治疗约1/3的患者会死亡。目前,VTE的治疗方法较多,但VTE仍是导致心血管疾病死亡的主要原因之一。美国每年新发VTE约90万人,死亡约30万人[2],给社会造成巨大的经济损失及精神负担,故引起临床医生的高度关注。近年来,新型口服抗凝药(novel oral anticoagulant,NOACs)的出现对急性静脉血栓栓塞症(acute venous thromboembolism,AVTE)患者的抗凝管理具有重要意义。笔者通过检索既往文献,对NOACs在AVTE治疗中的作用、NOACs的分类及其临床推荐方案、特殊情况下NOACs的应用、NOAC的实验室定性和定量分析、逆转NOACs相关性出血药物的最新研究进展进行综述。
1 NOACs在AVTE治疗中的作用
抗凝治疗可预防AVTE患者早期死亡、复发或致死性VTE的发生,在AVTE治疗中具有重要作用,尤其是危险分层为中低危的AVTE患者[1-2]。传统抗凝药物有肠外抗凝药物(如普通肝素及低分子肝素等)和维生素K拮抗剂,但其临床应用存在不足,故给VTE急性期的治疗带来诸多困难[3]。近年来,NOACs的出现对AVTE患者的抗凝管理具有重要意义。大量临床研究证实,NOACs的抗凝效果不劣于或优于传统抗凝药物,且其起效快、剂量固定、出血风险小[4],故适合用于治疗AVTE。目前的研究显示,NOACs有作为非首选药物的临床因素及禁忌证,NOACs作为非首选药物的临床因素包括获得性或遗传性易栓症、活动性出血或有其他抗凝禁忌证、活动性肿瘤(包括再发后转移性肿瘤、治疗时间>6个月的肿瘤及基底细胞和鳞状上皮细胞癌)、年龄<18岁、妊娠期和哺乳期、采用双联抗血小板聚集治疗、肥胖、前期行溶栓治疗、特殊位置静脉血栓(如远端血栓,内脏、颅内静脉血栓)、肾功能不全〔内生肌酐清除率(CrCl)<25~30 ml/min〕或高风险肾功能不全、留置腔静脉滤器;NOACs的禁忌证包括活动性或近期大出血(如胃肠道、中心静脉系统出血)、意识障碍、心力衰竭、血流动力学异常〔心率>110次/min、收缩压<100 mm Hg(1 mm Hg=0.133 kPa)、呼吸频率>20次/min、血氧饱和度<90%〕、肝素诱导血小板减少、大面积肺栓塞及髂静脉血栓、血小板计数<50×109/L、近期手术(<7~14 d)、收缩压>220 mm Hg和/或舒张压>120 mm Hg及拟行溶栓治疗[5-6],临床医师应充分评估患者具体情况后酌情选择NOACs治疗。
2 NOACs的分类及其临床推荐方案
NOACs根据作用靶点不同分为直接凝血酶(Ⅱa因子)抑制剂和Ⅹa因子抑制剂,直接凝血酶(Ⅱa因子)抑制剂主要包括达比加群(dabigatran),直接Ⅹa因子抑制剂主要包括利伐沙班(rivaroxaban)、阿哌沙班(apixaban)和依度沙班(edoxaban)。目前,达比加群、利伐沙班、阿哌沙班及依度沙班治疗AVTE已进入或完成了Ⅲ期临床试验[7],详见表1。临床研究显示,NOACs无需常规监测、起效快、抗凝效果可预测、剂量固定、受食物与药物影响小[8],其药理特性见表2。与传统抗凝药物相比,NOACs更加安全、有效、使用方便[9-10],故得到越来越多的临床医生和相关研究者的青睐和关注,NOACs的临床应用详见表3。
2.1 直接凝血酶(Ⅱa因子)抑制剂 凝血因子Ⅱa在凝血过程中可激活纤维蛋白原和血小板,直接凝血酶(Ⅱa因子)抑制剂可特异性地抑制凝血因子Ⅱa活性,从而阻止纤维蛋白原裂解为纤维蛋白,通过阻断凝血过程的终末步骤而发挥抗凝作用。目前,有两个重要的随机对照试验(RE-COVER试验和RE-COVER Ⅱ试验)评估了达比加群治疗VTE的抗凝效果和出血风险,结果显示,达比加群治疗VTE的抗凝效果与华法林相当〔RE-COVER试验:HR=1.10,95%CI(0.65,1.84);RE-COVERⅡ试验:HR= 1.08,95%CI(0.64,1.80)〕,但达比加群治疗VTE的出血风险低于华法林〔RE-COVER试验:HR=0.63,95%CI(0.47,0.84);RE-COVERⅡ试验:HR=0.62,95%CI(0.45,0.84)〕,表明达比加群治疗VTE的抗凝效果与华法林相当,但安全性优于华法林[11-12]。
目前,达比加群的临床推荐方案如下:采用达比加群治疗AVTE前5~10 d先使用肠外抗凝药物治疗,对CrCl>30 ml/min的AVTE患者给予达比加群150 mg/次,2次/d;对CrCl为15~30 ml/min的AVTE患者给予达比加群75 mg/次,2次/d;对CrCl<15 ml/min的AVTE患者建议慎用达比加群。骨科关节置换术后预防VTE时推荐患者术后1~4 h给予达比加群首剂量110 mg,之后为220 mg/d;膝关节或股关节术后患者给予达比加群至少治疗10 d,如条件允许股关节术后患者达比加群治疗时间应延长至28~35 d;VTE二级预防时达比加群使用剂量为150 mg/次,2次/d[13]。
2.2 直接Ⅹa因子抑制剂 凝血因子Ⅹa是外源性与内源性凝血途径的交汇点,直接Ⅹa因子抑制剂可通过选择性地与Ⅹa因子活性中心结合而阻止其与底物相互作用,从而阻止Ⅹa因子在磷脂膜表面形成凝血酶原复合物——FⅩa-FVa-Ca2+,阻止凝血酶原转变为凝血酶,进而发挥抗凝作用,且抗凝作用不依赖内源性抗凝血酶[14]。
2.2.1 利伐沙班 EINSTEIN等[15]研究结果显示,采用利伐沙班治疗者症状性VTE复发率低于采用低分子肝素桥接法华林治疗者(2.1%比3.0%),而两组患者大出血和临床相关性非大出血事件发生率间无差异。EINSTEIN-DVT试验和EINSTEIN-PE试验中的中国患者亚组分析结果显示,采用利伐沙班单药治疗AVTE的临床疗效及安全性与依诺肝素联合华法林标准治疗方案相当[16],提示利伐沙班可能成为中国AVTE患者新的治疗方案。2016年,美国胸科医师学会发布的《静脉血栓栓塞症抗凝治疗指南》推荐利伐沙班可作为肠外抗凝药物的替代药物治疗急性肺栓塞[17]。
目前,利伐沙班的临床推荐方案如下:可作为单药治疗AVTE,治疗前3周剂量为15 mg/次、2次/d,之后改为20 mg/次、1次/d,疗程6~12个月;预防VTE时剂量为10 mg/次,1次/d。骨科关节置换术后预防VTE时推荐术后6~12 h内给予利伐沙班,使用35 d;膝关节术后推荐使用12 d[16]。但需要注意,当CrCl为30~50 ml/min时利伐沙班剂量应减少至15 mg/d,而CrCl<30 ml/min时建议慎用利伐沙班[18]。
2.2.2 阿哌沙班 ADVANCE试验主要评估了阿哌沙班预防膝关节置换术后患者VTE的有效性及安全性,结果显示,阿哌沙班对VTE的预防效果与依诺肝素相当〔HR=1.02,95%CI(0.78,1.32)〕,阿哌沙班和依诺肝素引起的严重出血事件发生率间无差异[19]。AGNELLI等[20]研究结果显示,阿哌沙班治疗AVTE的主要终点事件(再发栓塞及静脉栓塞相关死亡)发生率及大出血和相关非大出血事件发生率均低于传统抗凝药物(依诺肝素桥接华法林),提示阿哌沙班治疗AVTE的临床疗效不劣于传统抗凝药物。
目前,阿哌沙班的临床推荐方案如下:可作为单药治疗AVTE,治疗前7 d使用剂量为10 mg/次、2次/d,之后改为5 mg/次、2次/d;预防VTE时使用剂量为2.5 mg/次、2次/d,骨科关节置换术后预防VTE时于术后12~24 h内给予首剂量2.5 mg,膝关节置换术后推荐使用10~14 d,股关节置换术后推荐使用32~38 d[20-21]。
2.2.3 依度沙班 STARS-E3试验主要评估了依度沙班和依诺肝素预防膝关节置换术后患者VTE的有效性及安全性,结果显示,主要终点事件发生率分别为7.4%、13.9%,主要出血事件发生率分别为1.1%、0.3%,提示依度沙班的抗凝效果优于依诺肝素[22]。目前,比较依度沙班和华法林治疗VTE临床疗效的最大临床试验结果显示,依度沙班治疗VTE的临床疗效不劣于华法林,且总体出血风险低于华法林[23]。
目前,依度沙班的临床推荐方案如下:治疗AVTE时先予以低分子肝素皮下注射7~10 d,再予以依度沙班60 mg/次,1次/d;对于体质量<60 kg或CrCl为30~50 ml/min的患者依度沙班使用剂量应减至30 mg/次,1次/d;预防用药时依度沙班为30 mg/次,1次/d[22-23]。
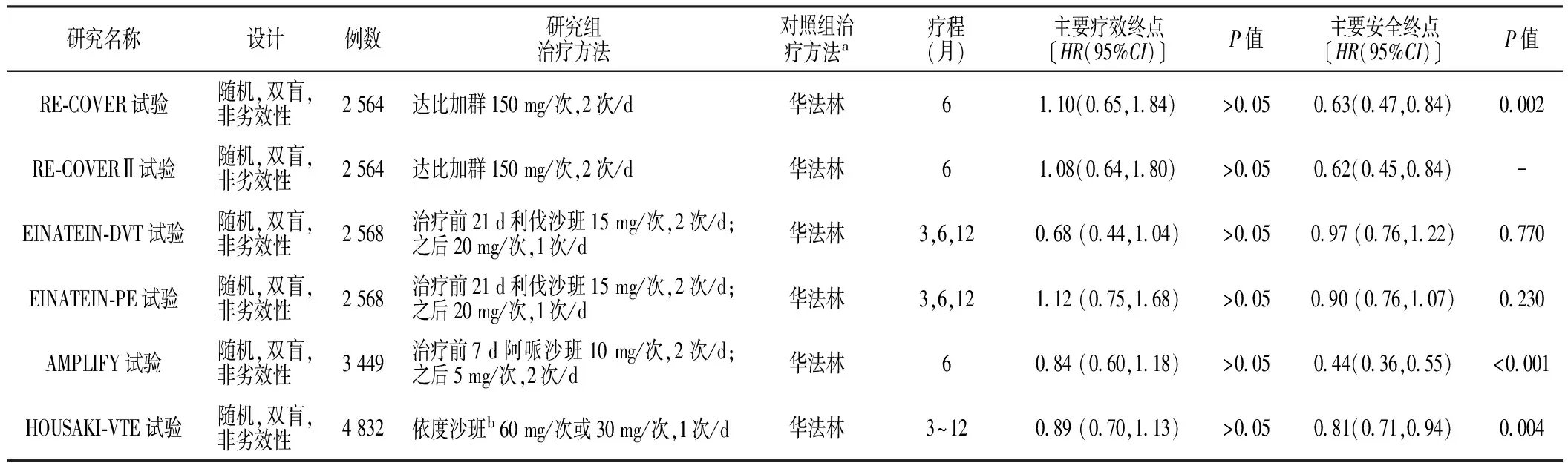
表1 NOACs治疗AVTE的Ⅲ期临床试验
注:a为华法林治疗方法,华法林剂量个体差异较大,每个患者均需根据国际标准化比值(INR)调整华法林用量,故文献均未提供华法林用量;b为体质量>60 kg或内生肌酐清除率(CrCl)>50 ml/min者给予依度沙班60 mg/次,体质量<60 kg或CrCl为30~50 ml/min者给予依度沙班30 mg/次;主要疗效终点是指症状性静脉血栓栓塞症(VTE)复发或VTE相关死亡,主要安全终点是指大出血或临床相关出血;“-”表示无相关数据

表2 NOACs的药理特性
注:NOACs=新型口服抗凝药,CYP3A4=细胞色素P4503A4酶
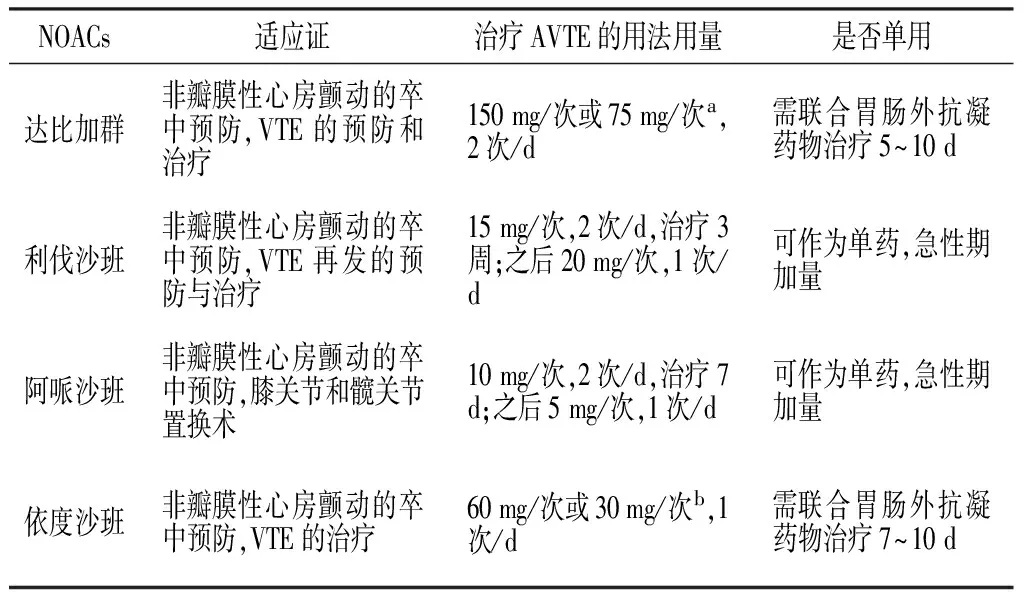
表3 NOACs的临床应用
注:a为CrCl>30 ml/min时给药剂量为150 mg/次,CrCl为15~30 ml/min时给药剂量为75 mg/次;b为体质量>60 kg或 CrCl>50 ml/min时给药剂量为60 mg/次,体质量<60 kg或CrCl为30~50 ml/min时给药剂量为30 mg/次
3 特殊情况下NOACs的应用
3.1 肾功能不全 部分NOACs是通过肾脏清除,对肾功能影响较大,可增加出血风险,故肾功能不全患者应慎用或禁用NOACs。但一项合并分析了8个随机对照试验的Meta分析结果显示,NOACs与华法林治疗合并肾功能不全(CrCl为30~50 ml/min)患者的有效性和安全性无差异,且临床推荐使用阿哌沙班治疗合并肾功能不全患者,因阿哌沙班较其他NOACs对肾脏的影响更小[24]。
3.2 妊娠与恶性肿瘤 由于缺乏安全性方面的研究,妊娠期妇女不建议使用NOACs[25]。目前,NOACs用于预防恶性肿瘤患者AVTE的相关研究报道较少。一项Ⅲ期临床试验结果显示,依度沙班可降低VTE复发率[26]。另一项有关NOACs研究的Meta分析结果显示,恶性肿瘤患者采用NOACs防治AVTE具有方便、安全、有效等优势[27],但该研究的入选对象为低危人群,故所得结果仍存在局限性。
3.3 极端体质量 目前,有关体质量>100 kg的患者采用NOACs预防AVTE的研究报道较少。采用剂量相对固定的NOACs治疗不同体质量患者的临床疗效无法准确评估,体质量较大者可能存在抗凝不充分,体质量较小者可能存在抗凝过度。AMPLIFY试验的亚组分析结果显示,与华法林相比,阿哌沙班治疗极端体质量患者(体质量>100 kg)更安全[20]。但目前尚缺乏一种规范的、简便可行的、可靠性较高的实验方法来评价NOACs的抗凝效果,故超重患者有效安全的用药剂量如何把握尚存在争议[28]。
3.4 围术期或有创操作前后NOACs的应用 大型高质量临床试验均证实NOACs相较于传统抗凝药物起效快、t1/2短(NOACs达峰时间基本在1~4 h[29]),能快速发挥抗凝作用,利于围术期或有创操作前调节凝血功能。临床研究显示,服用NOACs的同时需行手术治疗或无创操作患者,手术出血风险较低时(如牙科及皮肤科小手术、眼科治疗或无需取活检的内镜检查)无需中断NOACs,手术出血风险中等时建议根据CrCl决定是否停用NOACs,手术出血风险较高时必须停用NOACs,并确定最后一次服药时间,如可以拖延手术或无创操作建议利伐沙班至少停药24 h、达比加群和阿哌沙班至少停药1~2 d(CrCl<50 ml/min者推荐达比加群停药3~5 d);如需行紧急手术,临床医生必须严格评估手术出血风险、充分权衡手术利弊,以确定处理策略;术后应在充分止血、严密监测的基础上尽快使用NOACs[30-31]。目前,在我国已上市的NOACs包括达比加群和利伐沙班,其适应证均为预防骨科术后静脉血栓形成,如患者不能使用NOACs,则应考虑采用肠外抗凝药物。
4 NOACs的实验室定性和定量分析
虽然使用NOACs时不推荐行常规凝血功能检查,但患者处于急诊状态(如发生严重出血事件、眼内出血等关键部位出血、血栓栓塞事件、潜在药物过量、急诊手术)时仍需检查凝血功能。众所周知,华法林用药剂量是根据国际标准化比值(international normalized ratio,INR)进行调整,但目前临床上还没有方便可靠的实验室检查指标能准确评估NOACs用药剂量与出血风险之间的关系。CONWAY等[31]研究结果显示,检测凝血酶抑制剂或Ⅹa因子抑制剂可评估出血风险,但目前主要为商业用途,临床上还不能常规开展。凝血酶原时间(prothrombin time,PT)与利伐沙班浓度呈线性关系,故可作为监测达比加群药效的临床指标;在血药浓度低谷时测量凝血功能,如活化部分凝血活酶时间(active partial thromboplastin time,APTT)或稀释凝血活酶时间(dilute thrombin time,DTT)>参考范围上限值(ULR)2倍高度提示达比加群有出血风险,但APTT和DTT受检测试剂影响,故准确率和可重复操作性不高,且不能定性监测药物抗凝效果,故精确度有限[32-33]。NOACs的实验室定性和定量分析详见表4。
5 逆转NOACs相关性出血的药物
NOACs导致出血是其临床应用受限的一个重要因素,而拮抗剂可快速逆转出血,目前的拮抗剂分为非特异性拮抗剂和特异性拮抗剂,非特异性拮抗剂包括凝血酶原复合物(prothrombin complex concentrate,PCC)、活化的凝血酶原复合物(actived prothrombin complex concentrate,aPCC)、重组活化的Ⅶ因子(rFⅦa)。PCC包括Ⅲ因子PCC和Ⅳ因子PCC,特异性拮抗剂包括Idarucizumab、andexanet alfa、PER977。
5.1 非特异性拮抗剂 临床研究显示,非特异性拮抗剂的临床疗效存在矛盾[34]。多项动物实验结果显示,PCC能有效抑制达比加群相关性出血,但PCC无法终止达比加群过量引起的出血[35-36]。一项以男性作为研究对象的随机双盲试验发现,Ⅳ因子PCC不能逆转达比加群对APTT、ECT的影响,但可改善利伐沙班导致的PT延长[37]。另一项单中心研究显示,Ⅲ因子PCC和Ⅳ因子PCC可在一定程度上逆转利伐沙班的抗凝作用[38]。目前的研究结果显示,拮抗剂对Ⅹa因子抑制剂引起出血的临床疗效优于Ⅱa因子抑制剂。MARLU等[39]研究结果显示,aPPC可逆转达比加群、利伐沙班的抗凝作用,且临床疗效优于PCC和rFⅦa。与PCC相似,rFⅦa不仅无法在动物模型上逆转达比加群、利伐沙班相关性出血,人体研究结果也存在不确定性,但其可改善阿哌沙班、利伐沙班等所致部分凝血指标的改变,如PT、凝固时间延长等。由于临床疗效差于PCC和aPPC,故rFⅦa只考虑作为二线用药[38,40]。
有文献报道,PCC及aPCC或rFⅦa是治疗利伐沙班、阿哌沙班、达比加群相关性大出血的有效方法,不推荐用于治疗依度沙班相关性大出血[41],但基于目前有限的临床数据,上述药物的止血效果及再栓塞风险尚不明确,需进一步研究证实。
5.2 特异性拮抗剂 目前,有几种特异性拮抗剂正在研制。Idarucizumab是一种人源化单克隆抗体片段,与凝血酶的亲和力是达比加群的350倍,但无促凝和抗凝作用,t1/2短,可有效逆转达比加群的抗凝作用,尚未发现不良反应,其是目前美国食品药品管理局(FDA)批准的唯一可用于临床的NOACs特异性拮抗剂[42]。重整活化凝血因子X(andexanet alfa、PRT064445、AnnexaTM-A)保留了与Ⅹa因子抑制剂的高亲和性,但去除了原有的生物活性,从而逆转Ⅹa因子抑制剂的抗凝作用[43]。Ⅰ期和Ⅱ期临床试验显示,andexanet alfa具有起效快、作用时间长、逆转完全等优点。2015年一项前瞻性开放性Ⅲ期临床试验显示,andexanet alfa能治疗Ⅹa因子抑制剂所致的急性大出血[44],但急诊状态下如何选择合适用药剂量尚缺乏相关研究证据。蛋白结构改变可能影响免疫原性也需要关注。PER977(Aripazine)是一种小的、人工合成的、水溶性、阳离子型分子,以非共价结合的方式抗凝,通过氢键和电荷与电荷间的相互作用而抑制Ⅹa因子抑制剂和达比加群等的抗凝作用[45]。虽然有一些Ⅰ、Ⅱ期临床试验证实了PER977的安全性和有效性,但其临床疗效的证据还有限。GREINACHER等[46]认为PER977存在的主要挑战是作用模式尚不清楚和逆转治疗如何监测。
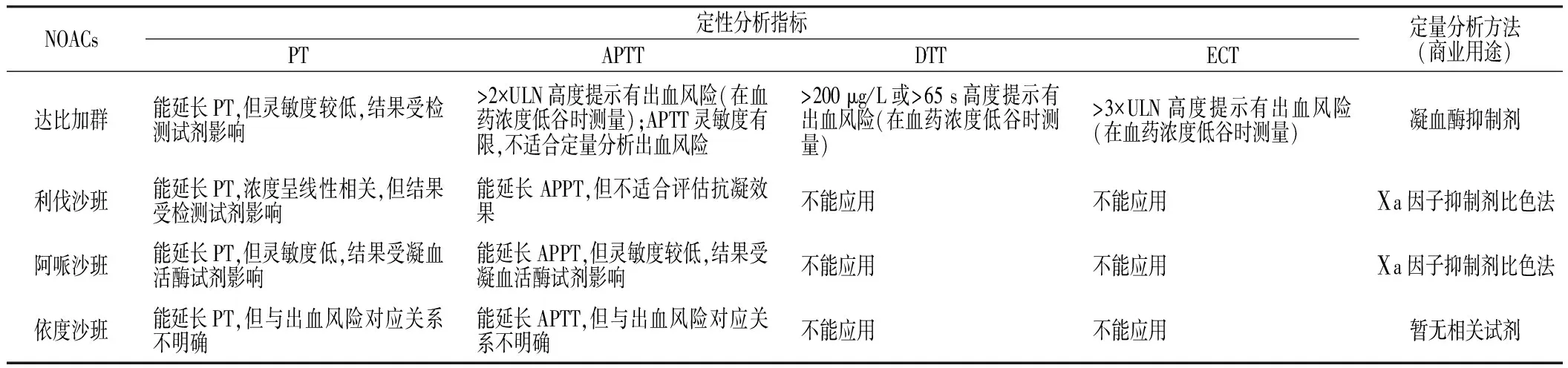
表4 NOACs的实验室定性和定量分析
注:PT=凝血酶原时间,APTT=活化部分凝血活酶时间,DTT=稀释凝血酶时间,ECT=蝰蛇毒凝血时间,ULN=参考范围上限值
6 小结
NOACs治疗AVTE的临床疗效、安全性及围术期抗凝管理方面均不劣于甚至优于传统抗凝药物,我国已批准将利伐沙班用于AVTE的治疗和预防,对于难以规律监测INR及因其他原因不适合使用华法林的AVTE患者可考虑使用利伐沙班。尽管短期内NOACs尚无法取代传统口服抗凝剂,但NOACs应用前景十分广阔。随着NOACs的进一步研究,更多的临床试验将开展,相关监测、拮抗剂等保护措施将不断完善,未来AVTE患者将会从NOACs获益更多。
[1]KONSTANTINIDES S V.2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism[J].Eur Heart J,2014,35(45):3145-3146.DOI:10.1093/eurheartj/ehu393.
[2]APRINI J A.Risk assessment as a guide for the prevention of the many faces of venous thromboembolism[J].Am J Surg,2010,199(1):S3-10.DOI:10.1016/j.amjsurg.2009.10.006.
[3]SINDET-PEDERSEN C,PALLISGAARD J L,OLESEN J B,et al.Safety and efficacy of direct oral anticoagulants compared to warfarin for extended treatment of venous thromboembolism-a systematic review and meta-analysis[J].Thromb Res,2015,136(4):732-738.DOI:10.1016/j.thromres.2015.07.022.
[4]FINKS S W,TRUJILLO T C,DOBESH P P.Management of Venous Thromboembolism[J].Ann Pharmacother,2016,50(6):486-501.DOI:10.1177/1060028016632785.
[5]HIRSH J,HULL R D.Treatment of venous thromboembolism[J].Springer International Publishing,2014:717-728.
[6]HILLIS C,CROWTHER M A.Acute phase treatment of VTE:Anticoagulation, including non-vitamin K antagonist oral anticoagulants[J].Thromb Haemost,2015,113(6):1193-1202.DOI:10.1160/TH14-12-1036.
[7]SCHULMAN S.Advantagesand limitations of the new anticoagulants[J].J Intem Med,2014,275(1):1-11.DOI:10.1111/joim.12138.
[8]FRANCHINI M,MANNUCCI P M.Direct oral anticoagulants and venous thromboembolism[J].Eur Respir Rev,2016,25(141):295-302.DOI:10.1183/16000617.0025-2016.
[9]MADAN S,SHAH S,DALE P,et al.Use of novel oral anticoagulant agents in venous thromboembolism[J].Cardiovasc Diagn Ther,2016,6(6):570-581.DOI:10.21037/cdt.2016.11.17.
[10]TUN N M,OO T H.Prevention and treatment of venous thromboembolism with new oral anticoagulants:a practical update for clinicians[J].Thrombosis,2013:183616.DOI:10.1155/2013/183616.
[11]SCHULMAN S,KAKKAR A K,GOLDHABER S Z,et al.Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis[J].Circulation,2014,129(7):764-772.DOI:10.1161/CIRCULATIONAHA.113.004450.
[12]SCHULMAN S,KEARON C,KAKKAR A K,et al.Dabigatran versus warfarin in the treatment of acute venous thromboembolism[J].N Engl J Med,2009,361(24):2342-2352.DOI:10.1056/NEJMoa0906598.
[13]WELLS P S,FORGIE M A,RODGER M A.Therapies for venous thromboembolism-reply[J].JAMA,2014,311(24):2543-2544.DOI:10.1001/jama.2014.6123.
[14]ROMUALDI E,AGENO W.Investigational factor Ⅹa inhibitors for thrombosis and acute coronary syndromes[J].Expert Opin Investig Drugs,2011,20(4):495-505.DOI:10.1517/13543784.2011.562190.
[15]EINSTEIN INVESTIGATORS,BAUERSACHS R,BERKOWITZ S D,et al.Oral rivaroxaban for symptomatic venous thromboembolism[J].N Engl J Med,2010,363(26):2499-2510.DOI:10.1056/NEJMoa1007903.
[16]WANG Y,WANG C,CHEN Z,et al.Rivaroxaban for the treatment of symptomatic deep-vein thrombosis and pulmonary embolism in Chinese patients:a subgroup analysis of the EINSTEIN DVT and PE studies[J].Thromb J,2013,11(1):25.DOI:10.1186/1477-9560-11-25.
[17]KEARON C,AKL E A,ORNELAS J,et al.Antithrombotic therapy for VTE disease:CHEST guideline and expert panel report[J].Chest,2016,149(2):315-352.DOI:10.1016/j.chest.2015.11.026.
[18]ROMUALDI E,AGENO W.Investigational factor Ⅹa inhibitors for thrombosis and acute coronary syndromes[J].Expert Opin Investig Drugs,2011,20(4):495-505.DOI:10.1517/13543784.2011.562190.
[19]LASSEN M R,RASKOB G E,GALLUS A,et al.Apixaban or enoxaparin for thromboprophylaxis after knee replacement[J].N Engl J Med,2009,361(6):594-604.DOI:10.1056/NEJMoa0810773.
[20]AGNELLI G,BULLER H R,COHEN A,et al.Oral apixaban for the treatment of acute venous thromboembolism[J].N Engl J Med,2013,369(9):799-808.DOI:10.1056/NEJMoa1302507.
[21]LASSEN M R,GALLUS A,RASKOB G E,et al.Apixaban versus enoxaparin for thromboprophylaxis after hip replacement[J].N Engl J Med,2010,363(26):2487-2498.DOI:10.1056/NEJMoa1006885.
[22]FUJI T,WANG C J,FUJITA S,et al.Safety and efficacy of edoxaban,an oral factor Xa inhibitor, versus enoxaparin for thromboprophylaxis after total knee arthroplasty:the STARS E-3 trial[J].Thromb Res,2014,134(6):1198-1204.DOI:10.1016/j.thromres.2014.09.011.
[23]HOKUSAI-VTE INVESTIGATORS,BÜLLER H R,DÉCOUSUS H,et al.Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism[J].N Engl J Med,2013,369(15):1406-1415.DOI:10.1056/NEJMoa1306638.
[24]HAREL Z,SHOLZBERG M,SHAH P S,et al.Comparisons between novel oral anticoagulants and vitamin K antagonists in patients with CKD[J].J Am Soc Nephrol,2014,25(3):431-442.DOI:10.1681/ASN.2013040361.
[25]ARMSTRONG E M,BELLONE J M,HORNSBYL B,et al.Pregnancy-Related Venous Thromboembolism[J].J Pharm Pract,2014,27(3):243-252.DOI:10.1177/0897190014530425.
[26]EINSTEIN-PE INVESTIGATORS,BÜLLER H R,PRINS M H,et al.Oral rivaroxaban for the treatment of symptomatic pulmonary embolism[J].N Engl J Med,2012,366(14):1287-1297.DOI:10.1056/NEJMoa1113572.
[27]VEDOVATI M C,GERMINI F,AQNELLI G,et al.Direct oral anticoagulants in patients with VTE and cancer:a systematic review and meta-analysis[J].Chest,2015,147(2):475-483.DOI:10.1378/chest.14-0402.
[28]CUKER A,SIEGAL D M,CROWTHER M A,et al.Laboratory measurement of the anticoagulant activity of the non-vitamin K oral anticoagulants[J].J Am Coll Cardiol,2014,64(11):1128-1139.DOI:10.1016/j.jacc.2014.05.065.
[29]FINKS S W,TRUJILLO T C,DOBESH P P.Management of Venous Thromboembolism:Recent Advances in Oral Anticoagulation Therapy[J].Ann Pharmacother,2016,50(6):486-501.DOI:10.1177/1060028016632785.
[30]RAVAL A N,CIGARROA J E,CHUNG M K,et al.Management of Patients on Non-Vitamin K Antagonist Oral Anticoagulants in the Acute Care and Periprocedural Setting: A Scientific Statement From the American Heart Association[J].Circulation,2017,135(7):e604-633.DOI:10.1161/CIR.0000000000000477.
[31]CONWAY S E,HWANG A Y,PONTE C D,et al.Laboratory and Clinical Monitoring of Direct Acting Oral Anticoagulants:What Clinicians Need to Know[J].Pharmacotherapy,2017,37(2):236-248.DOI:10.1002/phar.1884.
[32]HAWES E M,DEAL A M,FUNK-ADCOCK D,et al.Performance of coagulation tests in patients on therapeutic doses of dabigatran:a crosssectional pharmacodynamic study based on peak and trough plasma levels[J].J Thromb Haemost,2013,11(8):1493-1502.DOI:10.1111/jth.12308.
[33]SAMAMA M M,CONTANT G,SPIRO T E,et al.Laboratory assessment of rivaroxaban:a review[J].Thromb J,2013,11(1):11.DOI:10.1186/1477-9560-11-11.
[34]DICKNEITE G,HOFFMAN M.Reversing the new oral anticoagulants with prothrombin complex concentrates(PCCs):what is the evidence[J].Thromb Haemost,2014,111(2):189-198.DOI:10.1160/TH13-05-0431.
[35]ZHOU W,SCHWARTING S,ILLANES S,et al.Hemostatic therapy in experimental intracerebral hemorrhage associated with the direct thrombin inhibitor dabigatran[J].Stroke,2011,42(12):3594-3599.DOI:10.1161/STROKEAHA.111.624650.
[36]PRAGST I,ZEITLER S H,DOERR B,et al.Reversal of dabigatran anticoagulation by prothrombin complex concentrate(Beriplex P/N)in a rabbit model[J].J Thromb Haemost,2012,10(9):1841-1848.DOI:10.1111/j.1538-7836.2012.04859.x.
[37]EERENBERG E S,KAMPHUISEN P W,SIJPKENS M K,et al.Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate:a randomized,placebo-controlled,crossover study in healthy subjects[J].Circulation,2011,124(14):1573-1579.DOI:10.1161/CIRCULATIONAHA.111.029017.
[38]BROWN K S,WICKREMASINGHA P,PARASRAMPURIA D A,et al.The impact of prothrombin complex concentrate on the coagulopathy effects of edoxaban[J].JACC,2014,63:A2095.
[39]MARLU R,HODAJ E,PARIS A,et al.Effect of non-specific reversal agents on anticoagulant activity of dabigatran and rivaroxaban:a randomised crossover ex vivo study in healthy volunteers[J].Thromb Haemost,2012,108:217-224.
[40]LEE F M,CHAN A K,LAU K K,et al.Reversal of new,factor-specific oral anticoagulants by rFVIIa, prothrombin complex concentrate and activated protrhombin complex concentrate:a review of animal and human studies[J].Thromb Res,2014,133(5):705-713.DOI:10.1016/j.thromres.2014.01.031.
[41]CUKER A.Laboratory measurement of the nonvitamin K antagonist oral anticoagulants:selecting the optimal assay based on drug, assay availability,and clinical indication[J].J Thromb Thrombolysis,2016,41(2):241-247.DOI:10.1007/s11239-015-1282-7.
[42]SCHIELE F,VAN RYN J,CANADA K,et al.A specific antidote for dabigatran:functional and structural characterization[J].Blood,2013,121(18):3554-3562.DOI:10.1182/blood-2012-11-468207.
[43]LU G,DEGUZMAN F R,HOLLENBACH S J,et al.A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa[J].Nat Med,2013,19(4):446-451.DOI:10.1038/nm.3102.
[44]CROWTHER M,GOLD A,LU G,et al.ANNEXATM-A PART 2:A phase 3 randomized,double-blind, placebo-controlled trial,demonstrating sustained reversal of apixabaninduced anticoagulation in older subjects by andexanet alfa(PRT064445),a universal antidote for factor Xa(FXa)inhibitors[J].J Thromb Haemost,2015,13(Suppl 2):84.
[45]LAULICHT B,BAKHRU S,LEE C,et al.Small molecule antidote for anticoagulants[J].Circulation,2012,126:10021.
[46]GREINACHER A,THIELE T,SELLENG K.Reversal of anticoagulants:an overview of current developments[J].Thromb Haemost,2015,113(5):931-942.DOI:10.1160/TH14-11-0982.
ProgressonNovelOralAnticoagulantinthePreventionandTreatmentofAcuteVenousThromboembolism
WANGZhi-chao,FANGHong
DepartmentofCardiology,ShanghaiTongjiHospitalAffiliatedtoTongjiUniversity,Shanghai200065,China
FANGHong,E-mail:de_61@163.com
Acute venous thromboembolism(AVTE)is one of top three Fatal vascular diseases on clinic,with high morbidity.Anticoagulant therapy is one of important measures in preventing and treating venous thromboembolism.In recent years,effectiveness and safety of new oral anticoagulants(NOACs)in the prevention and treatment of AVTE has been one of hot clinical topics.This paper mainly reviewed the latest research progress on treatment outcome,classification,clinical recommendations,application in particular cases,laboratory qualitative and quantitative analysis,related bleeding reversal drugs of NOACs.
Anticoagulant;Acute venous thromboembolism;Review
200065上海市,同济大学附属上海市同济医院心内科
方宏,E-mail:de_61@163.com
R 619.2
A
10.3969/j.issn.1008-5971.2017.09.002
2017-06-25;
2017-09-18)
(本文编辑:谢武英)

