家兔雌激素受体1基因编码区序列分析
张翠霞,李丛艳,雷 岷,张翔宇,杨 超,邝良德,郑 洁,谢晓红
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,四川成都 610066)
家兔雌激素受体1基因编码区序列分析
张翠霞,李丛艳,雷 岷,张翔宇,杨 超,邝良德,郑 洁,谢晓红*
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,四川成都 610066)
家兔的繁殖性状属于低遗传力性状,基于传统育种方法的遗传改良很难取得显著进展。家兔雌激素受体1(ESR1)基因是影响繁殖性状的重要候选基因,本研究利用PCR技术扩增了德国巨型白兔ESR1基因的编码区序列。结果表明:基因进化树与已知进化树一致,哺乳动物的ESR1基因可能来自于同一个祖先基因;德国巨型白兔ESR1基因与猪的同源性最高(87.1%);预测的蛋白包括4个主要的功能区域A/B区(aa1-187)、C区(aa188-264)、D区(aa265-314)和E区(aa315-598);分析发现5个保守的磷酸化位点,可进一步作为与性状关联研究的候选位点。测定的德国巨型白兔ESR1编码区序列将为基因功能突变和繁殖性状的相关性研究提供理论基础。
家兔;雌激素受体;繁殖性状
家兔繁殖性状的改良是遗传育种领域的研究热点,也是提高养殖经济效益的关键环节。以分子标记技术为核心的分子育种逐渐成为家兔繁殖性状改良的新途径,其关键步骤是寻找与性状显著相关的DNA标记,常用方法包括全基因组扫描法和候选基因法。雌激素受体(Estrogen Receptor,ESR)基因是影响繁殖性状的重要功能候选基因,其通过与靶基因上特异性效应元件的结合,改变雌激素基因的转录,进而对雌性第二特征、繁殖周期、生殖力、妊娠维持产生影响[1]。目前已克隆出人的ESR1基因,其中人ESR1基因位于染色体6q24-q27区域,含7个内含子和8个外显子,全长约140 kb,编码595个氨基酸残基[2]。基因功能研究表明,该基因包含对靶基因起转录激活作用的A/B域、DNA结合所必需的C域、影响DNA稳定性的D域、配体结合和受体的二聚化所必需的E域4个功能区域[3]。人类的ESR1基因与多个生殖器官的发育和疾病有关,如卵巢和子宫内膜[4]。分析发现ESR1序列在不同物种间具有很高的保守性,其中人与鸡、人与鼠、鼠与鸡的同源性分别为88%、80%、77%[5-6]。已有文献资料表明,ESR1基因中存在多态性位点,且与畜禽繁殖性状中产仔数具有相关[7]。母猪的SNP(Single Nucleotide Polymorphisms)位点与繁殖性状关联分析表明,ESR1基因的SNP位点与断奶发情间隔以及初生死胎数存在显著关联[8]。不同ESR基因型母猪的初生窝重差异显著[9]。公猪ESR1基因与精液质量相关联,同时ESR1的表达量在睾丸和附睾中差异显著,对精原细胞的分化产生影响[10]。胚胎移植后的鲁西牛的配怀率和激素水平与ESR1的多态位点存在关联[11]。已有报道指出,土耳其绵羊的第4外显子发现6个SNP位点[12]。齐卡肉兔配套系中的G系德国巨型白兔,为配套系中的父系,具有生长速度快,但繁殖力相对较低,性成熟较晚等特性[13]。但德国巨型兔的ESR1基因编码区序列还未见报道,一定程度上限制了其基因结构和突变位点的研究,并且影响了与家兔繁殖性状相关DNA标记的开发利用。本研究扩增了德国巨型白兔ESR1基因编码区序列,以期能够为家兔ESR基因的结构和突变研究提供理论数据。
1 材料与方法
1.1 血液样本采集和全基因组DNA提取 采用人医用一次性采血管收集静脉采血5 mL,肝素钠抗凝处理;所有样本-20℃低温保存备用。利用Universal Genomic DNA Extraction Kit (TaKaRa,Dalian,China)试剂盒抽提基因组DNA。取DNA提取样本,混合适量的上样缓冲液,使用1.0%琼脂糖凝胶电泳进行检测,120 V电泳20 min,用凝胶成像系统检测DNA提取效果。
1.2 PCR引物设计 以ENSEMBLE数据家兔的参考基因组序列(ENSOCUG00000004829)作为模板进行PCR扩增引物的设计,利用Primer5软件进行引物设计,保证引物扩增的效率与特异性,共扩增ESR基因的1~9号外显子,引物信息及目的片段见表1。
1.3 PCR扩增与测序 以检测合格的单一样本基因组DNA为模板,分别对每一对设计的引物进行PCR扩增。PCR扩增反应体系:模板DNA0.2 μL,上、下游引物各0.15 μL,PCR扩增2× MasterMix 10 μL,加超纯水至终体积25 μL。PCR扩增反应程序:95℃预变性5 min,94℃变性60 s,退火50 s,72℃延伸90 s,根据扩增效率循环30~35次,最后72℃延伸10 min,4℃保持。取适量PCR扩增产物,用1.0%琼脂糖凝胶电泳进行检测,120 V电泳20 min,用凝胶成像系统检测结果(图1)。对PCR扩增成功的样本直接送上海英骏公司测序,返回测序胶图,用于序列分析。
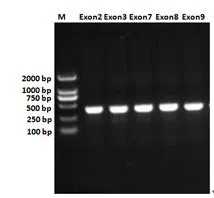
图1 家兔ESR基因不同外显子的PCR扩增产物检测
1.4 数据分析 利用DNA Star软件进行序列拼接、同源性比较和基因进化分析。利用在线的基因作图软件(http://ibs.biocuckoo.org/)绘制基因结构图。
2 结 果
2.1 不同物种间的同源性 利用DNA STAR的MegAlign程序对16个物种的ESR1基因编码区进行了同源性比对(其中哺乳动物7个,两栖动物2个,鸟类2个,爬行动物2个,鱼类3个),不同物种间ESR1基因编码区的相似性为42.5%~94.2%(表2)。哺乳动物间的同源性为78.4%~94.2%,其中兔与猪的同源性最高为87.1%,与人类的同源性为86.8%。鸟类与哺乳动物的同源性为67.3%~71.8%,两栖类与哺乳动物的同源性为58.5%~66.2%。哺乳类与鸟类的同源性最高。

表1 引物信息
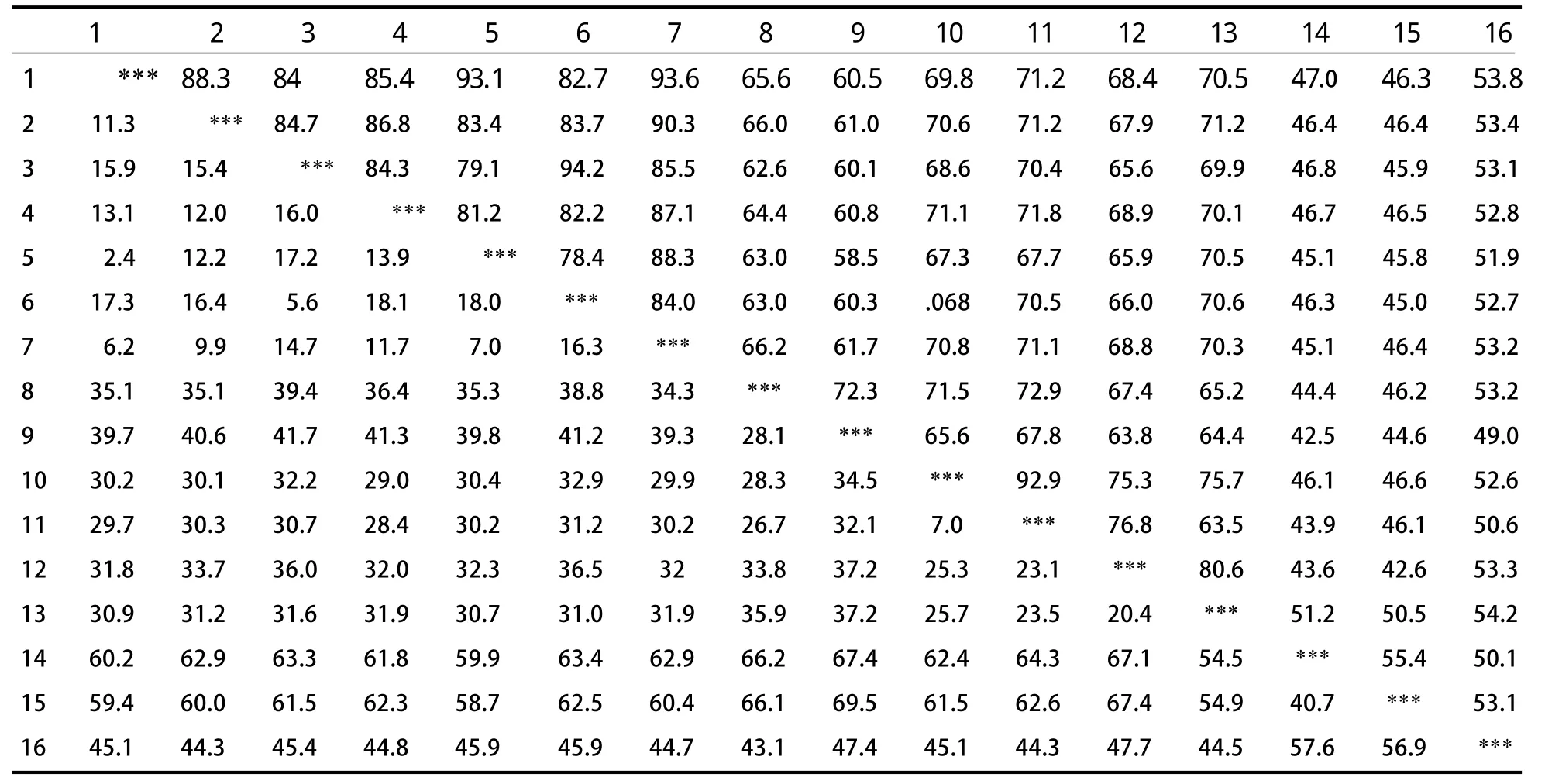
表2 不同物种间ESR1基因编码区核酸序列的同源性比较
2.2 基因结构及修饰位点 对家兔ESR基因的CDS区测序结果表明,该区域全长1 794 bp,编码598个氨基酸。通过与人的ESR序列比对表明,家兔ESR包含4个区域,分别为包含家族特征结构的A/B区(aa1-187)、C区(aa188-264)、D区(aa265-314)和 E区(aa315-598),见图 2。预测到8个磷酸化位点,分别为107、109、121、170、171、204、314和 540。 人 和 兔ESR1基 因存在5个保守的磷酸化位点,分别为107、109、121、170和 540。
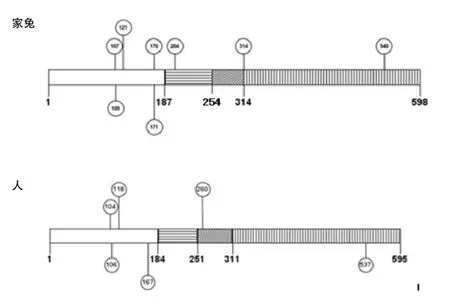
图2 家兔与人ESR1的结构图
2.3 基因进化树 基因进化分析结果表明,鱼类首先分为一支,两栖类分化为一支,鸟类、蜥蜴类和哺乳类再度分化(图3)。家兔首先和人及偶蹄动物聚集在一起,家兔与人的遗传距离最近。鸟类首先和蜥蜴类爬行动物聚在一起,再与两栖动物聚集最后与哺乳动物汇成一支。
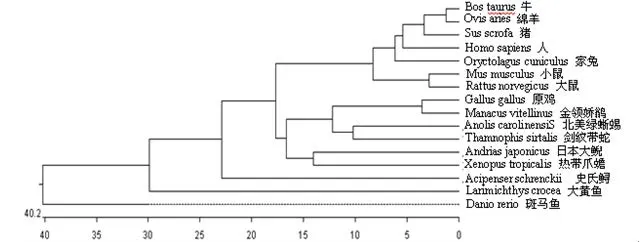
图3 不同物种的ESR1基因进化树
3 讨 论
家兔ESR1基因编码区与人具有很高的同源性,推测其各个区域和基因功能也具有相似性。人ESR1基因A/B域包含1个非配体依赖型转录激活功能区(Activation Function1,AF1),能与相关转录因子相互作用激活靶基因[14]。C域包含有2个锌指结构并富含高度保守的碱性氨基酸残基,主要参与DNA的结合。D区域为绞链区,在无雌激素的条件下,该区结合1个热应激蛋白并进行适当的折叠以保护疏水的配体结合区,从而维持受体的非活性状态。E区域含有1个在激素依赖的转录过程中有重要作用的 AF-2区(Activation Function 2,AF2),在转录激活中起调节作用[15]。
人类ESR1基因对生殖系统的发育起着重要作用,影响排卵、受精和胚胎着床等重要生殖过程[16]。目前研究表明,家兔ESR1基因对其生殖过程有直接影响。Baranda-Avila等[17]利用RT-PCR技术对怀孕早期家兔输卵管不同时期的壶腹和峡部进行了ERS1基因的表达差异分析,结果表明,怀孕母兔2个组织的ESR1表达量高于未孕的家兔;怀孕母兔壶腹的ESR1表达量在怀孕第3天最高,第4天开始下降;而峡部的表达量前4 d持续增加,第3天达到最大值,由此可知ESR基因可能对怀孕早期的产道起着特殊的生物学作用。ESR1基因能调控公兔附睾内的催产素受体的表达和活性[18]。雌激素受体通过雌激素敏感的类固醇激素合成途径调控雌二醇,进而影响母兔黄体中的孕酮水平[19]。另外,Okada等[20]利用实时荧光定量PCR对不同怀孕期大鼠输卵管内ESR1和ESR2的表达量进行了分析,结果发现不同孕期和不同组织细胞的输卵管中ESR1的表达量差异显著。因此,可以将ESR1作为影响家兔繁殖性状的重要功能候选基因。
根据受体是否与目的基因结合,可将ESR作用机理分为基因组作用和非基因组作用。非基因组作用主要通过激素和受体结合,再利用磷酸化激活转录因子,最后作用于目的基因[21]。基因组作用根据是否有激素参与可分为激素配体途径和激素非配体途径。非激素配体的途径通过相关调控因子如生长因子引起磷酸化的级联反应以激活受体,受体同雌激素反应元件(Estrogen Reactive Element,ERE)作用调节目的基因的转录[22]。激素配体途径可以分为ERE作用途径和非ERE作用途径2类。ERE作用属于经典方式,激素和受体结合后发生二聚化,再与目的基因的ERE区域结合,影响其转录[23]。非ERE作用途径则是激素和受体结合后与目的基因的复合物结合(复合物由相关因子和目的基因的启动区域结合产生)以调控目的基因[24]。磷酸化在非激素配体和非基因组激活途径中起作用,是ESR实现目的基因调控的重要方式之一。表皮生长因子和游离ESR1转录调控的分子机理就是通过SER118的磷酸化实现的。目前,人的ESR1基因发现6个影响转录的磷酸化位点,其中5个与预测的兔ERE磷酸化位点为同源保守性位点,这些位点可能在家兔ESR调控目的基因转录方面起着重要的作用。
化石证据表明,进化规律由水生到陆生。脊椎动物的共同祖先从鱼类开始进化,然后进化到两栖类的过渡阶段,再进化到完全陆生的爬行类,又进一步进化为鸟类和哺乳类动物。基因的变异是产生表型变异的内在原因,也是动物进化的遗传基础,因此基因的演化历程也是由水生到陆生,鱼类的ESR1基因首先分为一支,与动物的进化规律一致。基因决定表型,ESR1基因对繁殖周期、生殖力、骨骼密度等性状都有重要影响。哺乳动物的关键进化是能产生乳汁,都具有乳腺、胎生等特征表型。由于ESR1参与调控乳腺的形成和胚胎的发育,因此哺乳动物的ESR1基因同源性较高,亲缘关系最近,聚为一支[25-26]。羊膜动物具有羊膜结构,鸟类和哺乳动物属于羊膜动物,两栖类没有羊膜,因此哺乳动物ESR基因与鸟类的亲缘关系比两栖类要近,首先聚为一支再与两栖类聚在一起。ESR1基因编码区的保守结构表明,这些基因很可能来自同一个祖先,为进化出适应环境的表型而发生改变。
[1] Couse J F, Korach K S. Estrogen receptor-alpha mediates the detrimental effects of neonatal diethylstilbestrol (DES)exposure in them murine reproductive tract[J]. Toxicology,2004, 205:55-63.
[2] Enmark E, Pelto-Huikko M, Grandien K, et al. Human estrogen receptor beta-gene structure, chromosomal localization, and expression pattern[J]. J Clin Endocrinol Metab, 1997, 82:4258-4265.
[3] Montano M M, Muller V, Trobaugh A, et al. The carboxyterminal F domain of the human estrogen receptor: role in the transcriptional activity of the receptor and the effectiveness of antiestrogens as estrogen antagonists[J].Mol Endocrinol, 1995, 9:814-825.
[4] Drummond A E, Fuller P J. Ovarian actions of estrogen receptor-β: an update[J]. Semin Reprod Med, 2012,30(1):32-38.
[5] Krust A, Green S, Argo P, et al. The chicken estrogen receptor sequence: homology with verb A and the human estrogen and glucocorticoid receptor[J].EMBO J, 1986,5:891-897.
[6] Koike S, Sakai M, Muramalsu M, et al. Molecular cloning and characterization of rat estrogen receptor cDNA[J].Nucleic Acids Res, 1987, 15(6): 2499-2513.
[7] Szreder T1, Zwierzchowski L. Estrogen receptors and their genes potential markers of functional and production traits of farm animals[J]. Mol Biol Rep, 2007, 34(4):207-211.
[8] Rempel L A 1, Nonneman D J, Wise T H, et al. Association analyses of candidate single nucleotide polymorphisms on reproductive traits in swine[J]. J Anim Sci, 2010, 88(1):1-15.
[9] Isler B J, Irvin K M, Neal S M, et al. Examination of the relationship between the estrogen receptor gene and reproductive traits in swine[J]. J Anim Sci, 2002,80(9):2334-2339.
[10] Gunawan A, Kaewmala K, Uddin M J, et al. Association study and expression analysis of porcine ESR1 as a candidate gene for boar fertility and sperm quality[J]. Anim Reprod Sci, 2011, 128(1-4):11-21.
[11] Tang K Q, Yang W C, Pai B, et al. Effects of PGR and ESRα genotypes on the pregnancy rates after embryo transfer in Luxi cattle[J]. Mol Biol Rep, 2013, 40(1):579-584.
[12] Ozmen O, Seker I, Kul B C, et al. Haplotype variation of estrogen receptor-alpha (ER-alpha) gene exon 4 in Turkish sheep breeds[J]. Genetika, 2012, 48(10):1185-1189.
[13] 谷子林, 秦应和, 任克良. 中国养兔学[M]. 北京:中国农业出版社, 2013: 241-243.
[14] Tora L, White J, Brou C, et al. The human estrogen receptor has two independent nonacid transcriptional activation functions[J]. Cell, 1989, 59:477-487.
[15] Tzukerman M T, Esty A, Santiso-Mere D, et al. Human estrogen receptor transactivational capacity is determined by both cellular and promoter context and mediated by two functionally distinct intramolecular regions[J].Mol Endocrinol, 1994, 8: 21-30.
[16] Padmanabhan R A, Laloraya M. Estrogen-initiated protein interactomes during embryo implantation[J]. Am J Reprod Immunol, 2016, 75(3):256-262.
[17] Baranda-Avila N, Cardoso-Rangel M E, Cerbón M, et al.Differential expression of estrogen receptor alpha gene in the ampullae and isthmus regions of the rabbit oviduct during early pregnancy[J]. Anim Reprod Sci, 2010, 121(3-4):286-293.
[18] Filippi S, Luconi M, Granchi S, et al. Estrogens, but not androgens, regulate expression and functional activity of oxytocin receptor in rabbit epididymis[J]. Endocrinology,2002, 143(11):4271-4280.
[19] Holt J A. Regulation of progesterone production in the rabbit corpus luteum[J]. Biol Reprod, 1989 , 40(2):201-208.
[20] Okada A, Ohta Y, Inoue S, et al. Expression of estrogen,progesterone and androgen receptors in the oviduct of developing, cycling and pre-implantation rats[J]. J Mol Endocrinol, 2003, 30(3):301-315.
[21] Anbalagan M, Rowan B G. Estrogen receptor alpha phosphorylation and its functional impact in human breast cancer[J]. Mol Cell Endocrinol, 2015, 154(3):264-272.
[22] Murphy L C, Seekallu S V, Watson P H. Clinical significance of estrogen receptor phosphorylation[J]. Endocr Relat Cancer,2011, 18(1):1-14.
[23] O’Lone R, Frith M C, Karlsson E K, et al. Genomic targets of nuclear estrogen receptors[J]. Mol Endocrinol, 2004,18:1859-1875.
[24] Lannigan D A. Estrogen receptor phosphorylation[J].Steroids, 2003, 68(1):1-9.
[25] 冯涛, 赵有璋, 狄冉, 等. 山羊雌激素受体(ESR)基因部分外显子多态性分析[J]. 农业生物技术学报, 2009,17(2):237-242.
[26] 徐子清, 梅书棋, 樊俊华. 猪ESR基因一个外显子片段的克隆与序列分析[J]. 畜牧兽医学报, 2001, 32(2):101-107.
Analysis of Coding Sequence of Estrogen Receptor Alpha in Rabbit
ZHANG Cui-xia, LI Cong-yan, LEI Min, ZHANG Xiang-yu, YANG Chao, KUANG Liang-de,ZHENG Jie, XIE Xiao-hong*
(Sichuan Animal Sciences Academy, Animal Breeding and Genetics Key Laboratory of Sichuan Province, Sichuan Chengdu 610066, China)
The reproduction traits of rabbit are the low heritability traits. The traditional breeding method shows a slow improvement. The ESR1 gene is an important candidate associated with the reproduction traits in rabbit. In this research,the coding sequence of ESR1 of ZIKA meat rabbit was amplified with the PCR technology. The result shows that the gene evolution tree is consistent with the known evolution tree, so the ESR1 gene of a mammal may be from the same ancestral gene. The homology between ZIKA meat rabbits and pigs is the highest (87.1%). It is predicted that protein consists of four functional domains, which are namely A/B region (aa1-187), C region (aa188-264), D region (aa265-314) and E region(aa315-598). Five conservative phosphorylation sites have been found and can serve as candidate sites for further research related to traits. Besides, it is also predicted that the ESR1 coding sequence of ZIKA meat rabbit will provide necessary basic data for the research on correlation between functional mutation and reproduction traits.
Rabbit; Estrogen receptor; Reproductive traits
S829.2
A
10.19556/j.0258-7033.2017-10-029
2017-02-14;
2017-04-28
四川省畜牧科学研究院基本科研业务费专项资金(SASA2014A11);公益性行业(农业)科研专项经费(201303143);中国南方经济作物副产物饲料化利用技术研究与示范 (201403049);国家兔产业技术体系(CARS-44-B-4);四川省育种攻关项目(2016NYZ0046);四川省科技支撑计划(2016NZ0002)
张翠霞(1981-),女,四川自贡人,助理研究员,硕士,主要从事家兔遗传育种研究,E-mail:dawn713@163.com
*通讯作者:谢晓红,女,四川广安人,研究员,本科,主要从事家兔育种及饲养管理研究,E-mail:xkyyts@vip.126.com

