3个品种猪MEF2D基因启动子多态及其生物信息学分析
白 优 ,张 勇 *,陈 祥 ,2,张 雄 ,李 俊 ,3,何 琦 ,杨 红 ,陆 静
(1.贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室,贵州省动物遗传育种与繁殖重点实验室,贵州大学动物科学学院,贵州贵阳 550025;2.贵州省生猪健康养殖工程技术研究中心,贵州贵阳550025;3.贵州省种畜禽种质测定中心,贵州贵阳 550025)
3个品种猪MEF2D基因启动子多态及其生物信息学分析
白 优1,张 勇1*,陈 祥1,2,张 雄 ,李 俊1,3,何 琦1,杨 红1,陆 静1
(1.贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室,贵州省动物遗传育种与繁殖重点实验室,贵州大学动物科学学院,贵州贵阳 550025;2.贵州省生猪健康养殖工程技术研究中心,贵州贵阳550025;3.贵州省种畜禽种质测定中心,贵州贵阳 550025)
研究以从江香猪、杜×长×大外三元杂交猪及贵州宗地花猪为研究对象,采用混合DNA池结合直接测序技术筛选猪MEF2D基因5'UTR及第1外显子区SNPs位点;同时利用生物信息学软件分析SNPs位点对核心启动子区、CpG岛和转录因子结合位点的影响。结果表明:在猪MEF2D基因5'UTR区共筛查到4个SNPs位点,分别为A-511G、T-453A、T-242G和T-180A;生物信息学软件预测发现T-453A和T-242G位点附近有重要转录因子结合位点消失和新位点生成,据此推测猪MEF2D基因5'UTR区的T-453A和T-242G位点对调控启动子功能元件可能存在重要影响。
从江香猪;MEF2D基因;SNP;启动子;生物信息学
肌细胞增强因子2 (Myocyte Enhancerfactor 2,MEF2)是广泛存在于肌肉细胞的DNA结合活性因子,可与大多数肌肉发育相关基因的启动子或增强子结合,激活其活性。MEF2基因家族的4个成员(MEF2A、MEF2B、MEF2C、MEF2D)即使是同一物种中也位于不同染色体上。Larsen等[1]将猪MEF2A、MEF2C和MEF2D基因分别定位于1、2号和4号染色体。Wagenknecht等[2]在猪MEF2D基因第4内含子发现一处C-T突变,且该基因被定位于4q,该区域已定位多个QTL与胴体性状和生长速度相关[3]。陈磊[4]对几种猪MEF2D基因第4内含子Aci I位点进行分析,发现瘦肉率、眼肌面积较高的个体h等位基因占优势,但h等位基因对肉色和滴水损失不利。MEF2D基因主要调控肌肉和神经细胞的分化与存活[5]。研究表明,果蝇体中几乎全部的成肌细胞在MEF2D基因发生突变时停止分化[6]。祁艳霞等[7]发现,南阳黄牛3月龄到24月龄背最长肌组织中MEF2D 基因表达趋势为先升高后降低,且18月龄和24月龄表达量显著高于3月龄阶段。Neely等[8]发现,由于MEF2D基因mRNA选择性剪切,出生后的老鼠比出生前多了b外显子;含b外显子的MEF2D剪切体在出生后的老鼠心肌中起主导作用并随心肌的发育成熟表达量逐渐上调。程波[9]对山羊的MEF2D基因进行mRNA表达水平研究发现,该基因仅心肌和骨骼肌随年龄增加表达量逐渐上升。
启动子DNA 序列主要位于结构基因 5'-端上游,转录起始的特异性在于能活化RNA聚合酶并准确与模板 DNA结合。基因表达调控可以在复制、扩增、基因激活、转录、转录后、翻译和翻译后等多级水平上进行,最重要的调控发生在转录起始阶段。因此,启动子是基因表达所必需的重要序列信息。所以,真核生物启动子预测在基因分析中有重要研究意义。目前,鲜见关于猪MEF2D基因启动子区多态性研究报道。故本实验以3个不同品种猪为研究对象,筛选猪MEF2D基因启动子区SNPs位点,且结合生物软件预测分析,以期为从江香猪MEF2D基因结构、表达调控及其突变位点与从江香猪产肉性状等方面研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 贵阳市乌当区绿生源香猪养殖场采集从江香猪52个血样,贵阳市台农种猪养殖基地采集杜×长×大外三元猪46个血样,贵州紫云县宗地乡养猪场采集贵州宗地花猪36个血样。猪前腔静脉采集血液, EDTA-K2抗凝,标记后放入冰盒,每个样品约1 mL,带回实验室提取DNA。
1.1.2 主要试剂 DL 2000 DNA Marker、Goldview染料、Mixture溶液、上海生工Ezup柱式血液基因组DNA抽提试剂盒等;TAE缓冲液等由贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室自备。
1.2 实验方法
1.2.1 构建DNA混池 上海生工Ezup柱式血液基因组DNA抽提试剂盒提取DNA,紫外分光光度计测DNA浓度3次,取平均值,然后均稀释到100 ng/μL浓度。同一猪种样品各取5 μL构建DNA混池。
1.2.2 设计引物 根据GenBank公布的猪MEF2D基因(登录号: NC_010446.4),搜索猪MEF2D 基因启动子序列。Primer 5. 0设计扩增 MEF2D 基因5'UTR区及第1外显子区1对引物,引物信息详见表1。引物由上海生工进行合成。
1.2.3 PCR扩增 将构建好的DNA混池进行PCR反应,PCR反应体系10 μL:基因组DNA 1 μL,上、下游引物(10 pmol/μL)各 1 μL,2×Taq PCR Master Mix 试剂 5 μL,双蒸水 2 μL。PCR扩增程序:94℃预变性2 min;94℃变性30 s,61℃退火30 s;72℃延伸30 s,35个循环,72℃终延伸2 min。PCR产物用1.0%琼脂糖凝胶电泳检测,凝胶成像系统观察电泳结果。
1.2.4 SNPs筛选及等位基因频率估算 扩增的PCR产物送上海生工进行双向测序。利用BLAST筛选确定SNPs位点;运用MWSnap.3软件中的标尺测量各SNPs位点等位基因的相应峰高,根据fi=hi/(h1+h2)(i=1,2)估算等位基因频率。公式fi=hi/(h1+h2)(i=1,2)中,fi表示 SNP位点某等位基因频率,h1与h2分别表示测序峰图上该等位基因1、2峰的高度[10]。
1.2.5 生物信息学预测 采用生物信息学软件分析猪MEF2D基因启动子区调控元件(转录因子结合位点、核心启动子区及CpG岛范围),并将结果进行分析。
2 结果与分析
2.1 基因扩增结果 在凝胶成像系统中观察可知,扩增出的PCR产物条带特异性良好、清晰整齐、无杂带,与目的片段大小相符,可进行直接测序(图1)。2.2 序列分析 利用Seqman程序对测序结果进行BLAST筛选,确定SNPs位点。图2结果表明,在MEF2D基因的5'UTR区发现4个SNPs位点,分别为A-511G、T-453A、T-242G、T-180A。

表 1 引物序列、片段长度、扩增区域及退火温度
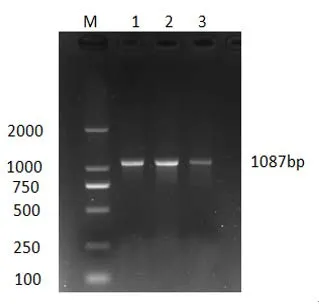
图1 电泳检测MEF2D基因启动子区PCR产物
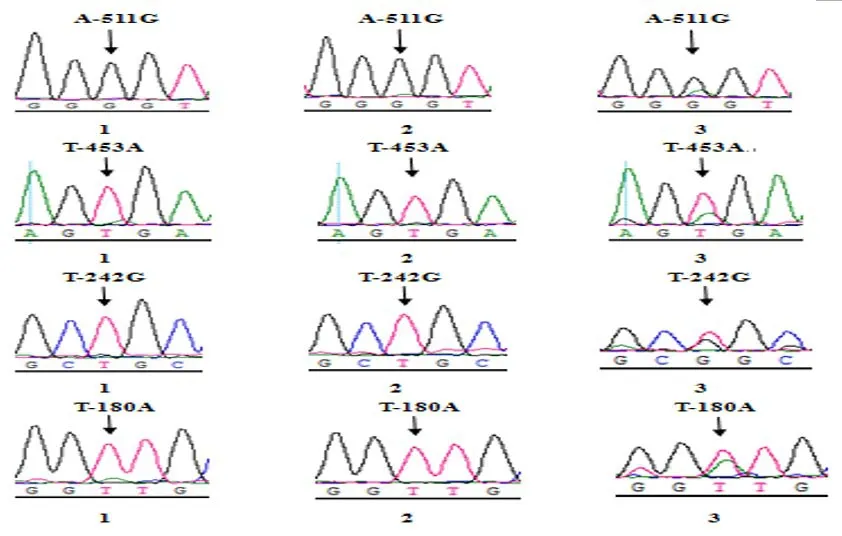
图2 3个品种猪的SNPs位点测序峰图
2.3 估算等位基因频率 利用MWSnap.3软件标尺测量3个群体猪SNPs位点等位基因峰值,并对各位点等位基因频率进行估算(表3)。4个SNPs位点分析得出,3个品种猪中从江香猪与贵州宗地花猪等位基因频率大致相同,但与外三元(杜×长×大)杂交猪存在明显差异,尤其T-242G位点。
2.4 MEF2D基因核心启动子范围预测 利用3种软件分别预测MEF2D基因核心启动子区域(表4)。3个软件对核心启动子区的预测评分均不是很高,说明突变前后序列对MEF2D基因核心启动子区影响不大。
2.5 MEF2D基因CpG岛预测 以CpG岛范围大于200 bp、GC含量大于50.0%、Obs/Exp比值大于0.6为标准,EMBOSS cpgplot等3种生物信息学软件预测序列CpG岛。如表5显示,CpG Island searcher、Webgene 2个软件均发现CpG岛,且CpG岛的预测范围和大小基本相同,但突变前后CpG岛数目和CpG岛大小均未发生改变。

表4 核心启动子区分析结果
2.6 MEF2D基因SNPs对转录因子结合位点影响 软件预测分析发现对 MEF2D 基因表达起重要调控作用的转录因子结合位点,如PPAR、MCP-1、TFⅡ、EIF-1等,且变化明显(表6)。分析TFsitescan 软件预测结果发现,T-453A 突变位点导致 iNOS-ISRE 结合位点消失,T-242G 导致 AP-2 转录结合位点消失和 NeuroD1-fp5 转录因子生成(图3)。Gene-regulation软件预测得到T-242G 突变位点导致 Pax-4 生成(评分为8.635)。JASPAR软件预测结果表明,T-242G突变位点导致NFIC转录结合位点消失,突变前主要结合 TTGGC序列(图4),突变后序列变为 GTGGC以致没有转录结合位点。
3 讨 论
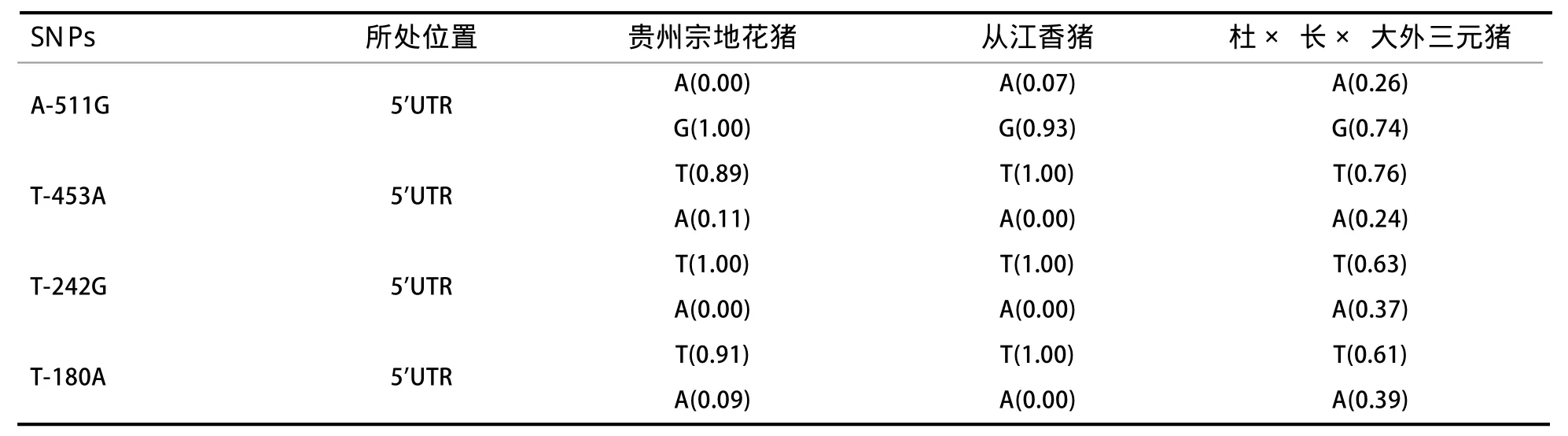
表3 3个群体猪种MEF2D基因SNPs等位基因频率估算结果
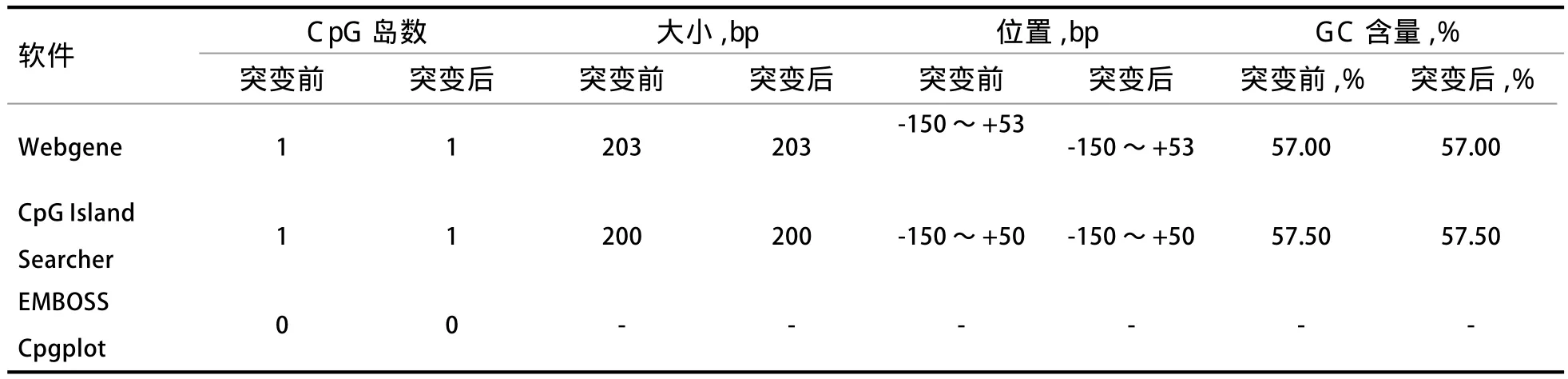
表5 不同软件预测MEF2D基因启动子区CpG岛结果

表6 不同软件对MEF2D基因转录因子结合位点的预测结果
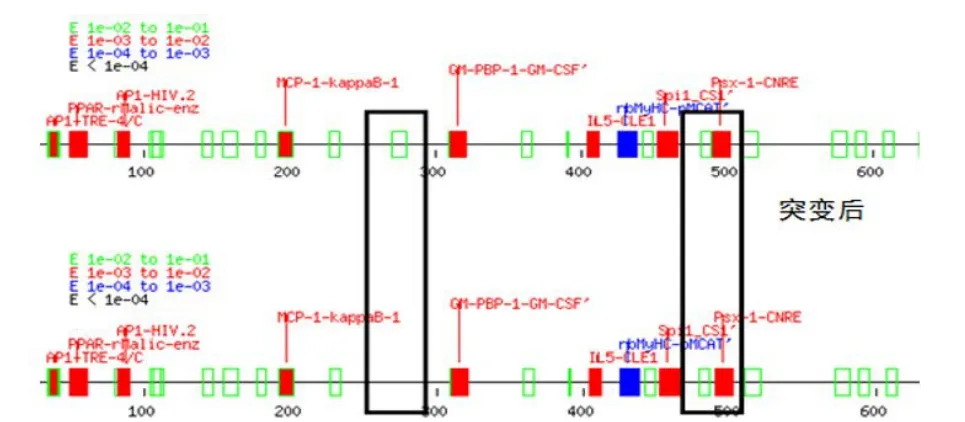
图3 TFsitescan 软件预测突变前和突变后的差异

图4 JASPAR软件预测T-242G突变前结合序列
启动子通过应答一种或多种基因转录因子调控基因的表达。临床肿瘤靶向治疗中,启动子应用前景广泛。进化过程中,启动子在稳定的调控功能前提下能够快速地沿不同的方向进化,由此可以确定各物种间亲缘关系远近。此外,如果生物在进化中产生新的序列元件可以与启动子相互作用但不干扰生物原有的表达调控系统,且使物种在进化上保持优势,那么新产生的元件可在物种中保持下来,并且和其他元件相互协同优化基因的表达,让该物质具有较大的选择优势。王鸾鸾[11]RT-PCR结果显示,DYRK1A与MEF2D的表达存在协同性,MEF2D磷酸化被DYRK1A激活同时其转录活性增强,DYRK1A与MEF2D互相调节形成正反馈循环,共同作用机体神经系统发育。另外,对启动子序列详尽研究,有助于深入了解其结构,为启动子人工合成及进一步研究和利用奠定基础[12]。
本实验结果发现,地方猪种与外三元(杜×长×大)杂交猪在T-242G位点存在明显差异。Lilly等[13]研究发现,如果敲除MEF2D基因,生物体的骨骼肌及其他肌肉组织的肌细胞分化会受到阻碍或停滞。因此,T-242G位点的突变所导致的转录结合位点的改变,可能影响MEF2D基因在肌肉发生过程中的作用机制。T-242G位点可能是影响猪肉品质的重要突变位点,是控制猪肉质性状的重要标记。
MEF2D 基因由于启动子的选择及 mRNA 选择性拼接产生多种不同的 MEF2D 蛋白,在神经细胞发育和肉质性状中发挥重要作用[14]。本实验预测突变前后的核心启动子区未发生差异,原因在核心启动子区基本位于翻译起始位点之后,而4个SNPs位于翻译起始位点前。对比突变前后序列,CPG岛于-150~+53附近。CpG 岛多位于基因的启动子区和第1外显子区,长约1 kb[15]。DNA甲基化主要发生在CpG岛,哺乳动物CpG位点约 60%~90%呈甲基化状态。因此,基因启动子区CPG岛预测可为研究甲基化奠定理论基础。3种生物学软件预测分析MEF2D 基因转录因子结合位点均有变化,研究发现很多肌肉特异性基因都由TEF1、SRF、MEF2等转录因子进行调控[16]。TFsitescan软件结果表明,T-453A 突变位点导致 iNOS-ISRE 结合位点消失,T-242G导致AP-2转录结合位点消失和生成NeuroD1转录结合位点。NeuroD1结合靶基因的特异序列,激活或阻遏了靶基因的转录,也可以相同的方式作用其他转录因子,如PDX1、Neurogenin3等协同调节靶基因的最终活性状态[17]。Generegulation软件得到T-242G突变位点导致Pax-4生成,而抑制作为胰腺发育的转录因子Pax-4,在胰腺β细胞的发育分化中具有重要作用。JASPAR软件预测表明,T-242G突变位点导致NFIC转录结合位点消失。NFIC通过与组蛋白竞争DNA的结合位点或者通过 NFI-C/CTF1中C 末端的反式激活区和组蛋白 H3 相互作用,移位抑制性组蛋白,行使转录活性作用[18]。 NFIC/CTF1 富含脯氨酸区的C末端在体内还可与TAFⅡ、P300 等多种辅激活蛋白发生协同作用。同样,NFIC可竞争性结合与其他有激活作用的反式作用因子结合位点,从而抑制基因的转录。虽然3个软件预测得到的转录结合位点不一致,但均由突变位点T-453A和T-242G造成。除了上述转录结合位点差异外,MEF2D基因启动子序列中含有PPAR、MCP-1、TFⅡ等转录结合位点,这些位点与基因的转录调控也有着密切的联系,因此,推测猪MEF2D基因5'UTR区域的T-453A和T-242G位点对调控启动子功能元件有重要影响。
[1] Larsen N J, Marklund S, Kelly K A, et al. New insights into porcine-human synteny conservation[J]. Mamm Genome,1999, 10(5):488-491.
[2] Wagenknecht D, Stratil A, Bartenschlage H, et al. Linkage and radition hybrid mapping of the porcine MEF2D gene to chromosome 4q[J]. Anim Genet, 2003, 34:232-240.
[3] Walling G A, Visscher P M, Andersson L, et al. Combined analyses of data from quantitative trait loci mapping studies: chromosome 4 effects on porcine growth and fatness[J]. Genntics, 2000, 155: 1369-1378.
[4] 陈磊. 猪 MSTN 基因和 MEF2D 基因的多态性及其与胴体和肉质性状间关联性研究[D]. 雅安:四川农业大学,2005.
[5] Hinits Y, Hughes S M. MEF2s are required for thick filament formation in nascent muscle fibres[J].Development, 2007, 134(13):2511-2519.
[6] 廖维甲, 梅铭惠, 谢兴旺, 等. 1号染色体扩增区 MEF2D基因在肝细胞癌组织中的表达[J]. 中国试验诊断学,2009, 13(11): 1570-1572.
[7] 祁艳霞, 张小辉, 庞有志, 等. 南阳黄牛肌肉发育过程中的 MyoD 和 MEF2 基因的表达变化研究[J]. 河南农业大学学报, 2012, 46(5): 558-561.
[8] Neely M D, Robert E M, Baucum A J, et al. Localization of myocyte enhancer factor 2 in the rodent forebrain:Regionally-specific cytoplasmic expression of MEF2D[J].Brain Res, 2009, 1274:55-65.
[9] 程波. 山羊MEF2基因家族的克隆及其组织表达规律的研究[D]. 雅安: 四川农业大学, 2012.
[10] 李敬瑞, 丁远华, 向程举, 等. 猪DAZ基因的DNA池测序分析[J]. 中国畜牧兽医, 2011, 38(8):60-62.
[11] 王鸾鸾. 双底物特异性酪氨酸磷酸化调节激酶 1A 与肌细胞增强因子 2D 相互作用的研究[D]. 济南: 山东大学,2012.
[12] 黄玉, 杨波, 迟小华, 等. 真核生物启动子的研究及应用[J]. 生物技术通讯, 2010 , (2): 275-279.
[13] Lilly B, Zhao B, Ranganayakulu G, et al. Requirement of the MADS domain transcription factor D-MEF2 for muscle formation in Drosophila[J]. Science,1995, 267(5198): 688.[14] Giron M D, Sevillano N, Vargas A M, et al. The glucoselowering agent sodium tungstate increases the levels and translocation of GLUT4 in L6 myotubes through a mech anism associated with ERK1 /2 and MEF2D[J].Diabetologia, 2008, 51(7): 1285-1295.
[15] Chen C, Chen H, Hsiaut T H, et al. Technical advance:methylation target array for rapid analysis of CpG island hypermethylation in multiple issue genomes[J]. Am J Pathol, 2003,163(1): 37-45.
[16] Tomoji M, Maheshp P, Gupt A, et al.TEF-1 and MEF2 transcription factors interact to regulate muscle-specific promoters[J]. BBRC, 2002, 294:791-797.
[17] 周敏. PAX4, NeuroD1 基因多态性与自身抗体阴性酮症倾向糖尿病的关联研究[D]. 长沙: 中南大学, 2009.
[18] 张菁. 转录因子 NFIC 在人根尖牙乳头干细胞分化中的作用及其机制研究[D]. 西安: 第四军医大学, 2013.
the Polymorphisms and bioinformatics of Promoter Region of MEF2D Gene in Congjiang Xiang Pig
BAI You1, ZHANG Yong1*, CHEN Xiang1,2, ZHANG Xiong1, LI Jun1,3,HE Qi1, YANG Hong1, LU Jing1
(1. Key Laboratory mountain Plateau Animal Genetics and Breeding, Ministry of Education; Key Laboratory of Animal Genetics, Breeding and Reproduction in Guizhou; College of Animal Science, Guizhou University, Guizhou Guiyang 550025, China; 2.Healthy Breeding Pigs Engineering Technology Research Center of Guizhou Province, Guizhou Guiyang 550025, China; 3. Guizhou Germplasm Determination Center of Livestock and Poultry, Guizhou Guiyang 550025, China)
The Congjiang Xiangpigs, the commercial crossbred pigs as well as the Guizhou Zongdi Huapigs as research animals. were used to screen the gene MEF2D of 5ˊUTR and the SNPs sites in part first exon region by using DNA pool and PCR direct sequencing. Variety bioinformatics softwares were used to analyse the SNPs sites how to affect the core region of the promoter, transcription factors binding sites and CpG island. The results showed there were four SNPs sites in the 5ˊUTR regions of MEF2D, including A-511G, T-453A, T-242G and T-180A. It was identified that various new transcription factors binding sites emerged and some significant transcription factors binding sites disappeared nearby the region at T-453A and T-242G site. So we speculated that T-453A and T-242G site locating MEF2D ˊ 5ˊ UTR have a deep effect on regulating the functional element of promoter.
Congjiang Xiang Pig; MEF2D gene; SNP; Promoter; Bioinformatics
S828.2
A
10.19556/j.0258-7033.2017-10-034
2017-03-06;
2017-08-10
贵州大学引进人才科研项目[贵大人基合字2013(21)号];贵州省工程中心建设项目(黔科合农C字[201 1]4022号)
白优(1992-),女,山东人,硕士研究生,研究方向为动物遗传育种与种质资源创新,Email:zzycbaiyou@163.com
*通讯作者:张勇(1975-),男,博士,副教授,主要从事动物遗传育种教学与科研工作,Email:as.yzhang@gzu.edu.cn

