延边黄牛ANGPTL4基因组织表达规律与肌内脂肪沉积相关性研究
徐 畅,宋霁轩,庞 吉吉,王冰冰,张 帅,夏广军
(延边大学农学院,吉林延吉133002)
延边黄牛ANGPTL4基因组织表达规律与肌内脂肪沉积相关性研究
徐 畅,宋霁轩,庞 吉吉,王冰冰,张 帅,夏广军*
(延边大学农学院,吉林延吉133002)
为分析ANGPTL4基因在延边黄牛各组织中的表达差异,进一步探讨该基因在肌内脂肪沉积中的作用,本实验利用qRT-PCR法比较分析了ANGPTL4基因在延边黄牛7个组织(心、肝、脾、肺、肾、背最长肌和后腿肌)中的表达水平及其与肌内脂肪沉积的相关性。结果表明:ANGPTL4基因在7个组织中表达水平从高到低依次为肝、肺、肾、心、脾、背最长肌和后腿肌,肝中表达量极显著高于心、脾、肺、肾、后腿肌和背最长肌组织(P<0.01),肺中表达量显著高于心、脾、肾、后腿肌和背最长肌组织(P<0.05);背最长肌中ANGPTL4基因的表达量与背最长肌的IMF含量呈显著正相关(P<0.05),相关系数为0.924;ANGPTL4基因在后腿肌的表达量与后腿肌的IMF含量呈显著正相关(P<0.05),相关系数为0.998。结果显示,ANGPTL4基因影响延边黄牛肌内脂肪沉积。
延边黄牛;ANGPTL4基因;组织表达谱;肌内脂肪沉积
血管生成素样蛋白4(Angiopoietin-like Protein 4,ANGPTL4),也称禁食诱导脂肪因子,属于类血管生成素家族成员之一[1]。ANGPTL4是与血管生成、脂类代谢、葡萄糖代谢、胰岛素敏感性密切相关的分泌性蛋白质因子[2]。研究表明,ANGPTL4可以促进脂肪酸氧化,并通过抑制脂蛋白酯酶(Lipoprotein Lipase,LPL)的活性和促进脂肪水解而直接影响脂类代谢,促进脂肪沉积[3]。大量研究表明,ANGPTL4 基因是过氧化物增殖物激活体受体(Peroxisome Prolifer Atoractivated Receptors,PPARs)γ 的下游靶基因,ANGPTL4基因的表达受PPAR 所有配体的激活,PPAR是调控脂类分化和葡萄糖代谢动态平衡的核受体,因此认为ANGPTL4 基因可能在脂类代谢和葡萄糖代谢动态平衡的调控方面发挥作用[4-5]。Legry 等研究发现,ANGPTL4 基因的rs4076317 多态位点与青少年高脂肪率显著相关[6]。马云[7]克隆了牛ANGPTL4基因序列,发现了该基因的遗传变异与牛育肥后肌内脂肪含量存在显著相关。ANGPTL4基因在牛肝脏和脂肪组织中表达量较高[8]。目前,在人和鼠上对 ANGPTL4 基因的研究报道较多,而在家畜上的研究报道较少。本实验以我国五大地方良种牛之一的延边黄牛为研究对象,利用qRT-PCR检测ANGPTL4基因在延边黄牛7个组织中的相对表达量,同时分析其在肌肉组织中的表达量与肌内脂肪沉积的关系,为揭示延边黄牛ANGPTL4基因的表达特点,并进一步探讨ANGPTL4基因在牛的肉质调控中的作用及其分子机制提供参考和依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及样品采集 选取吉林省珲春吉兴牧业有限公司6月龄延边黄牛公牛70头,在相同饲养条件育肥至36月龄屠宰。从宰前活重相近的个体中随机选择3头,分别采集心、肝、脾、肺、肾、背最长肌和后腿肌7个组织样品,每个组织采集3 g,并分割成0.3 cm3的小组织块装入冻存管,然后立即放入液氮低温保存,以备提取总RNA。同时采取第12~13肋间背最长肌和后腿肌,-20℃保存,用于IMF含量测定。
1.1.2 主要分子生物学软件及数据库 引物设计软件:Primer Premier5.0、Oligo6.0;GenBank数据库:http://www.ncbi.nlm.nih.gov/web/Genbank。
1.2 实验方法
1.2.1 引物设计与合成 本实验以GAPDH作为内参基因。根据NCBI数据库中牛的ANGPTL4基因序列,利用Primer5.0和Oligo6.0设计引物,由上海英骏生物技术有限公司合成(表1)。
1.2.2 总RNA的提取和质量检测 每个样品取0.5 g放入无RNAase处理过的研钵中加入液氮充分研磨,按 Trizol试剂盒说明书方法提取总 RNA。利用超微量分光光度计ND-2000和琼脂糖凝胶电泳检测RNA浓度和质量。
1.2.3 反转录 冰上操作反转录整个过程,建立反转录混合液体系:dNTP混合液(10 mmol/L)1 μL,寡dT引物(2.5 μmol/L) 1 μL,RNA 2 μL,无RNA酶双蒸水 6 μL,总体积 10 μL。在PCR仪上进行变性、退火反应,65℃ 5 min;4℃保存。瞬时离心,使混合液聚集于反应管的底部。建立反转录反应液:上述反应液 10 μL,5×反转录缓冲液4 μL,RNA酶抑制剂(40 U/μL) 0.5 μL,反转录酶 0.5 μL,无RNA酶双蒸水5 μL,总体积20 μL。反应程序:42℃ 30 min;95℃ 5 min;4℃保存。
1.2.4 qRT-PCR实验操作方法 按照SYBR Premix Ex Taq™Ⅱ(Tli RNaseH Plus)试剂盒说明书操作。冰上配制qRT-PCR反应液:SYBR预混液(2×) 10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板 2 μL,无RNA酶双蒸水6.4 μL,总体积 20 μL。反应程序:①预变性:95℃ 30 s(升温速率4.4℃/s)。②PCR(分析模式:定量分析):95℃ 5 s (升温速率4.4 ℃/s);60℃ 30 s(升温速率 2.2℃ /s,Acquisition Mode:Single)循环40次。③熔解(分析模式:熔解曲线):95℃ 5 s(升温速率4.4℃ /s);60℃ 1 min(升温速率2.2℃/s);95℃(升温速率0.11℃/s,Acquisition Mode:Continuous,Acquisitions:5 per℃)。④降温:50℃ 30 s(升温速率2.2℃/s)。
1.2.5 IMF含量测定 称取背最长肌和后腿肌样本各10 g左右,利用索氏抽提法进行IMF含量测定。
1.3 统计分析 采用2-ΔΔCT法计算基因的相对表达量,ΔCt目的基因= Ct目的基因- Ct内参基因,ΔΔCt =ΔCt试验组- ΔCt对照组。采用 SPSS 19.0 进行方差分析和相关分析。
2 结果与分析
2.1 RNA检测结果 经超微量分光光度计检测,A260/A280在1.9~2.1,表明RNA质量较好。1%的琼脂糖凝胶检测,18S和28S条带清晰,无条带弥散现象(图1)。符合实时荧光定量PCR实验的要求。
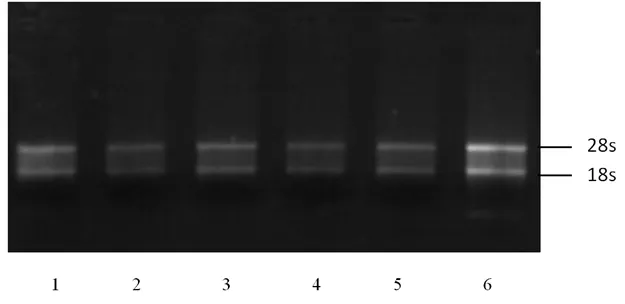
图1 RNA琼脂糖凝胶电泳
2.2 qRT-PCR的产物特异性 从ANGPTL4基因qRT-PCR 扩增和熔解曲线(图2)可以看出,ANGPTL4 基因的PCR 产物只有1 个特异峰,无引物二聚体和非特异性扩增产物,可用于进一步的荧光定量检测分析。
2.3 ANGPTL4基因组织表达谱分析 根据表2可知,ANGPTL4基因在延边黄牛7个组织中均有表达,其中,肝中表达量极显著高于心、脾、肺、肾、后腿肌和背最长肌组织(P<0.01),肺中表达量显著高于心、脾、肾、后腿肌和背最长肌组织(P<0.05)。ANGPTL4基因表达水平在7个组织中从高到低依次为肝、肺、肾、心、脾、背最长肌、后腿肌。
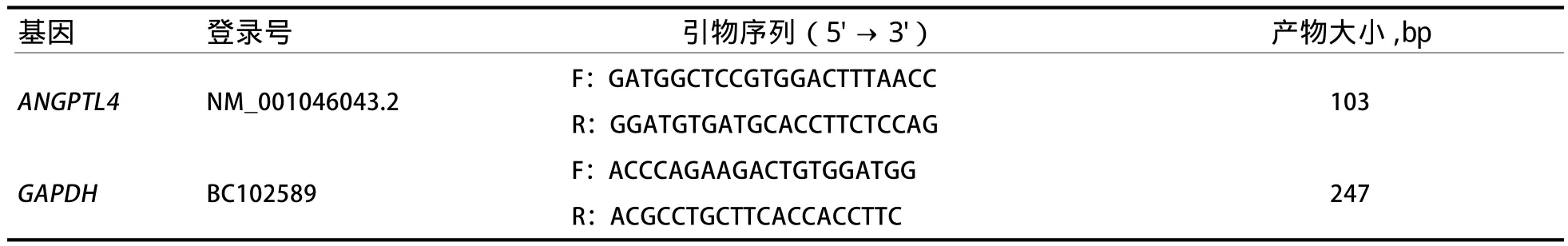
表1 qRT-PCR引物
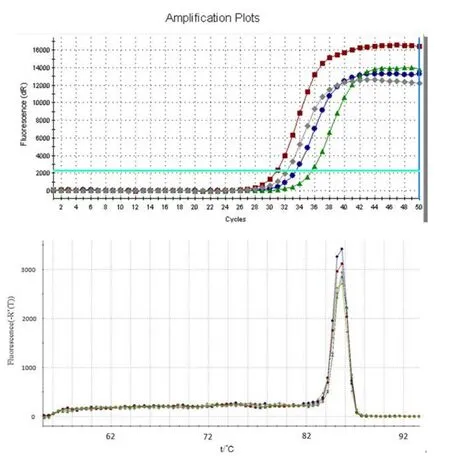
图1 RNA琼脂糖凝胶电泳
2.4 ANGPTL4基因在肌肉组织中的表达与IMF含量的相关性分析 根据表3可知,背最长肌中ANGPTL4基因的表达量与背最长肌的IMF含量呈显著正相关(P<0.05),相关系数为0.924;ANGPTL4基因在后腿肌的表达量与后腿肌的IMF含量呈显著正相关(P<0.05),相关系数为0.998。
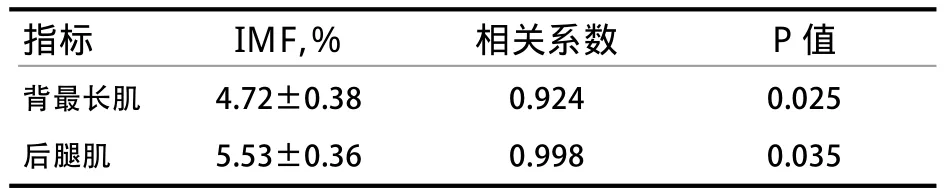
表3 ANGPTL4 mRNA表达量与IMF含量的相关性分析
3 讨 论
哺乳动物的脂类代谢、糖代谢、血管生成都受ANGPTL4基因调控[9],ANGPTL4基因是一种具有广泛生理功能的转录调节因子[10-11],与代谢、脂类代谢以及血管生成都密切相关[1],ANGPTL4基因的适量表达或过量表达都可能不同程度引起血浆不饱和脂肪酸浓度的升高[12]。本实验通过选取延边黄牛的不同组织,利用qRT-PCR检测ANGPTL4基因在延边黄牛7个组织中的相对表达量,分析延边黄牛ANGPTL4基因不同组织的表达情况及其与肌内脂肪的相关性。
基因在组织中表达受多因素的影响,不同组织的基因表达量存在差异。Mandard等[13]研究发现,ANGPTL4基因在牛的肝脏和脂肪组织中高表达,同时在心脏、肾脏、胰脏、骨骼肌中也有表达。丰胜求等[14]对猪ANGPTL4基因表达研究发现,脂肪组织、肝脏、肾脏中高表达,心脏、脾脏、肌肉等其他组织少量表达。Dutton等[15]对小鼠的ANGPTL4基因表达进行研究,结果表明,ANGPTL4基因在其研究的5个组织中都有表达,其中在肝脏表达量最高。以上3个研究与本实验研究结果一致。本实验通过对牛7个组织研究结果发现,ANGPTL4基因在肝脏的表达量最多,在后腿肌部分表达量最少。
Feng等[16]研究了ANGPTL4基因在瘦肉型猪和脂肪型猪组织中的表达差异, ANGPTL4基因对同一物种不同类型或不同部位的脂肪沉积都发挥着不同的作用,ANGPTL4基因在肥胖型猪的表达量较高,瘦肉型猪的表达量略低,脂肪型猪对脂肪沉积有增加作用,说明ANGPTL4可能与脂肪沉积有关。这与本实验中牛ANGPTL4基因的研究结果相一致。本实验研究结果发现,ANGPTL4基因在延边黄牛背最长肌和后腿肌表达差异显著,背最长肌组织中ANGPTL4 mRNA表达量与IMF含量呈显著正相关,后腿肌ANGPTL4 mRNA表达量与IMF含量呈显著正相关,证明ANGPTL4基因可以作为延边黄牛肌内脂肪沉积的候选基因。本实验只是对延边黄牛ANGPTL4基因表达的初步研究,应进一步扩大样本数量进行深入研究,为进一步了解ANGPTL4基因对牛脂肪蓄积以及利用该基因改良牛肉质性状提供理论依据。
4 结 论
ANGPTL4基因的表达不存在明显的组织特异性,在本实验所检测的7个组织中均有表达,其中肝脏表达量最高,后腿肌表达量最低,表达水平从高到低依次为肝、肺、肾、心、脾、背最长肌、后腿肌。ANGPTL4基因在肌肉组织中的表达量与IMF含量呈显著正相关,说明ANGPTL4基因影响肌内脂肪沉积,为进一步研究ANGPTL4基因对延边黄牛肉质的调控作用提供了一定的参考。
[1] 马云, 侯飞, 李荣荣, 等. 牛血管生成素样蛋白4基因(ANGPTL4)编码区SNPs检测及其与南阳牛生长性状的相关性[J]. 农业生物技术学报, 2011, 19(5):887-892.
[2] Adachi H, Fujiwara Y T, Nishikawa T, et al. Angptl 4 deficiency improves lipid metabolism, suppresses foam cell formation and protects against atherosclerosis[J]. Biochem Biophys Res Commun, 2009, 379(4):806-811.
[3] Mandard S, Zandbergen F, Van Straten E, et al. The fastinginduced adipose factor/ angiopoietin -like protein 4 is physically associated with lipoproteins and governs plasma lipid levels and adiposity[J]. J Biol Chem, 2006, 281: 934-944.
[4] Gbaguidi F G, Chinetti G, Milosavljevic D, et al. Peroxisome proliferator-activated receptor (PPAR) agonists decrease lipoprotein lipase secretion and glycated LDL uptake by human macrophages[J]. FEBS Lett, 2002, 512(1-3):85-90.
[5] Koster A, Chao Y B, Mosior M, et al. Transgenic angiopoietin-like (Angptl) 4 overexpression and targeted disruption of Angptl4 and Angptl3: Regulation oftriglyceride metabolism[J]. Endocrinology, 2005, 146(11): 4943-4950.
[6] Legry V, Bokor S, Cottel D, et al. Associations between common genetic polymorphisms in angiopoietin-like proteins 3 and 4 and lipid metabolism and adiposity in European adolescents and adults[J]. J Clin Endocrinol Metab, 2009, 94(12):5070-5077.
[7] 马云. 牛三个基因的分离、定位及其与牛经济性状的关联研究[D]. 杨凌: 西北农林科技大学, 2006.
[8] Mamedova L K, Robbins K, Johnson B J, et al. Tissue expression of angiopoietin-like protein 4 in cattle[J]. J Anim Sci, 2010, 88(1):124-130.
[9] 马云, 李荣荣, 侯飞, 等. ANGPTL4基因的表达调控及功能研究进展[J]. 中国牛业科学, 2009, 35(6):36-40.
[10] 徐龙鑫, 刘镜, 张麟, 等. 关岭黄牛ANGPTL4基因多态性与生长性状关联分析[J]. 江苏农业科学, 2016,44(9):51-53.
[11] 李文浩. 羔羊肉生产杂交组合筛选及藏绵羊ANGPTL4基因多态性分析[D]. 兰州: 甘肃农业大学, 2016.
[12] Hato T, Tabata M, Oike Y. The role of angiopoietinlike proteins in angiogenesis and metabolism[J]. Trends Cardiovasc Med, 2008, 18(1):6-14.
[13] 马云, 骆莹莹, 李芬, 等. 牛ANGPTL4基因结构和功能的生物信息学分析[J]. 江西农业大学学报, 2010,32(1):135-140.
[14] 丰胜求. 猪Angptl家庭基因的克隆、表达及调控研究[D].武汉: 华中农业大学, 2007.
[15] Dutton S, Trayhurn P. Regulation of angiopoietin-like protein 4/fasting-induced adipose factor (Angptl4/FIAF)expression in mouse white adipose tissue and 3T3-L1 adipocytes[J]. Br J Nutr, 2008, 100(1):18.
[16] Feng S Q, Chen X D, Xia T, et al. Cloning, chromosome mapping and expression characteristics of porcine ANGPTL3 and -4[J]. Cytogenet Genome Res, 2006,114(1):44-49.
S823.2
A
10.19556/j.0258-7033.2017-10-043
2017-04-26;收回日期:2017-07-09
吉林省科技发展计划重点科技攻关项目(201602 04017NY);吉林省现代肉牛产业技术体系建设研究课题(201635);吉林省教育厅“十三五”科学技术项目
徐畅(1991-),女,吉林长春人,硕士研究生,研究方向为动物营养与饲料科学,E-mail:591667504@qq.com
*通讯作者:夏广军,E-mail:ybuac@ybu.edu.cn
——以捆绑动词‘’为中心

