AM真菌对苗期棉花根系形态特征的影响
国秀丽,白灯莎·买买提艾力,张少民,孙良斌,冯固
AM真菌对苗期棉花根系形态特征的影响
国秀丽1,3,白灯莎·买买提艾力2,张少民2,孙良斌2,冯固1*
(1.中国农业大学资源与环境学院,北京100193;2.新疆农业科学院核技术生物技术研究所/农业部荒漠绿洲作物生理生态与耕作重点实验室,乌鲁木齐830091;3.石河子大学农学院,新疆石河子832003)
【目的】为探讨不同盐度土壤土著丛枝菌根(Arbuscular mycorrhizae,AM)真菌对苗期棉花根系形态的影响。【方法】采用 in-growth 生长系统进行了田间原位研究。【结果】低盐(σ 1.0 mS·cm-1)、中盐(σ 2.1 mS·cm-1)、高盐(σ4.0 mS·cm-1)土壤条件下,土著AM真菌侵染显著增加了棉花株高、叶片数、蕾数、叶面积指数,说明土著AM真菌能够改善棉花的生长提高耐盐能力。土著AM真菌显著提高了总根长、根体积、根表面积以及直径(d)≤0.5 mm细根根长,低盐土壤条件下土著AM真菌显著增加了d≤0.5 mm细根的根长占总根长的百分比。相关分析表明,棉花总根长、d≤0.5 mm的细根根长与菌根侵染率、叶片磷、钾浓度及吸收量呈显著正相关,与叶片钠浓度呈显著负相关关系;棉花总生物量与叶片吸磷量、吸钾量极显著正相关。【结论】上述结果说明盐渍化土壤中的土著AM真菌侵染对棉花植株的磷、钾等营养状况的改善和棉株钠、氯效应的降低,与土著AM真菌促进细根生长、提高细根根长占总根长的比例有关。
棉花;土著AM真菌;根系形态;抗盐性
Abstract:[Objective]In this study,we explored the effects of the soil indigenous arbuscular mycorrhizae (AM)fungal community on cotton root morphology and architecture at the seedling stage.[Method]A pot test at a field site was conducted using the in-growth system and included static(AM fungal colonization allowed freely)and vibrating(patting the top core edge twice every day to break any extradical hyphae attempting to access core)treatments in slightly (Electrical conductivityσ1.0 mS·cm-1),highly(σ 2.1 mS·cm-1),and extremely(σ 4.0 mS·cm-1)saline soils.[Result]The resultsindicated that colonization of indigenous AM fungi was accompanied by an increase in cotton plant height,leaf number,bud number,and leaf area index,and improved salt resistance.Indigenous AM fungisymbiosissignificantly increased total root length,root volume,root surface area,and the length of fine roots with a diameter(d)≤0.5 mm compared with the control(vibrating treatment).The percentage of the root length with a d≤0.5 mm under the static treatment was significantly higher than under the vibrating treatment in slightly saline soil but not with highly and extremely saline soils.Correlation analysis results showed significant positive correlations between both total root length,root lengths with a d≤0.5 mm and root colonization of AM fungi,leaf P/K content.A positive correlation wasalso observed between total biomassand leaf P/K content,while a significant negative correlation was observeds between both total root length,root lengths with a d≤0.5 mm and leaf Na concentration.An indigenous AM fungal community was advantageous to cotton total root length and fine root growth in saline soils,improved P/K status,reduced Na/Cl salt absorption,and increased salt resistance.[Conclusion]These results suggest that increasing root length and the percentage offine roots through the introduction of symbiotic indigenous AM fungi may improve P/K status and reduce Na/Cl acquisition in the cotton root system.
Keywords:cotton(Gossypium hirsutum L.);indigenous AM fungi;root morphology;salt resistance
棉花是我国重要的经济作物,抗盐能力较强,在盐碱地农业开发利用中通常作为先锋作物[1]。然而,土壤盐分过高会对棉花生长发育产生严重抑制作用,影响种子萌发、幼苗出土、花铃的形成及发育,严重影响棉花的生长和棉纤维品质[2]。生长在含盐土壤中的棉花苗期气孔导度、蒸腾速率、光合速率及呼吸作用明显降低[3]。花铃期土壤盐分推迟棉花花芽出现、减少蕾铃数量、增加蕾铃脱落,减轻铃重、降低棉纤维长度,因而影响产量[4]。盐化土壤中Na+和Cl-等盐分离子与养分离子产生竞争作用会导致植株氮、磷、钾等营养匮乏[5-6],而向含盐土壤中补充氮磷等养分可使植株生长得到改善[7]。
丛枝菌根(Arbuscular mycorrhizae,AM)真菌是1类可以和陆地上80%以上的植物建立共生关系的微生物类型,增强植物对土壤中养分尤其是难移动的养分(比如磷)的吸收[8-10]。Feng等研究表明,接种AM真菌可促进玉米生长,增加玉米植株磷的吸收量和根可溶性糖含量[11]。接种AM真菌后,棉花耐盐能力得到一定程度增强[12]。其机理是AM真菌调节了根系和地上部组织的渗透平衡和钾钠离子的平衡[9,13-14]。然而,以往关于AM真菌对提高棉花耐盐能力的效果研究大多采用盆栽模式先进行土壤灭菌、再接种经过纯化的AM真菌菌剂的试验方法,或者在田间接种AM真菌菌剂的方式。其实,土壤中存在大量的土著AM真菌,其种类和繁殖体都比较多[15],但对于这些土著AM真菌在田间条件下的作用鲜有研究报道。其主要原因是在田间条件下不能进行土壤灭菌,很难获得不被AM真菌侵染的“对照”。
Johnson等设计了1个in-growth系统[16],即:利用孔径30μm的尼龙网分隔根系与菌根菌丝生长空间的原理,将植物种在1个PVC管中,再将PVC管埋植于田间。PVC管四周开窗并用孔径30μm的尼龙膜分隔,阻止PVC管内的植株根系长出,同时允许PVC管外的土著AM真菌菌丝进入管内并侵染根系。通过保持PVC管的静置或者定期垂直轻轻拍打PVC管让尼龙网切断试图进入管内的菌丝、阻止管内的植物被侵染的方式建立了“对照”。他们用in-growth系统并结合同位素示踪法定量评价了牧草植物通过土著AM真菌菌落吸收土壤中33P的效应。目前还鲜有采用该方法研究盐渍化土壤中的土著AM真菌对棉花生长和抗盐能力影响的报道。本研究采用in-growth系统通过田间原位方式研究含盐土壤的土著AM真菌与棉花地上部及根系生物学性状的相互关系,为了解田间土著AM真菌对棉花抗盐性及根系生长的效应提供依据。
1 材料与方法
1.1 试验设计
1.1.1 试验地点与基本情况。试验在新疆昌吉州玛纳斯县新疆农业科学院经济作物研究所棉花良种繁育基地进行。该地区地理位置为东经86°22′,北纬 44°18′,海拔 383.21 m。属内陆温带大陆性干旱气候,冬季严寒夏季酷热,年均温7.2℃,无霜期165~172d,≥10℃积温为3450℃,年平均降水量170~210 mm,年蒸发量1000~1500 mm。
1.1.2 试验设计。本试验分别在3个不同盐度地块进行。3个地块土壤电导率(σ,水与土体积比为5∶1 下测定)为:低盐(Slight)1.0 mS·cm-1、中盐(High) 2.1 mS·cm-1、高盐(Extreme)4.0 mS·cm-1。每个地块设置2个处理:垂直拍打PVC管顶端边缘(Vibrating,切断土壤AM真菌菌丝与植株间联系),静置(Static,土壤土著AM真菌侵染)。为检验装置可能对植物产生的影响,在轻度盐分地块设置非菌根植物作为对照。每个处理20个重复,随机区组排列。
1.1.3 生育期管理。2010年6月30日播种,8月30日收获,培养时间为60 d。每盆播种4粒。播种后将装置浸泡在水位一致的盆子中让土壤充分吸水,待表层土湿润后取出,用塑料包裹住盆钵(避免水分散失)。播种后2 d出苗时,选择栽有生长整齐一致幼苗的PVC管,分别埋放到预先选择好的各盐度地块,按株距20 cm、行距30 cm分别均匀排列于滴管带两侧。出苗7 d后定苗,每个PVC管中保留棉苗1株。培养期间每天对Vibrating(振动)处理垂直轻轻拍打PVC管顶端边缘2次,切断棉株根系与装置外土壤AM真菌菌丝之间的联系,同时每天给所有的装置浇水2次,每次20 mL。
1.2 试验材料
1.2.1 供试植物。试验作物类型为棉花(Gossypium hirsutum L.,品种为07-1)。对照作物类型为甜菜(Beta vulgaris,新田14号)。试验前挑选出形状和大小均匀一致的种子用10%(质量分数)的H2O2浸泡消毒10 min,蒸馏水冲洗数次除去种子表面残留的H2O2,然后用预先准备好的温开水浸种使种子充分吸水膨胀,12 h后转移至有干净纱布的白色长方形搪瓷盘中,覆盖好纱布于25℃黑暗恒温培养箱中催芽,期间喷洒蒸馏水保持纱布呈润湿状态,2 d后选择芽长度一致的种子播种。
1.2.2 供试土壤。试验用土为盐渍化农田土壤,类型为灰漠土。选用土壤预先风干过孔径2 mm的筛后送至新疆农业科学院核技术生物技术研究所进行60Coγ射线(比授能:10 kGy)灭菌。土壤基本理化性质:有机质 7.6 g·kg-1,有效氮 27.6 mg·kg-1,速效磷(Olsen-P)7.1 mg·kg-1,有效钾370.0 mg·kg-1,pH 8.0,土壤电导率 (σ 1.0 mS·cm-1,水与土的体积比为5∶1时测定)。
1.2.3 土著AM真菌来源。棉花采用田间原位培养法,侵染AM真菌来自in-growth系统尼龙网外围田间土壤土著AM真菌。
1.2.4 in-growth系统。试验选用直径为5 cm、长度为25 cm的PVC管,管子底部用防水胶粘接PVC板。将其侧面对称切开,形成有2个距离上部边缘7 cm、底部边缘5 cm的宽4 cm、长12 cm的窗口,窗口外侧为用防水胶粘接孔径30μm的尼龙网。试验时PVC管内部装入预先准备好的灭菌土壤,培养期间用于种植供试作物。装置埋放到田间后,尼龙网可将PVC管内外分隔开形成根区(PVC管内部)和菌丝区(PVC管以外部分),研究方法参照Johnson等[16]。
1.3 测定指标与方法
1.3.1 生长状况调查和生物量测定。培养结束时分别调查株高、叶片数和蕾数。生物量测定,收获后将棉花按根、茎、叶分割开,除去灰尘等杂质后于105℃杀青30 min,再调低温度至70℃烘干48 h至质量恒定后称各器官质量。
1.3.2 叶片磷、钾、钠、氯质量分数测定。取倒四叶,经干灰化充分灼烧-硝酸溶解分别测定磷、钾、钠、氯质量分数,磷采用钒钼黄比色法,钾和钠采用火焰分光光度法,氯采用硝酸银滴定法。
1.3.3 菌根响应度。菌根响应度(MR)为接种菌根棉株样品分析值(M)与不接种菌根棉株样品分析值(NM)的差。菌根地上部和地下(根)生物量响应度、叶片P/K/Na/Cl质量分数菌根响应度分别记为:MSBR、MRBR、MLPR、MLKR、MLNaR、MLClR。
1.3.4 AM对棉花根系的侵染率。曲利苯蓝(Trypan blue)染色-乳酸甘油脱色镜检法测定[17]。
1.3.5 根长、根体积和根表面积。收获的根样漂洗除去泥沙后用扫描仪扫描,扫描得到的图像用WinRhizo Version 5.0a (Regent Instruments,Quebec,Canada)软件分析计算后得到总根长、根平均直径、根表面积、根体积、不同直径根长等根系形态指标。根长百分比为不同直径根长占总根长百分比。
1.3.6 叶面积指数。收样时各处理样品的叶片用蒸馏水洗掉附着的灰尘并用吸水纸吸干水分,用扫描仪透射扫描,所得图像用DT-SCAN软件分析,得到的叶面积的和为单株总叶面积(Leaf area index,LAI)。冠层叶面积指数:总叶面积/冠面积。
1.4 数据处理
试验数据计算处理均采用MSExcel 2003软件,数据统计和方差分析采用SPSS16.0软件。
2 结果与分析
2.1 甜菜生物量
甜菜是非菌根植物,不被AM真菌侵染。其植株叶片和根生物量在振动(Vibrating)和静置(Static)处理之间差异不显著,AM真菌处理与盐度对甜菜生物量的交互作用不显著(图1-Ⅰ)。这一结果说明本研究为阻止土壤菌丝进入PVC管而采取的振动措施不影响PVC管内外水分和养分交流。因此,尼龙膜的振动与静置处理导致的植物生长的差异必然由AM侵染引起。
2.2 不同盐度地块AM对棉花根系的侵染率
低盐、中盐、高盐下,AM静置处理的棉花根系侵染率显著低于AM振动处理。AM振动和静置处理的棉花根系侵染率为低盐>中盐>高盐,其中振动处理低盐、中盐显著高于高盐,静置处理低盐和中盐、中盐和高盐之间差异显著(图1-Ⅱ)。低盐下,AM静置处理的棉花根系侵染率最高,并且与振动处理差值最大。盐度与AM真菌对棉花根系侵染率的影响显著,且交互作用显著。
2.3 不同盐度地块棉花地上部生长状况
棉花株高:振动处理为中盐>高盐>低盐,静置处理为中盐>低盐>高盐,中盐静置和振动处理显著高于低盐、高盐(图2-Ⅰ);低盐、中盐、高盐下静置处理均显著高于振动处理,低盐、中盐、高盐下静置处理的株高比振动处理分别增加18.4%、14.4%、6.8%。AM真菌、盐度对棉花株高的影响显著,且交互作用显著(图2-Ⅰ)。
棉花单株叶片数:振动和静置处理均为中盐>低盐>高盐,振动处理中盐显著高于低盐、高盐,静置处理中盐与低盐、低盐与高盐差异显著;中盐和低盐静置处理显著高于振动处理。盐度、AM真菌、盐和AM真菌交互作用对棉花单株叶片数的影响均显著(图2-Ⅱ)。
棉花叶面积指数:振动处理为中盐>高盐>低盐,静置处理为中盐>低盐>高盐,静置与振动处理中盐与低盐、高盐之间差异均显著;低盐、中盐、高盐静置处理均显著高于振动处理,比振动处理提高53.5%、36.8%、26.2%;盐、土壤AM真菌影响显著(图2-Ⅲ)。
单株蕾数:振动处理为高盐>中盐>低盐,高盐与中盐、中盐与低盐之间差异显著;静置处理为中盐>低盐>高盐,低盐、中盐、高盐之间差异均不显著;低盐、中盐、高盐静置处理显著高于振动处理,与振动处理相比分别增加1812.5%、189.5%、59.4%。盐度、土著AM真菌、盐度和AM真菌的交互作用对单株蕾数的影响显著(图2-Ⅳ)。
2.4 棉花菌根响应度
棉花菌根地上部生物量响应度(图3-Ⅰ)、菌根根系生物量响应度(图3-Ⅱ)、菌根叶片磷质量分数响应度(图3-Ⅲ)、菌根叶片钾质量分数响应度(图3-Ⅳ)大于0,棉花地上部和根生长、植株对磷和钾吸收对土壤AM真菌呈正响应。棉花菌根叶片钠质量分数响应度(图3-Ⅴ)和菌根氯质量分数响应度(图3-Ⅵ)小于0,棉花对钠和氯吸收呈负响应。因此,在盐渍化条件下,土壤AM真菌有利于棉花地上部和根生物量的积累,增加棉花对土壤磷和钾的吸收,降低对钠和氯的吸收。

图1 不同盐度土壤上甜菜生物量(Ⅰ)和AM对棉花根系的侵染率(Ⅱ)Fig.1 Biomass of sugar beet(Ⅰ)and mycorrhizal colonization(Ⅱ)of cotton growing in vibrating or static PVC tube in slight,high and extreme saline soils

图2 棉花播种后不同时间株高(Ⅰ)、叶片数(Ⅱ)、叶面积指数(LAI,Ⅲ)和蕾数(Ⅳ)Fig.2 Cotton plant height(Ⅰ),number of leaves(Ⅱ),leaf area index(LAI,Ⅲ),and buds(Ⅳ)for every treatment plant in different saline soils
棉花菌根地上部生物量响应度、菌根根系生物量响应度均为低盐和中盐土壤显著高于高盐土壤。菌根叶片磷质量分数响应度在低盐、中盐、高盐土壤之间差异不显著。菌根叶片钾质量分数响应度高盐显著高于中盐和低盐,中盐显著高于低盐。菌根叶片钠和氯质量分数响应度低盐和中盐显著高于高盐。因此,不同水平盐渍化土中AM真菌对低盐土壤棉花的生长影响最大,对低盐、中盐和高盐土壤棉花叶片磷质量分数增加作用相同,对叶片钾质量分数增加幅度随土壤盐度增加而加大,对低盐条件下棉花叶片钠和氯质量分数的影响程度最大。
2.5 棉花根形态
总根长:振动处理为中盐>高盐>低盐,静置处理为中盐>低盐>高盐;振动处理中盐与低盐、高盐差异显著,静置处理中盐与高盐差异显著。低盐、中盐、高盐静置处理总根长显著高于振动处理,比振动处理分别增加122.1%、40.3%、46.0%(图4-Ⅰ)。盐度、AM真菌、盐度与AM真菌交互作用对总根长的影响均显著。
根表面积:振动处理为中盐>高盐>低盐,静置处理为中盐>低盐>高盐;振动处理中盐、高盐与低盐差异显著,静置处理中盐与高盐差异显著。低盐、中盐、高盐静置处理显著高于振动处理,比振动处理分别增加96.7%、45.1%、46.1%(图4-Ⅱ)。盐度、AM真菌对根表面积影响显著。
根平均直径:振动处理低盐、中盐、高盐差异不显著;静置处理高盐>中盐>低盐,高盐、中盐与低盐差异显著;低盐静置处理显著低于振动处理,与振动处理相比减少12.3%;AM真菌、AM真菌与盐度交互作用对根平均直径的影响均显著(图 4-Ⅲ)。

图 3 不同盐度土壤棉花 MSBR(Ⅰ)、MRBR(Ⅱ)、MLPR(Ⅲ)、MLKR(Ⅳ)、MLNaR 和 MLClR(Ⅵ)Fig.3 Cotton MSBR(Ⅰ),MRBR(Ⅱ),MLPR(Ⅲ),MLKR(Ⅳ),MLNaR(Ⅴ)and MLClR(Ⅵ)in different saline soils
根体积:振动和静置处理均为中盐>高盐>低盐,静置处理中盐与低盐、高盐差异显著,振动处理中盐与低盐差异显著。低盐、中盐、高盐静置处理显著高于振动处理,与振动相比静置处理增加80.8%、67.3%、39.7%。AM真菌、盐度影响显著(图 4-Ⅳ)。
2.6 棉花不同直径分级根长
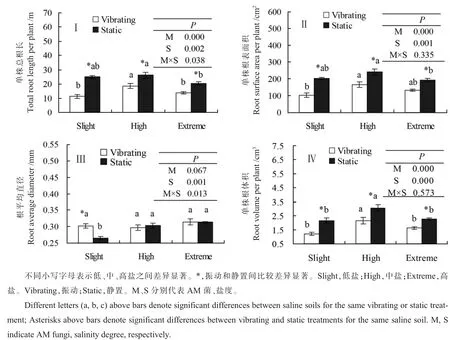
图4 不同盐度土壤棉花总根长(Ⅰ)、根表面积(Ⅱ)、根平均直径(Ⅲ)和根体积(Ⅳ)Fig.4 Cotton total root length(TRL,Ⅰ),root surface area(RSA,Ⅱ),root average diameter(RAD,Ⅲ),root volume(Ⅳ)growing in different saline soils for each treatment
d≤0.5 mm根长:振动处理为中盐>高盐>低盐,静置处理为中盐>低盐>高盐;振动处理中盐与低盐、高盐之间差异显著,静置处理低盐、中盐与高盐差异显著;低盐、中盐、高盐静置处理显著高于振动处理,与振动相比分别增加127.2%、40.9%、48.4%(图 5-Ⅰ)。该级根长占总根长百分比振动和静置处理均为低盐>中盐>高盐,静置处理低盐与中盐、高盐差异显著;低盐静置处理显著高于振动处理,与振动相比增加2.3%(图 5-Ⅳ)。
0.5 <d≤1 mm根长:振动处理为高盐>中盐>低盐,且中盐、高盐与低盐差异显著;静置处理中盐>高盐>低盐,中盐与低盐差异显著。低盐、中盐、高盐静置处理高于振动处理,但差异不显著(图5-Ⅱ)。该级根长占总根长百分比在振动和静置处理下均为高盐>中盐>低盐,静置处理高盐、中盐与低盐差异显著;低盐静置处理显著低于振动处理,比振动处理降低37.9%(图5-Ⅴ)。
d>1 mm根长:振动和静置处理均为中盐>高盐>低盐,振动处理中盐、高盐与低盐差异显著,静置处理中盐与低盐差异显著;低盐、中盐、高盐静置处理均大于振动处理,与振动相比分别增加29.7%、14.3%、0.1%(图5-Ⅲ),低盐静置处理与振动处理差异显著。该级根长占总根长百分比在振动与静置处理下均为高盐>中盐>低盐,静置处理高盐与低盐差异显著;低盐、中盐、高盐振动处理>静置处理,低盐、高盐振动处理与静置处理差异显著,静置处理在低盐、中盐、高盐下与振动处理相比分别降低46.8%、18.2%、32.1%(图 5-Ⅵ)。
2.7 棉花根形态及不同直径分级根长与AM侵染率及地上部生物指标相关分析
AM 侵染率与总根长(图 6-Ⅰ,P=0.024)、AM侵染率与 d≤0.5 mm 根长 (图 6-Ⅱ,P=0.020)呈显著正相关;总根长与叶片钠质量分数(图6-Ⅲ,P=0.000)、d≤0.5 mm根长与叶片钠质量分数(图6-Ⅳ,P=0.000)呈极显著负相关;AM侵染率与叶片磷质量分数 (图6-Ⅴ,P=0.018)、AM侵染率与叶片钾质量分数(图6-Ⅵ,P=0.001)呈显著和极显著正相关;植株总生物量与叶片磷质量分数(图6-Ⅶ,P=0.000)、植株总生物量与叶片钾质量分数(图6-Ⅷ,P=0.000)呈极显著正相关。这可以说明AM真菌侵染有利于棉花根系的生长,增加叶片磷和钾吸收,减少钠的吸收,有利于棉株生物量的积累。

图5 不同盐度土壤棉花不同直径根长(Ⅰ,Ⅱ,Ⅲ)、不同直径根长占总根长百分比(Ⅳ,Ⅴ,Ⅵ)Fig.5 Cotton different diameter root length(Ⅰ,Ⅱ,Ⅲ),and percentage of different diameter root length to total root length(Ⅳ,Ⅴ,Ⅵ)growing in different saline soils for vibrating and static treatment
3 讨论
3.1 盐渍化土壤中的土著AM真菌对棉花生长的影响
苗期棉花对土壤盐分敏感,随土壤盐分增加棉苗发育受抑制加重。本研究中,在不同盐分土壤静置处理的棉花株高显著高于振动处理,不同盐度下AM真菌侵染对株高增加作用为低盐>中盐>高盐。这可能因为低盐土壤影响棉花生长的主导因素为养分,而高盐条件下棉花受养分和盐双重因素的影响。因此,AM真菌对增强棉花抵御盐分危害存在一定限度。
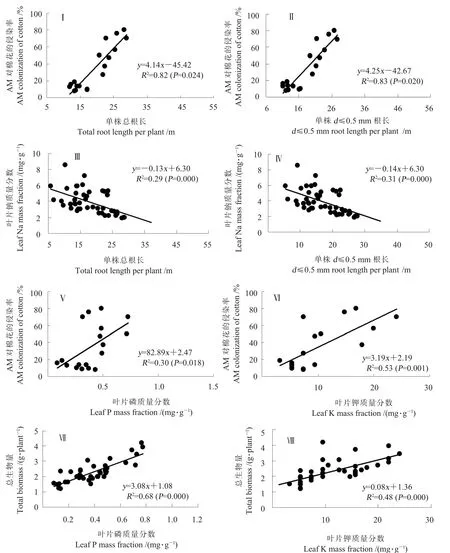
图6 直径≤0.5 mm根长和总根长与AM侵染率、直径≤0.5 mm根长和总根长与叶片Na质量分数、叶片P和K质量分数与AM侵染率、叶片P和K质量分数与总生物量相关性Fig.6 Correlation relationship of total root length and diameter≤0.5 mm root length to colonization and leaf Na mass fraction,and both colonization and biomass to leaf P and K mass fraction
盐胁迫条件下植物通过增加可溶性物质减少细胞水分外渗,降低盐对植株的危害[18]。本研究观察到棉花地上部和根生物量及叶片磷和钾质量分数对土著AM真菌侵染都呈正响应,而叶片钠和氯质量分数呈负响应,即土壤AM真菌侵染有利于棉花的生长和磷钾的利用,并且能减少植株对盐分的吸收。前人的接种试验也观察到接种AM真菌增加了植物对土壤磷钾等养分、水分吸收,增强了植物的光合作用而使抗盐性增加[19-20]。
叶片是接受光能进行光合作用合成有机物质的重要器官,对于光合产物的积累和生物量的增加及生长发育非常重要。本研究发现盐分显著抑制了棉花叶片和蕾的生长发育,这可能与高盐下叶片积聚过多盐分降低叶面蒸腾作用[21],对棉花叶片伸展产生抑制作用有关。土著AM真菌对于棉花叶片和蕾发育都有促进作用,不同盐度土壤棉花叶片数、叶面积指数均为静置处理显著高于振动处理,这与土壤AM真菌对棉花营养吸收和利用改善存在一定关系[21]。棉花蕾数的多少直接影响花铃期结铃数和成熟吐絮期产量。本研究静置处理低盐、中盐和高盐土壤棉花花蕾数都显著高于振动处理,盐渍化土壤中的土著AM真菌有利于棉花后期产量的形成,对棉花前期生长发育和后期产量都具有重要作用。
3.2 盐渍化土壤AM真菌对棉花根系生长的影响
土壤中的土著AM真菌与植物建立共生关系后运输到根的光合产物数量增加[22],用于补偿土壤AM真菌对碳水化合物的消耗,同时运输到地下部分的光合产物也参与了根系的建成[23]。本研究低盐、中盐、高盐土壤中静置处理AM侵染率、总根长、根表面积和根体积显著高于振动处理,盐渍化条件下土著AM真菌促进了棉花地下部(根系)的生长。本研究不同盐分条件下土著AM真菌显著增加总根长,但是从增幅可知菌根效应随盐分升高抑制加剧而逐渐变弱。低盐土著AM真菌显著减小棉花根平均直径,中盐和高盐土著AM真菌对根平均直径没有显著影响,这可能与盐胁迫程度较低时土壤AM真菌增加棉株抗逆性,使分配给根的干物质更多用于根长度的增加有关。
分析低盐、中盐、高盐土壤中棉花不同直径根长占总根长百分比得出d≤0.5 mm (盐分对这部分细根的抑制作用最大)根长占绝对优势,土著AM真菌显著增加了d≤0.5 mm根长和d≤0.5 mm根长占总根长的百分比;对于0.5 mm<d≤1 mm直径根长,土壤盐和AM真菌影响不显著,但减少了这部分直径根长占总根长的比例,且在低盐下显著减少;土著AM真菌显著增加低盐直径d>1 mm根长,显著降低了低盐和高盐该级直径根长占总根长百分比,这可能与不同盐分下AM真菌对棉花作用强弱有关。以上分析表明,盐渍化条件下土著AM真菌有利于棉花各级根系的生长,减小了0.5 mm<d≤1 mm和d>1 mm根系根长比例,增加了d≤0.5 mm根系根长比例,说明AM真菌更有利于较细小的根系生长发育。
3.3 土壤AM真菌与棉花根系及地上部生长相关性分析
根作为土壤中养分和水分进出植物的门户,根系的形态与构成直接关系到对不同土层中养分和水分的吸收利用,对植物与土壤的物质交换具有重要意义[24]。棉花作为双子叶植物,粗大的根主要起支撑和储存作用,细根主要起吸收养分和水分的作用。本研究总根长、d≤0.5 mm直径根长与叶片钠等盐离子质量分数呈负相关,AM侵染率与总根长、d≤0.5 mm根长、叶片磷质量分数、叶片钾质量分数呈显著正相关,地上部和根总生物量与叶片磷、叶片钾质量分数呈正效应,叶片钠和氯质量分数呈负效应,表明盐胁迫条件下土壤中的土著AM真菌群落促进了棉花根的生长及细根的发育,增加磷和钾的吸收利用,减少棉花对钠等盐离子吸收。盐分胁迫条件下,土壤中的土著AM真菌与棉花根系建立共生关系,对其根系和地上部生长产生显著促进作用。棉株根量的增加扩大了根与周围土壤的接触机会,使棉株吸收更多的水和矿质养分,改善了其地上部的生长。
4 结论
盐渍化土壤中的土著AM真菌增加了棉花总根长、d≤0.5 mm细根根长及百分比、根表面积、根体积,对总根长、d≤0.5 mm细根根长影响最大;土壤AM真菌促进根发育,改善了磷钾营养吸收与利用,降低了钠和氯的吸收,改善了棉花地上部生长。
[1]辛承松,董合忠,唐薇,等.棉花盐害与耐盐性的生理和分子机理研究进展[J].棉花学报,2005,17(5):309-313.
Xin Chengsong,Dong Hezhong,Tang Wei,et al.Physiological and molecular mechanisms of salt injury and salt tolerance in cotton[J].Cotton Science,2005,17(5):309-313.
[2]Maas E V,Hoffman G J.Crop salt tolerance:Current assessment[J].Journal of the Irrigation and Drainage Division,1977,103(2):115-134.
[3]Brugnoli E,Lauteri M.Effects of salinity on stomatal conductance,photosynthetic capacity,and carbon isotopediscrimination of salt-tolerant (Gossypium hirsutum L.)and salt-sensitive(Phaseolus vulgaris L.)C3non-halophytes[J].Plant Physiology,1991,95(2):628-635.
[4]Jafri A Z,Ahmad R.Reproductive physiology of cotton under salineconditions[M]//Ahmad R,Malik K A.Prospectsfor saline agriculture.Dordrecht:Springer,2002:209-214.
[5]Miura K.Nitrogen and phosphorus nutrition under salinity stress[M]//Ahmad R,Azooz M,Prasad M.Ecophysiology and responses of plantsunder salt stress.New York:Springer,2013:425-441.
[6]Loupassaki M H,Chartzoulakis K S,Digalaki N B,et al.Effects of salt stress on concentration of nitrogen,phosphorus,potassium,calcium,magnesium,and sodium in leaves,shoots,and roots of six olive cultivars[J].Journal of Plant Nutrition,2002,25(11):2457-2482.
[7]Grattan SR,Grieve CM.Mineral element acquisition and growth response of plants grown in saline environments[J].Agriculture,Ecosystems&Environment,1992,38(4):275-300.
[8]Smith SE,Read D J.Mycorrhizal symbiosis[M].2nd ed.London:Academic Press,Elsevier Inc.,2010.
[9]Chandrasekaran M,Boughattas S,Hu S,et al.A meta-analysis of Arbuscular mycorrhizal effects on plants grown under salt stress[J].Mycorrhiza,2014,24(8):611-625.
[10]George E,Marschner H,Jakobsen I.Role of arbuscular mycorrhizal fungi in uptake of phosphorus and nitrogen from soil[J].Critical Reviewsin Biotechnology,1995,15(3/4):257-270.
[11]Feng G,Zhang F S,Li X L,et al.Improved tolerance of maize plantsto salt stressby arbuscular mycorrhizaisrelated to higher accumulation of soluble sugars in roots[J].Mycorrhiza,2002,12(4):185-190.
[12]冯固,张福锁.丛枝菌根真菌对棉花耐盐性的影响研究[J].中国生态农业学报,2003,11(2):21-24.
Feng Gu,Zhang Fusuo.Effect of arbuscular mycorrhizal fungi on salinity tolerance of cotton[J].Chinese Journal of Eco-Agriculture,2003,11(2):21-24.
[13]AugéR M,Toler H D,Saxton A M.Arbuscular mycorrhizal symbiosisand osmotic adjustment in responseto NaCl stress:A meta-analysis[J].Frontiersin Plant Science,2014(5):562.
[14]Greenway A H,Munns R.Mechanisms of salt tolerance in nonhalophytes[J].Annual Review of Plant Physiology,1980,31(1):149-190.
[15]Gai JP,Gao W J,Liu L,et al.Infectivity and community composition of arbuscular mycorrhizal fungi from different soil depths in intensively managed agricultural ecosystems[J].Journal of Soilsand Sediments,2015,15(5):1200-1211.
[16]Johnson D,Leake JR,Read D J.Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks[J].New Phytologist,2001,152(3):555-562.
[17]Phillips J M,Hayman D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungifor rapid assessment of infection[J].Transactionsof the British Mycological Society,1970,55(1):158-161.
[18]Iqbal N,Umar S,Nazar R.Manipulating osmolytesfor breeding salinity-tolerant plants[M]//Ahmad P,Rasool S.Emerging technologies&management of crop stress tolerance:Vol 2.Tokyo:Academic Press,Elsevier Inc.,2014:385-404.
[19]Kumar A,Sharma S,Mishra S.Influence of arbuscular mycorrhizal(AM)fungiand salinity on seedling growth,soluteaccumulation,and mycorrhizal dependency of Jatropha curcas L.[J].Journal of Plant Growth Regulation,2010,29(3):297-306.
[20]Hameed A,Dilfuza E,Abd-Allah E F,et al.Salinity stress and arbuscular mycorrhizal symbiosis in plants[M].New York:Springer,2014:139-159.
[21]Liu SL,Guo X L,Feng G,et al.Indigenous arbuscular mycorrhizal fungi can alleviate salt stress and promote growth of cotton and maize in saline fields[J].Plant and Soil,2016,398(1):195-206.
[22]Wright D P,Scholes JD,Read D J.Effects of VA mycorrhizal colonization on photosynthesis and biomass production of Trifolium repens L.[J].Plant,Cell&Environment,1998,21(2):209-216.
[23]Kothari SK,Marschner H,George E.Effect of VA mycorrhizal fungi and rhizosphere microorganisms on root and shoot morphology,growth and water relations in maize[J].New Phytologist,1990,116(2):303-311.
[24]Lambers H,Shane M W,Cramer M D,et al.Root structure and functioning for efficient acquisition of phosphorus:Matching morphological and physiological traits[J].Annals of Botany,2006,98(4):693-713. ●
Effect of Indigenous Arbuscular Mycorrhizae Fungion the Root Morphological Characteristics of Cotton at the Seedling Stage
Guo Xiuli1,3,Baidengsha Maimaiti’aili2,Zhang Shaomin2,Sun Liangbin2,Feng Gu1*
(1.College of Resource and Environment Science,China Agricultural University,Beijing 100193,China;2.Research Institute of Nuclear and Biotechnologies,Xinjiang Academy of Agricultural Sciences/Key Laboratory of Crop Ecophysiology and Farming System in Desert Oasis Region,Ministry of Agriculture,Urumqi830091,China;3.Agricultural College of Shihezi University,Shihezi,Xinjiang 832003,China)
S562.01
A
1002-7807(2017)05-0476-11
10.11963/1002-7807.gxlfg.20170706
2016-11-29 第一作者简介:国秀丽(1973―),女,博士研究生,maryshz@126.com。*通信作者:fenggu@cau.edu.cn基金项目:国家自然科学基金(U1403285)

