陆地棉色素腺体与不同棉酚旋光体含量之间的相关性研究
刘慧,季灵艳,赵天伦,陈进红,祝水金
陆地棉色素腺体与不同棉酚旋光体含量之间的相关性研究
刘慧#,季灵艳#,赵天伦,陈进红,祝水金*
(浙江大学农业与生物技术学院,杭州310058)
【目的】研究不同基因型棉花不同器官的色素腺体与棉酚旋光体含量之间的相关性。【方法】以6个陆地棉材料中棉所12、中棉所12(无)、珂字棉312、珂字棉312(无)、IF11和冀棉14为对象,精确测定主要器官的色素腺体密度和大小,并采用柱前衍生拆旋方法进行高效液相色谱分析,测定其相应的棉酚旋光体含量,然后对色素腺体和棉酚旋光体含量进行相关性分析。【结果】低酚棉全株无色素腺体,但在各器官中仍能检测到低于0.02%(质量分数)的少量游离棉酚存在。有酚棉各器官均具有典型的色素腺体,其中棉仁的色素腺体最密,苞叶最稀;色素腺体大小(直径)以铃壳最大,花瓣和棉仁最小。不同器官中,总棉酚含量以棉仁最高,苞叶最小;棉仁和花瓣的右旋棉酚含量大于左旋棉酚,而萼片、铃壳、上部叶、中部叶和下部叶的左旋棉酚含量大于右旋棉酚。有酚棉的色素腺体密度与大小之间呈极显著负相关;而总棉酚含量与不同棉酚旋光体含量之间,以及左右旋棉酚含量之间呈极显著正相关。色素腺体密度与总棉酚含量以及不同棉酚旋光体含量之间呈极显著的正相关,而色素腺体大小与右旋棉酚含量之间呈显著的负相关。【结论】棉仁与花瓣的总棉酚含量存在高度的相关性,因此,可以通过花瓣的棉酚含量来判断棉仁的棉酚含量。
陆地棉;色素腺体密度;色素腺体大小;左旋棉酚;右旋棉酚;相关性分析
Abstract:[Objective]The aim of this study was to examine the correlation between pigment glands and(-)/(+)-gossypol contents in different organs of different upland cotton genotypes.[Method]Using upland cotton materials CCRI 12,CCRI 12(glandless),Coker 312,Coker 312(glandless),IF11 and Jimian 14,we accurately measured the density and sizeof thepigment glands,tested(-)/(+)-gossypol contents by pre-column derivatization-high performance liquid chromatography(HPLC),and then analyzed the correlation between pigment glands and(-)/(+)-gossypol contents.[Result]The whole plants of low gossypol cotton lines were without pigment glands,but free gossypol could still be detected in different organs at mass fractions less than 0.02%.The organs of glanded cotton all had typical pigment glands,the gland density was highest in the seed and lowest in the bract.The gland size(diameter)was largest in the boll shell and smallest in the petal and seed.Across different organs,the total gossypol content was highest in the seed and lowest in the bract.The contents of(+)-gossypol in the seed and petal were higher than(-)-gossypol.Conversely,the(-)-gossypol contents of the calyx,boll shell,upper leaf,middle leaf,and lower leaf were higher than(+)-gossypol.There was a significant negative correlation between the density and size of glands in glanded cotton.There were significant positive correlations between total gossypol content and(-)/(+)-gossypol contents,and between(+)-gossypol content and(-)-gossypol content.Gland density was positively correlated with total gossypol content and(-)/(+)-gossypol contents.Gland size was negatively correlated with(+)-gossypol content,and showed no significant correlation with(-)-gossypol content or total gossypol content.[Conclusion]Overall,the strong positive correlation between total gossypol content in the seed andpetal suggests that we can usethe petal gossypol content to infer the seed gossypol content.
Keywords:upland cotton;pigment gland density;pigment gland size;(-)-gossypol;(+)-gossypol;correlation analysis
棉花色素腺体通常呈褐色或黑褐色点状,遍布棉株除花粉、种皮以外的绝大多数器官[1]。棉酚是棉花及其近缘植物所特有的多酚物质,主要存在于色素腺体中[2]。棉酚具有旋光性,有左旋棉酚和右旋棉酚2种位阻光学异构体,天然棉酚一般以外消旋体棉酚的混合形式存在[3]。棉酚及其衍生物对棉花的多种病原菌和害虫具有拮抗作用[4-6]。研究发现,左旋棉酚和右旋棉酚的药理活性相差较大,左旋棉酚表现出更强的抑制精子产生和抗肿瘤作用,同时具有较强的毒副作用,而右旋棉酚几乎无活性[7]。
棉酚及其衍生物约占色素腺体内含物的30%~50%,棉酚含量与色素腺体数呈正相关[8-9]。棉酚由棉花根部合成,后向植株地上部分输送并贮藏于棉花的色素腺体内[10]。棉花有低酚棉和有酚棉2种不同类型,其植株各器官的棉酚含量,特别是棉酚旋光体的含量与其色素腺体之间的关系还鲜见报道。本研究以6个陆地棉基因型为材料,精确测定主要器官的色素腺体密度和大小,并采用柱前衍生拆旋方法进行高效液相色谱(High performance liquid chromatography,HPLC)分析,测定其相应的棉酚旋光体含量,研究不同基因型棉花不同器官的色素腺体与棉酚旋光体含量之间的相关性,丰富棉花生物学数据,并为棉花遗传育种提供依据。
1 材料与方法
1.1 试验材料
供试材料为6份陆地棉品种 (系):中棉所12、中棉所 12(无)、珂字棉 312、珂字棉 312(无)、IF11和冀棉14。其中:中棉所12(无)为显性无色素腺体种质系,是中棉所12的无色素腺体近等基因系;珂字棉312(无)为隐性无色素腺体种质系,是珂字棉312的无色素腺体近等基因系;上述材料均由本实验室自交保存。IF11是转iaaM基因的转基因棉种质系,表现为生长素(Indole-3-acetic acid,IAA)适度上调,冀棉14为该种质系的受体亲本,两者均由西南大学提供。所有材料均由本实验室自交多代保纯。
试验材料种植在浙江省杭州市浙江大学实验农场,开花期每份材料取长势一致的上部叶、中部叶、下部叶、花朵、开花后5 d的棉铃和成熟后的种子进行色素腺体密度和大小的观测。样品经色素腺体观察后在35℃下烘干至质量恒定,用于棉酚及其旋光体含量测定。
1.2 试剂
消旋棉酚 (HPLC级)标准品购自Sigma公司,左旋棉酚(HPLC级)标准品购自陕西慈缘生物技术有限公司,D-氨基丙醇购自阿拉丁公司,乙腈为购自永华化学科技有限公司的色谱纯试剂,其余试剂均为购自上海凌峰化学试剂有限公司的分析纯试剂。
1.3 色素腺体观察
样品在体视显微镜下取不同视野拍照,用Image Pro Plus6.0软件统计上部叶、中部叶、下部叶、棉仁及开花当天花朵各部位的色素腺体密度和大小,10个视野的平均值为每种材料的观察值。其中色素腺体密度在1倍镜下拍摄(取景框为9.19 mm ×6.86 mm=0.63 cm2),统计色素腺体数,再换算成单位面积的色素腺体数(如每平方厘米的色素腺体数为取景框内的色素腺体数除以0.63的商);色素腺体大小以色素腺体直径表示,在6倍镜下拍摄 (取景框为1.53 mm×1.14 mm),在软件中直接测量色素腺体的长轴直径(mm),并进行单位(μm)换算。
1.4 棉酚旋光体含量测定
1.4.1 样品前处理。各材料烘干后磨粉,过孔径0.178 mm(80目)筛,低温避光保存备用。精确称取各样品0.1 g,3次重复,置于10 mL离心管中,加入2 mL衍生化试剂,用封口膜封口,置于超声波清洗机(30℃、240 W)中超声30 min备用。
1.4.2 左右旋棉酚含量测定。衍生化试剂:2%(体积分数)D-氨基丙醇、10%(体积分数)冰醋酸、88%(体积分数)乙腈。配制完成后置于-20℃冰箱中避光保存。
配制左旋棉酚和消旋棉酚标准溶液:精确称取0.01 g左旋棉酚标准品和消旋棉酚标准品,分别用乙腈溶解,定容至10 mL棕色容量瓶,为1 g·L-1的左旋棉酚和消旋棉酚标准储备液,于-20℃冰箱中避光保存。分别取已配好的左旋棉酚和消旋棉酚标准溶液:0、5、10、20、50、100、200、500、800、1000、2000 μL,置于 10 mL 离心管中,加2 mL衍生化试剂,用封口膜封口,备用。
衍生化处理:将制备好待用的标样和样品置于水浴锅中进行加热衍生化(75℃,45 min)。衍生化结束后,标样用乙腈定容至10 mL,获得质量浓 度 梯 度 分 别 为 0、0.5、1.0、2.0、5.0、10.0、20.0、50.0、80.0、100.0、200.0 mg·L-1的左旋棉酚标准液和质量浓度梯度分别为 0、0.25、0.5、1.0、2.5、5.0、10.0、25.0、40.0、50.0、100.0 mg·L-1的消旋棉酚标准液。样品则进行低温高速 (4℃、6000 r·min-1)离心 5 min,经 0.45 μm 有机微孔滤膜抽滤至10 mL棕色容量瓶中,重复离心洗涤沉淀3次,用乙腈定容。于-20℃冰箱中避光保存。
1.4.3 HPLC分析条件。色谱条件:反向C18色谱柱(长250 mm,内径4.6 mm,填料颗粒直径5 μm),流动相为体积比 80∶20的乙腈与 10 mmol·L-1KH2PO4(pH 3),流速 1.0 mL·min-1,紫外检测波长238 nm,进样量10μL,柱温25℃。
1.5 数据处理
利用MSExcel、SPSS 19.0软件进行数据统计、差异显著性分析以及相关性分析。
2 结果与分析
2.1 色素腺体密度和大小
参试的6份陆地棉材料中,中棉所12(无)是由1对显性基因控制的全株无色素腺体棉类型,珂字棉312(无)是由2对隐性基因控制的全株无色素腺体棉类型,两者均为低酚棉类型。其他材料为典型的有色素腺体棉花类型,但不同材料之间、同一材料不同器官之间的色素腺体密度和大小存在差异(表1)。

表1 参试材料主要器官的色素腺体密度和大小Table 1 Density and size of the pigment glands in the main organs of the materials in the experiment cm-2,μm
从表1可以看出,4个色素腺体棉各器官均具有典型的色素腺体,植株各部位色素腺体密度均呈棉仁>花瓣>铃壳>萼片>苞叶,上部叶>中部叶>下部叶的规律;而色素腺体的大小基本呈铃壳>萼片>苞叶>花瓣≈棉仁,下部叶>中部叶>上部叶的规律。
从不同器官来看,萼片、铃壳、苞叶上的色素腺体密度较低,而色素腺体则较大。花瓣和下部叶的色素腺体密度相差不大,上部叶的色素腺体密度明显高于中部叶和下部叶,而棉仁的色素腺体密度最高。铃壳的色素腺体最大,棉仁、花瓣和叶片的色素腺体大小相差不大。
不同基因型之间,萼片、铃壳、苞叶上的色素腺体密度均为珂字棉312最大,IF11最小,中棉所12和冀棉14相近。而棉仁、上部叶和中部叶的色素腺体密度依次为IF11>珂字棉312>中棉所12>冀棉14;下部叶则为珂字棉312>中棉所12>冀棉14>IF11;花瓣为中棉所12>冀棉14>珂字棉312>IF11。
不同基因型之间,花瓣和萼片的色素腺体大小为冀棉14>珂字棉312>IF11>中棉所12;苞叶和上部叶为冀棉14>IF11>中棉所12>珂字棉312;铃壳为IF11>珂字棉312>冀棉14>中棉所12;中部叶为珂字棉312>IF11>冀棉14>中棉所12;棉仁和下部叶的色素腺体以中棉所12最大,IF11最小。
2.2 棉酚及其旋光体含量
2.2.1 HPLC色谱图。分别取左旋棉酚、消旋棉酚标准液和棉籽样品,根据上述色谱条件进样分析,得到色谱图(图1)。色谱图上杂质峰较少,主峰清晰,左右旋棉酚拆分状况良好,右旋棉酚衍生物先在9.99 min出峰,左旋棉酚在17.27 min出峰。
2.2.2 左右旋棉酚标准曲线。将配制好的消旋棉酚标准溶液在最佳色谱条件下上机进行检测,对目的峰面积(y)与棉酚质量浓度(x)进行线性回归,得到的左旋棉酚和右旋棉酚回归曲线见图2。二者的质量浓度与峰面积均呈现良好的线性关系。
2.2.3 陆地棉主要器官的棉酚及其旋光体含量。6个不同棉花基因型的棉仁、花瓣、萼片、铃壳、苞叶、上部叶、中部叶和下部叶样品的左右旋棉酚含量结果(表2)表明,陆地棉的基因型不同,总棉酚含量(质量分数,下同)及其旋光体含量与比例存在显著差异。
2个低酚棉种质各器官的总棉酚含量表现:棉仁>花瓣≈萼片>苞叶>铃壳,上部叶>中部叶>下部叶。除了铃壳中检测不到右旋棉酚以外,其他所有器官的右旋棉酚含量均大于左旋棉酚,低酚棉各器官中的左旋棉酚含量相对恒定,约为0.005%。
4个有酚棉品种 (系)中,总棉酚含量为棉仁>花瓣>铃壳>萼片>苞叶,上部叶>中部叶>下部叶。棉仁和花瓣中右旋棉酚含量大于左旋棉酚,萼片、铃壳、上部叶、中部叶和下部叶中的左旋棉酚含量大于右旋棉酚。除了中棉所12以外,苞叶中的左旋棉酚含量均大于右旋棉酚。
参试材料主要器官总棉酚含量间的相关性分析结果(表3)表明,棉仁与其他器官总棉酚含量间均为显著或极显著正相关,其中棉仁总棉酚含量与花瓣总棉酚含量间的相关性最强,相关系数达0.977。在所有器官之间,花瓣与苞叶、铃壳与苞叶和花瓣与铃壳之间的总棉酚含量的相关系数均较大,相关性达极显著水平。
2.3 色素腺体和棉酚旋光体之间的相关性分析
由表4可知,4个有酚棉材料主要器官的色素腺体密度和色素腺体大小呈极显著负相关,即色素腺体密度越大,色素腺体越小。左旋棉酚和右旋棉酚的含量呈极显著正相关,左旋棉酚、右旋棉酚含量与总棉酚含量均呈极显著正相关。色素腺体密度与总棉酚含量、左旋棉酚和右旋棉酚含量之间均呈极显著的正相关;色素腺体大小与右旋棉酚含量呈显著负相关,而与左旋棉酚含量和总棉酚含量的相关性未达显著水平。
4个有酚棉材料棉仁的色素腺体密度与左旋棉酚含量呈显著负相关(表5),花瓣色素腺体大小与左旋棉酚含量呈显著正相关,上部叶色素腺体大小与右旋棉酚含量呈显著正相关,中部叶色素腺体大小与左旋棉酚含量、总棉酚含量呈极显著正相关,而其他器官的色素腺体密度、大小与总棉酚含量、左旋棉酚含量、右旋棉酚含量均无显著的相关性。
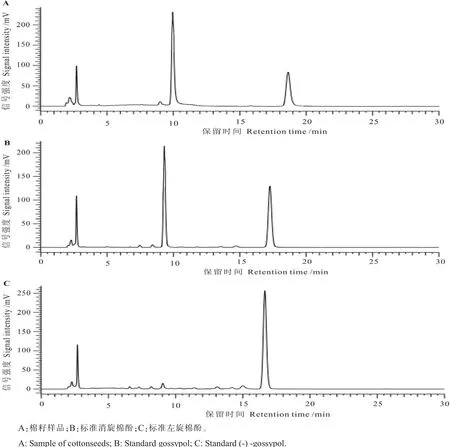
图1 HPLC色谱图Fig.1 HPLC chromatograms

图2 柱前衍生化-HPLC法获得的左右旋棉酚标准曲线Fig.2 Standard curves of(-)-and(+)-gossypol by pre-column derivatization-HPLC method

表2 参试材料的主要器官棉酚及其旋光体含量Table 2 (-)/(+)-gossypol contents in the main organs of the materials in the experiment

表3 参试材料主要器官总棉酚含量间的相关性分析Table 3 Correlation analysis between gossypol contents in the main organs of the materials in the experiment

表4 有酚棉色素腺体指标和棉酚及其旋光体含量之间的相关性分析Table 4 Correlation analysis between pigment gland indicators and(-)/(+)-gossypol contents in the glanded cotton
3 讨论与结论
棉酚含量低于国际卫生组织标准(0.04%)和国家标准(0.02%)的无色素腺体棉花品种均为低酚棉[11]。本研究表明,不同基因型陆地棉主要器官的色素腺体密度和大小、棉酚及其旋光体含量不同。本研究中的色素腺体近等基因系(中棉所12与中棉所12(无)、珂字棉312与珂字棉312(无))在棉仁、花瓣、铃壳这3个器官中的棉酚及其旋光体含量差异较大,而萼片、苞叶、上部叶、中部叶、下部叶这5个器官的棉酚含量差异较小。
有酚棉棉酚及其旋光体含量较高;在低酚棉各器官中也均能检测到低于0.02%的少量游离棉酚存在。这是因为棉酚是由棉株根部合成后输送到植株各器官并贮存在植株各器官的色素腺体内[12-13],低酚棉中无色素腺体,但其根部仍具有合成棉酚的能力,只是缺少了贮存棉酚的器官而已。有关研究表明,棉酚及其衍生物是1种抗生物质,对某些害虫的生长发育具有一定的抑制作用[14],且棉酚可能与棉花对枯萎病的抗性有关[15],当病虫危害发生时激发子可以诱导与棉酚的合成相关的基因的表达[16],故棉酚对于植株的生长发育具有非常重要的作用。低酚棉功能性器官存在一定含量的棉酚,可能具有增强植株抗逆性的作用。

表5 有酚棉主要器官色素腺体指标与棉酚及其旋光体含量间的相关性分析Table 5 Correlation analysis between pigment gland indicators and(-)/(+)-gossypol contents in the main organs of the glanded cotton
棉酚由于结构内部化学键的旋转引起的空间位阻而同时以2种对映异构体存在,其中左旋棉酚比右旋棉酚表现出更高的生物活性,尤其其抗肿瘤效果日益受到重视[17]。然而,有关左、右旋棉酚对于棉花生长发育的作用还未见报道。本研究结果表明,所有供试材料的各器官均含有左旋棉酚,而无色素腺体棉的铃壳中均不含有右旋棉酚,说明左旋棉酚在棉花生长发育中更加重要。左旋棉酚是有生物活性的光学异构体[18],可能对于保持棉花正常生长发育具有重要的作用,笔者正在进一步验证。此外,低酚棉各器官中的左旋棉酚含量非常接近,即0.005%左右。那么,微量左旋棉酚是否为低酚棉生长发育所必需的?这还有待更多的试验来证明。
IF11为转iaaM基因的IAA适度上调的转基因棉花种质系,转iaaM基因可显著提高种子表皮的纤维细胞的形成,而提高衣分和适度降低纤维细度,兼有提高产量和改善品质的效果[19]。本研究结果表明,IF11与受体亲本冀棉14之间,前者各器官的色素腺体密度、棉酚及其旋光体含量大多小于后者,其中左旋棉酚含量显著低于后者。iaaM基因不同插入位点对于色素腺体、棉酚及其旋光体含量的影响一致(另文报道)。由此可见,IF11色素腺体和棉酚的降低并非是外源基因插入而影响棉酚合成、输送和贮存或色素腺体形成,而可能与IAA上调有关,即IAA含量与色素腺体或棉酚合成有一定的相关性。但这还有待进一步研究。
许多学者认为,棉酚含量是色素腺体的生化指标,植株各部位的棉酚含量与色素腺体的密度存在正相关[20]。本研究中各器官的色素腺体密度、大小与棉酚及其旋光体含量的相关分析结果表明,不同器官的色素腺体与棉酚含量之间的相关性差异很大,其中中部叶片的色素腺体大小与棉酚含量呈极显著正相关,其他器官的色素腺体与棉酚含量的相关性并不密切。进一步对有酚棉色素腺体与不同棉酚旋光体之间的相关性分析发现,左旋棉酚含量、右旋棉酚含量、总棉酚含量两两间为极显著正相关,色素腺体密度与左旋棉酚含量、右旋棉酚含量、总棉酚含量呈极显著正相关,色素腺体大小与右旋棉酚含量呈显著负相关,而与左旋棉酚含量和总棉酚含量没有显著的相关性。不同器官中,花瓣总棉酚含量与棉仁总棉酚含量相关性较高,故可以根据花瓣棉酚含量来判断棉仁棉酚含量的高低,这对于选育低酚棉种具有非常重要的意义。
[1]邱志坚,刘文哲.棉花色素腺体研究进展[J].鲁东大学学报(自然科学版),2008,24(2):162-167.
Qiu Zhijian,Liu Wenzhe.Advances in research on pigment gland of cotton[J].Ludong University Journal(Natural Science Edition),2008,24(2):162-167.
[2]季道藩.棉花知识百科[M].北京:中国农业出版社,2001:23-25.
Ji Daofan.Cotton knowledge encyclopedia[M].Beijing:China Agriculture Press,2001:23-25.
[3]姚军,何晓文,李新霞,等.高效液相色谱-质谱法测定棉籽仁中左旋和右旋棉酚含量[J].食品工业科技,2013,34(19):277-280.
Yao Jun,He Xiaowen,Li Xinxia,et al.Determination of(-)-and(+)-gossypol in cottonseed by high-performance liquid chromatography with mass spectrum[J].Science and Technology of Food Industry,2013,34(19):277-280.
[4]Adams R,Geissman T A,Edwards JD.Gossypol,a pigment of cottonseed[J].Chemical Reviews,1960,60(6):555-574.
[5]Bell A A.Formadtion of gossypol in infected or chemically irritated tissuesof Gossypium species[J].Phytopathology,1967,57:759-764.
[6]季道藩.棉花腺体的遗传和育种[J].浙江农业大学学报,1980,6(1):32-45.
Ji Daofan.The genetic and breeding for cotton pigment glands[J].Journal of Zhejiang Agricultural University,1980,6(1):32-45.
[7]何晓文,李新霞,姚军,等.柱前手性衍生化-高效液相色谱法测定棉籽仁中左旋和右旋棉酚含量[J].食品科学,2013,34(12):125-128.
He Xiaowen,Li Xinxia,Yao Jun,et al.Determination of(-)and(+)-gossypols in cottonseed kernel by high-performance liquid chromatography with chiral pre-column derivatization[J].Food Science,2013,34(12):125-128.
[8]邓德旺.棉花色素腺体的研究进展[J].河北农业大学学报,1988,11(4):125-131.
Deng Dewang.Advance of research on thepigment gland of cotton[J].Journal of Agricultural University of Hebei,1988,11(4):125-131.
[9]沈仍愚,陈铭荻,王新其,等.估测棉仁中棉酚含量研究续报[J].中国棉花,1988(3):23-25.
Shen Rengyu,Chen Mingdi,Wang Xinqi,et al.Estimation of cottonseed gossypol contentsin theresearch report[J].China Cotton,1988(3):23-25.
[10]Smith FH.Determination of gossypol in leavesand flower buds of Gossypium[J].Journal of the American Oil Chemists Society,1967,44(4):267-269.
[11]朱四元,陈金湘.低酚棉育种研究进展[J].江西农业学报,2006,18(4):18-23.
Zhu Siyuan,Chen Jinxiang.Advancesin breeding of low gossypol cotton[J].Acta Agriculturae Jiangxi,2006,18(4):18-23.
[12]张程程,吴燕民,唐益雄.棉酚及其衍生物合成途径的研究进展[J].生物技术进展,2011,1(3):165-171.
Zhang Chengcheng,Wu Yanmin,Tang Yixiong.Progress on biosynthetic pathway of gossypol and its derivatives[J].Current Biotechnology,2011,1(3):165-171.
[13]唐爱民,万长寿.棉株不同部位棉酚含量及其与表型的相关分析[J].中国棉花,1985(6):20-22.
Tang Aimin,Wan Changshou.Correlation analysis between gossypol content in different parts and phenotype of cotton[J].China Cotton,1985(6):20-22.
[14]狄佳春,陈旭升,吴巧娟,等.棉盲蝽对低酚棉和有酚棉为害的差异[J].中国棉花,2007,34(11):20-21.
Di Jiachun,Chen Xusheng,Wu Qiaojuan,et al.Damage differences of cotton fleahopper in glandless cotton and glanded cotton[J].China Cotton,2007,34(11):20-21.
[15]宋凤鸣,郑重.棉酚和单宁含量与棉花对枯萎病抗性之间的关系[J].浙江农业大学学报,1997,23(5):529-532.
Song Fengming,Zheng Zhong.Involvement of gossypol and tannin in the resistance of cotton seedlings to Fusarium wilt[J].Journal of Zhejiang Agricultural University,1997,23(5):529-532.
[16]朱美霞,李永起,戴小枫.棉酚腺体与棉酚生物合成及低酚棉分子育种[J].分子植物育种,2004,2(3):307-312.
Zhu Meixia,Li Yongqi,Dai Xiaofeng.Gossypol gland and gossypol biosynthesis and molecular breeding of low gossypol cotton[J].Molecular Plant Breeding,2004,2(3):307-312.
[17]代友彪,杨四涛,唐辉.左旋棉酚抗肿瘤作用的研究进展[J].中国药业,2009,18(19):1-3.
Dai Youbiao,Yang Sitao,Tang Hui,Advances on anti-tumor research of(-)-gossypol[J].China Pharmaceutical,2009,18(19):1-3.
[18]雷海鹏.棉酚作为男用节育药的前途[J].药学学报,1983,18(5):321-324.
Lei Haipeng.Gossypol used as a male contraceptive[J].Acta Pharmaceutica Sinica,1983,18(5):321-324.
[19]Zhang Mi,Zheng Xuelian,Song Shuiqing,et al.Spatiotemporal manipulation of auxin biosynthesis in cotton ovule epidermal cells enhancesfiber yield and quality[J].Nature Biotechnology,2011,29(5):453-458.
[20]Wilson F D,Smith J N.Some genetic relationships between gland density and gossypol content in Gossypium hirsutum L.[J].Crop Science,1976,16(6):830-832. ●
Analysis of the Correlation between Pigment Glands and(-)/(+)-Gossypol Contents in Upland Cotton
Liu Hui#,Ji Lingyan#,Zhao Tianlun,Chen Jinhong,Zhu Shuijin*
(College of Agriculture and Biotechnology,Zhejiang University,Hangzhou 310058,China)
S562.01
A
1002-7807(2017)05-0437-10
10.11963/1002-7807.lhzsj.20170818
2016-12-07 第一作者简介:刘慧(1991―),女,硕士研究生;﹟同等贡献。*通信作者:shjzhu@zju.edu.cn
国家重点研发计划(2016YFD0101400);国家自然科学基金(31501342);国家现代农业产业技术体系——棉花产业体系岗位科学家专项(CARS-18-25);江苏省现代作物生产协同创新中心

