陆地棉PPO基因全基因组鉴定及对黄萎病菌的响应分析
张慧,田新权,高巍,蔡应繁,龙璐
陆地棉PPO基因全基因组鉴定及对黄萎病菌的响应分析
张慧,田新权,高巍,蔡应繁,龙璐*
(河南大学生命科学学院/棉花生物学国家重点实验室/河南省植物逆境生物学重点实验室,河南开封475004)
【目的】多酚氧化酶(Polyphenol oxidases,PPO)广泛参与植物抵抗病虫害等生物逆境胁迫的过程。本研究旨在研究棉花中的PPO基因及其表达模式,验证多酚氧化酶与棉花抗黄萎病的关系。【方法】分析了黄萎病菌V991侵染下异源四倍体陆地棉TM-1根系中PPO酶活力变化,并利用TM-1的基因组数据库,鉴定相关基因,并进行生物信息学和表达分析。【结果】共筛选到13个候选GhPPO基因。这些基因都不含内含子,所编码的蛋白包含2个铜离子结合位点和PPO的保守序列(酪氨酸酶、DWL和KFDV保守结构域)。进化分析显示,陆地棉PPO基因的种内相似性大于种间相似性,并且相互之间形成了多对重复基因。GhPPO的表达量差异较大,少数基因具有组织特异表达的特性,多数基因在棉花不同组织中表达量都很低。实时荧光定量聚合酶链式反应分析结果表明:GhPPO6D在棉花根系中表达量较高,且在黄萎病菌V991侵染后上调。【结论】GhPPO6D可能参与了棉花与黄萎病菌的互作过程,与V991侵染后棉花根系PPO酶活力上升相关。
陆地棉;多酚氧化酶;基因家族;黄萎病;生物信息学分析
Abstract:[Objective]Polyphenol oxidases(PPOs)areubiquitous among plants and have been shown to be involved in defense responses to biotic stresses,such as pathogens and insects.The aim of this study was to verify PPO genes and their expression patternsin upland cotton and determine therelationship between PPOand cotton resistance to Verticillium dahliae.[Method]We analyzed changes in PPO activity in allotetraploid cotton TM-1 roots after V991 (V.dahliae)inoculation,and isolated related genes from the TM-1 genome database.Bioinformatics and expression analysis were used to characterize the isolated genes.[Result]13 putative PPO genes were isolated,all of which were intron-free and encoded proteins containing two copper ion binding sites and conserved PPOdomains(tyrosinase,DWL and KFDV domain).Phylogenetic analysis revealed that there was greater genetic diversity in PPO genes within species than between species.GhPPO genes were duplicated,most of which were lowly expressed in all tissues examined,only a few showed tissue-specific expression in different organs.Quantitative real-time polymerase chain reaction showed that GhPPO6D was highly expressed in cotton roots and induced by V.dahliae inoculation.[Conclusion]These results indicated that GhPPO6D may participate in the interaction between cotton and V.dahliae and could beresponsible for the up-regulation of PPOactivity after V991 infection.
Keywords:Gossypium hirsutum;polyphenol oxidase;gene family;Verticillium dahliae;bioinformaticsanalysis
多酚氧化酶(Polyphenol oxidase,PPO)是广泛存在于植物、昆虫和真菌中的金属蛋白酶,具有2个铜离子结合域,能与二价铜离子结合,通过氧化作用催化酚类化合物形成醌类物质[1]。植物中的PPO存在于各组织和器官,是植物受到损伤等刺激后酶促褐变的主要原因。已有的研究表明,PPO作为1种重要的防御酶类,参与了多种植物抵抗病虫害等逆境胁迫的过程[2]。
植物在受到病原菌侵染或昆虫取食时,PPO的表达和活力受到诱导上升,通过多种途径增强植物对病虫害的防御反应。马铃薯野生种Solanum berthaultii的腺体中含有大量PPO,遭受胁迫时PPO快速催化酚类化合物的氧化聚合作用,产生褐色的黏性聚合物限制昆虫的取食和病原菌的扩散[3]。PPO还能通过其产生的醌类共价结合修饰亲核氨基酸,降低植物的营养价值,产生抗营养作用,发挥抗胁迫功能[4]。此外,PPO的上调还伴随着其他一些胁迫诱导的抗性蛋白的增加,醌类物质对昆虫和病原菌也具有直接毒害作用[5]。
PPO具有多基因家族的特性,由多个基因编码[2,6-7]。随着分子生物学的发展,植物PPO基因被逐渐分离和克隆。通过转基因技术操纵PPO基因的表达及其表达产物的活力,能够实现对植物抗病、抗虫能力的提高。2002年Li等在番茄中异源表达了1个马铃薯PPO基因,发现转基因植株PPO酶活力提高了5~10倍,增强了对假单胞菌的抗性,证明单个PPO基因能影响植物对病原菌的抵抗能力[8];反之,转入马铃薯PPO反义链能抑制蕃茄中所有PPO基因的表达,同时显著降低蕃茄的抗病性[9]。干涉蒲公英中PPO-2基因,植株对假单胞菌的抗性减弱,在拟南芥中异源表达该基因可增强转基因植株的抗病性[10]。番茄中PPO的酶活力与害虫的体质量和取食量呈负相关,超表达PPO基因的蕃茄抑制了斜纹夜蛾幼虫的生长并降低了其存活率[11]。超表达PtdPPO1基因的杨树对食草性森林天幕毛虫 (Malacosoma disstria)的抗性增强,用其树叶饲养的天幕毛虫幼虫死亡率高,平均体质量增幅相比对照组较小[12]。
早期的研究表明虫害和病害影响了棉花中PPO的酶活力[13-14]。但目前对于棉花中的PPO基因研究仍然很少。朱香镇等2014年从棉花绿盲蝽刺吸胁迫抑制消减杂交 (Suppression subtractive hybridization,SSH)文库中首次克隆和分析了棉花内源的PPO基因GhPPO1。GhPPO1表达受机械损伤诱导,参与棉花响应棉铃虫取食的过程[15]。为了研究棉花中的PPO基因及其表达模式,本研究分析陆地棉(Gossypium hirsutum)TM-1在黄萎病菌侵染下PPO酶活力的变化;在TM-1基因组中分离到13个PPO基因,对这些PPO基因进行了序列特征、进化分析,并分析了这些基因在TM-1中的组织表达模式和黄萎病菌侵染下的表达变化。
1 材料与方法
1.1 试验材料
陆地棉品种TM-1由中国农业科学院棉花研究所提供,棉花强致病力落叶型黄萎病菌菌系V991由中国农业科学院植物保护研究所简桂良研究员提供。
1.2 植物材料的种植和处理
将TM-1种子在水中浸泡8 h,转移至放有湿润滤纸的培养皿中催芽36 h。待种子胚根萌发至1.5 cm左右时,将其播种于混合营养土(营养土与蛭石质量比为1∶1)中,转移到光照培养箱生长(温度为25℃,相对湿度为60%,光周期为光照16 h、黑暗8 h)。待棉花幼苗生长至两叶一心时,选择长势良好且一致的幼苗进行胁迫处理。
黄萎病菌V991接种处理:将4℃保存的V991置于PDA培养基上,于25℃活化并继代培养2次。在活化后的V991菌落边缘,挑取约1 cm2的菌丝团,在查氏培养基中震荡培养3~5 d(25℃,暗培养)。用双层纱布过滤菌丝团,所获得的V991分生孢子悬浮液经1000 r·min-1离心10 min,去上清液后用蒸馏水稀释至每毫升2×105个孢子。幼苗接种采用伤根接种法[16],以伤根后水处理作为对照组 (Mock)。处理后观察幼苗发病情况,7 d 后照相,并分别取 0 h、1 h、6 h、12 h、24 h、72 h和120 h的根系样品置于-80℃保存备用。
1.3 PPO酶活力测定
酶活力测定方法参照Sugumaran等[17],略有改动。取待测样品0.2 g用液氮研磨成均匀的粉末,加入1.6 mL聚乙烯吡咯烷酮(PVP)质量浓度为 15 g·L-1的 Tris-HCl(pH=7.5)溶液,充分混匀后吸取500μL溶液至2 mL离心管中,涡旋震荡3 min,4 ℃、1300 r·min-1下离心 20 min, 上清液为PPO粗酶液。取200μL邻苯二酚 (10 mmol·L-1)至酶标板中,加入15μL粗酶液混匀,于室温反应30 min,测定反应前后398 nm处的吸光值,每变化0.01为1个酶活力单位。酶活力测定共进行3次生物学重复,设置5个技术重复。
1.4 PPO基因家族的鉴定和生物信息学分析
本研究中棉花PPO序列信息来源于南京农业大学公布的TM-1基因组和转录组数据库[18]。根据文献报道,从NCBI网站上下载马铃薯(Solanum tuberosum)[7]和蒲公英(Taraxacum officinale)[6]等物种的PPO氨基酸序列,以这些序列为参考序列进行HMM(Hidden Markov Model)建模(使用软件为HMMER3.1,http://hmmer.janelia.org/)在陆地棉TM-1数据库中搜索候选的PPO氨基酸序列。候选PPO序列使用软件InterPro(http://www.ebi.ac.uk/interpro)和 SMART(http://smart.embl-heidelberg.de/smart/)进行蛋白质结构域预测分析,包含酪氨酸酶、DWL和KFDV保守结构域的候选序列为本研究中所涉及的GhPPO。
GhPPO家族成员的等电点和相对分子质量预测软件为 ExPASy(http://web.expasy.org/compute_pi/);内含子预测 (基因结构分析)软件为GSDS2.0(http://gsds.cbi.pku.edu.cn/);氨基酸多重序列比对软件为DNAMAN;进化分析软件为MEGA6.0,选择马铃薯和蒲公英中的PPO成员,采用邻近法,设置1000次重复构建系统进化树。GhPPO基因的表达模式热图分析软件为Genesis。用已释放的表达谱数据分析了棉花中13个PPO基因在TM-1不同组织中的表达水平。
1.5 棉花RNA提取、反转录和实时荧光定量聚合酶链式反应(Polymerase chain reaction,PCR)
选择黄萎病菌V991处理12 h的根系样品,用液氮研磨至粉末状,进行总RNA提取。RNA提取使用北京艾德莱公司的ESAYspin Plus植物RNA快速提取试剂盒。取1μg棉花根系总RNA进行第一链cDNA合成,反转录试剂盒为日本东洋纺公司的ReverTra AceqPCRRT试剂盒。采用实时荧光定量PCR的方法检测陆地棉PPO家族基因的表达量,以棉花泛素蛋白基因UB7(Ubiquitin 7)为内参基因。引物设计软件为Primer Premier 5,引物序列见表1。实时荧光定量PCR扩增试剂为南京诺维赞公司的SYBRGreen Mater Mix试剂盒 (Q111-02),扩增仪器为ABI7500-Fast(购自应用生物系统公司,美国)。每个样品设置4次技术重复,反应后导出CT值,用
法计算目标基因的相对表达量。具体步骤参照试剂盒说明书。
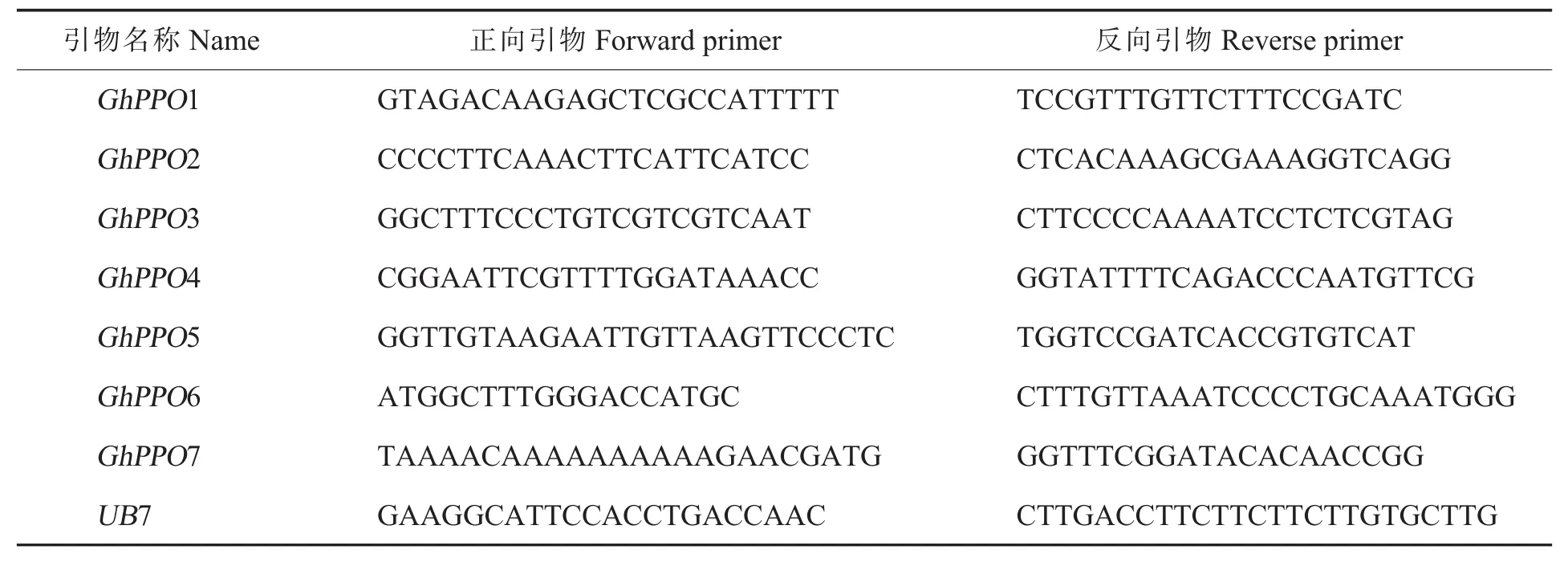
表1 所用引物序列Table 1 Primers used in this study
2 结果与分析
2.1 陆地棉中PPO基因的筛选
通过HMM在TM-1的基因组中共检索到13个可能编码PPO蛋白的候选基因,分别记为No.1~No.13。筛选到的13个GhPPO基因中有7个定位于6号染色体上,其余6个分别分布于第2、3、9和 12号染色体。GhPPO的编码序列(Coding sequence,CDS) 长度为 1587~1800 bp,编码528~599个氨基酸,相对分子质量为(60.55~68.34)×103,预测的等电点为 6.11~8.58。对GhPPO的CDS和基因组序列比对分析发现,陆地棉中13个GhPPO均不含内含子(表2)。
对13个GhPPO基因的核苷酸序列进行分析,发现其中12个GhPPO之间形成了共6对序列高度相似的重复基因 (Duplicated genes)。如GhA03G1718和GhD02G2150,CDS长度完全一致,仅存在少量单碱基差异。因此,将这2个基因分别命名为GhPPO1A (来源于A染色体组)和GhPPO1D(来源于D染色体组)。
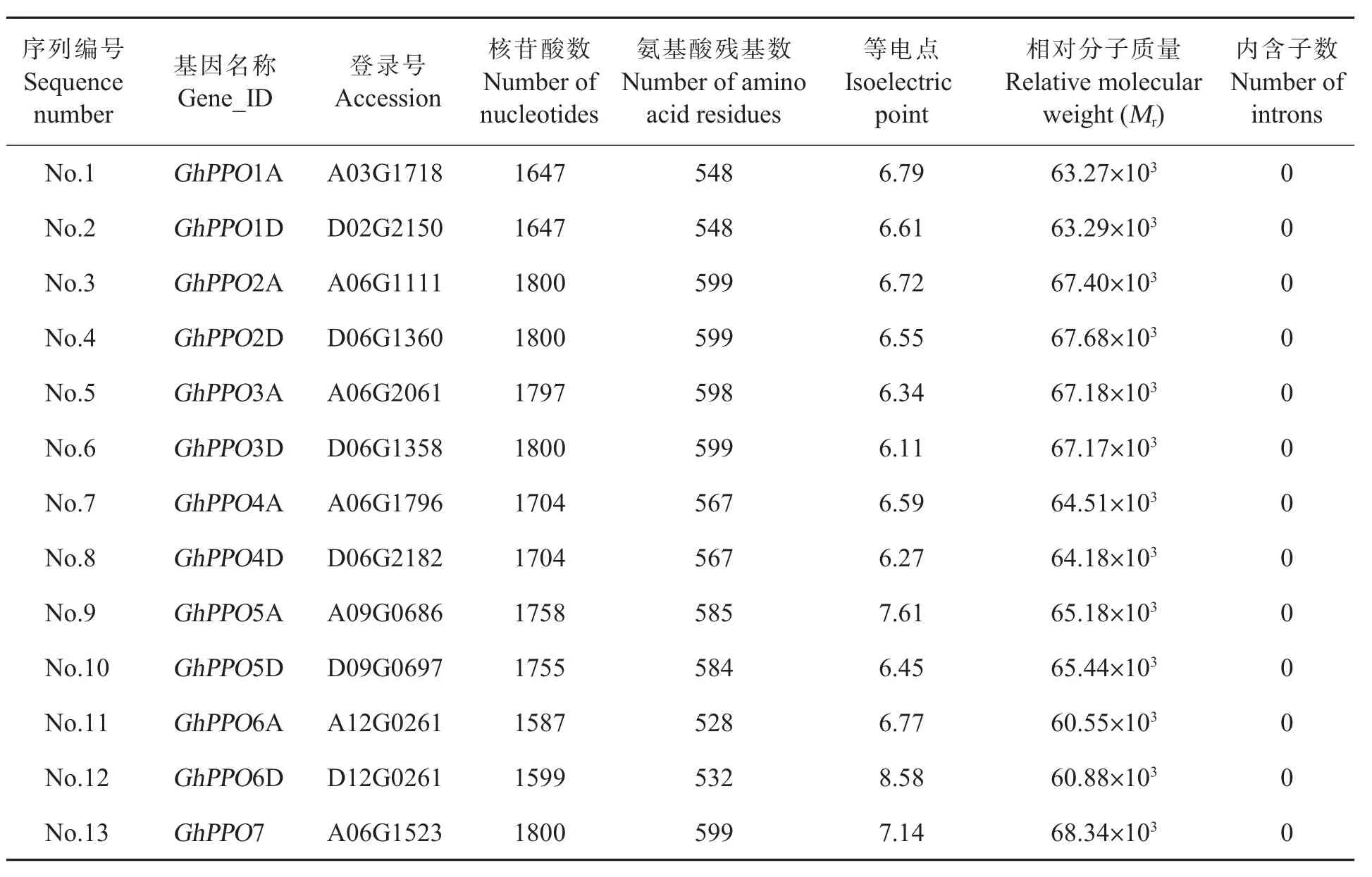
表2 陆地棉TM-1中预测的PPO基因Table 2 The putative PPO genes in G.hirsutum L.TM-1
2.2 GhPPO的氨基酸序列分析
用DNAMAN软件对所筛选得到的序列进行多重序列比对,发现TM-1中鉴定到的13个GhPPO都具有PPO_DWL、PPO_KFDV和酪氨酸酶3个结构域(图1)。其中酪氨酸酶结构域中包含2个铜离子结合位点CuA和CuB,这2个结合位点富含His残基,能与铜离子结合形成特定的三维结构,是PPO高度保守的活性中心[2]。
进化树分析显示,陆地棉GhPPO的种内相似性大于与马铃薯、蒲公英PPO的种间相似性(图 2)。在陆地棉的 13个 PPO成员中,GhP PO6A/D和GhPPO1A/D的进化关系较近;而Gh-PPO2A/D、GhPPO3A/D、GhPPO4A/D、GhPPO5A/D和GhPPO7的进化关系较近。其中GhPPO3A和GhPPO3D与已报道的棉铃虫取食诱导的陆地棉GhPPO1(GenBank 登录号:JQ345705)[15]相似性分别为97.66%和99.83%,据此认为GhPPO1和GhPPO3D是同一个基因。
2.3 GhPPO基因的组织表达模式分析
组织表达模式分析结果(图3-A)显示,在营养器官(根、茎和真叶)和生殖器官(花萼、花托、花瓣、雄蕊和雌蕊)8个组织中,GhPPO1D和Gh-PPO6D基因在7个组织中的表达丰度较高;同源基因 GhPPO3A、GhPPO3D和 GhPPO7在 3个组织中优势表达;GhPPO1A、GhPPO4A、GhPPO5A和GhPPO5D仅在1个组织中表达丰度稍高。
PPO基因也参与了棉花纤维发育的过程。分析GhPPO在棉纤维发育-3~25 DPA(Days post anthesis)的 RPKM(Reads per kilo bases per million reads)值显示:在13个GhPPO基因中,有9个的表达丰度一直较低,4个在纤维发育的不同时期呈现出较高的表达丰度。其中,GhPPO1D和GhPPO4D分别在10 DPA和20 DPA优势表达;GhPPO7从-3 DPA开始上调表达,在纤维发育的前期表达丰度较高,10 DPA之后下调;GhPPO6D与GhPPO7相反,在-3 DPA和-1 DPA的纤维中表达丰度较高,开花(0 DPA)之后迅速下降,而在纤维发育的中后期(10~25 DPA)上调表达(图 3-B)。

图1 陆地棉PPO 家族的氨基酸序列比对Fig. 1 Multiple sequence alignments of the cotton PPO family
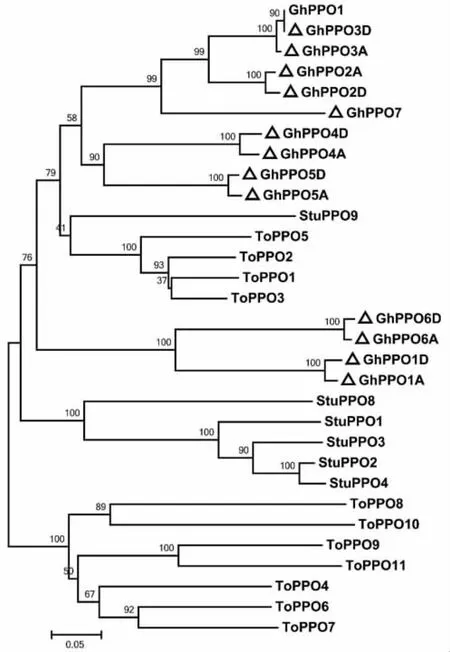
图2 陆地棉、马铃薯、蒲公英中PPO的进化分析Fig.2 Phylogenetic analysis of PPO in G.hirsutum,S.tuberosum and T.officinale
2.4 黄萎病菌侵染下陆地棉的PPO酶活力分析
如图4所示,对照组(Mock)在伤根处理后1 h时,根系PPO酶活力呈现出上升的趋势,处理6 h后下降,在随后的时间PPO酶活力维持在与0 h相似的水平。伤根接种黄萎病菌(V.dahliae)处理下PPO酶活力同样在1 h后上升,6 h时下降,在12 h时再次上升达到第2个PPO酶活力峰值,之后再次下降。12 h时对照组和伤根接种黄萎病菌处理的PPO酶活力差异达到了显著水平。
2.5 GhPPO在黄萎病菌诱导下的表达分析
由于序列之间的高度相似性,PCR技术不易分辨重复基因,所以本研究中扩增的为重复基因的总和。如图5所示,除GhPPO3A/D以外,其余基因均在棉花根系中被检测到。其中,GhPPO1A/D、GhPPO4A/D、GhPPO5A/D 和 GhPPO7在伤根处理对照组(Mock)和伤根接种黄萎病菌(V.dahliae)处理12 h后的陆地棉根系中表达水平没有显著差异。GhPPO2A/D在伤根接种处理后表达量显著下调,约为对照组的1/10。而根系中GhPPO6A/D的表达则被病原菌侵染激活,伤根接种黄萎病菌处理12 h时的GhPPO6A/D表达量升高至对照组的3倍。
3 讨论
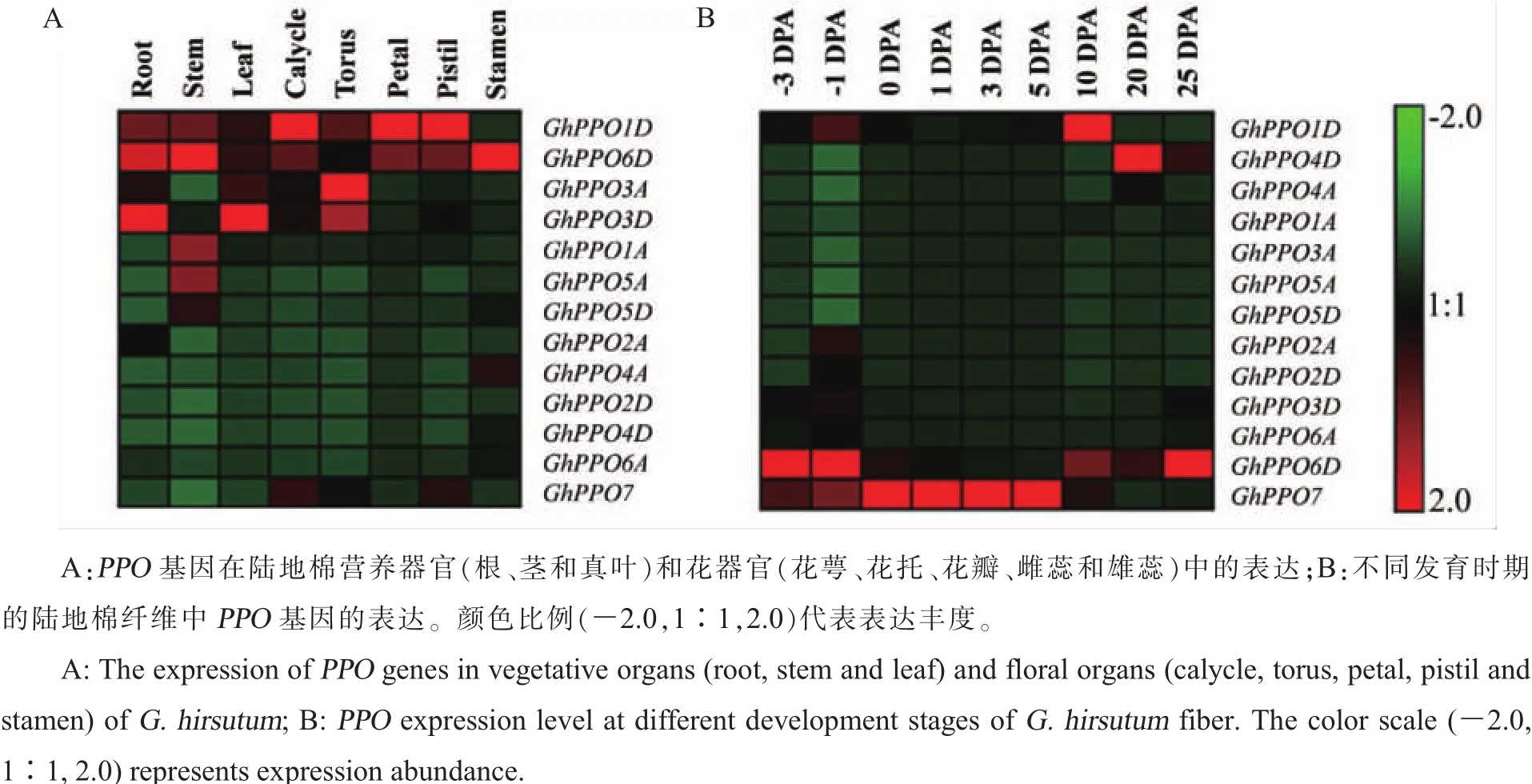
图3 PPO基因在陆地棉不同器官中的表达模式热图Fig.3 Expression heat map of PPO genes in different organs of G.hirsutum
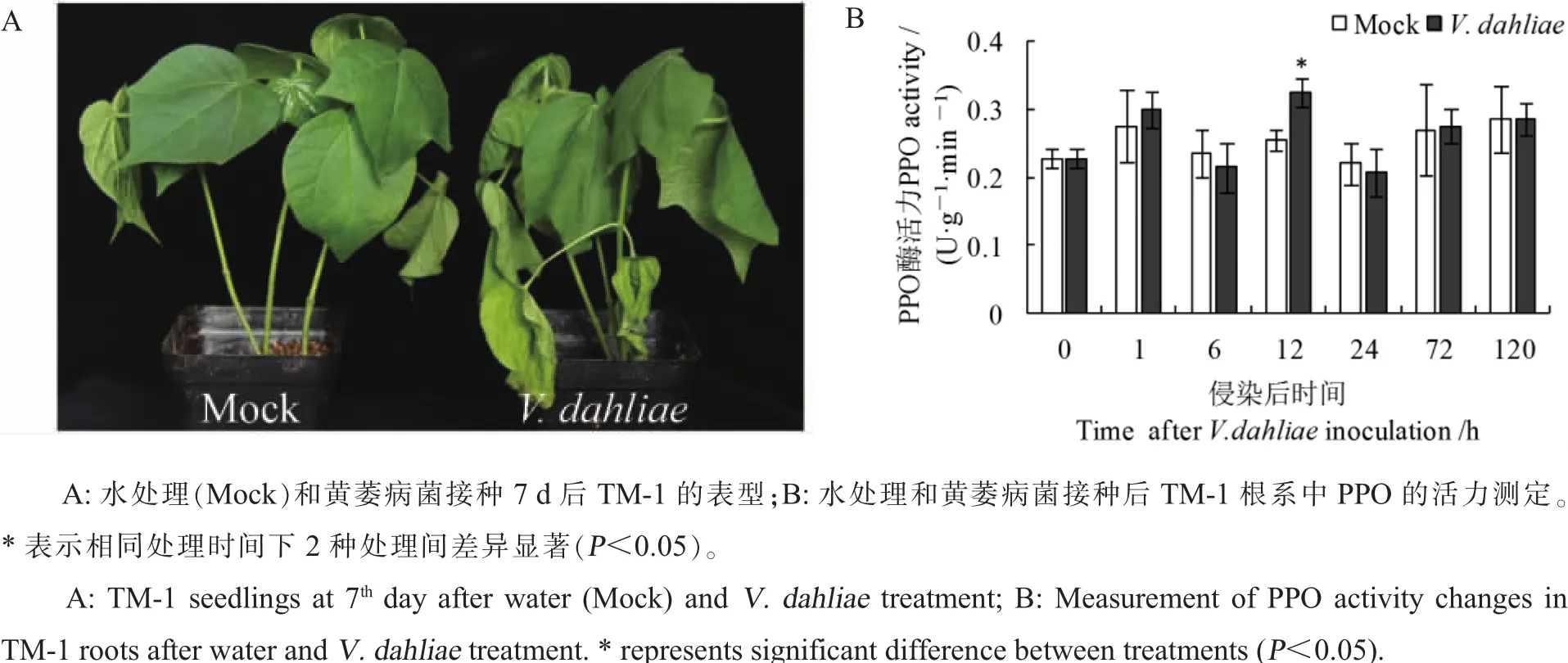
图4 黄萎病菌侵染对棉花根系PPO酶活力的影响Fig.4 The effect of V.dahliae infection on PPO activity in cotton roots and enzyme activity
PPO是1种重要的防御酶,参与了植物的花色形成、光合作用和抗病虫害的过程,并对其在各物种尤其是农作物中的作用等进行了深入的研究[2,19-21]。大量PPO基因的鉴定和功能分析,为农业生产和基因改良提供了可靠的理论基础和候选基因[12,22-24]。到目前为止,关于棉花中PPO在植物与病原菌、害虫之间互作的具体机制,已有部分报道。棉花的PPO被认为参与了抗枯萎病的过程,抗病品种的PPO酶活力略高于感病品种;病原菌侵染后,抗病品种中的PPO酶活力上升速率和幅度都显著高于感病品种[13]。本试验通过测定陆地棉根系中的PPO酶活力发现,对比伤根处理的对照组,伤根接种黄萎病菌处理下PPO的酶活力在处理后显著升高,表明PPO参与了棉花与黄萎病菌的互作过程。
植物中的PPO通常由多个基因编码,笔者以马铃薯、蒲公英等物种的PPO氨基酸序列为参照,从异源四倍体陆地棉TM-1基因组数据中共鉴定到了13个GhPPO成员。与其他物种相比,棉花PPO的数量相对较多,且有12个成员两两之间形成了6对高度相似的重复基因,这一现象可能是由于棉花基因组的大小和基因组内包含大量重复序列而造成的[18]。
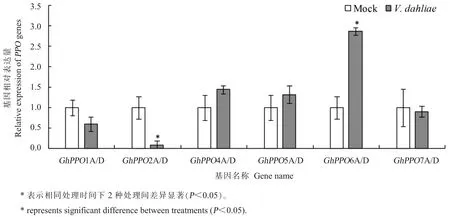
图5 V.dahliae处理12 h后陆地棉根系中PPO基因的表达变化Fig.5 Expression changes of PPO genes at 12 h after V.dahliae inoculation in upland cotton(G.hirsutum)roots
PPO的酶活力与基因数目之间没有明确的关系。但是在特定的条件下,PPO基因成员中可能存在优势表达的单个基因,通过对单个优势表达的PPO基因的调控能实现对植物PPO酶活力的调控[25]。如蒲公英中存在5个PPO基因,只有PPO-2受病原菌诱导,参与抗病的过程,且干涉PPO-2能显著降低蒲公英的抗病性[12]。本研究对棉花GhPPO基因成员的表达模式进行分析,发现13个GhPPO基因在棉花不同组织中的表达差异非常大,只有部分基因能在棉花组织中检测到。其中,GhPPO7仅在纤维发育-1~5 DPA有较高水平的表达,GhPPO7可能参与棉花纤维发育早期的过程;GhPPO6D在大部分组织中高量表达,如营养器官、花器官和纤维中,在正常情况下,GhPPO6D可能是棉花13个GhPPO成员中的优势表达基因。在黄萎病菌侵染的情况下,只有GhPPO2A/D和GhPPO6A/D出现了表达变化。GhPPO2A/D在根系中表达量很低,且在病原菌侵染后下调;相反,GhPPO6A/D受黄萎病菌诱导,表达量上调至对照的3倍。GhPPO6D在棉花根系中表达量较高,GhPPO6A在棉花不同组织中表达量都很低,因此在黄萎病菌处理下,棉花根系中的PPO酶活力上升可能是由GhPPO6D单个基因的表达量上升引起的,GhPPO6D可能参与了棉花与黄萎病菌互作的过程。但是GhPPO6D的具体功能以及GhPPO6D调控的PPO酶活力变化在棉花抗病中的作用还有待进一步研究。
4 结论
黄萎病菌侵染后陆地棉TM-1中根系的PPO酶活力上升。在TM-1基因组中鉴定到了13个PPO基因,其中GhPPO6D在各组织中表达量都较高,且受黄萎病菌诱导上调表达。推测GhPPO6D是陆地棉13个PPO基因中的优势表达基因,与黄萎病菌侵染下根系PPO的酶活力变化有关,可能参与了棉花与黄萎病菌的互作过程。
[1]Mayer A M,Harel E.Polyphenol oxidase in plants[J].Phytochemistry,1979,18:193-215.
[2]王曼玲,胡中立,周明全,等.植物多酚氧化酶的研究进展[J].植物学通报,2005,22(2):215-222.
Wang Manling,Hu Zhongli,Zhou Mingquan,et al.Advances in research of polyphenol oxidase in plants[J].Chinese Bulletin of Botany,2005,22(2):215-222.
[3]Kowalski SP,Eannetta N T,Hirzel A T,et al.Purification and characterization of polyphenoloxidase from glandular trichomes of Solanumberthaultii[J].Plant Physiology,1992,100(2):677-684.
[4]Felton G W,Donato K K,Broadway R M,et al.Impact of oxidized plant phenolics on the nutritional quality of dietar protein to a noctuid herbivore,Spodoptera exigua[J].Journal of Insect Physiology,1992,38(4):277-285.
[5]Bhonwong A,Stout M J,Attajarusit J,et al.Defensive role oftomato polyphenol oxidasesagainst cotton bollworm(Helicoverpaarmigera)and beet armyworm(Spodoptera exigua)[J].Journal of Chemical Ecology,2009,35(1):28-38.
[6]Dirks-Hofmeister M E,Singh R,Leufken C M,et al.Structural diversity in the dandelion(Taraxacum officinale)polyphenol oxidase family results in different responses to model substrates[J/OL].PLoSONE,2014,9(6):e99759[2016-12-01].http://dx.doi.org/10.1371/journal.pone.0099759.
[7]Chi Ming,Bhagwat B,Lane WD,et al.Reduced polyphenol oxidase gene expression and enzymatic browning in potato(Solanum tuberosum L.)with artificial microRNAs[J].BMC Plant Biology,2014,14:62.
[8]Li Li,Steffens J C.Overexpression of polyphenol oxidase in transgenic tomato plants results in enhanced bacterial disease resistance[J].Planta,2002,215(2):239-247.
[9]Thipyapong P,Hunt M D,Steffens JC.Antisense downregulation of polyphenol oxidase results in enhanced disease susceptibility[J].Planta,2004,220(1):105-117.
[10]Wang Jiehua,Peter C.Polyphenol oxidase overexpression in transgenic Populus enhances resistance to herbivory by forest tent caterpillar(Malacosoma disstria)[J].Planta,2004,220(1):87-96.
[11]Mahanil S,Attajarusit J,Stout M J,et al.Overexpression of tomato polyphenol oxidaseincreases resistanceto common cutworm[J].Plant Science,2008,174(4):456-466.
[12]Richter C,Dirks M E,Gronover C S,et al.Silencing and heterologous expression of PPO-2 indicate a specific function of a single polyphenol oxidase isoform in resistance of dandelion(Taraxacum officinale)against Pseudomonassyringae pv.tomato[J].Molecular Plant-Microbe Interactions,2012,25(2):200-210.
[13]宋凤鸣,郑重,葛秀春.枯萎病菌侵染后棉苗体内多酚氧化酶活性的变化[J].植物生理学通讯,1997,33(3):175-177.
Song Fengming,Zheng Zhong,Ge Xiuchun.Changes of polyphenol oxidase activity in cotton seedlings after infection by Fusarium oxysporun f.sp.vasinfectum[J].Plant Physiology Communications,1997,33(3):175-177.
[14]高丽锋,李彩霞,毛雪,等.棉花不同抗、感蚜虫品种的多酚氧化酶同工酶分析[J].山西农业大学学报,1997,17(3):229-231.
Gao Lifeng,Li Caixia,Mao Xue,et al.An analysis of polyphenol oxidase isozymes between resistant and susceptible cotton varietiesto cotton aphid[J].Journal of Shanxi Agricultural University,1997,17(3):229-231.
[15]朱香镇,麻巧迎,张帅,等.棉花多酚氧化酶基因GhPPO1的克隆及在棉铃虫取食诱导反应中的作用[J].中国农业科学,2014,47(16):3174-3183.
Zhu Xiangzhen,Ma Qiaoying,Zhang Shuai,et al.Cloning of a polyphenol oxidasegene(GhPPO1)of Gossypium hirsutum and itsrolein cotton after Helicoverpa armigera feeding[J].Scientia Agricultura Sinica,2014,47(16):3174-3183.
[16]Gao Wei,Long Lu,Xu Li,et al.Suppression of the homeobox gene HDTF1 enhances resistance to Verticillium dahliae and Botrytiscinerea in cotton[J].Journal of Integrative Plant Biology,2016,58(5):503-513.
[17]Sugumaran M,Nellaiappan K.Characterization of anew phenol oxidase inhibitor from the cuticle of Manduca sexta[J].Biochemical and Biophysical Research Communications,2000,268(2):379-383.
[18]Zhang Tianzhen,Hu Yan,Jiang Wenkai,et al.Sequencing of allotetraploid cotton (Gossypium hirsutum L.acc.TM-1)providesa resource for fiber improvement[J].Nature Biotechnology,2015,33:531-537.
[19]Mayer A M.Polyphenol oxidases in plants and fungi:Going places?A review[J].Phytochemistry,2006,67(21):2318-2331.
[20]Babu A N,Jogaiah S,Ito S,et al.Improvement of growth,fruit weight and early blight disease protection of tomato plants by rhizosphere bacteria iscorrelated with their beneficial traits and induced biosynthesis of antioxidant peroxidase and polyphenol oxidase[J].Plant Science,2015,231:62-73.
[21]Fuerst E P,Okubara PA,Anderson JV,et al.Polyphenol oxidase as abiochemical seed defensemechanism[J/OL].Frontiers in Plant Science,2014,5:689(2014-12-10)[2016-12-01].http://dx.doi.org/10.3389/fpls.2014.00689.
[22]Newman SM,Tantasawat P,Steffens JC.Tomato polyphenol oxidase B is spatially and temporally regulated during development and in response to ethylene[J].Molecules,2011,16(1):493-517.
[23]Jia Haifeng,Zhao Pengcheng,Wang Baoju,et al.Overexpression of polyphenol oxidase gene in strawberry fruit delays the fungus infection process[J].Plant Molecular Biology Reporter,2016,34(3):592-606.
[24]Llorente B,López M G,Carrari F,et al.Downregulation of polyphenol oxidase in potato tubers redirects phenylpropanoid metabolism enhancing chlorogenate content and late blight resistance[J].Molecular Breeding,2014,34(4):2049-2063.
[25]Thipyapong P,Stout M J,Attajarusit J.Functional analysis of polyphenol oxidases by antisense/sense technology[J].Molecules,2007,12(8):1569-1595. ●
Genome-Wide Identification of PPO Gene Family Members and Their Response to Verticillium dahliae in Upland Cotton
Zhang Hui,Tian Xinquan,Gao Wei,Cai Yingfan,Long Lu*
(School of Life Science,Henan University/State Key Laboratory of Cotton Biology/Henan Key Laboratory of Plant Stress Biology,Kaifeng,Henan 475004,China)
S562.035
A
1002-7807(2017)05-0428-09
10.11963/1002-7807.zhll.20170727
2016-12-01
张慧(1992-),女,硕士,zhanghui047@yeah.com。*通信作者:lulong1826@163.com
棉花生物学国家重点实验室开放课题(CB2015A31,CB2016A23)

