水稻OsDHHC13基因参与氧化胁迫响应的初步研究
刘选明�k王文文�k杨远柱�k夏妙林�k李夏�k左栋梁�k林建中


摘 要:DHHC型锌指蛋白参与细胞内蛋白质的棕榈酰化修饰,对细胞和个体的生长发育起着重要的调控作用.OsDHHC13是典型的DHHC型锌指蛋白基因.生物信息学分析发现,OsDHHC13的启动子区域含有胁迫及光响应元件,而且其编码蛋白是具有4个跨膜结构域的典型膜蛋白.对OsDHHC13过表达株系进行H2O2的氧化胁迫处理发现,过表达株系幼苗的根显著长于野生型,说明OsDHHC13能解除H2O2对根生长的抑制,提高了抗氧化胁迫的能力.随后H2O2含量测定发现,OsDHHC13过表达株系幼苗根部的H2O2含量显著低于野生型.进一步的qRTPCR分析发现,与清除H2O2相关的酶基因的转录水平在过表达株系中显著升高,说明OsDHHC13能促进清除H2O2的相关酶基因的表达,调节内源性H2O2的动态平衡.总之,本研究结果初步证明锌指蛋白基因OsDHHC13正调控水稻的抗氧化胁迫能力.
关键词: OsDHHC13基因;H2O2含量;根长;锌指蛋白
中图分类号:Q943 文献标识码:A
Abstract:DHHCtype zinc finger proteins are involved in the palmitoylated modification of intracellular proteins and play important roles in the growth and development of cells and individuals. OsDHHC13 is a typical DHHCtype zinc finger gene. Bioinformatics analysis showed that the OsDHHC13 promoter region contains some stress and light response elements, and its encoded protein is a typical membrane protein with four transmembrane domains. When the OsDHHC13 overexpressing lines were suffered from oxidative stress with H2O2, the roots of overexpressing seedlings were significantly longer than those of wildtype, indicating that OsDHHC13 can remove the inhibition of root growth by H2O2 and improve the ability of resistance to oxidative stress. Subsequently, analysis of H2O2 contents found that the H2O2 contents in the roots of overexpressing seedlings were markedly lower than that in wild type. qRTPCR analysis further revealed that the transcriptional levels of enzyme genes related to H2O2 elimination increased significantly, suggesting that OsDHHC13 can promote the expression of enzyme genes related to H2O2 elimination and regulate the homeostasis of endogenous H2O2 in plants. In a whole, present study preliminarily proved that the zinc finger protein gene OsDHHC13 positively regulates the ability of resistance to oxidative stress.
Key words:OsDHHC13 gene;H2O2 content;root length;zinc finger protein
DHHC型锌指蛋白是一类富含DHHC (AspHisHisCys) 型锌指结构域的蛋白质.DHHC型锌指结构域是一种富含半胱氨酸高度保守的锌指结构域,是一种常见的DNA结合结构单元.DHHC型锌指蛋白一般具有的通用结构,至少存在4段跨膜结构域、DHHCCRD结构域以及DPG功能元件[1].DHHC型锌指蛋白的主要功能是棕榈酰化其下游蛋白,从而影响其下游蛋白的定位、转运,最终影响其生理功能[2].DHHC型锌指蛋白的棕榈酰化是生物体一种常见的修饰方式,它包括3种方式[3-4],最主要是PAT介導的硫酰基转移,其次是硫酰基辅酶A介导的转移和以硫酰基辅酶A为辅酶的蛋白质介导转移.
以往对DHHC型锌指蛋白的研究主要集中在动物和酵母的研究.Pedram等[5]发现动物体内DHHC7与DHHC21蛋白能够作为新靶点选择性地抑制膜性类固醇受体定位并影响其功能.Fukata等[6]在人和鼠基因库筛选时,筛选出23个能够编码不同DHHC型蛋白的DHHC基因.在植物中DHHC基因的功能研究相对甚少,目前只有OsDHHC1,AtTIP1(TIP GROWTH DEFECTIVE1)和At5g04270这3个基因的功能是研究的比较清楚的.研究发现OsDHHC1基因主要与水稻株型构建及产量相关[7],AtTIP1主要影响拟南芥的根毛的生长[2].
活性氧ROS(Reactive oxygen species)是植物体内普遍存在的一种代谢产物,主要包括超氧根离子、过氧化氢和羟自由基等[8-10].在正常情况下细胞内ROS的产生与清除处于动态平衡中,ROS浓度相对比较低.但是当植物受到非生物胁迫时,植物体内这种动态平衡就会受到破坏,导致细胞内积累过多的ROS[11-12],从而影响植物的各种生理功能.其中H2O2是研究最多的ROS,研究发现过量的H2O2会对植物造成损伤,而适量的H2O2可作为细胞内一种信号分子,参与并调控植物的生长发育和对各种生物和非生物刺激的应答反应[13].近年的研究揭示, H2O2通过在信号传导途径的上游抑制或激活相关激酶的活性来启动或增强信号的作用从而影响植物的氧化胁迫反应、细胞凋亡、气孔的关闭、发育以及组织的形态建成[10,14-16].Ivanchenko等[17]发现H2O2能够影响西红柿根的发育,在IAA或H2O2处理下会导致dgt11突变体根部内源性H2O2增加,从而抑制西红柿根的发育.Zhang等[18]发现H2O2可作为信号分子介导OsRACK1基因调控水稻种子的萌发.
在本研究中,我们克隆了OsDHHC13基因,构建了该基因过表达的转基因株系,并对OsDHHC13过表达株系的H2O2胁迫响应进行了初步研究,发现锌指蛋白OsDHHC13正调控水稻的抗氧化胁迫响应.
1 材料与方法
1.1 实验材料
粳稻品种日本晴用于OsDHHC13基因的克隆和组织特异性表达分析.粳稻品种Kitaake用于作为转化受体,其转基因植株用于后续的分子及表型分析.
1.2 实验方法
1.2.1 生物信息学分析
OsDHHC13基因全长CDS序列与氨基酸序列通过TIGR(http://tigrblast.tigr.org/tgi, RiceGenome Annotation Project)和NCBI(http://www.ncbi.nlm.nih. gov, National Center for Biotechnology information)数据库获得.利用植物启动子顺式作用元件分析网站plantCARE (http://bioinformatics.psb.ugent.be/ webtools/ plantcare/html/) 对OsDHHC13基因启动子进行分析.采用丹麦科技大学生物序列分析中心(CBS)的蛋白跨膜结构域预测程序TMHMM (http://www.cbs.dtu.dk/services/TMHMM/) 进行跨膜结构域预测.
1.2.2 载体构建与水稻转化
利用Premier 5.0软件设计克隆正向引物5CCCAAGCTTATGCTCTTCGTCATATGTGG TG3(下划线为HindⅢ酶切位点) 和反向引物5CGGGATCCAAGAAGTTTTGAAC TCGAAT TGTC3 (下划线为BamHⅠ酶切位点),然后以日本晴的cDNA为模板,用prime STAR 高保真酶(TaKaRa),通过PCR反应获得目的片段.PCR反应条件为:98 ℃,5 min;98℃,10 s;56 ℃,15 s;72 ℃,1 min ;共35个循环.然后将PCR产物连接至pGEMT Easy Vector (Promega),送至铂尚生物技术公司测序.最后将测序正确的OsDHHC13的CDS片段通过酶切连接到pHB载体[19].在pHBOsDHHC13载体中,目标基因OsDHHC13由2×35S启动子驱动表达,植物中的筛选标记基因为潮霉素抗性基因Hpt (主要用于转化过程的抗性愈伤组织筛选)和除草剂Basta抗性基因bar (主要用于苗期筛选).
根据林建中等[20-21]的水稻转化方法,将重组的质粒pHBOsDHHC13经电击法转入农杆菌,通过农杆菌侵染水稻粳稻品种Kitaake的愈伤组织以获取过表达转基因株系.
1.2.3 转基因水稻的鉴定及实时定量PCR(qRTPCR)分析
采用经典的CTAB(十六烷基三甲基溴化铵)法[ 20]从再生的转基因水稻株系中提取DNA.然后以特异性引物(F: 5ATCTCGTGCTTTCAGCTTCG3; R: 5ACATCGCCTCGCTCCAGT3)进行PCR鉴定TDNA区域的潮霉素抗性基因Hpt.同时,采用Trizol试剂盒(Invitrogen)提取各转基因株系叶片的总RNA,然后再利用Maxima First Strand cDNA Synthesis Kit 试剂盒(TaKaRa)逆转录成cDNA, 并以此为模板进行qRTPCR鉴定OsDHHC13的转录水平.PCR反应程序为:95 ℃,2 min;95 ℃,10 min;95 ℃,30 s;55 ℃,30 s;72 ℃,30 s;45个循环.重复3次,以持家基因OsActin1为内参,然后使用Mx3000P软件对相关基因的相对表达水平进行分析(qRTPCR引物见表1).未转化的Kitaake野生型(WT)作为对照.
为了检测OsDHHC13的表达对H2O2的响应,将野生型Kitaake幼苗水培培养至三叶期,然后用5 mmol/L的H2O2分别处理幼苗1 h, 3 h, 6 h, 9 h, 12 h和24 h,选取水稻幼苗根部用于提取总RNA并逆转录为cDNA.采用qRTPCR鉴定OsDHHC13在H2O2处理的不同时间点的转录水平.另外,提取营养生长期(20 d的幼苗)和生殖生长期(抽穗期)野生型的各组织器官的总RNA并逆转录为cDNA, 然后采用qRTPCR分析OsDHHC13在水稻不同生长时期和不同组织器官中的转录水平.
为了检测转基因株系中与H2O2清除相关的基因OsCATb,OsSOD1,OsAPX1和OsAPX2的转录水平[14-17],将转基因株系和野生型幼苗水培培养至三叶期,然后用5 mmol/L的H2O2处理幼苗12 h,然后提取幼苗总RNA并逆转录为cDNA.采用qRTPCR鉴定4个基因的转录水平(qRTPCR引物见表1).
1.2.4 水稻幼苗的处理及根长的测定
挑选OsDHHC13转基因株系及野生型的饱满种子,用10% NaClO消毒30 min,再用去离子水(ddH2O)漂洗4~5次,然后放置于室溫吸胀处理48 h,接着转移至28 ℃恒温培养箱催芽48 h.待种子露白后,再转入添加和未添加H2O2(5 mmol/L)的1/2 MS培养液的试管里.种子用棉花作为支撑让其位于试管上部,置于恒温培养室(28 ℃,光照16 h/黑暗8 h)培养10 d.然后观察幼苗表型,并测量和统计根长.
1.2.5 水稻根部H2O2含量的测定
将水培至三叶期的OsDHHC13转基因株系及野生型幼苗用浓度为5 mmol /L H2O2处理5 d,然后用碧云天生物技术公司的H2O2检测试剂盒提取并测定水稻根部H2O2含量.
2 结 果
2.1 OsDHHC13基因启动子调控元件分析
通过相关网站(http://www.ncbi.nlm.nih.gov/)的sequence viewer工具找到OsDHHC13基因起始密码子上游1 500 bp的片段,然后把这段核苷酸序列输入植物专用的启动子分析网站在线分析工具中,对OsDHHC13基因上游启动子进行预测分析(如图1所示).结果发现,OsDHHC13基因启动子存在大量的AEbox,Box 4,Gbox和Ibox等光响应元件,同时也存在一些与激素相关的AuxRRcore和Pbox等元件.有趣的是,在启动子区域还发现了TCrich repeats和 MBS等与抗旱以及胁迫响应密切相关的元件.该分析结果表明,OsDHHC13基因可能被光信号、激素以及其他非生物胁迫诱导表达,并且其编码蛋白有可能参与植物的光信号转导、激素转导以及非生物胁迫响应.
2.2 OsDHHC13蛋白的跨膜结构域预测
将OsDHHC13的氨基酸全长序列输入跨膜结构域预测程序TMHMM (http://www.cbs.dtu.dk/ services/TMHMM/),结果显示OsDHHC13蛋白可能存在4个跨膜结构域(图2).在跨膜结构域的预测结果中,其跨膜分值越高,则表明该段序列跨膜的可能性越大.在OsDHHC13可能存在的4个跨膜结构域中,3个分值较高,而另1个分值则稍低,但是其分值仍大于0.8.因此,该结果表明,OsDHHC13可能是一个具有4个跨膜结构域的典型膜蛋白.(图中断裂双线表示该段氨基酸序列处于质膜的胞外侧;断裂单线表示该段氨基酸序列处于质膜的胞质侧; 连续线表示该段氨基酸序列为跨膜结构域)
2.3 OsDHHC13基因的克隆与转基因植株的鉴定
通过NCBI以及TIGR等数据库查找到OsDHHC13的基因组序列及其CDS序列,利用特异性的克隆引物,从水稻品种日本晴的cDNA中克隆了OsDHHC13的CDS序列(如图3(a)所示).通过酶切连接的方式将OsDHHC13连接至终载体pHB.最后转入农杆菌浸染水稻愈伤组织,再经组织培养及田间栽培后,共收获8个独立的OsDHHC13过表达转基因株系的种子.随后,对T1代幼苗分别进行了DNA与RNA水平的鉴定(如图3(b)(c)所示).从图3(b)可以看出,8个转基因株系均能检测到潮霉素抗性基因hpt,说明TDNA已经成功整合到转基因株系的基因组中.OsDHHC13的转录水平检测发现,5个株系中的转录水平显著高于野生型(WT; 图3(c)),说明OsDHHC13已成功过表达于转基因株系.随后我们选取了3个过表达株系:35S::OsDHHC139,35S::OsDHHC1312和35S::OsDHHC1319的T2代纯合子用于后续的表型鉴定.
2.4 OsDHHC13基因的时空表达分析
基因的时空表达模式可为预测和研究其生物学功能提供参考依据.于是,我们采用qRTPCR方法分析了营养生长期和生殖生长期OsDHHC13在水稻不同组织器官中的相对表达量(如图4所示).结果发现,在营养生长的苗期OsDHHC13在根、茎和叶中均有表达,尤其在叶片中的表达量相对较高,而根中的相对较低(如图4(a)所示).在生殖生长的抽穗期,OsDHHC13在各组织器官中均有表达,其中叶片中的表达量最高,根中的表达量仅次于叶片,而节间的表达量最低(如图4(b)所示).
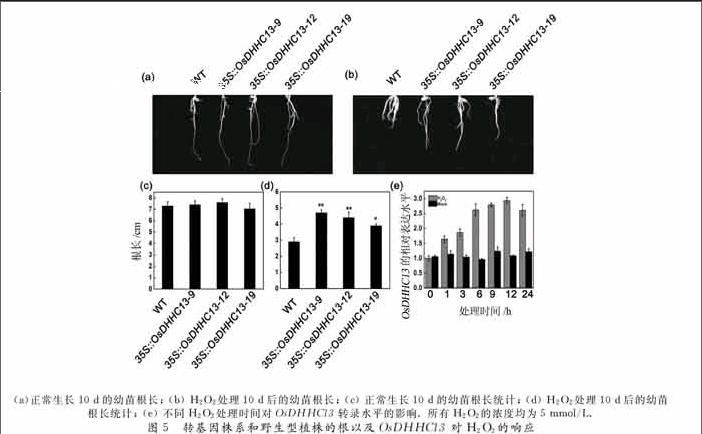
2.5 OsDHHC13转基因株系对H2O2的响应
启动子分析发现,OsDHHC13基因的启动子存在TCrich repeats和 MBS等与抗旱以及胁迫响应密切相关的元件(如图1所示), 说明该基因可能参与了非生物胁迫响应.为了验证该假设,我们用5 mmol/L的H2O2处理刚发芽的OsDHHC13转基因株系种子10 d,然后观察表型并统计根长.结果发现,在正常水培条件(未含H2O2)下转基因株系的根长与野生型没有差别(如图5(a)(c)所示),而在H2O2处理条件下转基因株系的根显著长于野生型(如图5(b)(d)所示).该结果说明,OsDHHC13转基因植株提高了对H2O2胁迫的抗性,锌指蛋白OsDHHC13可能正调控植物的抗氧化胁迫.随后,我们检测了H2O2对野生型幼苗根部OsDHHC13转录水平的影响,发现OsDHHC13的转录水平随着H2O2处理时间的延长而升高,在12 h时达到最大值,随后稍有下降(如图5(e)所示).该结果说明H2O2能够诱导OsDHHC13基因的表达,意味着OsDHHC13基因可能参与胁迫条件下水稻根部生长和发育的调控.
2.6 根部内源性H2O2含量变化及相关基因测定
为了进一步探究在外源性H2O2处理下OsDHHC13基因如何影响水稻幼苗根部生长与发育,我们进一步对幼苗根部内源性H2O2含量进行了测定.如图6(a)所示,当OsDHHC13转基因株系幼苗经5 mmol /L H2O2处理5 d后,其水稻根部H2O2含量比野生型显著降低,而在未经H2O2处理的幼苗根中转基因株系与野生型间没有明显的差别.该结果说明,OsDHHC13可能正调控氧化胁迫条件下体内H2O2的降解,从而解除氧化胁迫对植株的伤害.
为了进一步验证以上推測,我们检测了5 mmol/L H2O2处理12 h的转基因株系幼苗中与H2O2清除相关的酶基因OsCATB,OsSOD1,OsAPX1和OsAPX2等的转录水平(如图6所示).结果发现,在正常条件下OsCATB,OsSOD1,OsAPX1和OsAPX2等4个酶基因的转录水平在转基因株系和野生型(WT)间没有明显差异,但是在H2O2处理条件下转基因株系中4个酶基因的转录水平显著高于野生型(如图6(b)~(e)所示).该结果表明,在氧化胁迫条件下OsDHHC13确实能促进清除H2O2的相关酶基因表达,从而调节内源性H2O2含量的动态平衡,最终解除H2O2对根的生长与发育的抑制.
3 討 论
DHHC蛋白是一类典型的膜蛋白,一般具有多段跨膜结构域,包含了DHHCCRD结构域.它的主要功能是棕榈酰化其下游蛋白,从而影响其转运与定位,最终调控植物的各种生理功能[2].通过生物信息学的预测发现,OsDHHC13蛋白具有4段跨膜结构域(如图1所示),并且发现其启动子含有多个与光调控、激素和胁迫响应相关的元件(如图2所示),为研究该基因与激素、光调控相关功能提供了重要线索.
通过对基因在植物不同组织器官中的表达分析,可以对该基因的功能进行预测[22].我们对OsDHHC13在水稻不同时期和不同组织器官的表达特异性进行了分析,发现OsDHHC13主要在水稻叶片、根以及茎表达(如图4所示),暗示该基因可能参与水稻根、茎和叶的生长与发育调控.随后,通过H2O2处理发现转基因株系的根要显著长于野生型,相反正常条件下的根长则没有明显变化,说明该基因参与逆境下根的生长与发育调控.同时,我们发现转基因株系与野生型间在叶片形态及株高等方面没有明显变化(结果未列出),因此OsDHHC13在叶和茎中的功能还有待进一步研究.
ROS的稳态在植物中发挥重要功能[13].H2O2是最主要的一种ROS,在植物中参与信号转导、植物的生长发育以及非生物胁迫响应的作用[22-23].H2O2在植物抗病反应中的作用已经得到了广泛的研究, 而在非生物胁迫条件下,同样扮演了关键的调控作用, 参与多种生理生化过程, 包括光合作用、光呼吸、气孔运动与细胞程序性死亡等.前人已有活性氧代谢以及H2O2信号转导方面的综述报道[24].Ivanchenko等[17]发现H2O2积累能够抑制西红柿根部的生长与发育,但具体机制尚不清楚.本研究通过H2O2处理野生型与转基因幼苗,发现转基因株系根显著长于野生型(如图5所示).通过测定根部H2O2含量以及与H2O2清除相关的酶基因表达分析,过表达株系H2O2含量以及相关基因表达量显著高于野生型(如图6所示).这些结果说明,在氧化胁迫等逆境下OsDHHC13确实能促进清除H2O2的相关酶基因表达,从而解除H2O2对根的生长与发育的抑制.至于作为锌指蛋白的OsDHHC13如何棕榈酰化其下游蛋白,最终如何调控水稻根部H2O2的动态平衡的分子机制尚且未知,还有待进一步研究.
综上所述,本研究初步发现,水稻锌指蛋白基因OsDHHC13能促进清除H2O2的相关酶基因表达,调节内源性H2O2的动态平衡,从而正调控水稻的抗氧化胁迫能力.
参考文献
[1] MITCHELL D A, VASUDEVAN A, LINDER M E, et al. Thematic review series: lipid posttranslational modifications. Protein palmitoylation by a family of DHHC protein Sacyltransferases [J]. Journal of Lipid Research, 2006, 47(6): 1118-1127.
[2] HEMSLEY P A, KEMP A C, GRIERSON C S. The TIP GROWTH DEFECTIVE1 Sacyl transferase regulates plant cell growth in Arabidopsis[J]. Plant Cell, 2005, 17(9): 2554-2563.
[3] RESH M D. Use of analogs and inhibitors to study the functional significance of protein palmitoylation[J]. Methods, 2006, 40(2): 191-197.
[4] GREAVES J, CHAMBERLAIN L H. Sacylation by the DHHC protein family[J]. Biochemical Society Transactions, 2010, 38(2): 522-524.
[5] PEDRAM A, RAZANDI M, DESCHENES R J, et al. DHHC7 and21 are palmitoylacyltransferases for sex steroid receptors[J]. Molecular Biology of the Cell, 2012, 23(1): 188-199.
[6] FUKATA Y, IWANAGA T, FUKATA M. Systematic screening for palmitoyl transferase activity of the DHHC protein family in mammalian cells[J]. Methods, 2006, 40(2): 177-182.
[7] ZHOU B, LIN J Z, PENG D, et al. Plant architecture and grain yield are regulated by the novel DHHCtype zinc finger protein genes in rice (Oryza sativa L.)[J]. Plant Science, 2016.
[8] INZ D, VAN MONTAGU M. Oxidative stress in plants[J]. Current Opinion in Biotechnology, 1995, 6(2): 153-158.
[9] DAT J, VANDENABEELE S, VRANOV E, et al. Dual action of the active oxygen species during plant stress responses[J]. Cellular and Molecular Life Sciences CMLS, 2000, 57(5): 779-795.
[10]HALLIWELL B. Redox biology is a fundamental theme of aerobic life [J]. Plant Physiol, 2006, 141(8): 312-322.
[11]SONG X H, WANG K, GUO L L, et al. Effects of catalase and ascorbate peroxidase on the root growth of rice under cadmium stress[J]. Agricultural Science & Technology, 2011, 12(9): 1256-1259.
[12]JIANG S J, YU H, ZHANG G Q, et al. Research on oxidative stress induced by tenuazonic acid from Alternaria augustiovoide and changes in antioxidant enzyme activities in leaves of Echinochloa crusgalli[J]. Agricultural Science & Technology, 2011, 12(6): 792-794.
[13]DRGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1): 47-95.
[14]GAPPER C, DOLAN L. Control of plant development by reactive oxygen species[J]. Plant Physiology, 2006, 141(2): 341-345.
[15]GECHEV T S, HILLE J. Hydrogen peroxide as a signal controlling plant programmed cell death[J]. The Journal of Cell Biology, 2005, 168(1): 17-20.
[16]MITTLER R, VANDERAUWERA S, GOLLERY M, et al. Reactive oxygen gene network of plants[J]. Trends in Plant Science, 2004, 9(10): 490-498.
[17]IVANCHENKO M G, OS D D, MONSHAUSEN G B, et al. Auxin increases the hydrogen peroxide (H2O2) concentration in tomato (Solanum lycopersicum) root tips while inhibiting root growth[J]. Annals of Botany, 2013, 112(6): 1107-1116.
[18]ZHANG D, CHEN L, LI D, et al. OsRACK1 is involved in abscisic acidand H2O2mediated signaling to regulate seed germination in rice (Oryza sativa, L.)[J]. Plos One, 2014, 9(5): e97120.
[19]REN Z H, GAO J P, LI L G, et al. A rice quantitative trait locus for salt tolerance encodes a sodium transporter[J]. Nature Genetics, 2005, 37(10): 1141-1146.
[20]LIN J Z, ZHOU B, YANG Y Z, et al. Piercing and vacuum infiltration of the mature embryo: a simplified method for agrobacterium mediated transformation of Indica rice [J]. Plant Cell Reports, 2009, 28: 1065-1074.
[21]林建中, 楊远柱, 周波, 等. 一种简单高效的水稻体细胞诱变育种新方法[J]. 湖南大学学报: 自然科学版, 2013, 40(9): 79-85.LIN J Z, YANG Y Z, ZHOU B, et al. A simple and effective novel somatic mutagenesis breeding method for rice[J]. Journal of Hunan University: Natural Sciences, 2013, 40(9): 79-85.(In Chinese)
[22]ZHANG Y K, ZHU D F, ZHANG Y P, et al. Low pHinduced changes of antioxidant enzyme and ATPase activities in the roots of rice (Oryza sativa L.) seedlings[J]. Plos One, 2015, 10(2): e0116971.
[23]MILLER G, SUZUKI N, CIFTCIYILMAZ S, et al. Reactive oxygen species homeostasis and signaling during drought and salinity stresses [J]. Plant Cell and Environment, 2010, 33(4): 453-467.
[24]CHENG Y, SONG C. Hydrogen peroxide homeostasis and signaling in plant cells[J]. Science in China, Series C: Life Sciences, 2006, 49(1): 1-11.

