PARP-1蛋白抑制剂降低TNF-α介导的人心肌细胞生长抑制和凋亡
谢月群,王蕾,陈玲珑,徐颖,杨之涛,卢中秋
(1.温州医科大学第三临床学院 温州市人民医院 急诊科,浙江 温州 325000;2.上海交通大学医学院附属瑞金医院 急诊科,上海 200025;3.温州医科大学附属第一医院 急诊医学中心,浙江 温州325015)
PARP-1蛋白抑制剂降低TNF-α介导的人心肌细胞生长抑制和凋亡
谢月群1,王蕾1,陈玲珑1,徐颖1,杨之涛2,卢中秋3
(1.温州医科大学第三临床学院 温州市人民医院 急诊科,浙江 温州 325000;2.上海交通大学医学院附属瑞金医院 急诊科,上海 200025;3.温州医科大学附属第一医院 急诊医学中心,浙江 温州325015)
目的:研究PARP-1蛋白抑制剂对由肿瘤坏死因子α(TNF-α)介导的人心肌细胞生长抑制和凋亡的干预作用。方法:MTT比色法检测TNF-α抑制人心肌细胞HCM细胞株生长的IC50浓度,以及PARP-1蛋白抑制剂干预对HCM细胞生长抑制率的影响;流式细胞术检测TNF-α和PARP-1蛋白抑制剂对HCM细胞的细胞凋亡比率的影响;RT-PCR和Western blot分析PARP-1蛋白抑制剂干预对PARP-1基因的mRNA和蛋白水平表达影响。结果:TNF-α对HCM细胞具有明显细胞增殖抑制和细胞凋亡诱导作用,并且上调PARP-1基因mRNA水平,促进PARP-1蛋白裂解(P<0.05);PARP-1蛋白抑制剂干预后,TNF-α对HCM细胞的生长抑制和诱导细胞凋亡作用均减弱(P<0.05),PARP-1基因表达下调(P<0.05),PARP-1蛋白和其裂解产物与对照组比较差异无统计学意义(P>0.05)。结论:通过PARP-1蛋白抑制剂阻断PARP-1蛋白活性和基因的转录水平可以减弱TNF-α对HCM的细胞生长抑制和细胞凋亡诱导作用。
肿瘤坏死因子α;肌细胞,心脏;PARP-1蛋白抑制剂;细胞凋亡
Abstract: Objective:To study the effect of PARP-1 inhibitor (4-Aminonaphthalimide) on the apoptosis of human cardiomyocytes mediated by TNF-α.Methods:MTT assays were used to detect the IC50concentration of TNF-α on human cardiomyocytes cell line HCM, this assays were also performed to analyze the effect of the treatment with IC50concentration of TNF-α combined with different concentration of PARP-1 inhibitor on proliferation of the HCM cells. Flow cytometry was used to monitor the apoptosis of HCM cells treated with different concentrations of TNF-α with or without PARP-1 inhibitors; RT-PCR and Western blot were used to analyze the expression level of PARP-1 in HCM cells after treated with different concentration of TNF-α with or without PARP-1 inhibitor.Results:TNF-α could perform the inhibitory effect of proliferation and induced the apoptosis of HCM cells, TNF-α also induced the degradation of PARP-1 protein and up-regulated expression ofPAPR-1gene in HCM cells (P<0.05); The inhibit effect of proliferation and the apoptosis rate of HCM cells induced by TNF-α was decreased after the intervention of PARP-1 inhibitors (P<0.05). The mRNA expression level ofPARP-1gene was down-regulated and the difference between the intervention group and the control group was not significantly in protein level.Conclusion:The effect of cells growth inhibition and apoptosis induced by TNF-α on HCM can be attenuated by blocking the activity of PARP-1 protein and gene transcription.
Key words:tumor necrosis factor-α; myocytes, cardiac; PARP-1 inhibitor; apoptosis
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作为一种关键的调节因子参与炎症反应,除了通过与其受体结合启动炎症免疫应答,还可以作为独立因素参与心肌损伤[1]。在心脏组织中多种损伤和炎症均可促进心肌细胞产生TNF-α,如心肌梗死、缺血再灌注和慢性心衰等[2-3]。聚腺苷酸二磷酸核糖转移酶-1[poly(ADP-ribose)polymerase-1,PARP-1]催化将NAD+中的多聚ADP核糖转移至DNA或蛋白受体中,这种翻译后修饰参与了包括DNA损伤修复、DNA复制和基因表达调控等多种细胞过程[4-6]。有研究[7]证实PARP的过度活化可能导致细胞内存储的NAD+衰竭,从而诱导细胞死亡。因此,本研究通过体外实验研究PARP-1蛋白抑制剂干预TNF-α对人心肌细胞的生长抑制和细胞凋亡的诱导作用,为进一步探讨TNF-α诱导心肌细胞凋亡的机制和信号途径奠定实验基础。
1 材料和方法
1.1 材料 人心肌细胞HCM细胞株购于南京凯基生物科技有限公司;重组TNF-α购于北京义翘神州生物科技有限公司;兔抗人PARP-1多克隆抗体(ab32064)和PARP-1蛋白抑制剂(4-Aminonaph-thalimide,ab144620)购于美国Abcam公司;兔抗人β-actin多克隆抗体、HRP标记的羊抗兔IgG多克隆抗体、预染蛋白Marker、eECL试剂盒和Trizol试剂购于北京康为世纪生物科技有限公司;2×Taq PCR Mastermix、反转录试剂盒FastQuant RT Kit(With gDNase)、DNA Marker和BCA蛋白定量试剂盒购于北京天根生化科技有限公司;MTT、DMEM培养基购于北京索莱宝生物科技有限公司;胎牛血清购于杭州四季青生物工程材料有限公司;细胞凋亡试剂盒购于美国BD公司。
1.2 方法
1.2.1 MTT法检测细胞抑制率:取对数生长期HCM细胞,用胰蛋白酶消化后用含10%胎牛血清的DMEM培养基悬浮,调节细胞浓度至1×107个细胞/mL,取200 μL铺种至96孔板,待贴壁后处理组加入不同浓度的TNF-α,干预组加入TNF-α的同时加入PARP-1抑制剂,对照组(即TNF-α浓度为0时)加入同体积的0.9%氯化钠溶液,继续培育24 h后加入20 μL MTT溶液,继续培育4 h后去上清并加入150 μL DMSO,
充分混匀后用酶标仪于492 nm处测吸光度,计算各组细胞的生长抑制率。
1.2.2 流式细胞仪检测PARP-1抑制剂干预后TNF-α对HCM细胞凋亡的影响:取对数生长期的HCM细胞,铺种至6孔板,待贴壁后处理组加入不同浓度的TNF-α,干预组分别加入不同浓度的TNF-α和PARP-1抑制剂,继续培育24 h后消化并悬浮细胞,按照细胞凋亡试剂盒说明书加入FITC-Annexin V和PI染料,避光孵育后用贝克曼流式细胞仪上机检测。
1.2.3 RT-PCR检测PARP-1基因表达:细胞处理方法同上述实验,继续培育24 h后收集细胞并用PBS清洗2次,加入1 mL的Trizol试剂充分混匀,按照产品说明书进行RNA抽提,用无RNA酶水溶解后用核酸蛋白测定仪检测RNA溶液的OD260/OD280以及OD260/OD230比值和RNA浓度,取等量的RNA溶液进行反转录反应;反转录完成后用2×Taq PCR Mastermix配置PCR反应液,并加入等体积的cDNA后进行扩增。内参β-actin基因的引物序列为:β-actin-F:5’-GCAC TCTTCCAGCCTTCCTT-3’,β-actin-R:5’-AGGTCTTTGCG GATGTCCA-3’,PARP-1基因的引物序列为:PARP-1-F:5’-AGCCTTCAGGAGTTGTTCTTAG-3’,PARP-1-R:5’-GAGTG TTCCAGTCCAGAATCA-3’。扩增完成后用2%的琼脂糖凝胶进行电泳分离,凝胶成像系统拍照后用Image J软件对电泳条带进行灰度值分析,并计算目的基因的相对表达量。
1.2.4 Western blot检测PARP-1蛋白的表达:细胞铺种和药物处理如同上述MTT实验步骤,药物处理0、6、12、18、24、32 h后加收集细胞并加入细胞裂解液进行总蛋白提取,通过BCA法测定总蛋白后取等量蛋白进行SDS-PAGE凝胶电泳、半干法转膜、封闭,按照抗体说明书进行比例稀释一抗并于4 ℃孵育过夜,清洗后加入HRP标记的二抗室温孵育2 h,清洗后用eECL试剂孵育醋酸纤维素膜,暗室中进行曝光显影。
1.3 统计学处理方法 采用GraphPad prism 5软件进行统计学分析和绘图。结果以 ±s表示,各组间比较采用单因素方差分析和t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞抑制率 MTT实验结果显示TNF-α可以抑制HCM细胞的生长,并呈浓度依赖性,其IC50浓度经Graphpad prism 5软件计算为235 ng/mL,见图1。用235 ng/mL的TNF-α作用于HCM细胞的同时,加入不同浓度的PARP-1抑制剂进行干预,24 h后MTT法检测细胞抑制率,结果显示干预组的细胞生长抑制率低于处理组,差异有统计学意义(P<0.05),见图2。
2.2 细胞凋亡 不同的TNF-α浓度处理HCM细胞24 h后经PE-Annexin-V和7-AAD双染色后上机检测,结果显示细胞主要以凋亡为主,并呈浓度依赖性,见图3A。干预组中各浓度的TNF-α加入PARP-1抑制剂(100 ng/mL)干预后的细胞凋亡比率与相同浓度TNF-α处理组比较明显降低,差异有统计学意义(P<0.05),见图3B。

图1 TNF-α对HCM细胞的生长抑制作用

图2 不同浓度的PARP-1抑制剂干预TNF-α对HCM细胞的生长抑制作用
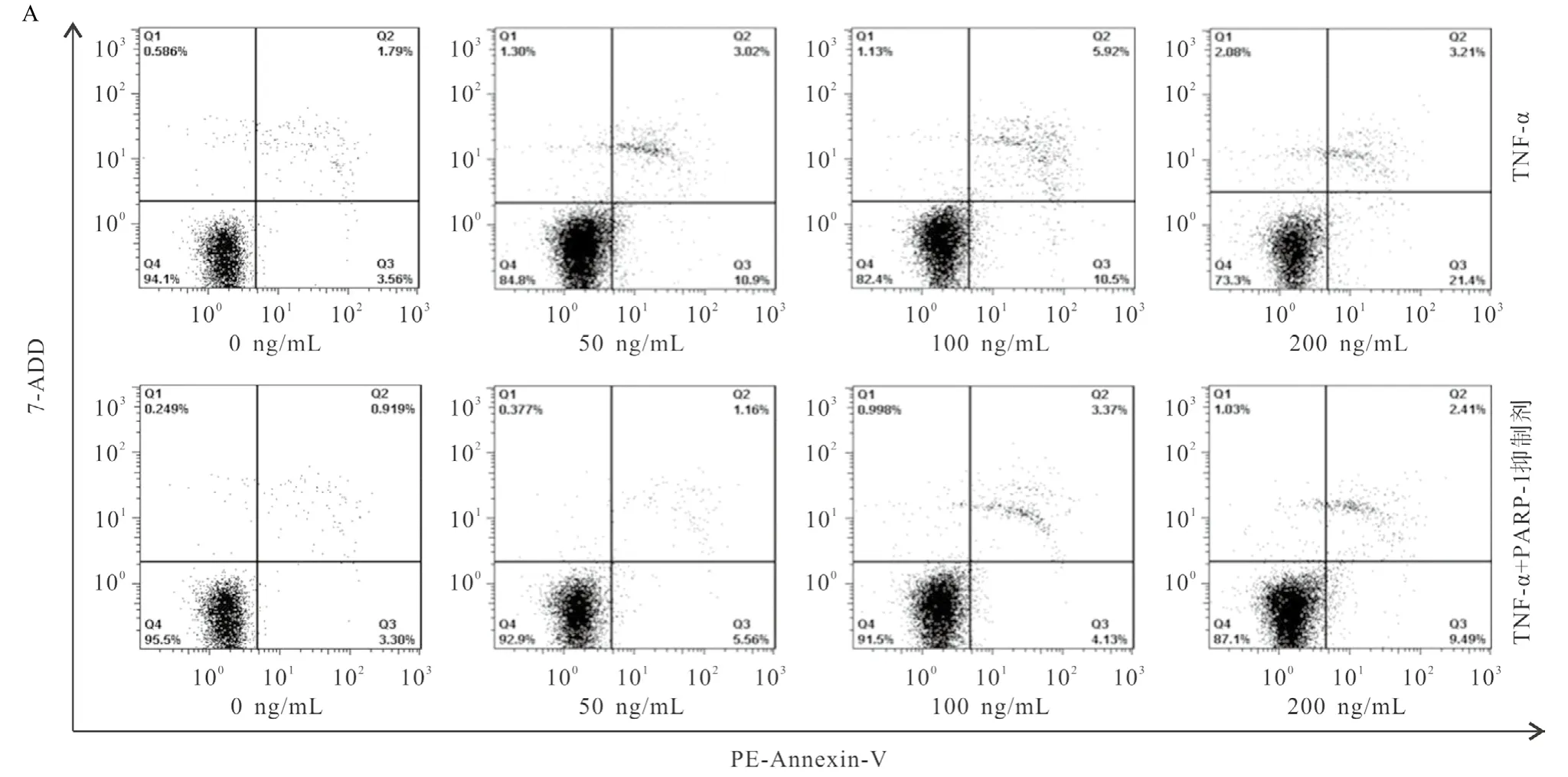
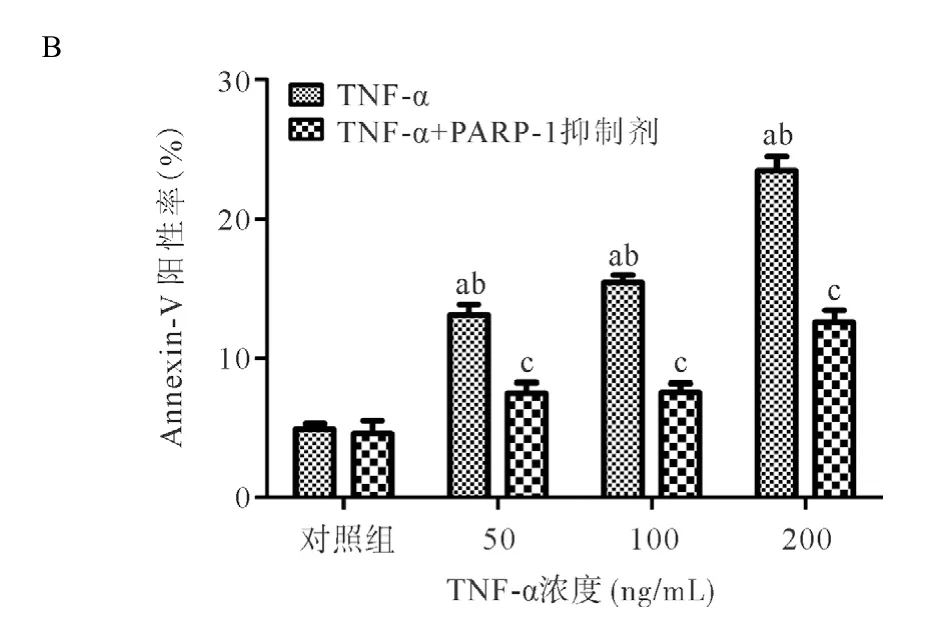
图3 PARP-1蛋白抑制剂干预TNF-α对HCM细胞凋亡的诱导作用
2.3PARP-1基因表达 HCM细胞在TNF-α诱导后,通过RT-PCR分析PARP-1基因的mRNA表达水平,结果显示100~250 ng/mL浓度的TNF-α诱导后PARP-1基因的mRNA表达水平明显上升,与对照组(TNF-α浓度为0)比差异有统计学意义(P<0.05);50 ng/mL浓度的TNF-α处理HCM细胞后PARP-1基因的mRNA表达水平与对照组比差异无统计学意义(P>0.05),见图4AB。PARP-1抑制剂(100 ng/mL)对TNF-α进行干预,各个浓度的TNF-α处理HCM细胞后PARP-1基因的mRNA表达水平均出现明显下调,与对照组相比,差异均有统计学意义(P<0.05),但加入PARP-1抑制剂的干预组中,各不同浓度TNF-α组间相比差异无统计学意义(P>0.05),见图4C-D。
2.4 PARP-1蛋白表达 Western blot结果显示TNF-α处理HCM细胞后PARP-1蛋白水平均表达下调,并呈浓度依赖性,但是PARP-1裂解产物cleaved-PARP-1的蛋白水平却随着TNF-α处理浓度增加而递增,与对照组比差异有统计学意义(P<0.05)。在加入100 ng/mL的PARP-1抑制剂的干预组中,不同浓度TNF-α处理HCM细胞后PARP-1和cleaved-PARP-1蛋白与对照组比差异均无统计学意义(P>0.05),见图5。
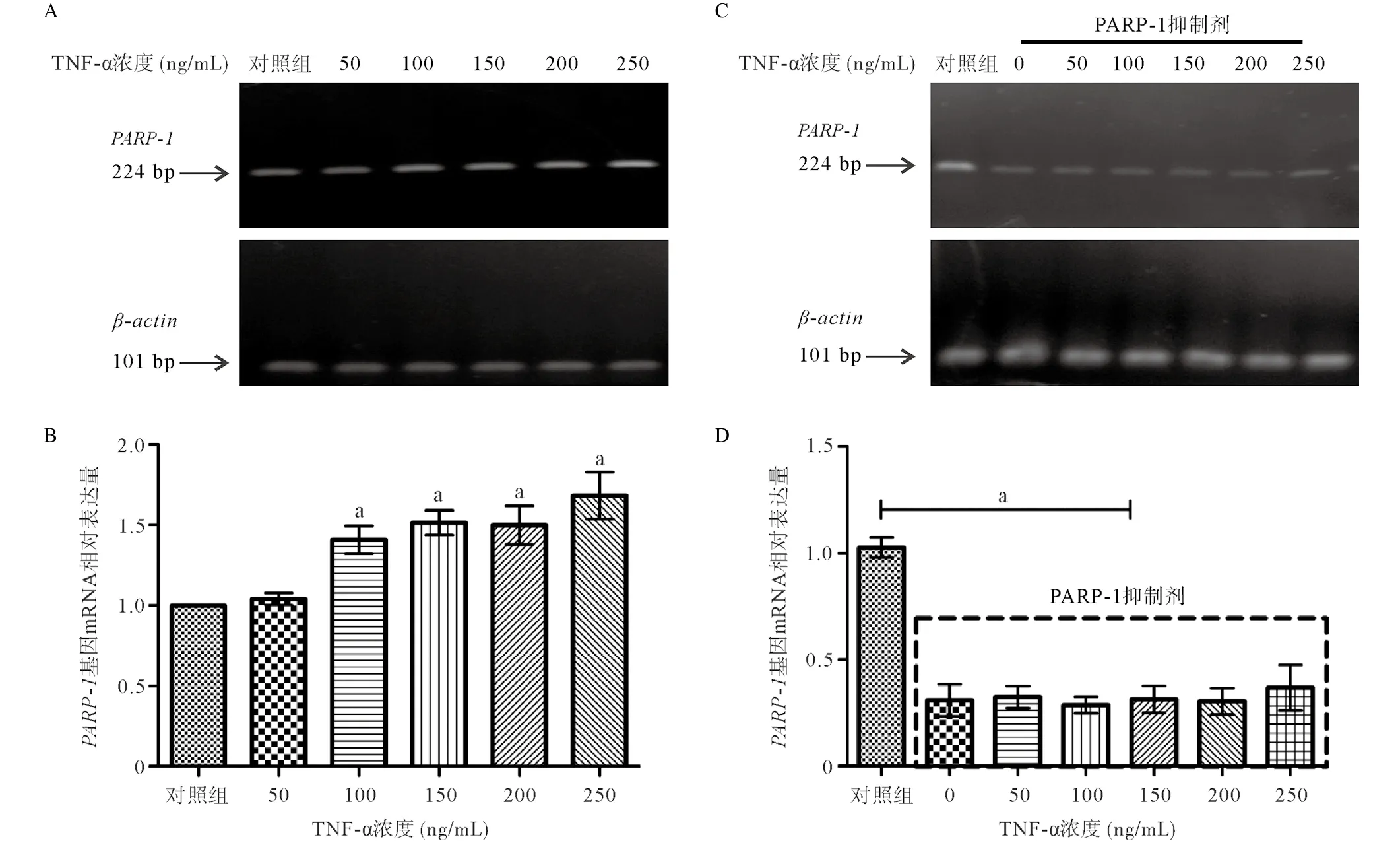
图4 不同浓度TNF-α以及PARP-1抑制剂干预对HCM细胞PARP-1基因表达的影响
3 讨论
急性心肌梗死是一种由于冠状动脉粥样硬化斑块破裂导致冠状动脉血供急剧减少甚至中断或血栓性阻塞,使得心肌严重或者持久地缺血,引起心肌细胞坏死的疾病。重症医学和经皮冠状动脉介入治疗的发展实现了为患者尽早恢复血流供应,但在恢复血流灌注的同时不可避免地会引发心肌缺血-再灌注损伤,导致各种并发症。研究发现TNF-α和PARP-1蛋白在缺血再灌注损伤诱导细胞凋亡过程中有着重要的作用。TNF-α作为参与炎症反应调节的重要因子,在AMI发病过程中发挥着重要作用,对动脉粥样硬化患者发生心血管事件危险分层意义重大[8]。国内学者通过米诺环素处理经冠状动脉左前降支结扎缺血/再灌注损伤模型大鼠的研究发现,米诺环素可能是通过抑制心肌细胞和外周血白细胞中PARP蛋白过度活化而减轻对大鼠心肌细胞损伤[9],还有研究表明PARP-1蛋白抑制剂具有减少心肌梗死面积、减弱心肌功能障碍、促进心脏停搏后心肌功能恢复等心肌保护作用[10-12]。
尽管以上文献报道说明通过抑制PARP-1蛋白的活性具有保护心肌细胞的功能,但是其具体作用机制仍未阐明,因此,本研究通过TNF-α处理HCM人心肌细胞并诱导细胞凋亡,建立心肌细胞缺血再灌注损伤模型,干预组通过PARP-1抑制剂对心肌细胞凋亡坏死过程进行干预,逆转细胞凋亡坏死,从而保护心肌细胞。实验结果显示不同浓度的TNF-α对HCM细胞具有一定的生长抑制作用,特别是终浓度为200 ng/mL条件下对HCM细胞的生长抑制作用明显增强,但是通过PARP-1抑制剂干预后,明显降低TNF-α对细胞生长抑制作用,并表现对PARP-1抑制剂具有浓度依赖性。细胞凋亡检测实验结果也显示PARP-1抑制剂干预后Annexin-V阳性比例较未干预组有明显降低。本研究还通过RT-PCR和Western blot实验分析HCM细胞在不同浓度的TNF-α以及PARP-1抑制剂干预作用下PARP-1基因的mRNA和蛋白表达水平。实验结果显示TNF-α可以诱导HCM细胞中PARP-1基因的mRNA上调表达,但是在蛋白表达水平上伴随其裂解产物cleaver-PARP上调,PARP-1蛋白水平出现下调。在不同浓度的TNF-α处理HCM细胞的同时加入PARP-1抑制剂可以逆转细胞中PARP-1基因的上调表达,并且在0 ng/mL的TNF-α处理组细胞中PARP-1基因同样也出现下调表达,但是对蛋白水平分析结果显示PARP-1和cleaved-PARP的表达量与对照组相比未见明显差异,但是在细胞增殖实验和细胞凋亡实验组中均发现PARP-1抑制剂对HCM细胞增殖和诱导细胞凋亡具有明显的影响,因此推测TNF-α诱导细胞凋亡过程中可能还存在其他信号途径。
据文献报道,TNF-α可以在无DNA损伤的情况下通过TNFR1/ERK2信号途径介导PARP-1蛋白磷酸化从而激活PARP-1的酶活性,并且TNF-α在激活NF-κB的转录活性过程中表现出对PARP-1的酶活性的依赖性[13]。还有学者通过对未经LPS处理的小胶质细胞的研究发现PARP-1可以持续与IL-1β和TNF-α的启动子结合,经LPS诱导后ADP-核糖化作用将NF-κB招募至IL-1β和TNF-α的启动子同源区从而诱导炎症因子的表达[14]。
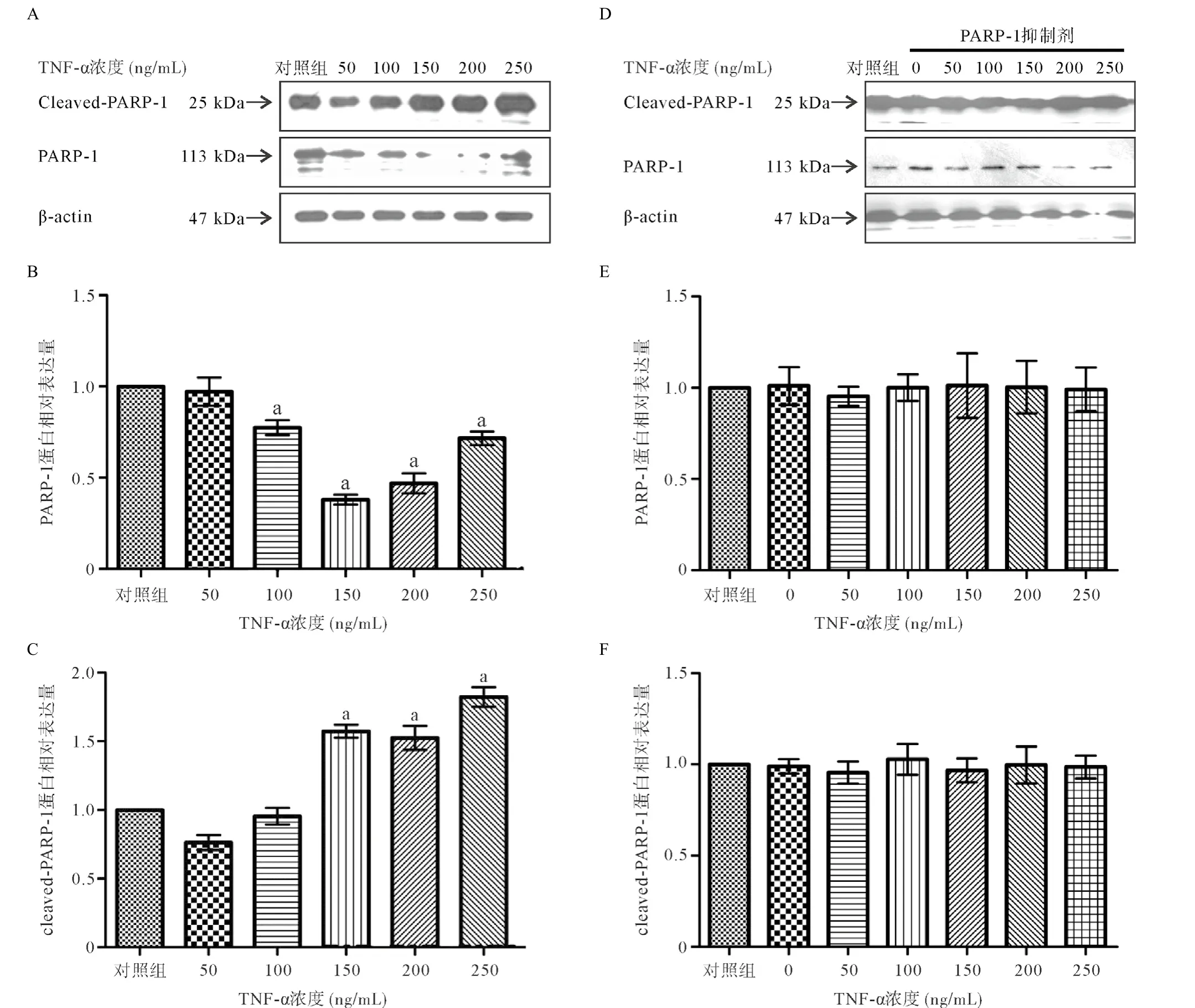
图5 处理组和干预组HCM细胞中PARP-1和cleaved-PARP-1表达
本研究结果提示TNF-α通过诱导HCM细胞PARP-1活化和蛋白裂解,从而介导细胞凋亡,PARP-1抑制剂通过抑制PARP-1蛋白活化和基因的转录逆转TNF-α对HCM细胞的生长抑制和细胞凋亡诱导作用,但是具体的分子机制和参与的信号途径,以及PARP-1抑制剂干预是否对NF-κB的转录活性以及相关炎症因子的表达产生影响均尚未阐明。尽管如此,PARP-1仍可能成为降低心肌梗死引起的缺血再灌注对心肌细胞损伤理想的靶标。
[1] TIAN M, YUAN Y C, LI J Y, et al. Tumor necrosis factor-a and its role as a mediator in myocardial infarction: A brief review[J]. 慢性疾病与转化医学 (英文), 2015, 1(1):18-26.
[2] EREMENKO A A, CHERNOVA E V, VINNITSKIĬ L I, et al.Effect of clarithromycin on the systemic inflammatory response syndrome severity in patients after myocardial revascularization surgery[J]. Anesteziol Reanimatol, 2012(3): 67-71.
[3] ADAMY C, LE C P, CANDIANI G, et al. Tumor necrosis factor alpha and glutathione interplay in chronic heart failure[J]. Arch Mal Coeur Vaiss, 2005, 98(9): 906-912.
[4] DE MURCIA J M, NIEDERGANG C, TRUCCO C, et al.Requirement of poly (ADP-ribose) polymerase in recovery from DNA damage in mice and in cells[J]. Proc Natl Acad Sci U S A, 1997, 94(14): 7303-7307.
[5] GIBSON B A, KRAUS W L. New insights into the molecular and cellular functions of poly (ADP-ribose) and PARPs[J]. Nat Rev Mol Cell Biol, 2012, 13(7): 411-424.
[6] SISTIGU A, MANIC G, OBRIST F, et al. Trial Watch-Inhibiting PARP enzymes for anticancer therapy[J]. Mol Cell Oncol, 2015, 3(2): e1053594.
[7] BERGER N A, SIMS J L, CATINO D M, et al. Poly (ADP-ribose) polymerase mediates the suicide response to massive DNA damage: studies in normal and DNA-repair defective cells[J]. Princess Takamatsu Symp, 1983, 13: 219-226.
[8] KABLAK-ZIEMBICKA A, PRZEWLOCKI T, SOKOŁOWSKI A, et al. Carotid intima-media thickness, hs-CRP and TNF-α are independently associated with cardiovascular event risk in patients with atherosclerotic occlusive disease[J]. Atherosclerosis, 2011, 214(1): 185-190.
[9] 张利群, 陈冬, 齐国先. 米诺环素后处理通过抑制P A R P过度活化减轻心肌缺血/再灌注损伤[J]. 中国病理生理杂志,2 0 1 5, 3 1(1 1): 2 0 0 9-2 0 1 5.
[10] YAMAZAKI K, TANAKA S, SAKATA R, et al. Protective effect of cardioplegia with poly (ADP-ribose) polymerase-1 inhibitor against myocardial ischemia-reperfusion injury:in vitro study of isolated rat heart model[J]. J Enzyme Inhib Med Chem, 2013, 28(1): 143-147.
[11] KHAN T A, RUEL M, BIANCHI C, et al. Poly (ADP-ribose) polymerase inhibition improves postischemic myocardial function after cardioplegia-cardiopulmonary bypass[J].J Am Coll Surg, 2003, 197(2): 270-277.
[12] SZABÓ G, BUHMANN V, ANDRÁSI T, et al. Poly-ADP-ribose polymerase inhibition protects against myocardial and endothelial reperfusion injury after hypothermic cardiac arrest[J]. J Thorac Cardiovasc Surg, 2003, 126(3): 651-658.
[13] VUONG B, HOGAN-CANN A D, ALANO C C, et al. NF-κB transcriptional activation by TNFα requires phospholipase C, extracellular signal-regulated kinase 2 and poly(ADP-ribose) polymerase-1[J]. J Neuroinflamm, 2015, 12:229.
[14] MARTINEZ-ZAMUDIO R I, HA H C. PARP1 enhances inflammatory cytokine expression by alteration of promoter chromatin structure in microglia[J]. Brain Behav, 2014, 4(4):552-565.
(本文编辑:赵翠翠)
PARP-1 protein inhibitor attenuated the growth inhibition and apoptosis of human cardiomyocytes in- duced by TNF-α
XIE Yuequn1, WANG Lei1, CHEN Linglong1, XU Ying1, YANG Zhitao2, LU Zhongqiu3.1.Department of Emergency, Wenzhou People’s Hospital, the Third Clinical Institute Affiliated to Wenzhou Medical University, Wenzhou, 325000; 2.Department of Emergency, Ruijin Hospital Shanghai JiaoTong University School of Medicine, Shanghai, 200025; 3.Department of Emergency, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
R541
A
10.3969/j.issn.2095-9400.2017.09.006
2017-01-10
浙江省医学创新学科建设计划项目(11-CX26);浙江省中医药重点学科计划项目(2012-XK-A28);浙江省“十二五”重点学科建设项目(2012-207);温州市科技局科研基金资助项目(Y20170736)。
谢月群(1985-),女,浙江瑞安人,主治医师,硕士。
卢中秋,主任医师,Email:lzq640815@163.com。

