伴肾小管间质损害的儿童紫癜性肾炎临床病理及预后分析
胡云霞,胡小涵,张玉桦,何晓青,陈丽虹,杨青,林益怡,庄捷秋
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.儿童肾内科;2.儿童超声科)
伴肾小管间质损害的儿童紫癜性肾炎临床病理及预后分析
胡云霞1,胡小涵1,张玉桦1,何晓青1,陈丽虹1,杨青1,林益怡2,庄捷秋1
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.儿童肾内科;2.儿童超声科)
目的:探讨伴肾小管间质损害的儿童紫癜性肾炎(HSPN)的临床、病理及预后情况。方法:回顾性分析2005年1月至2013年12月温州医科大学附属第二医院育英儿童医院收治的确诊为HSPN并行肾活检的93例患儿资料,根据肾小管间质损害程度进行分组,分析其临床、肾脏病理以及预后特点。结果:根据肾小管-间质病理分级结果将93例患儿分为无肾小管-间质损害组(1组,16例,占17.2%)、轻度肾小管-间质损害组(2组,66例,占71.0%)、中重度肾小管-间质损害组(3组,11例,占11.8%)。3组血肌酐高于1组(P<0.05),内生肌酐清除率(Ccr)低于1组和2组(P<0.05)。3组系膜基质评分高于1组(P<0.05),球囊粘连评分、纤维性新月体评分、肾小球硬化评分高于1组和2组(P<0.05)。多因素回归分析结果显示,球囊粘连是HSPN患儿肾小管间质损害的危险因素。随访86例,83例(占96.5%)临床恢复正常或有轻度尿异常,3例(占3.5%)进展为肾功能不全,3组预后差于2组(P<0.05)。结论:HSPN患儿可伴随肾小管-间质损害,但大部分较轻;肾小管-间质损害无敏感的临床检测指标,需尽早肾活检明确;肾小管-间质损害严重者,常早期出现肾功能受损,且肾小球病理如系膜基质增多、球囊粘连、纤维性新月体形成、肾小球硬化等病变明显,预后不良的可能性更大。
儿童;紫癜性肾炎;肾小管-间质损害;临床病理;预后
Abstract: Objective:To investigate the clinicopathological characteristics and prognosis in childhood Henoch-Schönlein purpura nephritis (HSPN) with or without tubulointerstitial lesions.Methods:The clinical and pathological data from 93 children with biopsy-proved HSPN were collected retrospectively in the Second Affiliated Hospital & Yuying Children’s Hospital of Wenzhou Medical University from January 2005 to December 2013. The patients were grouped according to the degree of tubulointerstitial lesions, and relationship between their clinical, glomerular parameters, prognosis and tubulointerstitial lesions was analyzed.Results:Ninety-three cases were divided into 3 groups according to the degree of tubulointerstitial lesions, group 1 with no tubulointerstitial lesions (16 cases, 17.2%), group 2 with mild tubulointerstitial lesions (66 cases, 71.0%), and group 3 with severe tubulointerstitial lesions (11 cases, 11.8%). The serum creatinine level (P<0.05) and the mesangial matrix score (P<0.05) was significantly higher in group 3 than that in group 1, and creatinine clearance rates of group 3 was significantly lower than that in group 1 and group 2 (P<0.05). The balloon adhesion score, fibrous crescents score and glomerulosclerosis score of group 3 were significantly higher than that in group 1 and group 2 (P<0.05). Multivariate logistic regression analysis showed that the balloon adhesion was risk factor of tubulointerstitial lesions. In 86 cases with follow-up, 96.5% had clinical normal or mild abnormal urine, 3.5% developedto renal dysfunction, the prognosis of group 3 was significantly worse than that in group 2 (P<0.05). Conclusion:Some HSPN patients may present with tubulointerstitial lesions in pathology at early stage of disease, which is reliable indicator for patients to develop severe glomerular lesion, and the patients with poor prognosis in future.
Key words:children; Henoch-Schönlein purpura nephritis; tubulointerstitial lesions; clinicopathology;prognosis
过敏性紫癜(Henoch-Schönlein purpura,HSP)是好发于儿童的、以坏死性小血管炎为主要病理改变的全身性疾病,紫癜性肾炎(Henoch-Schönlein purpura nephritis,HSPN)则是影响HSP预后的决定因素。目前公认大量蛋白尿、早期肾功能不全、严重肾小球硬化和广泛新月体形成是HSPN预后不良的重要因素[1];也有研究报道肾小管损伤及肾间质纤维化同样影响HSPN的预后[2]。本研究回顾性分析93例HSPN患儿的临床、病理及转归情况,探讨肾小管-间质损害与HSPN患儿临床、病理及预后的关系。
1 对象和方法
1.1 对象 2005年1月至2013年12月温州医科大学附属第二医院育英儿童医院儿童肾内科收治临床诊断为HSPN患儿共1 325例,其中经肾穿刺活检共106例。纳入标准:①有确切皮肤紫癜病史,伴或不伴关节或消化道症状;②起病6个月之内出现尿常规、尿微量蛋白检测或尿沉渣显微镜检查异常,伴或不伴水肿、高血压和肾功能不全;③肾活检符合HSPN的表现;④排除IgA肾病、特发性血小板减少性紫癜、抗中性粒细胞胞浆抗体相关性血管炎、乙肝病毒相关性肾炎和系统性红斑狼疮等全身性疾病。根据纳入标准实际纳入统计93例。本研究经本院伦理委员会批准,所有患儿由其监护人签署知情同意书。
1.2 资料收集 收集患儿性别、身高、体质量、发病年龄、病程、血压、肉眼血尿、关节肿痛、胃肠道症状、实验室检查[包括尿常规、24 h尿蛋白定量、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、内生肌酐清除率(creatinine clearance rate,Ccr)、血清白蛋白、总胆固醇、甘油三酯、血清IgA、IgG、IgM及补体C3、尿α1-微球蛋白、尿β2-微球蛋白、尿N-乙酰-β-D-葡萄糖苷酶(NAG)等]资料。
1.3 临床分型 依据中华医学会儿科学分会肾脏病学组2009年试行指南[3]分为孤立性血尿型、孤立性蛋白尿型、血尿和蛋白尿型、急性肾炎型、肾病综合征型、急进性肾炎型及慢性肾炎型。
1.4 肾活检病理资料 患儿在超声引导下行肾穿刺活检术,肾组织行光镜、免疫荧光及电镜检查。
1.4.1 肾小球病理分级:根据国际儿童肾脏病学会(International Study of Kidney Disease in Children,ISKDC)和国内2009年试行指南[3]制定的标准分为I~VI级,并参考文献[4]使用半定量法对肾小球病变进行积分评定,评分标准:系膜细胞增生、系膜基质增多按无、局灶节段、弥漫节段、弥漫球性分别计0、1、2、3分;内皮细胞肿胀和透明变性按无、局灶、弥漫分别计0、1、2分;细胞性新月体形成、球囊粘连、毛细血管袢坏死、毛细血管内增生、纤维性新月体形成、肾小球硬化按受累肾小球比率分为无、1%~20%、21%~50%、50%以上,分别计0、1、2、3分。
1.4.2 肾小管-间质病理分级:参考相关文献[4-5]使用半定量法对肾小管-间质病变进行积分评定,评分标准:①肾小管-间质急性病变:间质单个核细胞浸润、肾小管浊肿空泡变性按病变面积占总肾小管-间质面积的百分比分为无、1%~20%、21%~50%、50%以上,分别计0、1、2、3分;②肾小管-间质慢性病变:间质纤维化、肾小管萎缩按病变面积占总肾小管-间质面积的百分比分为无、1%~20%、21%~50%、50%以上,分别计0、1、2、3分。肾小管-间质病理分级参考相关文献[5],分为0级(0分)、1级(1~3分)、2级(4~6分或慢性病变在20%以下)、3级(7~9分或慢性病变占21%~50%)、4级(10~12分或慢性病变超过50%)。
1.4.3 免疫病理分型:按免疫球蛋白沉积类型分为单纯IgA沉积型、IgA+IgG沉积型、IgA+IgM沉积型和IgA+IgG+IgM沉积型,并对IgA、IgG、IgM、C3、C1q、纤维蛋白原进行半定量分析,按荧光强度(-)~(++++)分别计0~4分。
1.5 分组 根据肾小管-间质病理分级结果将93例患儿分为以下几组:肾小管-间质病理分级0级者为1组(无肾小管-间质损害组),肾小管-间质病理分级1级者为2组(轻度肾小管-间质损害组),肾小管-间质病理分级2~4级者为3组(中重度肾小管-间质损害组)。
1.6 随访及预后判断 成功随访86例,时间31~2 701 d,中位随访时间700 d,随访指标包括血尿、蛋白尿定性、24 h尿蛋白量、血生化指标及肾功能状况。参照文献[6]将预后分为A、B、C、D四种情况,A(正常):体格检查、尿检及肾功能均正常;B(轻度尿异常):体格检查和肾功能正常,有镜下血尿和(或)蛋白尿<1 g/24 h(或<40 mg·h-1·m-2);C(活动性肾病):高血压或(和)尿蛋白≥1 g/24 h(或≥40 mg·h-1·m-2),肾功能正常,肾小球滤过率(glomerular filtration rate,GFR)≥60 mL·min-1·(1.73 m2)-1;D(肾功能不全):GFR<60 mL·min-1·(1.73 m2)-1,或已死亡。其中A和B认为预后良好,C和D预后不佳。
1.7 统计学处理方法 采用SPSS18.0软件进行统计学分析。计量资料均进行正态性检验,正态分布资料以 ±s表示,非正态分布资料以 M(1/4,3/4)表示,组间比较采用Kruskal-Wallis H秩和检验或Mann-Whitney U检验。计数资料比较采用χ2检验。对各因素分别进行单因素logistic回归分析,将有统计学意义的变量纳入多因素logistic回归,分析影响肾小管-间质损害的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 各组患儿一般情况、临床特点及临床分型 93例患儿分组结果:1组16例,2组66例,3组11例。3组患儿肉眼血尿发生率有上升趋势,但差异无统计学意义(P>0.05);3组Scr水平高于1组(P<0.05),Ccr明显低于1组和2组,差异有统计学意义(P<0.05);2组血IgM水平低于1组和3组,差异有统计学意义(P<0.05),但各组患儿血IgM水平均在临床参考值内;各组患儿性别、年龄、病程、血压、尿蛋白定量、血清白蛋白、尿β2-微球蛋白等指标及临床分型差异无统计学意义(P>0.05),见表1。
2.2 各组患儿肾小球病理 1组、2组、3组患儿肾小球病理分级表现为ISKDC I I I级及以上者分别有10例、51例和9例,分别占各组总例数的62.50%、77.27%和81.82%,差异无统计学意义(P>0.05)。3组患儿系膜基质评分明显高于1组(P<0.05),球囊粘连评分、纤维性新月体评分和肾小球硬化评分均明显高于1组和2组(P<0.05);2组毛细血管内增生评分高于1组(P<0.05),余指标差异无统计学意义(P>0.05),见表2。
2.3 各组患儿免疫病理 1组、2组、3组患儿免疫病理分型、C3沉积、C1q沉积、纤维蛋白原沉积、毛细血管壁累及以及IgA、IgG、IgM、C3和纤维蛋白原沉积量差异均无统计学意义(P>0.05),见表3。2.4 各组患儿临床转归 随访86例,96.5%患儿临床恢复正常或有轻度尿异常,3.5%进展为终末期肾功能不全(end-stage renal disease,ESRD),1组、2组、3组患儿分别有1例、0例和2例,差异有统计学意义(P<0.05),见表4。进一步行行×列分割χ2检验,3组和2组在预后上差异有统计学意义(Fisher χ2=8.108,P=0.017),余组间差异无统计学意义(P>0.05)。
2.5 肾小管-间质损害的相关危险因素分析 各相关连续变量依据四分位数分组原则分为4个等级,再进行回归分析。单因素回归分析提示,Ccr(每下降10 mL·min-1)、系膜基质增多、球囊粘连、纤维性新月体、肾小球硬化是肾小管-间质病变的相关危险因素(P<0.05),进一步行多因素logistic回归分析,结果显示,球囊粘连是肾小管-间质病变的危险因素,见表5。
3 讨论
HSPN的ISKDC病理分级主要考虑了系膜增生程度以及新月体形成比例,但不包括肾小管-间质纤维化程度、毛细血管内增生和肾小动脉损伤或节段硬化等可能预测预后的因素。目前有关儿童HSPN伴发肾小管间质损害的研究为数不多。
本研究根据肾小管间质损害程度进行评分,结果显示,轻度损害者占71.0%,中重度损害者占11.8%,而肾小管间质无病变者仅占17.2%,与以往研究[7-8]一致,均提示较大比例的HSPN患儿伴有肾小管间质改变,但大部分程度较轻。
LIM等[9]发现,肾小管-间质损害是否进展与起病年龄、性别、HSP临床表现(关节肿痛、腹痛、黑便、肉眼血尿)、实验室指标等无关。本研究结果与其基本一致,但我们发现出现肾小管-间质慢性病变的HSPN患儿,其Scr水平明显高于、Ccr明显低于无肾小管-间质慢性病变者,提示肾小管-间质损害严重者早期可出现肾功能受损。尿α1-微球蛋白、尿β2-微球蛋白及尿NAG是反映肾小管功能较好的指标,段翠蓉等[10]研究发现HSPN患儿尿β2-微球蛋白水平越高,其肾小管-间质损害越重;而MISE等[11]报道,糖尿病肾病患者尿β2-微球蛋白及尿NAG水平与肾小管-间质损伤严重程度相关,但不能用于预后判断。本研究各组患儿尿α1-微球蛋白、β2-微球蛋白及NAG水平差异无统计学意义,与上述研究结果不一致,我们认为这3种临床指标尚不能很好地反映HSPN的肾小管间质损害情况,仍需肾活检明确。
本研究还发现,中重度肾小管-间质损害的HSPN患儿其系膜基质增生明显,球囊粘连严重,纤维性新月体比例高,肾小球硬化严重。多因素回归分析结果也提示球囊粘连是肾小管-间质损害的危险因素。HODGKINS等[12]报道,肾小球损伤出现足细胞足突融合、足细胞脱落可导致球囊粘连,促进局部成纤维细胞增生、炎性细胞浸润,使局部细胞外基质增多,引发局部肾小球和球旁肾小管-间质的慢性病变;新月体形成则可阻塞球管连接和近端小管初始段,导致肾小管萎缩和退化;肾小球硬化可导致有效肾单位减少、残余肾单位高滤过,局部缺血缺氧,引起肾小管-间质损伤;且肾小管-间质损伤可以通过球管反馈机制影响肾小球滤过功能,进一步加重肾小球损伤,从而形成恶性循环。因此,临床上应结合肾小球、肾小管-间质病理全面评估HSPN的肾损害程度。
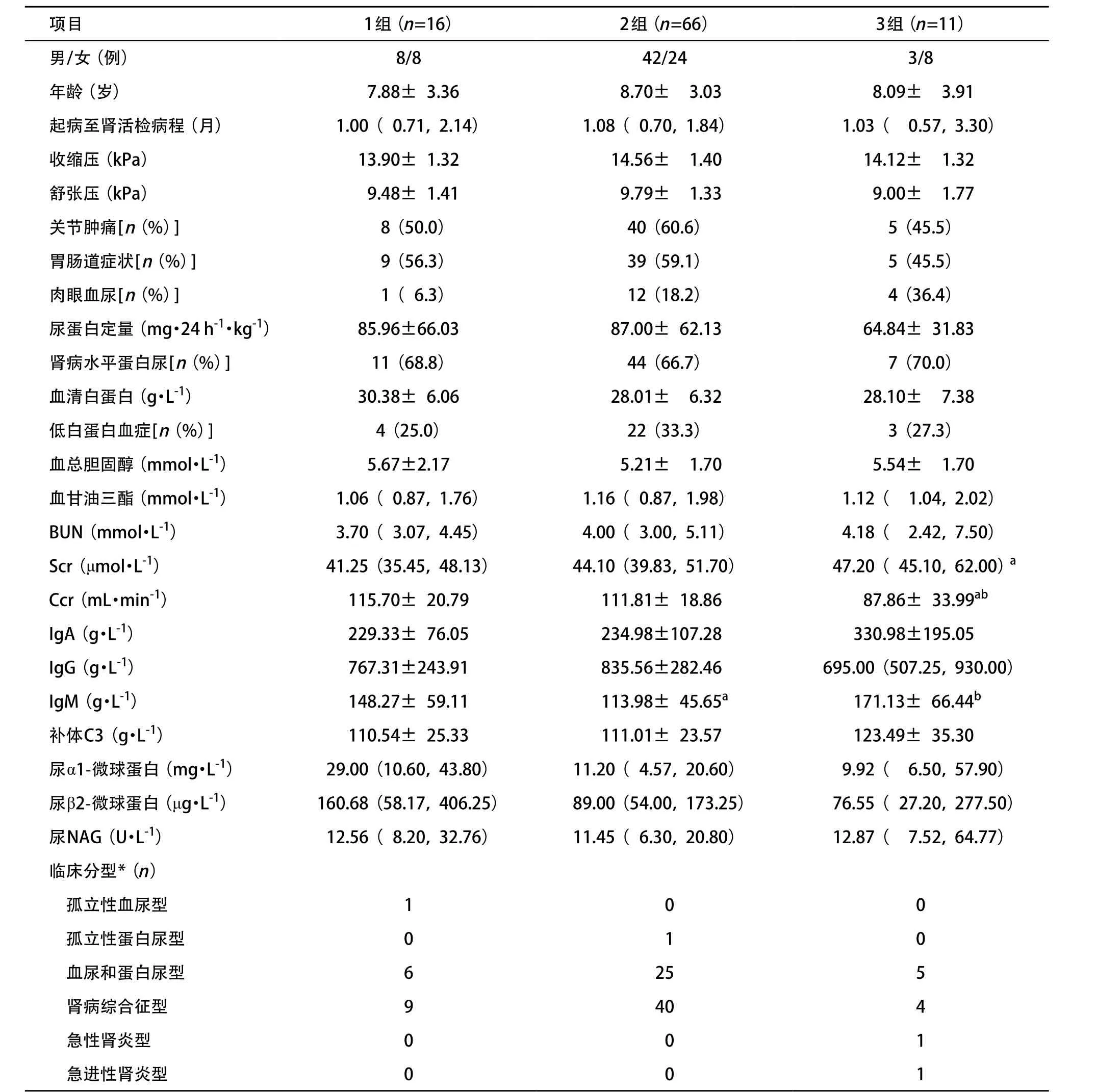
表1 各组患儿一般情况、临床特点及临床分型比较
刘小荣等[13]研究发现肾小管-间质损害是IgAN进展的重要因素之一。PAGNI等[14]发现狼疮性肾炎患者经治疗后ISN/RPS病理分级从II级进展为IV-G级者,其肾小管萎缩和肾间质纤维化明显;从IV-G级恢复至I I级者,其肾小管-间质基本正常;而I I I级和IV-S级者,其肾小管-间质病理改变较稳定,提示肾小管-间质损伤是预测狼疮性肾炎患者预后的影响因素。越来越多的研究表明肾小管-间质病变在各种肾脏疾病病情进展的过程中起重要作用[12]。
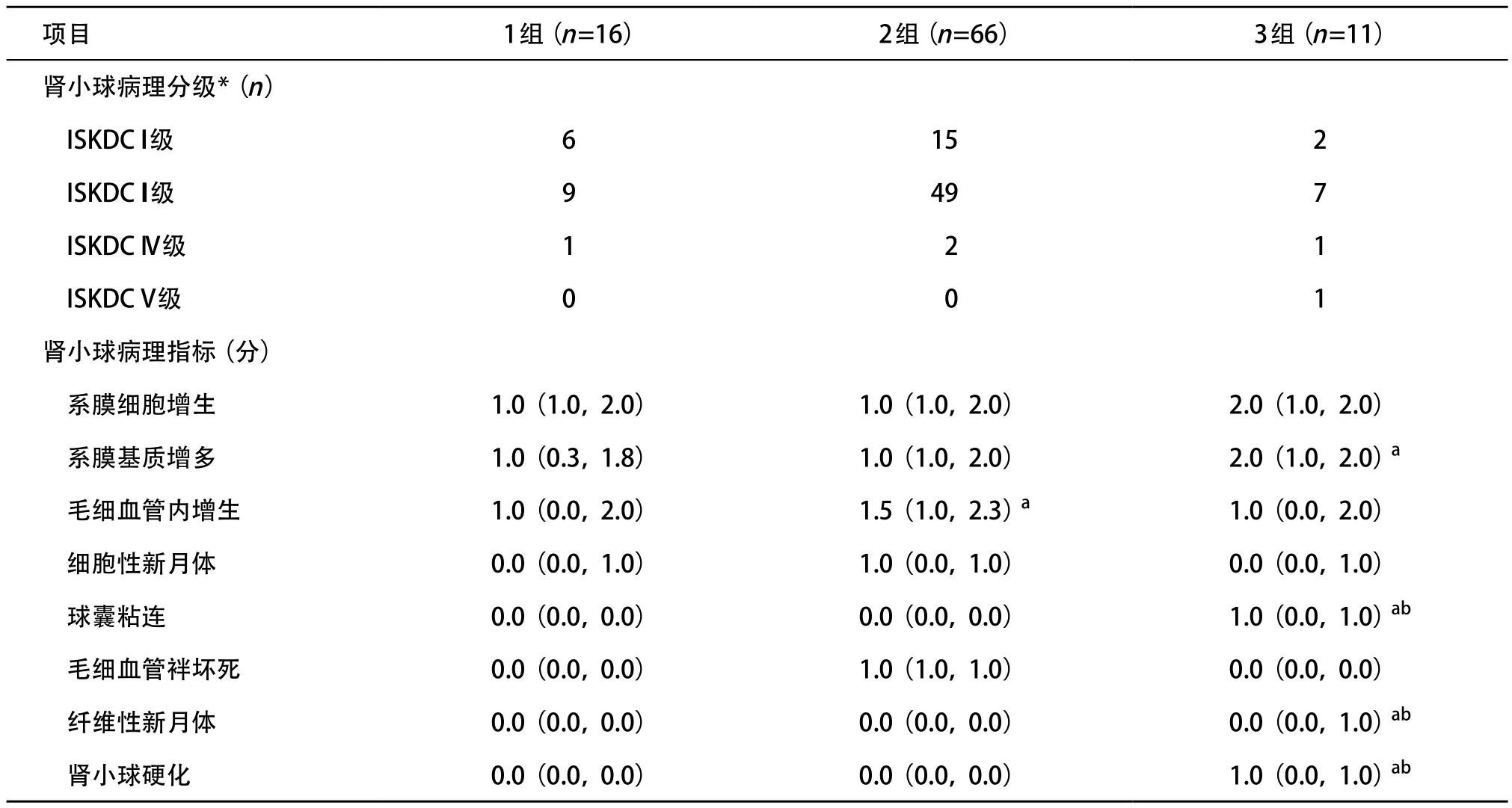
表2 各组HSPN患儿肾小球病理比较
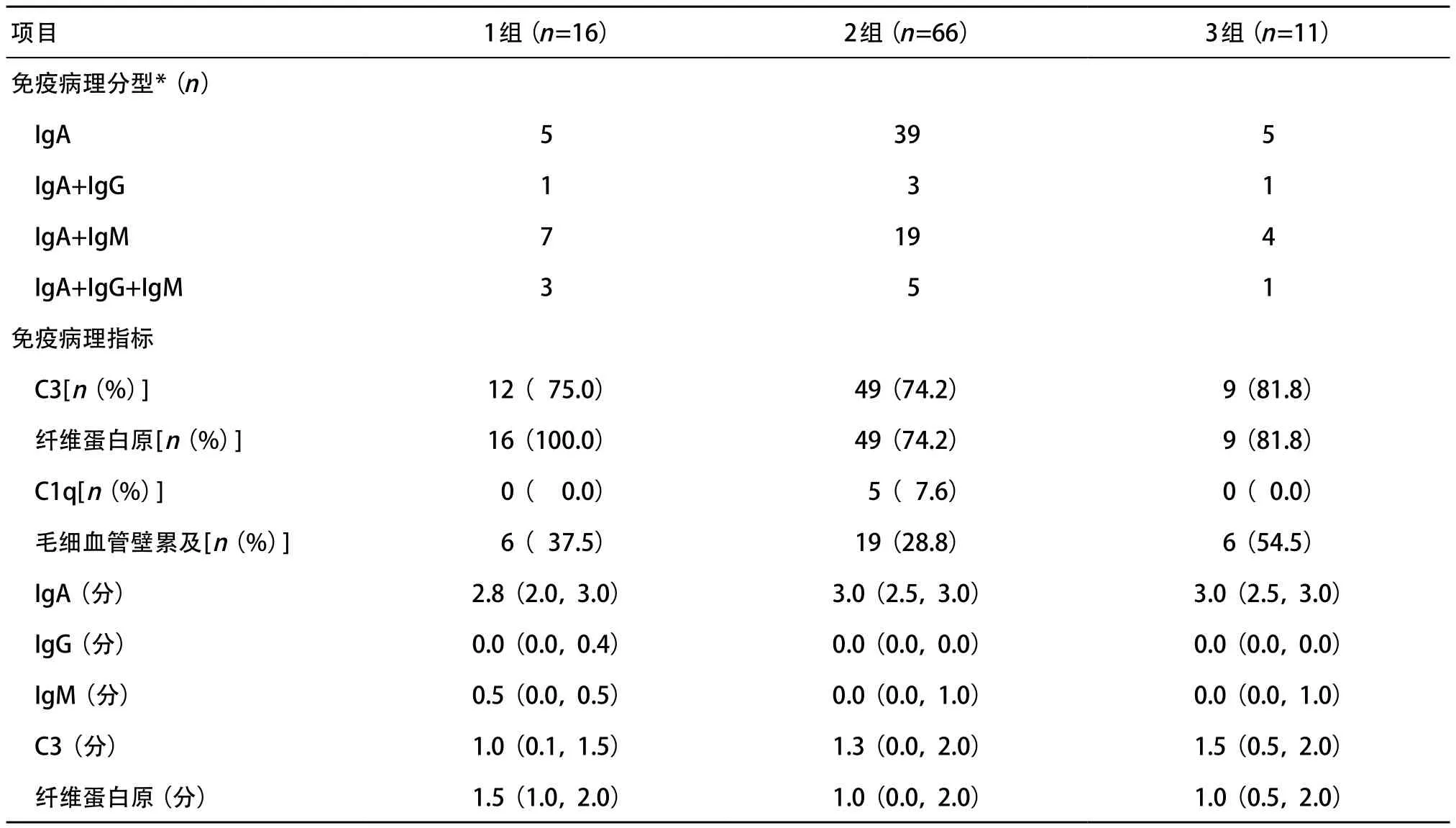
表3 各组HSPN患儿免疫病理比较
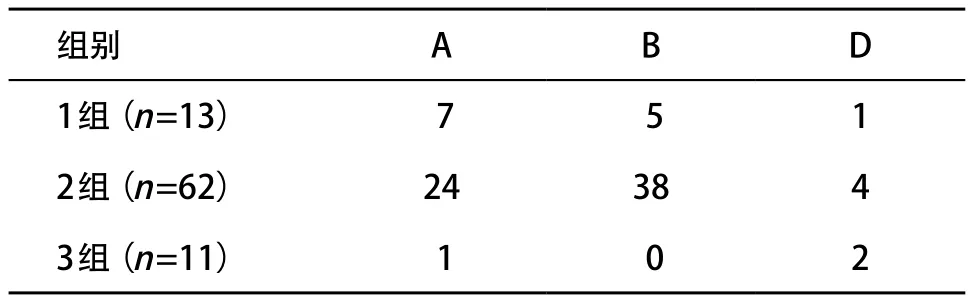
表4 各组HSPN患儿临床转归比较(n)
多数研究认为HSPN患儿大部分预后良好,仅1%~5%的HSPN患儿进展为ESRD;但也有研究[15]发现20%~30%的HSPN患儿可进展为ESRD,其中包括少数起病时症状轻微或治疗后临床恢复正常的患儿。本组数据显示,绝大部分HSPN患儿预后较好,仅3例(占3.5%)进展为ESRD,其中2例表现为严重肾小管-间质慢性损害,但有1例肾小管-间质无损害的HSPN患儿在随访8年左右时进展为ESRD。研究发现,肾小管-间质损伤、肾小球损伤在一定程度上可逆[9,12],对肾损害程度较重(包括肾小球和肾小管-间质)的患儿,早期合理治疗(激素、激素联合免疫抑制剂)可以改善预后。但LIM等[9]发现,即使HSPN患儿接受激素联合免疫抑制剂治疗,其肾小管-间质损害仍可能进展。PAGNI等[14]则指出重复肾活检能更准确直观地反映肾小球和肾小管损害,是狼疮性肾炎监测的良好指标。因此,有必要在HSPN患儿治疗过程中或结束后酌情进行重复肾活检,以及早发现肾小管-间质的病变情况。
综上所述,HSPN患儿可伴随肾小管-间质损害,严重者常早期出现肾功能受损,肾小球慢性病变严重,预后不良的可能性更大。因此应对合适HSPN患儿及早行肾穿刺活检,早期合理治疗,改善预后;必要时重复肾活检以发现肾小管-间质病变。
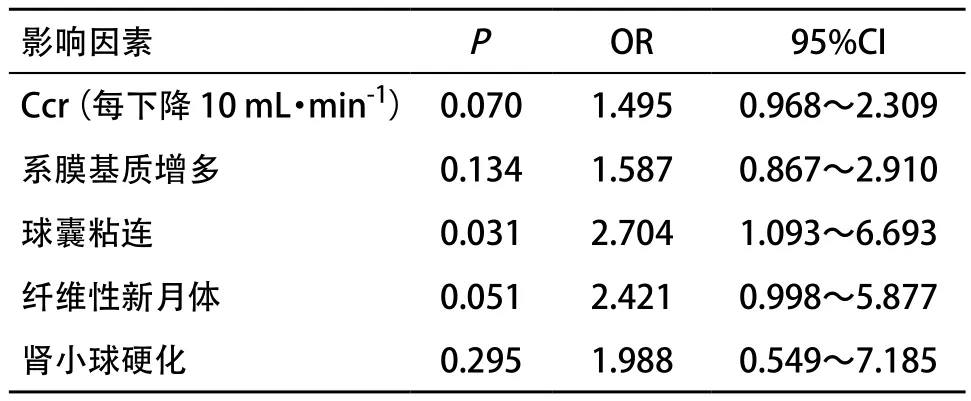
表5 肾小管-间质病变相关危险因素的多因素logistic回归分析
[1] NICKAVAR A, MEHRAZMA M, LAHOUTI A. Clinicopathologic correlations in Henoch-Schonlein nephritis[J].Iran J Kidney Dis, 2012, 6(6): 437-440.
[2] KAWASAKI Y, SUZUKI J, SAKAI N, et al. Clinical and pathological features of children with Henoch-Schoenlein purpura nephritis: risk factors associated with poor prognosis[J]. Clin Nephrol, 2003, 60(3): 153-160.
[3] 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南(二): 紫癜性肾炎的诊治循证指南(试行)[J].中华儿科杂志, 2 0 0 9, 1 2(4 7): 9 1 1-9 1 3.
[4] FOSTER B J, BERNARD C, DRUMMOND K N, et al.Effective therapy for severe Henoch-Schönlein purpura nephritis with prednisone and azathioprine: a clinical and histopathologic study[J]. J Pediatr, 2000, 136: 370-375.
[5] 沈茜, 徐虹, 宋善路, 等. 肾小管间质损害对儿童过敏性紫癜肾炎预后影响的探讨[J]. 中国实用儿科杂志, 2 0 0 3, 1 8(6): 3 5 6-3 5 8.
[6] COUNAHAN R, WINTERBORN M H, WHITE R H, et al.Prognosis of Henoch-Schonlein nephritis in children[J]. Br Med J, 1977, 2(6078): 11-14.
[7] 张利果, 张建江, 史佩佩, 等. 儿童紫癜性肾炎1 0 3例病理分析[J/C D]. 中华临床医师杂志:电子版, 2 0 1 2, 6(1 1): 3 0 6 9-3 0 7 1.
[8] FENG D, HUANG W Y, HAO S, et al. A single-center analysis of Henoch-Schonlein purpura nephritis with nephrotic proteinuria in children[J]. Pediatr Rheumatol Online J, 2017,15(1): 15.
[9] LIM B J, SHIN J I, CHOI S E, et al. The significance of tubulointerstitial lesions in childhood Henoch-Schonlein nephritis[J]. Pediatr Nephrol, 2016, 31(11): 2087-2093.
[10] 段翠蓉, 李志辉, 何金华, 等. 儿童过敏性紫癜性肾炎肾小管间质损害程度的临床判定[J]. 医学临床研究, 2 0 0 9, 2 6(4): 7 1 4-7 1 5.
[11] MISE K, HOSHINO J, UENO T, et al. Prognostic value of tubulointerstitial lesions, urinary N-acetyl-β-d-glucosaminidase, and urinary β2-microglobulin in patients with type 2 diabetes and biopsy-proven diabetic nephropathy[J].Clin J Am Soc Nephrol, 2016, 11(4): 593-601.
[12] HODGKINS K S, SCHNAPER H W. Tubulointerstitial injury and the progression of chronic kidney disease[J]. Pediatr Nephrol, 2012, 27(6): 901-909.
[13] 刘小荣, 沈颖, 伏利兵, 等. 肾小管间质损害与儿童I g A肾病进展的关系[J]. 实用儿科临床杂志, 2 0 1 0, 2 5(1 9): 1 4 9 7-1 4 9 9.
[14] PAGNI F, GALIMBERTI S, GALBIATI E, et al. Tubulointerstitial lesions in lupus nephritis: International multicentre study in a large cohort of patients with repeat biopsy[J]. Nephrology (Carlton), 2016, 21(1): 35-45.
[15] DAVIN J C, COPPO R. Henoch-Schonlein purpura nephritis in children[J]. Nat Rev Nephrol, 2014, 10(10): 563-573.
(本文编辑:丁敏娇)
Analysis of clinicopathology and prognosis of childhood Henoch-Schönlein purpura nephritis with renal tubulointerstitial lesions
HU Yunxia1, HU Xiaohan1, ZHANG Yuhua1, HE Xiaoqing1, CHEN Lihong1, YANGQing1, LIN Yiyi2, ZHUANG Jieqiu1. 1.Department of Pediatric Nephrology, the Second Affiliated Hospital &Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Pediatric Ultrasound, the Second Affiliated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou,325027
R72
A
10.3969/j.issn.2095-9400.2017.09.004
2017-04-24
国家自然科学基金资助项目(81170709);浙江省自然科学基金资助项目(Y2080291);温州市科技局对外科技合作交流项目(H20090022)。
胡云霞(1991-),女,浙江永康人,硕士生。
庄捷秋,主任医师,硕士生导师,Email:zjq200506@126.com。

