TCDD对大鼠睾丸间质细胞凋亡相关蛋白表达及ROS含量的影响*
殷 俊,谭雪梅,张秀丽,冀萌萌,陶宇昌,刘蔓蔓,余增丽
郑州大学公共卫生学院营养与食品卫生学教研室 郑州 450001
TCDD对大鼠睾丸间质细胞凋亡相关蛋白表达及ROS含量的影响*
殷 俊,谭雪梅,张秀丽,冀萌萌,陶宇昌,刘蔓蔓,余增丽#
郑州大学公共卫生学院营养与食品卫生学教研室 郑州 450001
二噁英;睾丸间质细胞;凋亡相关蛋白;大鼠
目的:探讨2,3,7,8-四氯二苯并二噁英(TCDD)对大鼠睾丸间质细胞凋亡相关蛋白表达及ROS 含量的影响。方法用不同剂量TCDD(0、1、5、10、50 nmol/L)处理大鼠睾丸间质细胞24 h后,采用MTT法检测细胞增殖抑制率,利用荧光探针DCFH-DA检测细胞ROS含量,Annexin V-FITC/PI染色联合激光共聚焦显微镜观察细胞凋亡情况,采用Western blot法检测细胞中凋亡相关蛋白Bax、 Bcl-2、 Caspase-3的表达水平。结果随着TCDD剂量的增加,细胞增殖抑制率和ROS含量逐渐升高(P<0.05),细胞中Bax、Caspase-3蛋白相对表达量逐渐增加,而Bcl-2蛋白相对表达量逐渐降低(P<0.05)。结论TCDD可诱导大鼠睾丸间质细胞凋亡。
近年来,人类生殖系统相关疾病发病率呈逐年升高趋势,而环境因素与之密切相关。二噁英是一类持久性有机污染物的总称,包含210种化合物,其中毒性最强的一种为2,3,7,8-四氯二苯并二噁英(TCDD)[1]。废弃物的焚烧处理、尾气排放、冶金化工以及农药生产是TCDD产生的主要来源[2]。研究[3-6]表明,TCDD易在人体蓄积,且对肝脏、皮肤、神经系统以及生殖发育等都有一定的毒性作用。相较于雌性,雄性生殖系统对TCDD更为敏感,TCDD可通过降低雄性大鼠血清睾酮水平以及精子浓度和质量从而导致其生殖系统的损伤[7],但具体的机制尚不清楚。睾丸间质细胞分布于曲细精管间的疏松结缔组织中,占睾丸细胞总数的2%~4%[8]。机体内睾酮主要由睾丸间质细胞合成和分泌。睾酮是一类由19个碳原子组成的类固醇激素,可促进精子的成熟,促进内、外生殖器的发育,刺激第二性征的出现等[9]。在此背景下,作者在查阅相关文献以及前期实验的基础上,观察了TCDD染毒对体外培养大鼠睾丸间质细胞增殖的影响,以及其对细胞内凋亡相关蛋白Bax、Caspase-3、Bcl-2表达和活性氧(ROS)含量的影响,探讨TCDD生殖毒性的可能机制,为预防相关性疾病提供理论依据。
1 材料与方法
1.1动物健康清洁级雄性SD大鼠,8~10周龄,购自河南省实验动物中心[许可证号:SCXK(豫)2015-0004],于检疫室隔离观察1周后,在屏障环境下饲养2周。在此期间,严格按照SPF级动物饲养标准(温度、湿度、饮水饮食模式、昼夜交替时间)进行饲养。
1.2主要仪器及试剂多功能酶标仪(上海美谷分子仪器有限公司),JY-SCZ2型SDS-PAGE蛋白电泳仪(北京六一仪器厂),水平摇床(沃德生物医学仪器公司),超灵敏凝胶成像仪(美国通用电气仪器集团),徕卡TCS SP5激光共聚焦显微镜(德国徕卡仪器有限公司)。DMEM/F-12培养基购于美国Hyclone公司,胎牛血清购于杭州四季青有限公司,二甲基亚砜(DMSO)、胶原酶Ⅳ购于美国Sigma公司。ROS检测试剂盒购于北京索莱宝生物科技有限公司,Annexin V-FITC/PI染色法细胞凋亡检测试剂盒购于江苏凯基生物技术股份有限公司,ECL高效化学发光试剂盒购于美国Genview公司。兔抗大鼠Bax、Caspase-3、Bcl-2、β-actin(内参)多克隆抗体以及二抗辣根过氧化物酶标记的山羊抗兔IgG均购于武汉三鹰生物技术有限公司。
1.3大鼠睾丸间质细胞的分离与分组将大鼠颈椎脱位法处死,于体积分数75%乙醇中浸泡消毒5 min,于超净台下无菌摘取双侧睾丸置于无菌PBS培养皿中,除去被膜和血管。将睾丸组织拉散后置于含有胶原酶的DMEM/F-12培养基中,34 ℃恒温振荡10~15 min(90 r/min),消化完全后加入无血清培养基终止消化,静止5 min后取上清液,1 000 r/min离心5 min,弃上清液,加入无血清培养基吹打至单个细胞悬液,静置2 min后,100目钢网过滤。将过滤后的悬液转移至梯度Percoll分离液中(70%、58%、30%、5%),1 600 r/min离心20 min。离心结束后,可看见4条细胞带,小心吸取第3条细胞带(30%~58%层)于离心管中,加入含体积分数10%胎牛血清的培养基吹打混匀,并转移到培养瓶和6孔板中,于37 ℃体积分数5%CO2培养箱中培养。调整细胞密度为5×104mL-1,转入96孔板中,分别加入0(对照)、1、5、10、50 nmol/L TCDD进行染毒,每个剂量设置6个平行孔,24 h后进行指标检测。
1.4观测指标
1.4.1 细胞增殖抑制率的检测 染毒24 h后,每孔加入20 μL MTT溶液(5 g/L)继续培养4 h,弃去培养液,每孔加入150 μL DMSO于37 ℃恒温振荡箱中振荡20 min,在酶联免疫检测仪490 nm处检测各孔的吸光度(A)值。细胞增殖抑制率=1-(实验组A-调零孔A)/(对照A-调零孔A)×100%。
1.4.2 细胞内ROS含量的检测 染毒24 h后收集细胞并计数,吸取1×106个细胞加入10 nmol/L DCFH-DA工作液中,置于细胞培养箱中避光孵育30 min,用PBS洗涤细胞3次以充分去除未进入细胞的DCFH-DA。用一定量PBS重悬细胞并转移到96孔板中,使用488 nm激发波长、525 nm发射波长,酶标仪检测。
1.4.3 细胞凋亡检测 染毒24 h后收集细胞,加入1×Annexin V Binding Solution 制成细胞浓度为1×106mL-1的细胞悬液,取100 μL细胞悬液,加入5 μL FITC和5 μL PI,吹打混匀,室温下避光反应15 min,再加入400 μL Binding Solution,吹打混匀,吸取一滴细胞悬液于玻片上,于激光共聚焦显微镜下观察。
1.4.4 细胞中Bax、Caspase-3、Bcl-2蛋白的检测 染毒24 h后收集细胞,提取总蛋白,BCA法测定蛋白浓度。变性后每组取约30 μg蛋白进行SDS-PAGE电泳分离,220 V恒压转膜1.5 h后用50 g/L脱脂牛奶37 ℃封闭2 h,TBST洗脱4次,加入稀释后的一抗4 ℃孵育过夜,TBST洗脱4次,再加入稀释后的二抗37 ℃孵育2 h,TBST洗脱4次,然后加入ECL发光液,在超灵敏凝胶成像仪上进行曝光,结果采用Image J软件进行相对定量分析。
1.5统计学处理通过SPSS 17.0进行统计学分析,多组间各指标的比较采用单因素方差分析,组间两两比较,若方差齐采用LSD-t检验,若方差不齐采用Dunnett-t3检验,检验水准α=0.05。
2 结果
2.1TCDD对大鼠睾丸间质细胞增殖的影响见表1。随着染毒剂量的增加,细胞增殖抑制率逐渐增大。
2.2TCDD对大鼠睾丸间质细胞内ROS含量的影响见表1。结果显示,随着TCDD剂量的增加,胞内ROS含量逐渐上升。

表1 5组大鼠睾丸间质细胞增殖抑制率及ROS含量的比较
*:与0 nmol/L对照组比较,P<0.05。
2.3TCDD对大鼠睾丸间质细胞凋亡的影响Annexin V-FITC/PI染色、显微镜下观察,结果见图1。随着染毒剂量的增加,细胞凋亡阳性信号也逐渐增强,说明TCDD可诱导大鼠睾丸间质细胞凋亡。
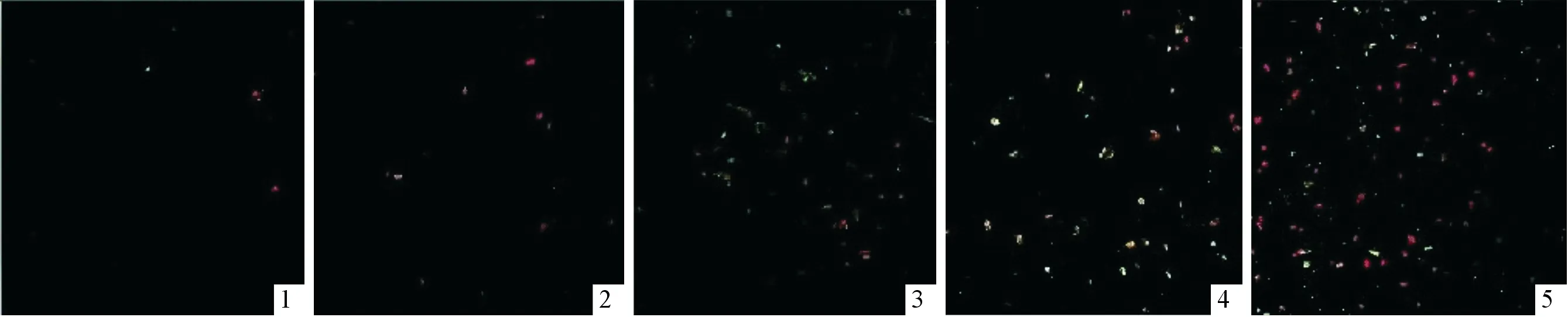
1~5:0、1、5、10、50 nmol/L TCDD组。 图1 5组大鼠睾丸间质细胞凋亡的表现
2.4TCDD对大鼠睾丸间质细胞凋亡相关蛋白表达的影响见图2和表2。结果显示,随着TCDD染毒剂量的增加,大鼠睾丸间质细胞Bax、Caspase-3蛋白相对表达量逐渐升高,而Bcl-2蛋白相对表达量逐渐降低。
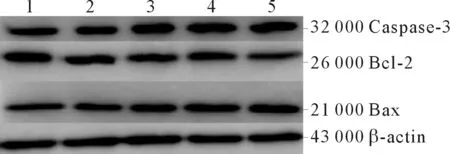
1~5:0、1、5、10、50 nmol/L TCDD组。 图2 5组大鼠睾丸间质细胞凋亡相关蛋白的表达
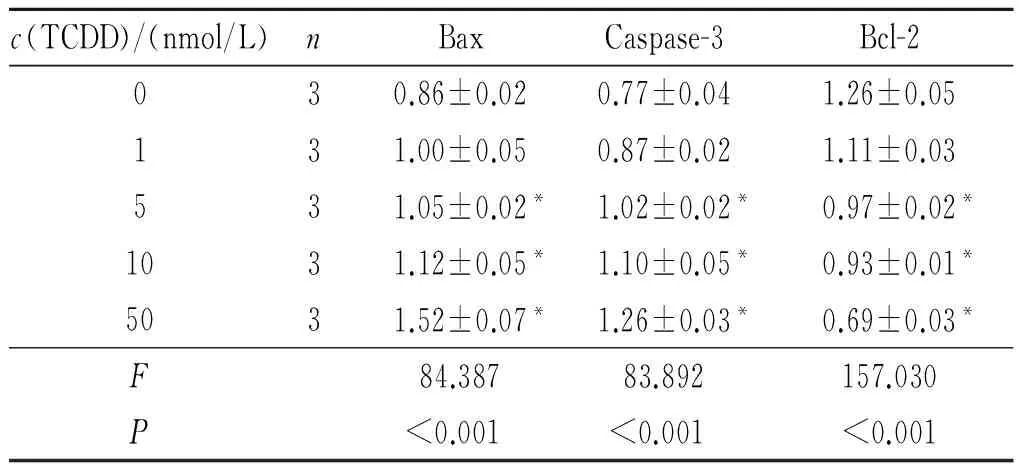
c(TCDD)/(nmol/L)nBaxCaspase-3Bcl-2030.86±0.020.77±0.041.26±0.05131.00±0.050.87±0.021.11±0.03531.05±0.02*1.02±0.02*0.97±0.02*1031.12±0.05*1.10±0.05*0.93±0.01*5031.52±0.07*1.26±0.03*0.69±0.03*F84.38783.892157.030P<0.001<0.001<0.001
*:与0 nmol/L对照组比较,P<0.05。
3 讨论
生命体中,细胞增殖和细胞凋亡处于一个动态平衡的状态,以此维持机体正常的生长发育过程。诱导细胞凋亡的因素十分复杂,涉及物理因素(高温、射线),化学因素(环境内分泌干扰物、强酸、强碱),生物因素(病毒、细菌)等多个方面。在这些因素的刺激下,细胞增殖会受到抑制,并处于病理性凋亡状态。当前研究[10]发现,至少有三条细胞凋亡通路:线粒体通路、内质网通路和死亡受体通路。ROS是一类具有极强氧化能力的活性氧簇,在细胞凋亡中起着关键作用[11]。有研究[12]发现,ROS可破坏线粒体的结构和功能,而线粒体由于呼吸链的断裂反过来又促进细胞内ROS的生成,从而形成一种循环,因此认为ROS参与了线粒体凋亡通路。Bcl-2、Bax是Bcl-2蛋白家族重要成员,Bcl-2为抑制凋亡蛋白,Bax为促进凋亡蛋白,两者通过相互作用参与细胞色素C和其他凋亡因子释放的调节,从而参与线粒体凋亡通路的调节[13]。Caspase-3是细胞凋亡的关键执行因子,其活化标志着凋亡进入不可逆阶段[14-15]。在线粒体通路中,当促凋亡蛋白激活后,其通过线粒体途径诱导Caspase发生级联反应,从而进入凋亡程序,而Bcl-2等抑制凋亡蛋白则可通过抑制细胞色素C的表达,导致Caspase无法激活。
TCDD作为一种污染物,其对雄性生殖系统的影响逐渐受到重视。王亚军等[16]的研究显示,随着玉米赤酶烯酮染毒剂量的增加,大鼠睾丸间质细胞内Bax、Caspase-3蛋白表达量有所增加,而Bcl-2表达量逐渐降低。该研究结果显示,低剂量TCDD染毒24 h对睾丸间质细胞增殖无明显影响,但随着染毒剂量的增加,细胞增殖抑制率显著增加,凋亡细胞增多,说明TCDD可诱导睾丸间质细胞凋亡。研究结果还显示,随着TCDD染毒剂量的增加,睾丸间质细胞内ROS含量也显著升高,同时Bax、Caspase-3蛋白表达上调, Bcl-2蛋白表达下调。研究结果提示,TCDD可能诱导了睾丸间质细胞线粒体通路的细胞凋亡。
综上所述,TCDD能够抑制大鼠睾丸间质细胞的增殖并诱导其凋亡,其机制可能与细胞凋亡的线粒体通路有关。
[1] 杨永滨,郑明辉,刘征涛.二恶英类毒理学研究新进展[J].生态毒理学报,2006,1(2):105
[2] KERKVLIET NI.TCDD: an environmental immunotoxicant reveals a novel pathway of immunoregulation:a 30-year odyssey[J].Toxicol Pathol,2012,40(2):138
[3] 刘云儒,汤乃军,白景文,等.TCDD对SD大鼠肝脏超微结构的影响[J].中国工业医学杂志,2004,17(6):370
[4] IKUTA T,NAMIKI T,FUJII-KURIYAMA Y,et al.AhR protein trafficking and function in the skin[J].Biochem Pharmacol,2009,77(4):588
[5] COLLINS LL,WILLIAMSON MA,THOMPSON BD,et al.2,3,7,8-tetracholorodibenzo-p-dioxin exposure disrupts granule neuron precursor maturation in the developing mouse cerebellum[J].Toxicol Sci,2008,103(1):125
[6] 黄莉,黄韧,冯媛瑜,等.2,3,7,8-四氯苯并二噁英(TCDD)短期染毒可造成着床前胚胎丢失并伴随雌性生殖器官中毒物相关蛋白的诱导表达[J].生态毒理学报,2010,5(3):334
[7] BEYTUR A,CIFTCI O,AYDIN M,et al.Protocatechuic acid prevents reproductive damage caused by 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in male rats[J].Andrologia,2012,44(Suppl 1):454
[8] VELDHUIS JD.Recent neuroendocrine facets of male reproductive aging[J].Exp Gerontol,2000,35(9/10):1281
[9] CHEN H,HARDY MP,ZIRKIN BR.Age-related decreases in Leydig cell testosterone production are not restored by exposure to LH in vitro[J].Endocrinology,2002,143(5):1637
[10]杨绍杰,孟金萍,屈祎,等.细胞凋亡信号传导通路的研究进展[J].中国比较医学杂志,2007,17(5):297
[11]MARTINDALE JL,HOLBROOKNJ.Cellular response to oxidative stress: signaling for suicide and survival[J].J Cell Physiol,2002,192(1):1
[12]薛利剑.MC-LR诱导大鼠睾丸支持细胞凋亡的线粒体-Caspase依赖性途径研究[D].郑州:郑州大学,2015.
[13]SHARPE JC,ARNOULT D,YOULE RJ.Control of mitochondrial permeability by Bcl-2 family members[J].BiochimBiophys Acta,2004,1644(2/3):107
[14]马会明,张永芸,王蒙蒙,等.α-硫辛酸对小鼠卵巢颗粒细胞氧化应激损伤和凋亡的影响[J].西安交通大学学报(医学版),2016,37(1):54
[15]左俐俊,任亚萍.小鼠不动情周期子宫内膜组织中Bcl-2、Bax和Caspase-9蛋白的表达[J].郑州大学学报(医学版),2016,51(2):183
[16]王亚军,刘青,郑王龙,等.玉米赤霉烯酮对Leydig细胞凋亡及caspase-9、caspase-3蛋白表达的影响[J].中国兽医学报,2014,34(1):131
(2017-02-27收稿 责任编辑王 曼)
Effects of TCDD on expressions of apoptosis related proteins and ROS content in leydig cells of rats
YINJun,TANXuemei,ZHANGXiuli,JIMengmeng,TAOYuchang,LIUManman,YUZengli
DepartmentofNutritionandFoodHygiene,CollegeofPublicHealth,ZhengzhouUniversity,Zhengzhou450001
TCDD;leydig cell;apoptosis related protein;rat
Aim: To explore the effects of TCDD on expressions of apoptosis related proteins and ROS content in leydig cells of rats. Methods: Leydig cells from rats were treated with different doses of TCDD(0,1,5,10,50 nmol/L)for 24 hours, and the proliferation inhibition rate of leydig cells was determined by MTT assay, ROS content in leydig cells was determined by DCFH-DA method, apoptosis was observed by confocal microscopy combined Annexin V-FITC/PI staining, and the expressions of Bax, Caspase-3 and Bcl-2 proteins were detected by Western blot.Results: With the increase of the dose of TCDD, the proliferation inhibition rate and ROS content showed a rising trend(P<0.05), the expressions of Bax and Caspase-3 increased whereas that of Bcl-2 protein decreased(P<0.05).Conclusion: TCDD could significantly induce apoptosis of rat leydig cells.
10.13705/j.issn.1671-6825.2017.05.010
R114
*国家自然科学基金资助项目 21577119
#通信作者,女,1970年11月生,博士,教授,研究方向:孕期营养,E-mail:zly@zzu.edu.cn

