氧化石墨烯-二氧化钛纳米材料对吲哚菁绿稳定性及体内分布的影响
李文武,张晓戈,祝 杏,张慧娟#
1)河南省食品药品评价中心 郑州 450018 2)郑州大学药学院药物分析教研室 郑州 450001
氧化石墨烯-二氧化钛纳米材料对吲哚菁绿稳定性及体内分布的影响
李文武1),张晓戈2),祝 杏2),张慧娟2)#
1)河南省食品药品评价中心 郑州 450018 2)郑州大学药学院药物分析教研室 郑州 450001
吲哚菁绿;氧化石墨烯-二氧化钛纳米材料;紫外-可见吸收光谱;稳定性;体内分布
目的:研究氧化石墨烯-二氧化钛纳米材料(TiO2-GO)对吲哚菁绿(ICG)稳定性及体内分布的影响,探讨TiO2-GO/ICG作为光敏剂应用于肿瘤治疗的可能性。方法采用紫外-可见吸收光谱法,研究储存时间及激光照射等因素对ICG 和TiO2-GO/ICG稳定性的影响;并以荷瘤小鼠为模型,静脉注射后,利用小动物活体成像仪观察TiO2-GO对 ICG 体内分布的影响。结果TiO2-GO可以有效增强ICG在常温储存以及近红外激光照射下的稳定性;作为纳米材料,TiO2-GO可显著改善ICG在体内的分布,增强其在肿瘤部位的蓄积。结论TiO2-GO可通过增强ICG稳定性及肿瘤部位蓄积提高其光疗效果。
光疗包括光热治疗和光动力学治疗(PDT),作为一种新的肿瘤治疗手段,具有选择性强、毒副作用低以及非侵入性等优势[1-2]。而在临床应用中,近红外光源(>780 nm)由于组织穿透能力强而被广泛采用。吲哚菁绿(indocyanine green, ICG),作为一种被美国食品药品监督管理局(FDA) 批准用于临床的近红外医学诊断试剂,在肿瘤光疗应用中亦有较大潜力[3-5]。但ICG自身的一些缺陷会大大削弱其治疗效果,如在水溶液中不稳定、光照易分解、体内会被快速清除、肿瘤靶向能力差等[6]。因而,如何提高ICG的稳定性,增加其在肿瘤部位的有效转运是提高其肿瘤光疗效率的关键[7-8]。作者用紫外-可见吸收光谱法研究了实验室自制的氧化石墨烯-二氧化钛纳米材料(TiO2-GO)对ICG稳定性的影响,并用近红外成像方法分析了纳米制剂(TiO2-GO/ICG)对ICG体内分布行为的影响,以期为ICG在肿瘤光疗领域的开发与应用提供实验依据。
1 材料与方法
1.1仪器与材料UV-2102紫外分光光度仪;PN156激光发射器(808 nm);Ti27 Fluke 红外热成像照相机;FX PRO小动物活体成像仪; ICG购自上海金穗生物科技有限公司;TiO2-GO由郑州大学药学院药物分析教研室合成;水为二次蒸馏水;所用试剂均为分析纯。
1.2TiO2-GO/ICG的制备和表征称取2.0 mg TiO2-GO,加入4.0 mL超纯水,超声使之分散,得0.5 g/L的TiO2-GO溶液。称取1.0 mg ICG,加入2.0 mL上述TiO2-GO溶液,探超2 min(超声时间5 s, 间隔3 s,超声次数24次,功率100 W),得0.5 g/L的TiO2-GO/ICG溶液,避光保存。采用紫外可见分光光度法对其进行表征。
1.3稳定性实验
1.3.1 长期稳定性 将ICG和TiO2-GO/ICG水溶液常温(25 ℃)避光保存7 d,在刚配制完以及第2、4和7天分别取出3 mL,检测其紫外可见吸收光谱,考察TiO2-GO对ICG水溶液稳定性的影响。
1.3.2 光照稳定性 取ICG和TiO2-GO/ICG水溶液各20 mL于透明试剂瓶中,使用近红外激光光源(808 nm,1.5 W/cm2)对样品溶液进行处理,每次照射时间30 s,共照射3次。每次照射结束后检测其吸收光谱,考察近红外激光照射下TiO2-GO对ICG稳定性的影响。
1.4体内组织分布取(18~22) g BALB/c雌性小鼠,皮下接种4T1肿瘤细胞,等肿瘤长至100~150 mm3时,尾静脉注射含ICG和TiO2-GO/ICG的PBS溶液(ICG:1.0 mg/kg)。给药不同时间后,在720 nm激发波长和830 nm发射波长处进行活体成像处理,考察纳米材料TiO2-GO对ICG在荷瘤小鼠体内的组织分布及肿瘤蓄积的影响。
2 结果
2.1TiO2-GO/ICG的表征见图1、2。TiO2-GO纳米材料(实验室自制)具有较大的比表面积以及sp2杂化碳,可以作为一种优良的药物载体。ICG结构含离域π键,通过π-π堆积作用可以很容易地负载到TiO2-GO纳米载体上。从图1可知,ICG在近红外区有两个很强的吸收峰,分别位于711 nm和777 nm处。负载于TiO2-GO上后,700~800 nm的吸收光谱发生了显著的变化,证明ICG和TiO2-GO之间存在着较强的共轭作用,从而影响到了ICG分子的微观结构。图2表明TiO2-GO/ICG的电位为-40.5 mV,纳米粒之间通过静电斥力可以稳定的存在于水溶液中,良好的分散性是TiO2-GO/ICG体内应用的基础。
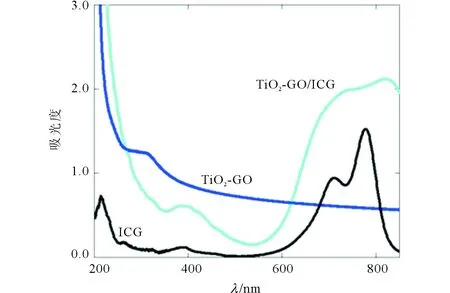
图1 ICG、TiO2-GO和 TiO2-GO/ICG的紫外可见吸收光谱图
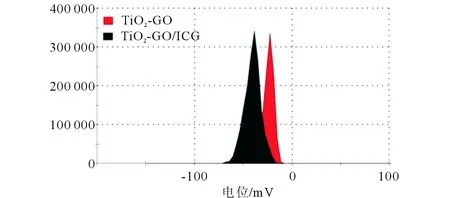
图2 TiO2-GO和 TiO2-GO/ICG的Zeta电位分布
2.2ICG的稳定性见图3。作为一种光敏剂,ICG的稳定性会较大程度的影响其光疗效果。而通过纳米载体负载或包封,可以显著提高ICG的稳定性。从图3A可知,游离的ICG水溶液在避光保存4 d时,ICG在777 nm的吸光度快速下降,到第7天时,ICG的光谱也发生了变化,证明游离的ICG分子在水溶液中不稳定,容易发生降解或结构破坏。图3B表明ICG负载到TiO2-GO上后,常温保存4 d吸光度降低很少,到第7天时吸收光谱亦未发生改变,证明TiO2-GO可以增强ICG在水溶液中的稳定性,显著降低ICG的降解。图3C显示在808 nm激光第一次照射时,游离ICG的吸收光谱便发生了显著改变,随着照射次数的增多,ICG的特征峰消失,结构发生了严重破坏。而TiO2-GO/ICG组(图3D)在激光照射下,除了吸光度降低一些以外,吸收光谱一直很稳定,没有明显的变化。

A:7 d内ICG水溶液吸收光谱的变化;B:7 d内TiO2-GO/ICG水溶液吸收光谱的变化;C: 808 nm激光照射下ICG水溶液吸收光谱的变化;D:808 nm激光照射下TiO2-GO/ICG水溶液吸收光谱的变化。 图3 ICG的稳定性
2.3ICG的体内分布见图4。由于ICG本身具有荧光,可直接用于小动物活体成像,可视化观察其在荷瘤小鼠体内的分布。由图4A和4B可知,给药后0.5 h游离药物(ICG组)主要分布于肝,到达肿瘤的量极少,给药后药物在体内代谢较快。负载于TiO2-GO上后,药物(TiO2-GO/ICG组)在肿瘤部位的蓄积增加,且在体内的半衰期延长;给药后8 h,在体内,特别是肿瘤部位,依然有较强的荧光。8 h后解剖小鼠,荧光强度统计结果(图4C)显示,TiO2-GO/ICG组肿瘤部位的荧光强度是ICG组的8.4倍。这说明纳米材料TiO2-GO可以通过高渗透长滞留效应增加ICG在肿瘤部位的蓄积,同时由于与ICG的强共轭作用,可实现ICG在体内的缓慢释放,延长其半衰期。

A:静脉注射后不同时间ICG和TiO2-GO/ICG在4T1荷瘤小鼠活体内的分布;B:给药8 h后,各个脏器内ICG的近红外成像(a:TiO2-GO/ICG组,b:ICG组);C:各个脏器荧光强度定量分析。 图4 ICG的体内分布
3 讨论
作为光敏剂,ICG的稳定性及体内分布代谢特征是决定其光疗效果的关键因素。作者使用紫外可见吸收光谱法及小动物活体成像法分析了TiO2-GO纳米材料对ICG稳定性及体内分布行为的影响。结果表明,TiO2-GO可显著增强ICG在正常储存及近红外激光照射下其水溶液的稳定性,保护其结构不被降解或破坏。通过高渗透长滞留效应,TiO2-GO可增加ICG在4T1荷瘤小鼠肿瘤部位的靶向蓄积。二者之间的共轭作用亦可延缓ICG在体内的代谢速度。这些特性为ICG在肿瘤光疗领域的开发与应用提供了新思路。
[1] PUNJABI A,WU X,TOKATLI-APOLLON A,et al.Amplifying the red-emission of upconverting nanoparticles for biocompatible clinically used prodrug-induced photodynamic therapy[J].ACS Nano,2014,8(10):10621
[2] 刘慧龙,刘端祺,介雅慧,等. 激光光动力疗法治疗皮肤恶性肿瘤的临床研究[J]. 解放军医学杂志, 2007, 32(4): 396
[3] CHEN R,WANG X,YAO X,et al.Near-IR-triggered photothermal/photodynamic dual-modality therapy system via chitosan hybrid nanospheres[J].Biomaterials,2013,34(33):8314
[4] ZHAO P,ZHENG M,YUE C,et al.Improving drug accumulation and photothermal efficacy in tumor depending on size of ICG loaded lipid-polymer nanoparticles[J].Biomaterials,2014,35(23):6037
[5] LI Y,WEN T,ZHAO R,et al.Localized electric field of plasmonic nanoplatform enhanced photodynamic tumor therapy[J].ACS Nano,2014,8(11):11529
[6] YAN F,WU H,LIU H,et al.Molecular imaging-guided photothermal/photodynamic therapy against tumor by iRGD-modified indocyanine green nanoparticles[J].J Control Release,2016,224:217
[7] BEZIERE N,LOZANO N,NUNES A,et al.Dynamic imaging of PEGylated indocyanine green (ICG) liposomes within the tumor microenvironment using multi-spectral optoacoustic tomography (MSOT)[J].Biomaterials,2015,37:415
[8] 张艳艳,张晓艳,付旭东,等.紫杉醇肿瘤靶向给药系统对 MCF-7 细胞的抑制作用观察[J].郑州大学学报(医学版), 2013,48(5):595
(2016-12-01收稿 责任编辑赵秋民)
Influence of graphene oxide-titanium dioxide nanomaterial on the stability andinvivodistribution of indocyanine green
LIWenwu1),ZHANGXiaoge2),ZHUXing2),ZHANGHuijuan2)
1)FoodandDrugEvaluationCenterofHenanProvince,Zhengzhou450018 2)DepartmentofPharmaceuticalAnalysis,SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001
indocyanine green;graphene oxide-titanium dioxide nanomaterial;UV-Vis absorption spectra;stability;invivodistribution
Aim: To investigate the influence of graphene oxide-titanium dioxide nanomaterial(TiO2-GO) on the stability andinvivodistribution of indocyanine green(ICG). To explore the possibility of TiO2-GO/ICG used for cancer treatment as a photosensitizer. Methods: UV-Vis absorption spectrum was used to evaluate the impact of storage time and laser irradiation on the stability of ICG and TiO2-GO/ICG. The effects of TiO2-GO oninvivodistribution of ICG were observed in 4T1 tumor-bearing mice by intravenous injection. Results: The results showed that TiO2-GO could enhance storage stability of ICG at room temperature and under near-infrared laser irradiation. As a nanomaterial, TiO2-GO could significantly improve theinvivodistribution of ICG and enhance its accumulation in the tumor. Conclusion: TiO2-GO can improve the phototherapy effect of ICG by enhancing its stability and tumor accumulation.
10.13705/j.issn.1671-6825.2017.05.012
R917
#通信作者,女,1986年1月生,博士,讲师,研究方向:肿瘤靶向治疗,E-mail:zhanghuijuan4@163.com

