肠道病毒71型荧光定量PCR方法的比较与评价*
赵伊珂,卫海燕,黄学勇,程宁宁,潘静静,王若琳,许汴利,郭万申#
1)郑州大学公共卫生学院流行病学教研室 郑州 450001 2)河南省疾病预防控制中心传染病预防控制所 郑州 450016
肠道病毒71型荧光定量PCR方法的比较与评价*
赵伊珂1),卫海燕2),黄学勇2),程宁宁1),潘静静2),王若琳2),许汴利2),郭万申1)#
1)郑州大学公共卫生学院流行病学教研室 郑州 450001 2)河南省疾病预防控制中心传染病预防控制所 郑州 450016
肠道病毒71型;荧光定量PCR;TaqMan 探针
目的:定量检测肠道病毒71型(EV71)临床标本中病毒拷贝数,评价3种商业化TaqMan探针荧光定量PCR方法。方法将VP1全序连接到克隆质粒pMAL-c2X上,纯化的质粒作为标准品。选取河南开封手足口病监测试点的105份手足口病患儿粪便标本,分别应用bioPerfectus Technologies(方法A)、KINGHAWK(方法B)和Beijing ABT(方法C)公司的荧光定量PCR方法进行检测,比较EV71阳性检出率和定量分析结果的差异,分析3种方法的一致性。结果成功构建重组质粒并绘制标准曲线,方程为Y=-3.35X+47.49;分别用方法A、B、C对105份标本进行检测,EV71阳性检出率分别为41.90%(44/105)、42.86%(45/105)和41.90%(44/105),差异无统计学意义(P=0.987);CT值分别为(24.34±3.92)、(25.08±3.94)和(14.17±3.19),差异有统计学意义(P<0.001),方法C测得的CT值小于方法A和B(P<0.05);3种方法最低检测限值分别为102、10和102拷贝,灵敏度分别为93.62%、95.74%和93.62%,特异度分别为100.00%、75.00%和100.00%;一致性分析结果显示,3种方法一致性较差。结论商业化的EV71荧光定量PCR试剂盒适用于定性检测临床标本,定量检测EV71方法需要进一步研究。
自20世纪70年代初首次报道手足口病与肠道病毒71型(EV71)感染有关以来,全球多个国家相继报道了EV71相关手足口病的大规模爆发和流行情况[1-3]。报道[4]显示EV71感染是重症手足口病患者发病的主要危险因素,因此,及时、快速、准确检测EV71病毒对于治疗手足口病和保护高危人群至关重要。虽然荧光定量PCR方法检测EV71的分子诊断技术已经得到大力发展[5],但目前实验室使用的诊断方法良莠不齐。该研究采用3种商业化TaqMan探针荧光定量PCR方法,即bioPerfectus Technologies(方法A)、KINGHAWK(方法B)和Beijing ABT(方法C)3个公司的EV71荧光定量PCR方法检测临床标本和毒株,通过定性和定量比较,系统评价3种商业化荧光定量PCR试剂盒,为研究人员选择定量方法提供参考意见。
1 材料与方法
1.1标本、毒株、细胞及载体2016年于河南开封监测试点收集的105份手足口病患儿粪便标本,年龄均小于3岁;毒株:EV71,柯萨奇病毒A组(CA)4、5、6、10、16,柯萨奇病毒B组(CB)2、5,埃可病毒6(ECHO6),河南省疾病预防控制中心分子实验室保存;细胞:RDa细胞、Hep-2细胞、DH5α感受态细胞(Tiangen公司);载体:pMAL-c2X(英国NEB公司)。
1.2仪器与试剂ABI 7500 Fast荧光定量PCR仪(美国生命技术公司)、PCR仪(德国Jena公司)、全自动核酸提取仪(苏州天隆生物科技有限公司)、微量核酸蛋白测定仪(Eppendorf公司)、凝胶图像分析仪(美国Syngene公司)等。病毒RNA/DNA提取试剂盒(苏州天隆生物科技有限公司)、PCR产物纯化试剂盒(Foregene公司)、一步法RT-PCR试剂盒(Qiagen公司)、质粒纯化试剂盒4.0(TaKaRa公司)等。
1.3VP1全序克隆对河南省疾病预防控制中心分子实验室保存的EV71毒株进行VP1全序(891 bp)扩增。引物序列如下。P3:5’-CGGGATCCAT GGGAGATAGGGTGGCAG-3’;P4:5’-CGCCTGCAGT TAAAGAGTGGTGATCGC-3’。P3含有BamH酶切位点,P4含有Pst1酶切位点。反应条件:95 ℃ 5 min; 94 ℃ 30 s,45 ℃ 45 s, 72 ℃ 45 s,35个循环;72 ℃ 10 min。PCR产物纯化后与pMAL-c2X载体连接,连接产物转化DH5α感受态细胞。PCR初步鉴定后,重组质粒和PCR产物送南京金斯瑞生物科技有限公司测序。测序结果用DNAssist 2.2进行分析。
1.4标准曲线和最低检测限值用质粒纯化试剂盒提取克隆质粒后,用微量核酸蛋白测定仪测定质粒浓度和纯度(测定3次,取平均值),10倍倍比稀释,测定3种荧光定量PCR方法检测范围,建立标准曲线。每次实验平行做2孔。
1.5临床标本前处理和检测离心管中加1 g玻璃珠、10 mL PBS、1 mL氯仿、约2 g标本,振荡20 min后,室温1 500×g离心10 min,取上清液待用。提取病毒核酸:按照病毒RNA提取试剂盒说明书,在配套的全自动核酸提取仪上操作,提纯产物-80 ℃保存待用。定量PCR:分别用3种方法进行荧光定量PCR检测,观察结果并记录CT值,反应条件严格参照说明书,在ABI 7500 Fast荧光定量PCR仪上进行扩增和结果分析。测序:105份标本染毒RD细胞,盲传2代后,进行RT-PCR扩增,产物送南京金斯瑞生物科技有限公司测序。CA4、CA5、CA6、CA10、CA16、CB2、CB5、ECHO6毒株用RD和Hep-2细胞进行培养,培养产物PCR鉴定后,分别用3种荧光定量方法进行检测,每次实验平行做2孔,进行特异性评价。
1.6统计学处理采用 SAS 9.1和MedCalc 13.1进行统计学分析。不同组间EV71阳性率的比较采用χ2检验;不同组间EV71 CT值的比较采用单因素方差分析,组间两两比较采用SNK-q检验;一致性分析采用Altman-Bland法。检验水准α=0.05。
2 结果
2.1VP1全序克隆阳性克隆菌落(白斑)增菌培养后,提取质粒,鉴定克隆结果。重组质粒PCR产物电泳的条带位置与EV71毒株扩增产物的条带相同,为945 bp,证明质粒构建成功,见图1。
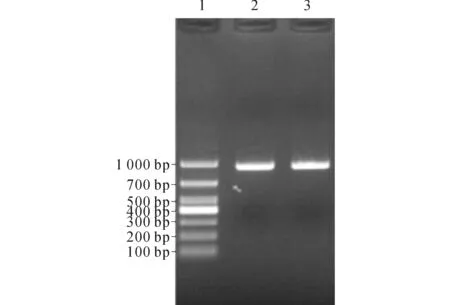
1~3:分别为DNA Marker DL1000、重组质粒PCR产物、毒株扩增产物。 图1 重组质粒电泳鉴定结果
2.2标准曲线微量核酸蛋白测定仪检测到的质粒浓度为53.0 g/L,A(260 nm)/A(280 nm)等于1.84,10倍倍比稀释后在ABI 7500 Fast荧光定量PCR仪上做标准曲线;标准曲线方程为Y=-3.35X+47.49,截距为3.35,决定系数R2=0.999,PCR扩增效率为98.83%,曲线具有较好的相关性且有较宽的线性范围。
2.3临床标本和毒株检测结果用A、B、C 3种荧光定量方法分别检测105份临床标本,EV71阳性检出率分别为41.90%(44/105)、42.86%(45/105)和41.90%(44/105),差异无统计学意义(χ2=0.026,P=0.987)。
克隆质粒标准品10倍倍比稀释检测3种方法的检测低限,方法B最灵敏。以测序结果为金标准(105份临床标本处理后,PCR产物测序结果显示47例为EV71)计算灵敏度,方法B最高;7例非EV71毒株用3种方法复孔检测,得到特异度,方法B最低。见表1。
用3种方法检测的105份临床标本中,均为阳性的标本有44例。方法A、B和C检测44份标本的CT值分别为(24.34±3.92)、(25.08±3.94)和(14.17±3.19),3组CT值比较,差异有统计学意义(F=119.120,P<0.001);且方法A和方法B检测的CT值比较,差异无统计学意义(P>0.05),方法A、B与方法C检测的CT值比较,差异均有统计学意义(P<0.05)。
以 A方法为参考,A方法与B方法相比,2.27%(1/44)的点在95%一致性界限以外,差值的均值为-0.7;方法A与方法C相比,4.54%(2/44)的点在95%一致性界限以外,差值的均值为10.2。在一致性界限范围内,方法A与方法B和C相比,差值的绝对值最大为3.80和13.74。方法A和B有较好的一致性,方法A和C一致性较差。

表1 3种方法定量检测结果
3 讨论
手足口病实验室诊断的“金标准”[6]虽然是病毒分离,但由于其敏感性差、操作复杂、耗时长等缺点,核酸检测逐渐取代病毒分离,成为手足口病病原学检测新的“金标准”[7]。该实验以高通量测序为金标准,对105份临床标本进行检测,发现3种方法真阳性率都超过90%,这与文献[8-9]报道一致,表明3种方法进行定性检测时灵敏度都非常高。手足口病病毒定量方法包括组织半数感染量测定法[10]、空斑形成单位法[11]和荧光定量PCR法,前两种因操作复杂、结果不够准确逐渐被取代,也有研究[9,12]对荧光定量PCR方法进行比较,但未做定量比较。该实验用稳定表达的克隆质粒做标准品,对3种方法进行定量比较,均为阳性的44份标本CT值均值分别为(24.34±3.92)、(25.08±3.94)和(14.17±3.19),3组间比较,差异有统计学意义,且方法C检测的CT值小于方法A和B。分析其原因,可能是由于方法C加样量(6 μL)大于方法A和B(均为5 μL),模板量影响了荧光信号进入指数增长阶段的阈值;观察扩增曲线发现,S曲线的平台期出现情况分别为方法A>方法B>方法C,分析其原因,可能是由于方法A循环数大于方法B循环数和方法C循环数,扩增条件不同扩增曲线的形状不一致;用3种方法检测7份非EV71毒株时,方法B检测CA4和CB2阳性,推测方法B的扩增过程中可能产生了非特异性的扩增,该方法需要针对特异性进行进一步的优化。
综上所述,商业化的荧光定量PCR试剂盒可用于定性检测EV71感染的手足口病临床标本,而对于EV71病毒的定量检测方法,则需要进一步改进和开发。
[1] 宋远斌,陈志江,曾其毅,等.肠道病毒71型感染致中枢神经系统损伤机制的研究进展[J].实用儿科临床杂志,2012,27(22):1765
[2] 许红梅,赖方方.肠道病毒71型对神经系统和免疫功能的影响及疫苗研究进展[J].实用儿科临床杂志,2012,27(22):1701
[3] 杨镒宇.重症肠道病毒71感染与多脏器功能损害[J].实用儿科临床杂志,2012,27(6):397
[4] 冯慧芬,赵秋民,段广才,等.重症手足口病主要危险因素的Meta分析[J].吉林大学学报(医学版),2015,41(5):974
[5] 严菊英,卢亦愚,徐昌平.肠道病毒EV71荧光定量RT-PCR法快速检测[J].中国公共卫生,2009,26(7):843
[6] 手足口病预防控制指南:2008年版[J].中国乡村医药,2009,16(S1):6
[7] 秦楠,栗东芳,杨瑞馥.高通量测序技术及其在微生物学研究中的应用[J].微生物学报,2011,51(4):445
[8] TAN EL,YONG LL,QUAK SH,et al.Rapid detection of enterovirus 71 by real-time TaqMan RT-PCR[J].J Clin Virol,2008,42(2):203
[9] 李华,杨婷,姜广菊,等.EV71及CA16不同检测方法敏感度及特异性比较[J].医学研究杂志,2015,44(1):58
[10]HU X,ZHANG Y,ZHOU X,et al.Simultaneously typing nine serotypes of enteroviruses associated with hand, foot, and mouth disease by a GeXP analyzer-based multiplex reverse transcription-PCR assay[J].J Clin Microbiol,2012,50(2):288
[11]LIOU AT,WU SY,LIAO CC,et al.A new animal model containing human SCARB2 and lacking stat-1 is highly susceptible to EV71[J].Sci Rep,2016,6:31151
[12]卫海燕,黄学勇,许玉玲,等.EV71病毒核酸快速检测方法的比较[J].病毒学报,2012,28(6):670
(2016-12-28收稿 责任编辑姜春霞)
Comparison and evaluation of different fluorescent quantitative PCR methods for enterovirus 71
ZHAOYike1),WEIHaiyan2),HUANGXueyong2),CHENGNingning1),PANJingjing2),WANGRuolin2),XUBianli2),GUOWanshen1)
1)DepartmentofEpidemiology,CollegeofPublicHealth,ZhengzhouUniversity,Zhengzhou450001 2)InstituteforInfectiousDiseaseControlandPrevention,HenanProvincialCenterforDiseaseControlandPrevention,Zhengzhou450016
enterovirus 71; fluorescent quantitative PCR; TaqMan probe
Aim: To determine copy number of the enterovirus 71(EV71) in clinical specimens by quantitative analysis, and compare 3 commercial TaqMan fluorescence quantitative PCR methods systematically and comprehensively.Methods: VP1 sequence of EV71 was inserted into cloning vector pMAL-c2X. The purified plasmid was used as the standard sample for quantitative detection of 105 clinical specimens collected from the special monitoring system of HFMD in Henan Province. Positive rate and CT value among the 3 commercial TaqMan fluorescence quantitative PCR methods from bioPerfectus Technologies(method A), KINGHAWK(method B), and Beijing ABT(method C) were compared, and consistency was analyzed.Results: The recombinant plasmid pMAL-c2X was constructed successfully. Standard curve equation wasY=-3.35X+47.49.For 105 specimens, positive rate of EV71 measured by method A, B, and C was 41.90%(44/105), 42.86%(45/105), and 41.90%(44/105), respectively, and the difference was not significant(P=0.987). Among positive specimens, copy number by method C(14.17±3.19) was less than method A(24.34±3.92) and B(25.08±3.94), and the difference was significant(P<0.05). For 3 methods, the limit of detection was 102, 10, and 102copies; sensitivity was 93.62%, 95.74%, and 93.62%; specificity was 100.00%, 75.00%, and 100.00%. The result of 3 methods showed poor consistency.Conclusion: EV71 fluorescence quantitative PCR kit for commercialization is suitable for the qualitative detection of clinical samples; however, it needs further study for the quantitative detection of EV71.
10.13705/j.issn.1671-6825.2017.05.006
R373.2
*国家自然科学基金资助项目 81573204;河南省杰出青年资助项目 164100510008;河南省科技厅项目 122102310268
#通信作者,男,1966年4月生,本科,主任医师,研究方向:流行病学,E-mail:cdcgws@163.com
——一道江苏高考题的奥秘解读和拓展

