透明质酸修饰的氧化石墨烯负载米托蒽醌载药体系在乳腺癌模型裸鼠体内的药动学特征和组织分布*
贾 欣,冯倩华,张宛霞,李玉真,杨雪梅,杜 娟
郑州大学药学院 郑州 450001
透明质酸修饰的氧化石墨烯负载米托蒽醌载药体系在乳腺癌模型裸鼠体内的药动学特征和组织分布*
贾 欣,冯倩华,张宛霞,李玉真,杨雪梅,杜 娟#
郑州大学药学院 郑州 450001
米托蒽醌;透明质酸;药动学;组织分布;小鼠;MCF-7细胞
目的:考察透明质酸(HA)修饰的氧化石墨烯(GO)负载米托蒽醌(MIT)载药体系(MIT/HA-GO)在乳腺癌模型裸鼠体内的药动学特征和组织分布。方法建立MIT测定的高效液相色谱法。荷瘤小鼠由尾静脉分别注射MIT、MIT/GO以及MIT/HA-GO,用上述方法检测MIT浓度,分析其在小鼠体内的药动学特征及在心、肝、肺、肾、瘤等部位的分布情况。结果与MIT组相比,MIT/GO组及MIT/HA-GO组MIT的血循环时间均延长,且在心、肺、肾的AUC降低;MIT/GO及MIT/HA-GO在肿瘤组织的靶向效率分别为MIT的1.55和2.61倍。结论MIT/HA-GO载药体系降低了MIT的全身毒副作用并提高了对肿瘤部位的靶向性。
米托蒽醌(mitoxantrone,MIT)为蒽醌类广谱抗肿瘤药物,与阿霉素结构类似,可广泛应用于乳腺癌、原发性肝癌及恶性淋巴瘤的治疗[1-3]。但该药静脉滴注后在体内的半衰期短,同时具有较大的分布容积,可快速分布在心脏、骨髓、肺、肾中,且有长期全身毒副作用[4]。组织选择性差及肿瘤细胞耐药性限制了MIT在临床上的应用。针对该问题,研究者们将目光转向了肿瘤靶向纳米转运系统。纳米(50~250 nm)载药体系可利用实体瘤的高通透性和滞留效应将药物被动靶向到肿瘤组织中,并延长药物血循环时间[5-6]。另外,研究[7]发现乳腺癌、宫颈癌、膀胱癌等癌细胞表面高表达CD44受体,而天然黏多糖透明质酸(hyaluronic acid,HA)作为CD44配体可与之特异性结合,通过CD44受体介导的内吞作用被摄取到肿瘤细胞内。故HA可作为一种主动靶头修饰到纳米载体上,从而提高肿瘤对纳米载体的摄取率。作者采用氧化石墨烯(graphene oxide,GO)纳米载体负载化疗药物MIT,然后在GO表面修饰上HA,制备得MIT/HA-GO。以荷人乳腺癌MCF-7细胞小鼠为模型,采用高效液相色谱法考察MIT/HA-GO在体内的药动学参数及组织分布情况。
1 材料与方法
1.1材料盐酸MIT(北京益康思达科技有限公司),GO(南京吉仓纳米科技有限公司),透明质酸钠(山东福瑞达生物医药有限公司),MIT/HA-GO(自制),甲醇(色谱纯)、乙酸铵、磺基水杨酸、抗坏血酸、枸橼酸钠均购自天津市恒兴化学试剂制造有限公司。MCF-7细胞株(中科院上海生命科学研究院细胞资源中心);BALB/C裸鼠,SPF级,雌性,购自湖南斯莱克景达实验动物有限公司。JY 92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份公司),Agilent1200高效液相色谱仪(美国Agilent公司)。
1.2色谱条件Agilent1200高效液相色谱仪;色谱柱:C18柱(150 mm×4.6 mm,5 μm);流动相:甲醇与0.2 mol/L 乙酸铵水溶液(pH 3)体积比4258;检测波长:663 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:20 μL[8-9]。
1.3MCF-7荷瘤裸鼠模型的构建和样品预处理取BALB/C裸鼠,于右腋皮下注射MCF-7细胞(3×106mL-1,0.2 mL)。接种7~10 d后,肿瘤体积达到(100±20) mm3时,即认为MCF-7荷瘤裸鼠模型构建成功。荷瘤裸鼠经尾静脉注射给药(MIT,5 mg/kg)后进行眼眶静脉丛采血。将采集的血样置于含有肝素的离心管中,3 000 r/min离心5 min,分离血浆。取小鼠血浆0.5 mL,加入50 μL含50 g/L抗坏血酸的0.1 mol/L枸橼酸盐缓冲液(pH 3.0)后涡旋混合。脱颈处死小鼠后将各组织洗净称重,小鼠各个组织(心、肝、肺、肾、瘤)先用生理盐水洗净,用滤纸吸干后精密称重组织样品,按组织的重量(g)与生理盐水、含50 g/L抗坏血酸的0.1 mol/L枸橼酸盐缓冲液(pH 3.0)以不同配比(肝、肾、瘤为120.2,肺为130.3,心为140.4)加入匀浆,制备成组织匀浆。然后每200 μL组织匀浆或血浆再加入50 μL磺基水杨酸和150 μL甲醇沉淀蛋白,涡旋混匀1 min,4 ℃下12 000 r/min离心15 min,取上清液进行HPLC测定[10]。
1.4方法专属性考察将空白血浆、空白血浆混合MIT溶液和1.3中制备的给药后裸鼠血浆样品按1.2色谱条件进行HPLC分析,记录色谱图。
1.5标准曲线的建立及回收率、精密度考察取1.3中小鼠各组织匀浆,加入一定量的MIT标准品溶液,分别制成组织系列样品,按照1.3项下处理进样,测定MIT浓度,得到各组织的标准工作曲线。同时根据标准曲线范围选取出高、中、低不同浓度的组织质控样品,考察各组织样品的回收率、精密度。
1.6体内药动学和组织分布观察将荷瘤裸鼠分为3组,每组6只,经尾缘静脉分别注射MIT溶液、MIT/GO和MIT/HA-GO,给药剂量为5 mg/kg。在给药后5、15、30 min及1、3、6、8、12、24 h取血样和组织,按1.3项下处理,并通过标准曲线计算药物浓度。将药时曲线用PK Solver软件拟合,计算药动学参数及各组织AUC0-inf及MRTinf以及不同组织的靶向效率Te。
2 结果
2.1方法专属性考察结果见图1。如图1所示,MIT保留时间约为5.8 min,MIT样品峰与杂质峰分离良好,药物峰不受内源性物质干扰。

A:空白血浆;B:空白血浆混合MIT溶液;C:给药后裸鼠血浆样品。 图1 裸鼠血浆样品色谱图
2.2标准曲线绘制及回收率、精密度考察各组织标准曲线的回归方程、线性范围及相关系数(r)见表1。在标准曲线范围内,方法的批内、批间精密度RSD均小于3%,方法回收率为96.95%~101.74%,提取回收率为84.57%~93.80%,符合生物样品分析要求。

表1 各组织的标准曲线
A:药时曲线下面积;C:MIT的浓度。
2.3 3组药动学参数和药时曲线的比较用PK Solver软件分析药动学参数如表2所示。MIT和MIT/GO均符合二室模型,而MIT/HA-GO符合三室模型。MIT、MIT/GO、MIT/HA-GO的消除半衰期[t1/2(β)]分别为1.76、2.33、4.60 h,说明MIT/HA-GO肿瘤靶向制剂显著延缓了MIT的消除速度。另外,与MIT比较,MIT/HA-GO的曲线下面积(AUC)增大,药物体内平均滞留时间(MRT)延长,清除率(CL)降低,说明MIT/HA-GO在不同程度上改善了MIT的体内过程,提高了生物利用度。3组小鼠的体内药时曲线如图2所示。研究结果表明,MIT/GO和MIT/HA-GO组各时间点的血药浓度均提高,说明MIT/HA-GO给药系统延长了药物的血循环时间。

表2 各组给药后MIT药动学参数
Vc:表观分布容积;t1/2(pi):深室分布半衰期;t1/2(α):浅室分布半衰期;t1/2(β):消除半衰期;AUMC:统计矩时间曲线下面积。
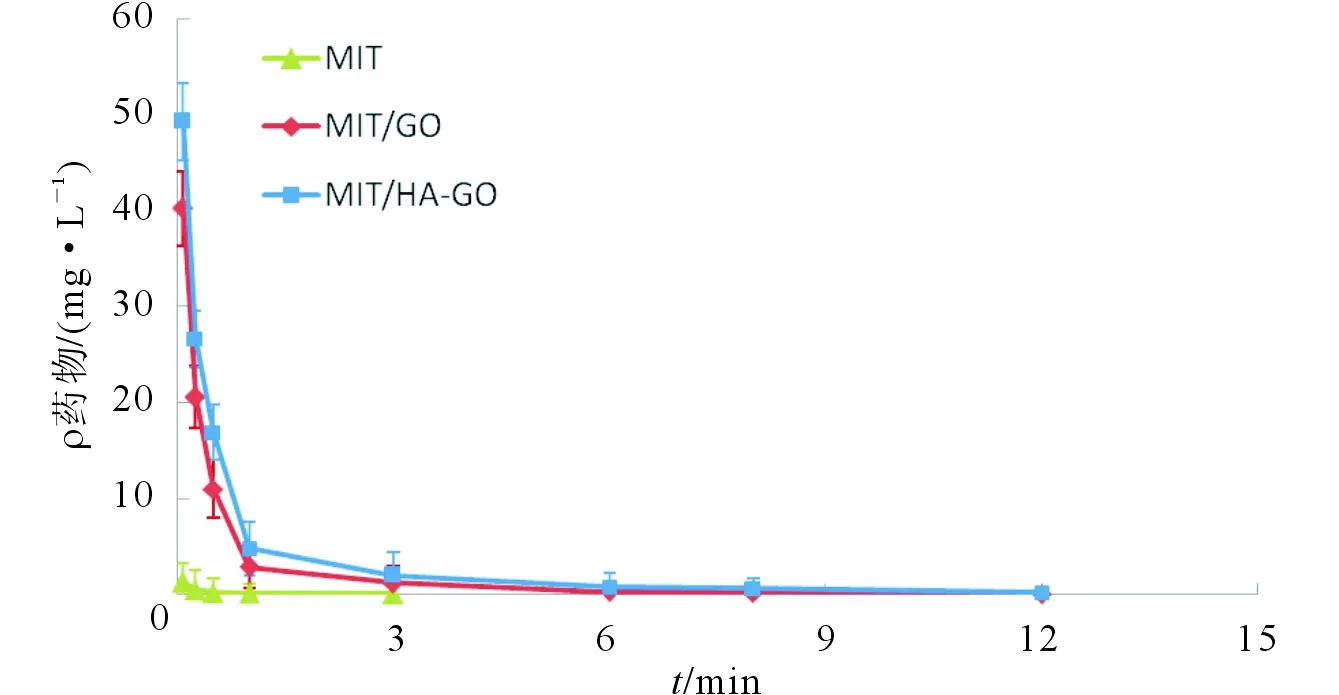
图2 3组血浆MIT的药时曲线
2.4 3组MIT体内组织分布状况的比较3组小鼠各脏器药物分布如图3所示。利用PK Solver软件得出各组织的AUC0-inf及MRTinf,见表3。结果表明,MIT/HA-GO组和MIT/GO组MIT的体内分布特征发生了改变,在心、肺、肾的AUC显著降低,在肿瘤组织的靶向效率(Te)分别为MIT组的1.55和2.61倍,说明该制剂可以有效降低MIT在临床应用中的心、肺、肾毒性,提高肿瘤组织靶向性。
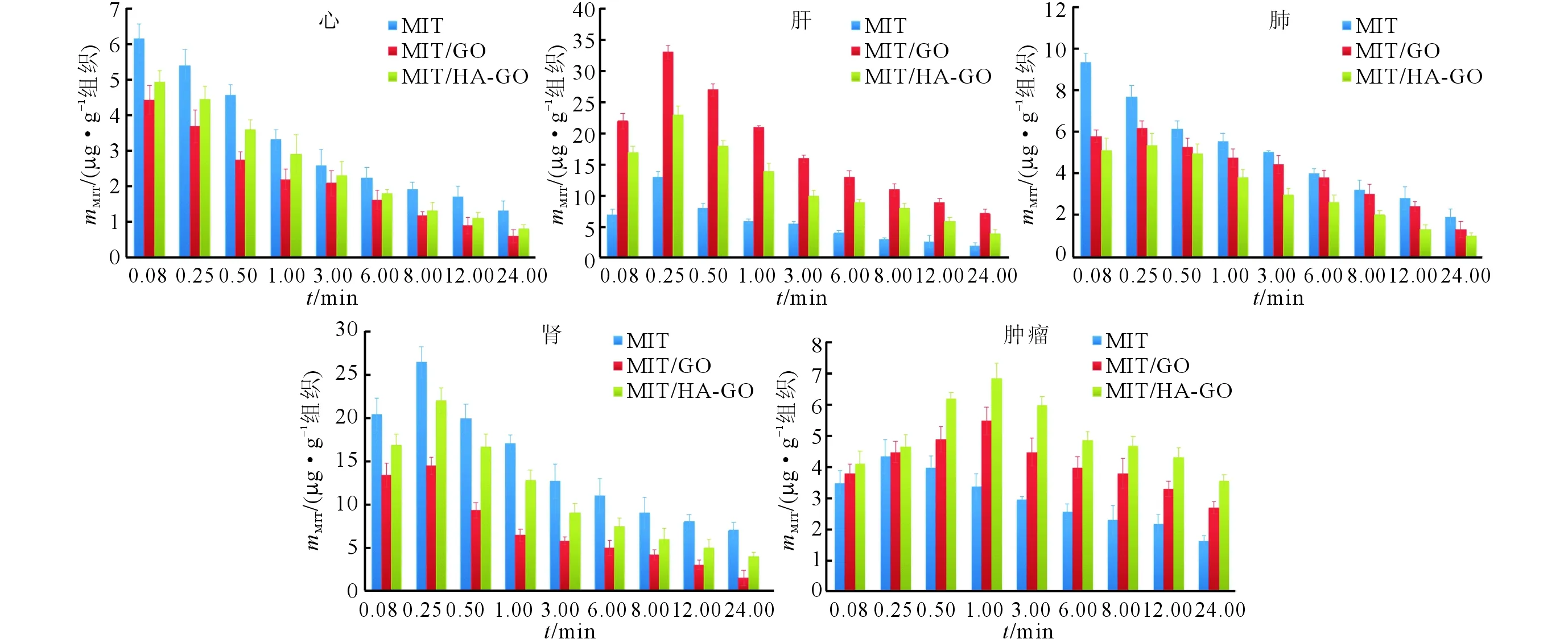
图3 各制剂MIT的组织分布
3 讨论
MIT存在骨髓抑制、脱发等全身毒性,且肿瘤细胞易对其产生耐药性,限制了其临床应用范围。该研究中作者用GO负载MIT并用HA修饰,得到MIT/HA-GO,结果表明MIT/HA-GO可明显改变MIT在小鼠体内的药动学特征:MIT的消除速度显著放缓,药物血循环时间延长,这些体内过程的改善可能与HA-GO装载的MIT可缓慢释放以及载体系统在体内滞留时间长有关[11-12]。
组织分布实验中MIT游离药物在各组织均有较大的分布容积,组织选择性差。MIT/GO制剂有良好的肿瘤靶向性,这是由于GO等纳米材料可通过高通透性和滞留效应被动靶向渗透进入肿瘤组织,但同时也发现该制剂在肝组织有较多的分布,推测为该纳米颗粒容易被肝巨噬细胞吞噬而滞留导致[13]。MIT/HA-GO制剂可在一定程度上降低肝脏吞噬并更多地分布于肿瘤组织,原因可能为HA配体作为主动靶头与乳腺癌细胞表面高表达的CD44受体特异性结合,通过CD44受体介导的内吞作用被癌细胞摄取[14]。
综上所述,MIT/HA-GO作为一种有潜力的肿瘤靶向药物传递系统,可高效靶向肿瘤细胞,这为肿瘤的有效治疗开拓了新的途径。关于其在体内的药效学和安全性评价等需进一步研究。
[1] HOU L,FENG Q,WANG Y,et al.Multifunctional hyaluronic acid modified graphene oxide loaded with mitoxantrone for overcoming drug resistance in cancer[J].Nanotechnology,2016,27(1):15701
[2] 欧阳学农,王文武,彭永海,等.GMEP方案治疗难治性或复发性非霍奇金淋巴瘤的近期疗效报告[J].解放军医学杂志,2005,30(8):726
[3] 雷巧,陶静楠.蒽环类药物相关研究进展[J].医学信息,2015,28(10):340
[4] HOU L,FENG QH,WANG YT,et al.Multifunctional nanosheets based on hyaluronic acid modified graphene oxide for tumor-targeting chemophotothermal therapy[J].J Nanoparticle Res,2015,17(3):162
[5] 梁春丽,沈国鹏,王舒雨,等.5-氟尿嘧啶固体脂质纳米粒对S180腹水瘤小鼠的抑瘤作用[J].郑州大学学报(医学版),2010,45(4):579
[6] 王艳芝,郑甲信,徐炳欣,等.盐酸小檗碱固体脂质纳米粒包封率的聚结离心法测定[J].郑州大学学报(医学版),2009,44(1):188
[7] CHOI KY,SARAVANAKUMAR G,PARK JH,et al.Hyaluronic acid-based nanocarriers for intracellular targeting: interfacial interactions with proteins in cancer[J].Colloids Surf B Biointerfaces,2012,99(1):82
[8] 熊素彬,陆彬,杨红,等.RP-HPLC法研究米托蒽醌白蛋白纳米粒在大鼠的体内分布和淋巴结靶向性[J].药物分析杂志,2006,26(8):1043
[9] 张良珂,侯世祥,卢懿,等.叶酸受体介导米托蒽醌白蛋白纳米粒的体内分布及药效学研究[J].中国药学杂志,2007,42(9):676
[10]庄婕,石勇平,平其能,等.壳聚糖包覆米托蒽醌脂质体在荷瘤小鼠体内的组织分布及药效学[J].中国药科大学学报,2010,41(4):353
[11]ZHANG RX,CAI P,ZHANG T,et al.Polymer-lipid hybrid nanoparticles synchronize pharmacokinetics of co-encapsulated doxorubicin-mitomycin C and enable their spatiotemporal co-delivery and local bioavailability in breast tumor[J].Nanomedicine,2016,12(5):1279
[12]张兰,杜艳玲,刘勋涛,等.盐酸米托蒽醌脂质体的制备及药效学、药动学研究[J].中国药学杂志,2013,48(17):1475
[13]EDELMAN R,ASSARAF YG,LEVITZKY I,et al.Hyaluronic acid-serum albumin conjugate-based nanoparticles for targeted cancer therapy[J].Oncotarget,2017,8(15):24337
[14]WANG Z,CHEN Z,LIU Z,et al.A multi-stimuli responsive gold nanocage-hyaluronic platform for targeted photothermal and chemotherapy[J].Biomaterials,2014,35(36):9678
(2017-01-13收稿 责任编辑徐春燕)
Pharmacokinetic characteristics and tissue distribution of hyaluronic acid-modified mitoxantrone-loaded graphene oxide in MCF-7 tumor bearing mice
JIAXin,FENGQianhua,ZHANGWanxia,LIYuzhen,YANGXuemei,DUJuan
SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001
mitoxantrone;hyaluronic acid;pharmacokinetics;tissue distribution;mouse;MCF-7 cell
Aim: To investigate the pharmacokinetic characteristics and tissue distribution of hyaluronic acid(HA)-modified mitoxantrone(MIT)-loaded graphene oxide(GO) in the MCF-7 tumor bearing mice. Methods: The mice were injected with MIT, MIT/GO and MIT/HA-GO via tail vein, respectively. And the pharmacokinetics study and drug distrubution in major organs of the three different formulations were determined by HPLC.Results: Compared with MIT, MIT/GO and MIT/HA-GO possessed prolonged circulation features and decreased the AUC in heart, lung and kidney. And the tumor targeting efficiency of MIT/GO and MIT/HA-GO were 1.55 and 2.61 times as compared with that of MIT, respectively.Conclusion: The HA-mediated MIT-loaded GO decreases the systemic toxicity of MIT and increases the tumor targeting efficiency.
10.13705/j.issn.1671-6825.2017.05.019
R737.9
*国家自然科学基金资助项目 81202485,81273451
#通信作者,女,1969年11月生,硕士,副教授,研究方向:药事管理学,E-mail:dujuan2004@zzu.edu.cn