非小细胞肺癌组织中MAGE-A3和MAGE-C2 mRNA的表达*
马 星,陈新峰,张超奇,乔亚敏,张 毅1,,王丽萍#
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052
非小细胞肺癌组织中MAGE-A3和MAGE-C2mRNA的表达*
马 星1),陈新峰2),张超奇2),乔亚敏2),张 毅1,2),王丽萍1)#
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052
非小细胞肺癌;MAGE-A3;MAGE-C2
目的:检测肿瘤相关抗原恶性黑色素瘤相关抗原(MAGE)-A3、MAGE-C2在非小细胞肺癌(NSCLC)中的表达情况,并探讨其临床意义。方法收集206例NSCLC手术患者肿瘤组织,应用real-time PCR技术检测组织中 MAGE-A3、MAGE-C2 mRNA的表达,并分析其与NSCLC患者临床病理特征(性别、年龄、组织学分级、病理类型、淋巴结转移和临床分期)之间的关系。用基因沉默的方法将肺癌A549细胞MAGE-A3下调,观察处理前后MAGE-A3 mRNA表达水平的改变,并分析其对细胞生物学功能(凋亡率、成球率、穿膜细胞数)的影响。结果MAGE-A3、MAGE-C2 mRNA在NSCLC组织中的表达率分别是73.3%(151/206)和52.9%(109/206);MAGE-A3 mRNA的表达与疾病分期和淋巴结转移有关(P<0.05);不同病理特征的NSCLC组织中MAGE-C2 mRNA的表达比较,差异无统计学意义(P>0.05);MAGE-A3、MAGE-C2 mRNA共表达与年龄和临床分期有关(P<0.05)。MAGE-A3表达降低后肺癌A549细胞的成球能力和侵袭转移能力降低(P<0.001)。结论MAGE-A3、MAGE-C2在NSCLC组织中有较高的表达率, 两者有望成为肺癌免疫治疗的潜在靶点。
肺癌是我国乃至全世界发病率及病死率最高的的恶性肿瘤之一[1],其组织亚型主要有非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌两种,分别占肺癌的85%和15%[2]。早期肺癌常因症状不典型而漏诊,当患者自感症状明显就医时大多数已经发展到中晚期。化疗和(或)放疗是这类患者的主要治疗方法,但是传统治疗方案疗效有限且常引起严重的不良反应,因此需要探索新的有效且不良反应轻的治疗模式。目前发现,肿瘤免疫在肺癌发生发展中起着重要作用。近年来,各种免疫治疗手段层出不穷,显示出了明显的抗肿瘤效应。已经完成的一系列临床试验[3]肯定了免疫治疗在肺癌治疗中的巨大潜力。恶性黑色素瘤相关抗原(melanoma-associated antigens, MAGE)于1991年首次被发现[4]。一般情况下,MAGE在恶性肿瘤组织中高表达,而在除睾丸和胎盘外的正常组织中不表达[5-6]。MAGE根据其染色体位置及组织分布不同,分为6个大家族,包括MAGE-A、MAGE-B、MAGE-C、MAGE-D、MAGE-E和MAGE-F。 MAGE-A3、MAGE-C2 是 MAGE家族中较有特征的代表,在许多恶性肿瘤中表达,但关于它们在NSCLC中的表达及其与NSCLC生物学行为的相关性的研究还较少。作者检测了206例NSCLC患者肿瘤组织中MAGE-A3、MAGE-C2的表达,并进行了相关的细胞实验,为应用MAGE及其产物进行肺癌免疫治疗提供了理论依据。
1 材料与方法
1.1NSCLC患者一般情况选取2014年9月至2015年9月于郑州大学第一附属医院胸外科初治的206例NSCLC手术患者。患者入院前未接受过化疗和放疗等辅助手段。排除标准:合并免疫系统疾病或者病理诊断不明确。所有患者均经临床诊断和病理活检确诊。标本获取均经患者知情同意。所有标本均具有完整的临床病理数据,包括年龄、性别、淋巴结转移情况、组织学分级、病理类型、临床分期等。
1.2引物合成与设计通过检索GenBank中相关序列信息,利用Primer Premier 5软件与美国NCBI网站提供的基因序列进行比对,设计获得GAPDH、MAGE-A3、MAGE-C2 3对特异性引物并由生工生物工程(上海)股份有限公司合成,si-MAGE-A3引物序列由上海吉玛制药技术有限公司设计并合成。引物序列见表1。

表1 引物序列
1.3细胞总RNA的提取与cDNA的合成采用Trizol法抽提总RNA,所得RNA经琼脂糖凝胶电泳测定OD值,确定无降解后,取3 μg总 RNA用逆转录酶(TaKaRa公司)合成cDNA。
1.4肺癌组织和肺癌细胞H460、A549MAGE-A3、MAGE-C2mRNA表达的检测以 cDNA 为模板进行 PCR反应,反应条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40个循环。绘制融解曲线。应用 Agilent Mx3005P 仪器进行定量检测和融解曲线分析,每个反应设4个复孔。以GAPDH 作为内参,记录每个反应的 Ct值,ΔCt=目的基因Ct值-内参Ct值,以公式2-ΔΔCt计算目的基因的相对表达量。
1.5MAGE-A3下调对A549细胞生物学特性的影响
1.5.1 siRNA的转染 转染前1 d,将处于对数生长期的A549细胞接种于24孔板中。转染当天,小心吸走上清,并用无血清RPMI 1640洗2次,取1 μL/孔Lipofectamine 3000用50 μL的Opti-MEM培养液稀释,轻轻混匀后室温静置5 min。取2 μL siRNA/孔,用50 μL的Opti-MEM培养液稀释,轻轻混匀。将配置好的Lipofectamin 3000和siRNA混合,充分混匀,室温放置 20 min后加入到含有细胞和培养基的孔中,轻柔摇晃细胞培养板。培养24~48 h后检测干扰效率。以未转染的A549细胞作为对照。
1.5.2 细胞凋亡检测 采用PI-Annexin V双染法。胰蛋白酶消化目的细胞、离心,弃上清。加入预冷的PBS洗2次,将PBS弃净,冰上加入200 μL Binding Buffer,重悬至细胞密度为1×106mL-1。避光加入1.5 μL Annexin V抗体,振荡混匀。4 ℃避光孵育15 min。转到上样管中,上机前加入2 μL PI并轻轻混匀。检测时要低速收集细胞,检测细胞凋亡率。实验重复6次。
1.5.3 细胞成球能力检测 胰蛋白酶消化生长状态良好的A549细胞,加入无血清干细胞条件培养基,吹打成单细胞悬液。铺入6孔低黏附板,1 000~5 000个 mL-1,每孔5 mL。5~7 d后观察细胞成球情况及细胞球的大小。显微镜下拍照,根据细胞球的直径进行计数并计算成球率。实验重复6次。
1.5.4 Transwell细胞迁移实验 消化A549细胞,离心并弃去上清液,用 PBS 洗1~2 遍后计数细胞。取1×105个细胞,用200 μL无血清培养基重悬。将200 μL细胞悬液加入Transwell小室。24孔板下室加入 600 μL含血清的培养液。常规培养24 h。用棉签轻拭去上室内未迁移的细胞,用PBS 洗3遍。40 g/L多聚甲醛固定30 min,PBS洗3遍。结晶紫染色30 min,PBS洗3遍。选取 10个100倍视野,照相后计数每个视野中穿膜细胞数,结果取平均值。实验重复6次。
1.5.5 细胞MAGE-A3 mRNA表达的检测 方法同1.4。实验重复6次。
1.6统计学处理采用SPSS 21.0进行数据分析。MAGE-A3、MAGE-C2 mRNA表达与NSCLC临床病理特征的关系采用χ2检验进行分析;H460细胞、A549细胞MAGE-A3、MAGE-C2 mRNA相对表达量的比较采用两独立样本的t检验;si-MAGE-A3组、对照组细胞凋亡率、成球率、穿膜细胞数、MAGE-A3 mRNA相对表达量的比较采用两独立样本的t检验。检验水准α=0.05。
2 结果
2.1MAGE-A3、MAGE-C2mRNA在NSCLC组织中的表达206例NSCLC组织中81.6%(168/206)至少表达1种MAGE(MAGE-A3或MAGE-C2),MAGE-A3、MAGE-C2表达率分别为73.3%(151/206)、52.9%(109/206),两者均表达的有92例(44.7%),两者均不表达的有38例(18.4%)。PCR代表性结果见图 1。

M:Marker;1:阳性对照;2:阴性对照;3~7:NSCLC组织。 图1 MAGE-A3、MAGE-C2 mRNA在NSCLC组织中的表达
2.2MAGE-A3、MAGE-C2mRNA表达与NSCLC临床病理特征的关系结果见表2。
2.3MAGE-A3、MAGE-C2mRNA在肺癌细胞中的表达A549和H460肺癌细胞中MAGE-A3、MAGE-C2 mRNA相对表达量的比较见表3。由表3可知,A549细胞表达MAGE-A3、MAGE-C2较高。
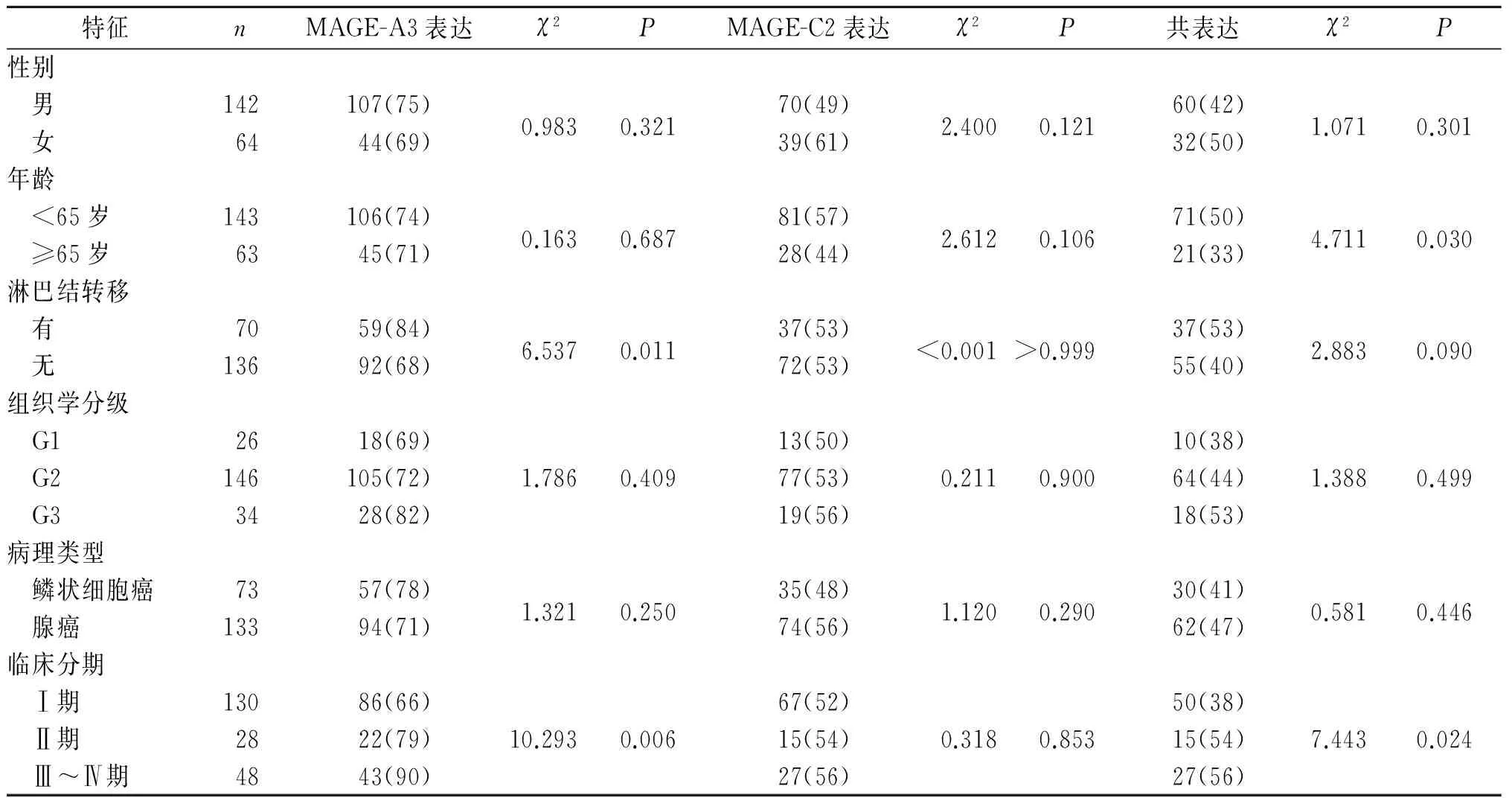
表2 MAGE-A3、MAGE-C2 mRNA 表达与NSCLC临床病理特征的关系 例(%)
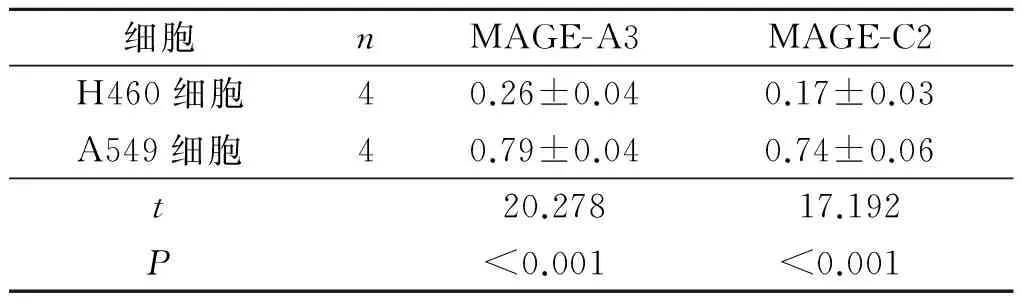
表3 肺癌细胞 MAGE-A3、MAGE-C2 mRNA相对表达量的比较
2.4MAGE-A3下调对A549细胞生物学特性的影响结果见图2、表4。
3 讨论
免疫治疗使肺癌患者的生存期及生存质量都得到了质的飞跃[7]。肿瘤-睾丸抗原是特异性免疫治疗的理想靶点之一,是包含MAGE、NY-ESO-1、SSX、LAGE等的一个基因大家族,在肿瘤的综合治疗中占重要地位[8]。MAGE于1991年被发现于黑色素瘤患者体内,后于不同肿瘤组织中发现多个MAGE基因。细胞毒性T淋巴细胞能通过识别MAGE基因的产物而杀伤肿瘤细胞,为肿瘤的特异性免疫治疗提供了一种新的方法[9]。Thurner等[10]用MAGE-A3编码的抗原肽MAGE-3A1(EVDPIGHLY)负载树突状细胞,用于治疗Ⅳ期黑色素瘤患者,可使患者肿瘤消退。检测黑色素瘤患者外周血肿瘤标志物表达水平变化来评估患者预后因素的研究[11]发现,MAGE-A3表达阳性组比阴性组预后差,且表达水平高的患者比表达水平低的患者预后差。Gure等[12]研究发现,MAGE-A3表达阳性的NSCLC患者临床治疗效果较差,MAGE-A3表达水平高低也同样影响患者的预后。作者采用real-time PCR方法检测肺癌组织中 MAGE-A3、MAGE-C2 mRNA的表达,发现73.3%的NSCLC患者表达MAGE-A3,52.9%表达MAGE-C2,说明MAGE-A3、MAGE-C2可作为NSCLC患者免疫学检测的分子标志物。MAGE-A3 mRNA表达与淋巴结转移有关,表明其具有影响肿瘤细胞扩散和转移到淋巴结的能力。且MAGE-A3 mRNA表达与患者临床分期有关,提示MAGE-A3表达与不良预后相关并且是NSCLC更差预后的标志物。
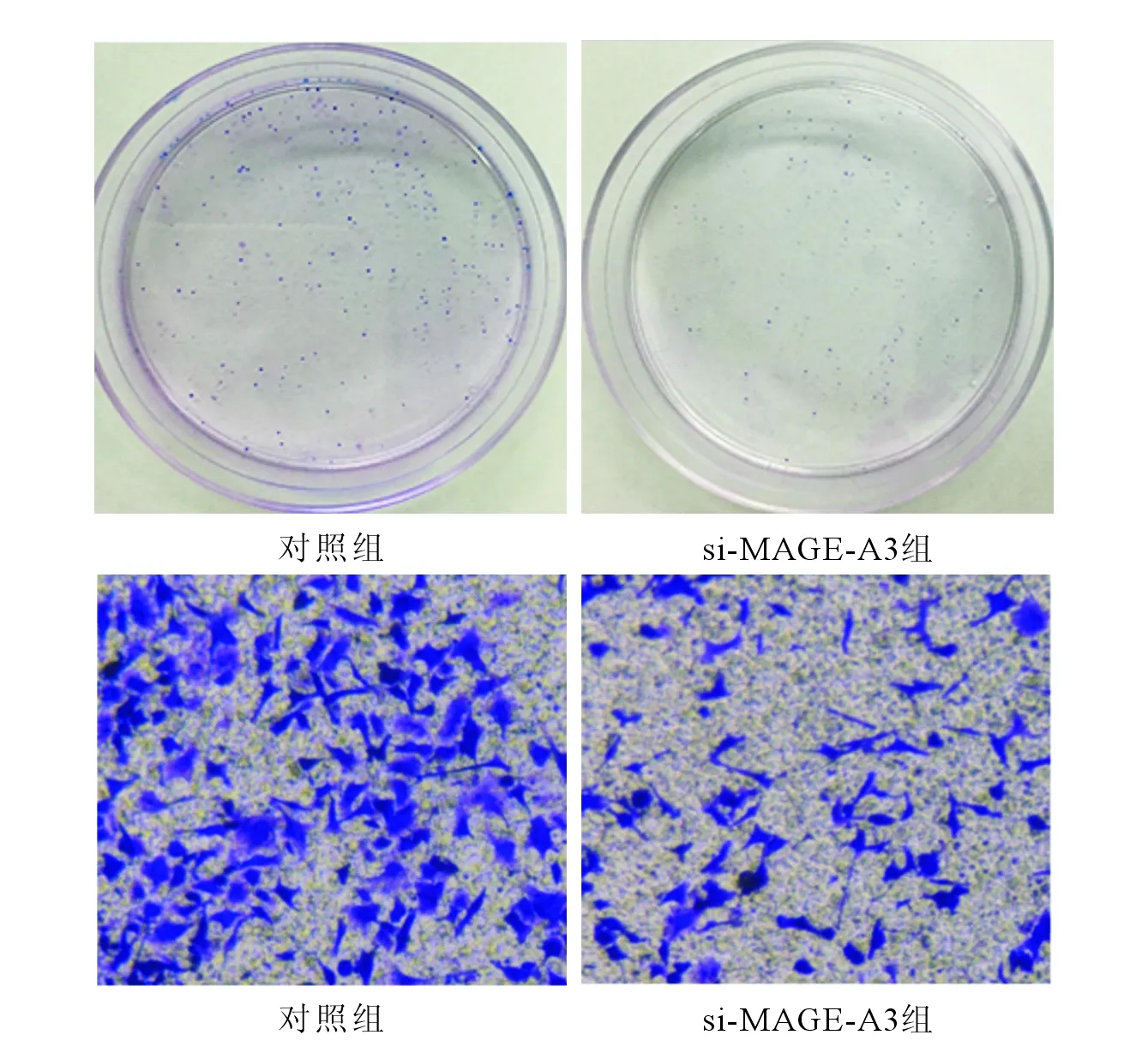
上排:与对照组相比,si-MAGE-A3组细胞成球数目减少;下排:与对照组相比,si-MAGE-A3组细胞体外迁移能力下降(结晶紫染色,×100)。 图2 特异性si-MAGE-A3 对A549细胞成球(上排)和迁移(下排)能力的影响

组别n细胞凋亡率/%成球率/%穿膜细胞数MAGE-A3mRNA相对表达量si-MAGE-A3组66.6±0.945.8±5.736.6±6.60.30±0.05对照组65.9±0.393.8±4.786.8±5.40.93±0.03t1.80314.55213.18322.168P0.102<0.001<0.001<0.001
MAGE-C2 mRNA的表达与肿瘤的淋巴结转移、分期等临床特征无关,说明其表达与NSCLC的恶性程度及疾病的进展无关。由于该研究所选取的样本量较小,尚需进一步扩大样本量以证实该研究结果的准确性。
MAGE-A3、MAGE-C2 mRNA的共表达与年龄和分期有关,MAGE-A3、MAGE-C2共表达多见于晚期患者和年轻患者中。据文献[13]报道,许多肿瘤往往不是单一表达一种MAGE,因此应用联合性肽疫苗能靶向消灭表达不同抗原的肿瘤细胞,从而起到治疗作用。
作者猜测MAGE-A3对NSCLC分期及淋巴结转移的影响是通过促进肺癌细胞的恶性生物学功能如侵袭、转移来发挥的。体外实验结果显示,MAGE-A3、MAGE-C2在2种肺癌细胞中均表达,且在A549细胞表达较高,因此作者选择了A549细胞进行下一步研究。作者采用基因沉默技术使肺癌细胞本体表达的MAGE-A3下调后体外实验检测其凋亡、成球及侵袭能力。实验结果证明,MAGE-A3表达降低对细胞凋亡率没有影响,细胞成球能力和侵袭能力受抑制。结果表明MAGE-A3通过增强肺癌细胞恶性增殖及浸润转移能力来参与疾病进展。
综上所述,该研究结果提示MAGE-A3或MAGE-C2在NSCLC组织中具有较高的表达率。检测患者肿瘤组织中MAGE-A3、MAGE-C2的表达能够判断NSCLC患者的预后。该研究结果对于下一步针对肺癌进行MAGE-A3或MAGE-C2基因靶向治疗及免疫治疗研究具有指导意义。
[1] SUNDAR R,SOONG R,CHO BC,et al.Immunotherapy in the treatment of non-small cell lung cancer[J].Lung Cancer,2014,85(2):101
[2] TRAVIS WD, TRAVIS LB, DEVESA SS. Lung cancer[J].Cancer,1995,75(1 Suppl):191
[3] ANAGNOSTOU VK, BRAHMER JR. Cancer immunotherapy: a future paradigm shift in the treatment of non-small cell lung cancer[J]. Clin Cancer Res, 2015, 21(5):976
[4] VAN DER BRUGGEN P, TRAVERSARI C, CHOMEZ P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma[J]. Science, 1991, 254(5038):1643
[5] WEON JL, POTTS PR. The MAGE protein family and cancer[J]. Curr Opin Cell Biol, 2015, 37:1
[6] SINGH V,BRADDICK D.Recent advances and versatility of MAGE towards industrial applications[J].Syst Synth Biol,2015,9(Suppl 1):1
[7] 宋勇, 杨雯. 2014年晚期非小细胞肺癌内科治疗进展[J]. 解放军医学杂志, 2015, 40(1):10
[8] SIMPSON AJ,CABALLERO OL,JUNGBLUTH A,et al.Cancer/testis antigens, gametogenesis and cancer[J].Nat Rev Cancer,2005,5(8):615
[9] MA W, GERMEAU C, VIGNERON N, et al. Two new tumor-specific antigenic peptides encoded by gene MAGE-C2 and presented to cytolytic T lymphocytes by HLA-A2[J]. Int J Cancer, 2004, 109(5):698
[10]THURNER B,HAENDLE I,RÖDER C,et al.Vaccination with mage-3A1 peptide-pulsed mature, monocyte-derived dendritic cells expands specific cytotoxic T cells and in-duces regression of some metastases in advanced stage Ⅳ melanoma[J].J Exp Med,1999,190(11):1669
[11]GKALPAKIOTIS S,ARENBERGER P,KREMEN J,et al.Quantitative detection of melanoma-associated antigens by multimarker real-time RT-PCR for molecular staging: results of a 5 years study[J].Exp Dermatol,2010,19(11):994
[12]GURE AO,CHUA R,WILLIAMSON B,et al.Cancer-testis genes are coordinately expressed and are markers of poor outcome in non-small cell lung cancer[J].Clin Cancer Res,2005,11(22):8055
[13]ZANDBERG DP,ROLLINS S,GOLOUBEVA O,et al.A phase Ⅰ dose escalation trial of MAGE-A3- and HPV16-specific peptide immunomodulatory vaccines in patients with recurrent/metastatic (RM) squamous cell carcinoma of the head and neck (SCCHN)[J].Cancer Immunol Immunother,2015,64(3):367
(2017-04-07收稿 责任编辑姜春霞)
Expressions of MAGE-A3 and MAGE-C2 mRNA in non-small cell lung carcinoma tissue
MAXing1),CHENXinfeng2),ZHANGChaoqi2),QIAOYamin2),ZHANGYi1,2),WANGLiping1)
1)DepartmentofOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)BiotherapyCenter,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
non-small cell lung cancer;MAGE-A3;MAGE-C2
Aim: To analyze the expressions of MAGE-A3 and MAGE-C2 mRNA in non-small cell lung cancer(NSCLC) tissue and the relationship between their expressions and clinical pathological characteristics. Methods: Tumor tissue was collected from 206 patients diagnozed as NSCLC. Real-time PCR was performed to detect the expressions of MAGE-A3 and MAGE-C2 mRNA. The correlation of clinicopathological characteristics(gender, age, histologic grading, pathological type, lymph node metastasis, clinical stage) with the expressions of MAGE-A3 and MAGE-C2 mRNA in NSCLC tissue was evaluated. Then siRNA was used to down-regulate the expression of MAGE-A3 in A549 cells and the effects of MAGE-A3 knockdown on biology behavior of A549 cells were observed.Results: The mRNA expression rates of MAGE-A3 and MAGE-C2 in NSCLC tissue were 73.3%(151/206) and 52.9%(109/206), respectively. The mRNA expression of MAGE-A3 was associated with clinical stage and lymph node metastasis(P<0.05). However, there was no relation between MAGE-C2 mRNA expression and clinical characteristics(P>0.05). The mRNA coexpression of MAGE-A3 and MAGE-C2 was associated with age and clinical stage(P<0.05).MAGE-A3 knockdown led to decrease of sphere formation, invasion, and metastasis abilities of cells(P<0.001).Conclusion: MAGE-A3 and MAGE-C2 are expressed in NSCLC at high level; MAGE-A3 and MAGE-C2 might be potential target antigens for immunotherapy of NSCLC.
10.13705/j.issn.1671-6825.2017.05.016
R734.2
*国家自然科学基金资助项目 81171986,81271815;科技部国家重点研发计划 2016YFC1303500
#通信作者,女,1963年5月生,博士,教授,研究方向:肿瘤的化疗和免疫治疗,E-mail:wlp@zzu.edu.cn