HPK1在乳腺癌组织中的表达及HPK1过表达对人乳腺癌MCF-7细胞增殖、凋亡的影响*
王娇娇,范智蕊,李砺锋,丁显飞,周学良,杨子悦,袁 博,许振涛,马丙钧,赵 杰,王留兴#
1)郑州大学第一附属医院超声科 郑州 450052 2)郑州大学第一附属医院肿瘤科 郑州450052 3)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 4)郑州大学第一附属医院综合ICU 郑州 450052 5)郑州大学第一附属医院药学部 郑州 450052#通信作者,男,1952年2月生,本科,教授,主任医师,研究方向:乳腺癌和前列腺癌的基础与临床,E-mail:lxwang2006@126.com
HPK1在乳腺癌组织中的表达及HPK1过表达对人乳腺癌MCF-7细胞增殖、凋亡的影响*
王娇娇1),范智蕊2),李砺锋2,3),丁显飞2,4),周学良2),杨子悦4),袁 博2,4),许振涛2,4),马丙钧5),赵 杰5),王留兴2)#
1)郑州大学第一附属医院超声科 郑州 450052 2)郑州大学第一附属医院肿瘤科 郑州450052 3)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 4)郑州大学第一附属医院综合ICU 郑州 450052 5)郑州大学第一附属医院药学部 郑州 450052#通信作者,男,1952年2月生,本科,教授,主任医师,研究方向:乳腺癌和前列腺癌的基础与临床,E-mail:lxwang2006@126.com
HPK1;过表达;乳腺癌;MCF-7细胞;增殖;凋亡
目的:检测造血祖细胞激酶1(HPK1)在人非特异型浸润性乳腺癌组织及乳腺癌细胞中的表达,并构建HPK1慢病毒载体以探究HPK1过表达对人乳腺癌细胞增殖、凋亡的影响。方法采用Western blot检测48例乳腺癌组织和配对癌旁组织中HPK1蛋白的表达,采用Western blot、RT-PCR法检测正常乳腺上皮细胞(MCF10A)和乳腺癌MCF-7细胞中HPK1的表达水平。PCR扩增HPK1序列,构建慢病毒pCDH-HPK1-puro重组载体,包装病毒、转染MCF-7细胞(过表达组),以感染空载体病毒的MCF-7细胞作为对照组,分别采用Western blot、RT-PCR检测2组细胞HPK1的表达水平,MTT法检测细胞增殖能力的变化,流式细胞术检测细胞凋亡及细胞周期。结果与癌旁组织相比,HPK1蛋白在乳腺癌组织中低表达(P=0.036)。与MCF10A细胞相比,HPK1蛋白及mRNA在MCF-7细胞中低表达;与对照组相比,过表达组中HPK1蛋白及mRNA的表达水平上调,细胞增殖能力下降,细胞凋亡率升高,G0/G1期细胞比例升高(P均<0.05)。结论HPK1在乳腺癌组织及细胞中低表达,HPK1过表达可抑制MCF-7细胞增殖和诱导凋亡,并使细胞周期阻断在G0/G1期。
乳腺癌已经成为全球女性癌症死亡的第二大原因,其死亡人数占女性癌症总死亡人数的14%[1]。美国癌症协会预计,2017年美国乳腺癌将新发约255 180例、死亡41 070例[1]。目前,乳腺癌在手术治疗、放疗、化疗和内分泌治疗等方面已经取得了明显的疗效,但其5 a生存率依然较低。因此寻找新的改善乳腺癌患者预后的基因靶点有着重要的意义[2]。造血祖细胞激酶1(hematopoietic progenitor kinase 1, HPK1)是造血系统特异性丝氨酸/苏氨酸蛋白激酶,哺乳动物Ste-20相关蛋白激酶MAP4K家族成员之一[3]。HPK1在免疫反应和炎症信号通路以及造血细胞的应激反应、增殖、凋亡中发挥着重要作用[4],且其可能参与肿瘤的免疫治疗[5]。近年发现,HPK1与胰腺癌[6]、肺癌[7-8]、膀胱癌[9]等多种恶性肿瘤的发生发展有关。作者的前期研究[10]发现HPK1在乳腺癌中呈现低表达,与非特异型浸润性乳腺癌(invasive ductal breast carcinoma-not otherwise specified, IDC-NOS)的发生发展有关。该研究通过构建慢病毒载体获得HPK1过表达的慢病毒颗粒,并感染乳腺癌MCF-7细胞,以探究HPK1过表达对人乳腺癌细胞增殖、凋亡的影响,为未来HPK1应用于乳腺癌的治疗提供理论基础。
1 材料与方法
1.1材料MCF-7细胞、293T细胞、MCF10A细胞及慢病毒包装质粒pCDH-puro、pCMV-dR8.2 dvpr、pCMV-VSVG均由郑州大学肿瘤生物学研究室储存。体积分数10%胎牛血清、DMEM高糖培养基、磷酸盐缓冲液购自HyClone公司。KOD FX DNA聚合酶购自Toyobo公司,核酸内切酶、DNA连接酶购自TaKaRa公司。全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒及PCR相关引物购自上海生工生物工程有限公司。兔抗人HPK1一抗购自美国Abgent公司,β-actin一抗及辣根过氧化物酶标记的山羊抗兔IgG购自武汉三鹰生物技术有限公司。RNA抽提试剂、反转录试剂盒、PCR扩增试剂盒、2.5 g/L胰蛋白酶等购自北京索莱宝生物科技有限公司。无内毒素质粒提取试剂盒、磷酸钙转染试剂盒购自Tiangen公司。 MTT和Annexin V-FITC/PI凋亡检测试剂盒购自南京凯基生物科技发展有限公司。
1.2乳腺癌组织与癌旁组织中HPK1蛋白表达的检测采用Western blot法。选取郑州大学第一附属医院乳腺外科收治的48例病理证实为ER阳性的IDC-NOS患者新鲜冰冻的癌组织和癌旁组织,剪碎研磨后,加入裂解液提取总蛋白,BCA法进行蛋白定量测定,SDS-PAGE电泳,转至PVDF膜。加入一抗HPK1抗体、GAPDH抗体(按11 000稀释)孵育过夜,TBST冲洗3次,每次10 min。加入二抗(按15 000稀释)室温摇床孵育1 h,TBST冲洗3次,每次10 min。ECL显影,蛋白印记采用Image J软件进行分析。
1.3pCDH-HPK1-puro慢病毒骨架质粒的构建以HPK1 cDNA为模板进行PCR。上游引物5’-TGACCTCCATAGAAGATTCTAGAATGGACGTCGTGGA CCC-3’,下游引物5’-GAGCGATCGCAGATCCTTGCG GCCGCTCATTCCTGGATGTAGA-3’, 产物大小为109 000 bp。反应体系参考KOD FX DNA聚合酶使用说明书。反应条件: 94 ℃ 3 min;94 ℃ 10 s,57 ℃ 30 s,68 ℃ 2.5 min,共35个循环;68 ℃ 5 min,12 ℃保存。PCR产物采用10 g/L琼脂糖凝胶进行电泳,电泳条件为电压120 V、时间30 min;电泳后成像观察,切胶回收,将PCR产物插入pCDH-puro质粒EcoRⅠ、XbaⅠ酶切位点之间,调节目的片段及质粒片段的酶切产物质量浓度至50 mg/L,按质量比51于16 ℃连接,转化热激后,涂板倒置于37 ℃烘箱15 h。
1.4细胞培养MCF-7、293T、MCF10A细胞培养于含有体积分数10%胎牛血清的DMEM高糖培养基中,37 ℃、体积分数5% CO2培养箱中培养,2 d传代1次,待细胞进入对数生长期进行实验。
1.5慢病毒包装及转染包装:将慢病毒包装质粒pCMV-dR8.2 dvpr、pCMV-VSVG、pCDH-HPK1-puro及pCDH-puro分别通过转化扩大,使用无内毒素质粒提取试剂盒提取质粒。将293T细胞接种至10 cm细胞培养皿中,12 h后将pCDH-HPK1-puro(过表达组)或pCDH-puro(对照组)以及pCMV-dR8.2 dvpr、pCMV-VSVG按照质量比111共转染293T细胞,8 h后换液,36 h后提取病毒液,1 500 r/min离心5 min后,取上清液采用0.45 μm滤头过滤,4 ℃保存备用。24 h后可二次提取病毒液。
转染:转染前12 h将MCF-7细胞传代,使细胞达到约40%融合。将2组(过表达组、对照组)病毒液分别转染MCF-7细胞,并加入终质量浓度为5 mg/L聚凝胺,转染8 h后,更换为正常培养基。第1次转染24 h后可进行二次转染。转染3 d后,加入终质量浓度1 mg/L嘌呤霉素筛选3~5 d。
1.6正常乳腺上皮MCF10A细胞及乳腺癌MCF-7细胞HPK1蛋白表达水平的检测采用Western blot法。实验分为3组,即正常乳腺上皮细胞组(MCF10A组)和乳腺癌MCF-7细胞无转染组(对照组)、HPK1转染组(过表达组),各组分别取5×106个细胞,培养过夜后,加入200 μL的RIPA蛋白裂解液提取细胞全蛋白,BCA法测定蛋白浓度,SDS-PAGE分离蛋白,半干法将分离后的蛋白转移至PVDF 膜上,加入一抗(按11 000稀释),室温下孵育2 h 后,TBST 洗膜,加入二抗(按12 000稀释),37 ℃反应1 h 后,ECL显影,结果用Image J软件进行分析。实验重复3次。
1.7正常乳腺上皮MCF10A细胞及乳腺癌MCF-7细胞HPK1mRNA表达水平的检测采用RT-PCR法。收集MCF10A组、对照组及过表达组细胞,计数后各组取5×105个细胞,用Trizol法提取细胞总RNA,紫外分光光度计检测RNA的浓度及纯度。42 ℃ 2 min去除基因组DNA;37 ℃ 15 min,85 ℃ 5 s,进行反转录。以cDNA为模板,采用SYBR@Premix Ex TaqTMⅡ进行PCR。反应条件: 95 ℃变性30 s;95 ℃ 5 s,60 ℃ 34 s,45个循环。以β-actin作为内参,采用2-ΔΔCT法计算HPK1 mRNA的相对表达量。实验重复3次。引物序列及扩增产物大小见表1。
1.8对照组和过表达组MCF-7细胞增殖的检测
采用MTT法。分别取对照组及过表达组对数生长期细胞接种在96孔板中,细胞密度为1×105mL-1,每孔加入100 μL的细胞悬液,培养过夜后,每组设3个复孔,37 ℃分别培养24、48、72、96 h,加入5 g/L的MTT 20 μL,37 ℃孵育4 h后弃上清继续培养4 h,每孔加入DMSO 150 μL,室温振荡混匀,于酶标仪波长450 nm 处测定各孔的吸光度值,计算2组细胞的增殖率:细胞增殖率=(1-实验组吸光度值/对照组吸光度值)×100%。

表1 引物序列及扩增产物大小
1.9对照组和过表达组MCF-7细胞凋亡及细胞周期的检测分别取对照组及过表达组对数生长期细胞,经2.5 g/L胰蛋白酶处理后,1 500 r/min离心5 min收集细胞。按照Annexin V-FITC/PI凋亡检测试剂盒操作步骤检测细胞凋亡率;上流式细胞仪检测细胞周期。每组均设3个复孔。
1.10统计学处理采用SPSS 21.0进行数据分析。乳腺癌组织与癌旁组织中HPK1蛋白相对表达量的比较采用配对资料的t检验;对照组、MCF10A组、过表达组HPK1蛋白及mRNA相对表达量的比较均采用单因素方差分析,两两比较采用LSD-t检验;对照组及过表达组细胞凋亡率和细胞周期的比较均采用两独立样本的t检验。检验水准α=0.05。
2 结果
2.1乳腺癌组织和癌旁组织中HPK1蛋白的表达
结果见图1。乳腺癌组织HPK1蛋白的相对表达量(0.194±0.019)低于癌旁组织(0.426±0.082),差异有统计学意义(t配对=3.104,P=0.036)。
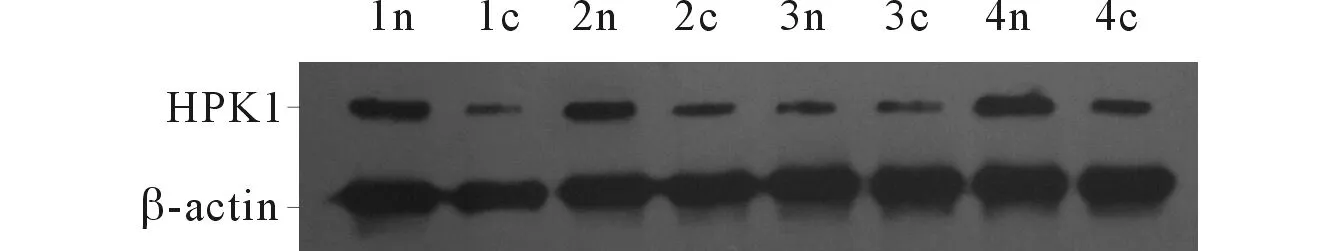
n:癌旁组织;c:癌组织。 图1 4例典型患者乳腺癌组织与癌旁组织中HPK1蛋白的表达
2.2pCDH-HPK1-puro载体构建结果PCR扩增结果(图2)显示条带单一,亮度高,引物特异性强,提示载体构建成功。
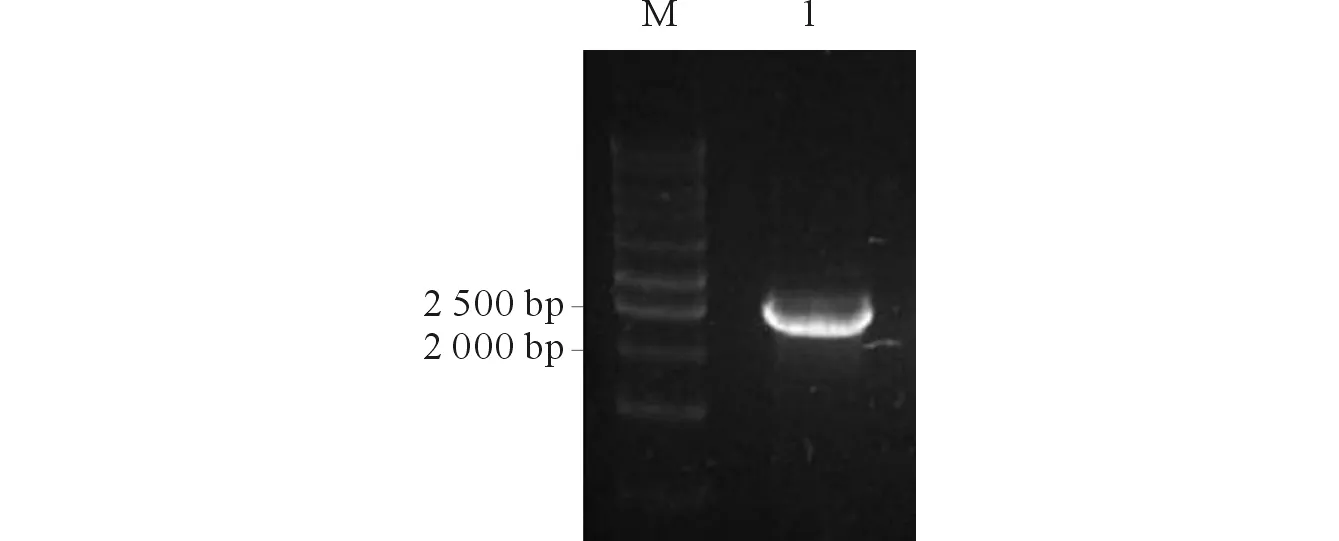
M:Marker;1:HPK1。 图2 PCR电泳图
2.3对照组、MCF10A组、过表达组HPK1蛋白及mRNA相对表达量的比较结果见图3、表2。与MCF10A组相比,对照组HPK1表达降低;与MCF10A组相比,过表达组HPK1表达增加。表明转染成功,可进行后续实验。

图3 3组细胞Western blot结果
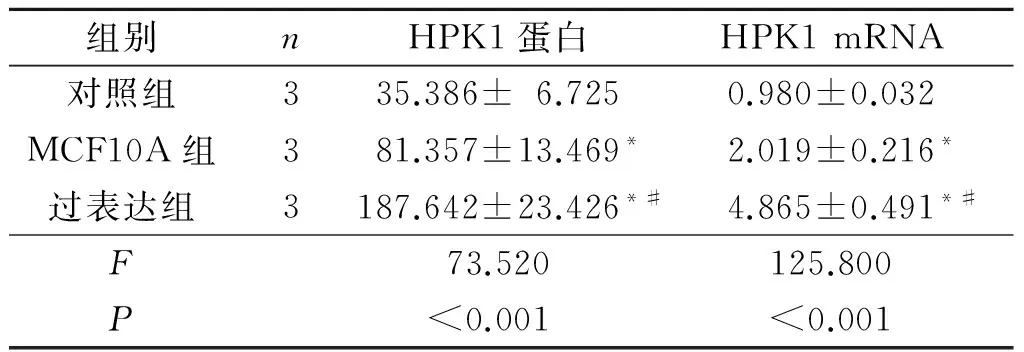
组别nHPK1蛋白HPK1mRNA对照组335.386±6.7250.980±0.032MCF10A组381.357±13.469*2.019±0.216*过表达组3187.642±23.426*#4.865±0.491*#F73.520125.800P<0.001<0.001
*:与对照组相比,P<0.05;#:与MCF10组相比,P<0.05。
2.4HPK1过表达对MCF-7细胞增殖的影响结果见图4。由图4可知,过表达组细胞增殖率低于对照组。
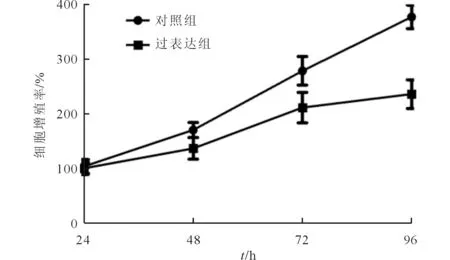
图4 对照组和过表达组细胞生长曲线
2.5HPK1过表达对MCF-7细胞凋亡的影响流式细胞仪检测结果(表3)显示,HPK1过表达可诱导细胞凋亡。

表3 对照组和过表达组MCF-7细胞凋亡率的比较 %
t=4.205,P=0.013。
2.6HPK1过表达对MCF-7细胞周期的影响结果见表4。
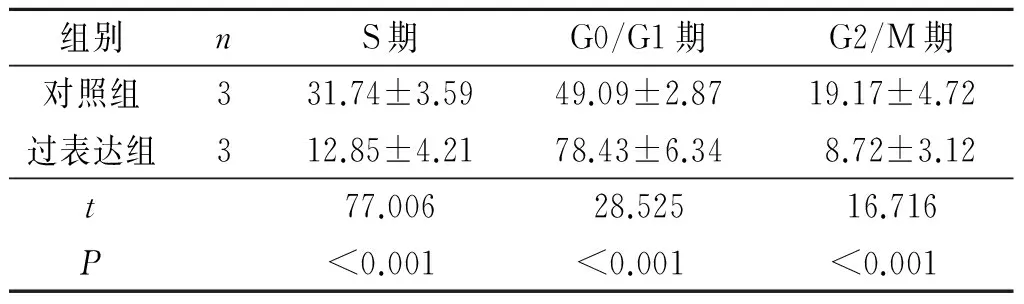
表4 对照组和过表达组MCF-7细胞周期的比较 %
3 讨论
乳腺癌是全世界女性发病率最高的恶性肿瘤[1],IDC-NOS是其最常见的病理类型。目前新辅助化疗和靶向治疗均取得较大进展,但是近处复发、远处转移以及化疗药、靶向药物耐药仍严重影响患者的生存质量,其生存期仍有待延长。因此,研究影响乳腺癌治疗及预后的分子靶点具有重要临床意义。
该研究首先在组织部分进行研究,发现HPK1在乳腺癌组织中的表达明显低于癌旁组织;然后通过Western blot、RT-PCR发现HPK1在乳腺癌MCF-7细胞中呈现低表达。为明确其可能机制,成功构建了HPK1过表达慢病毒并感染乳腺癌MCF-7细胞,以进一步探究HPK1过表达对MCF-7细胞增殖和凋亡的影响。该研究结果表明, HPK1在乳腺癌细胞中低表达,HPK1过表达可抑制MCF-7细胞的增殖并诱导凋亡,使细胞周期阻断在G0/G1期。总之,HPK1作为潜在基因靶点未来应用于乳腺癌的治疗有一定的前景。
研究中作者发现HPK1在乳腺癌MCF-7细胞中表达低,且证明了HPK1过表达可抑制人乳腺癌细胞的增殖并诱导凋亡,将细胞周期阻断在G0/G1期。该研究中,MTT法检测结果显示,HPK1过表达组48、72、96 h的细胞增殖能力明显受到抑制;流式细胞分析发现,HPK1过表达组细胞凋亡率明显增加,表明可诱导细胞凋亡。HPK1是MAP4K家族的重要成员之一,具有重要的生物学作用,其在多种恶性肿瘤中表达较低,且可能参与了肿瘤细胞的增殖、侵袭、转移等。同样,Li等[8]证明,HPK1可以抑制肺癌细胞的增殖、集落形成、迁移和浸润等。Wang等[6]指出,胰腺癌细胞中的HPK1经蛋白酶介导降解后缺失,提示HPK1降解可能参与了胰腺癌的发生发展。Alzabin等[7]发现,HPK1是抑制前列腺素E2介导的抗肿瘤免疫反应的重要组成部分。此外,HPK1可以用于预测肿瘤进展或者复发[11-12]。由此可见,HPK1蛋白可能具有抗癌作用,上调其表达或增强其活性可能成为治疗恶性肿瘤的重要手段[5]。
此外,张艳杰等[13]通过慢病毒表达载体使全长组织因子过表达。该研究构建了慢病毒pCDH-HPK1-puro重组载体,包装病毒、转染乳腺癌MCF-7细胞,成功获得了HPK1过表达细胞;PCR基因扩增全长凝胶电泳以及Western blot、RT-PCR检测过表达细胞中HPK1蛋白和mRNA的高表达都证明了载体构建的成功。同时,随着技术进步,慢病毒包装系统已经发展到第4代,具有更强的选择性、稳定性和安全性[14]。因此,通过慢病毒包装系统过表达HPK1是一种安全、稳定且成熟、有效的手段。
综上所述,实验建立了HPK1慢病毒稳定表达系统,在MCF-7细胞中成功过表达HPK1,并初步探讨了HPK1对MCF-7细胞增殖、凋亡的影响,为后续研究HPK1过表达抑制乳腺癌的机制奠定了基础,也为乳腺癌的治疗提供了新方向。但HPK1抗癌的具体机制需要进行更深一步的研究。
[1] SIEGEL RL,MILLER KD,JEMAL A.Cancer statistics, 2017[J].CA Cancer J Clin,2017,67(1):7
[2] 丁显飞,周学良,豆萌萌,等.哺乳动物雷帕霉素靶蛋白的表达及其与乳腺癌预后关系的Meta分析[J].吉林大学学报(医学版),2016,42(4):783
[3] LING P,YAO Z,MEYER CF,et al.Interaction of hematopoietic progenitor kinase 1 with adapter proteins Crk and CrkL leads to synergistic activation of c-Jun N-terminal kinase[J].Mol Cell Biol,1999,19(2):1359
[4] CHUANG HC,WANG X,TAN TH.MAP4K family kinases in immunity and inflammation[J].Adv Immunol,2016,129:277
[5] SAWASDIKOSOL S,ZHA R,YANG B,et al.HPK1 as a novel target for cancer immunotherapy[J].Immunol Res,2012,54(1/3):262
[6] WANG H,SONG X,LOGSDON C,et al.Proteasome-mediated degradation and functions of hematopoietic progenitor kinase 1 in pancreatic cancer[J].Cancer Res,2009,69(3):1063
[7] ALZABIN S,PYARAJAN S,YEE H,et al.Hematopoietic progenitor kinase 1 is a critical component of prostaglandin E2-mediated suppression of the anti-tumor immune response[J].Cancer Immunol Immunother,2010,59(3):419
[8] LI Z,PARK HR,SHI Z,et al.Pro-oncogenic function of HIP-55/Drebrin-like (DBNL) through Ser269/Thr291-phospho-sensor motifs[J].Oncotarget,2014,5(10):3197
[9] WANG Y,LUO H,LI Y,et al.hsa-miR-96 up-regulates MAP4K1 and IRS1 and may function as a promising diagnostic marker in human bladder urothelial carcinomas[J].Mol Med Rep,2012,5(1):260
[10]王娇娇,宋丽杰,杨森,等.造血祖细胞激酶1在雌激素受体阳性乳腺癌中的表达及其与预后的关系[J].中华实验外科杂志,2016,33(8):2022
[11]VAN DER HEIJDEN AG,MENGUAL L,LOZANO JJ,et al.A five-gene expression signature to predict progression in T1G3 bladder cancer[J].Eur J Cancer,2016,64:127
[12]LIN M,ZHANG Y,LI A,et al.High-throughput RNAi screening of human kinases identifies predictors of clinical outcome in colorectal cancer patients treated with oxaliplatin[J].Oncotarget,2015,6(18):16774
[13]张艳杰,武敏,蒋贤杰,等.慢病毒表达载体研究全长组织因子对乳腺癌的作用[J].兰州大学学报(医学版),2015,41(3):1
[14]孟凡荣,陈琛,万海粟,等.慢病毒载体及其研究进展[J].中国肺癌杂志,2014,17(12):870
(2017-06-10收稿 责任编辑姜春霞)
Expression of HPK1 in breast carcinoma tissue and effects of HPK1 overexpression on proliferation and apoptosis of human breast carcinoma cell MCF-7
WANGJiaojiao1),FANZhirui2),LILifeng2,3),DINGXianfei2,4),ZHOUXueliang2),YANGZiyue4),YUANBo2,4),XUZhentao2,4),MABingjun5),ZHAOJie5),WANGLiuxing2)
1)DepartmentofUltrasound,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 3)BiotherapyCenter,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 4)DepartmentofGeneralICU,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 5)DepartmentofPharmacy,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
HPK1;overexpression;breast carcinoma;MCF-7 cell;proliferation;apoptosis
Aim: To detect the expression of hematopoietic progenitor kinase 1(HPK1) in carcinoma tissue of human invasive ductal breast carcinoma-not otherwise specified and breast carcinoma cells, and to investigate the effects of HPK1 overexpression on proliferation and apoptosis of human breast carcinoma cells by constructing HPK1 lentiviral vector. Methods: The expression level of HPK1 protein in carcinoma tissue and paired adjacent tissue from 48 cases of breast carcinoma was detected by Western blot. The expression level of HPK1 in MCF10A and MCF-7 cells was detected by Western blot and RT-PCR. The HPK1 sequence was amplified by PCR, lentivirus recombinant vector pCDH-HPK1-puro was constructed, virus was packaged and MCF-7 cells were transfected(overexpression group). The MCF-7 cells infected with empty vector virus was used as control group. The expression level of HPK1 protein and mRNA was detected by Western blot and RT-PCR, respectively. The cell proliferation ability, cell apoptosis and cell cycle were detected by MTT assay and flow cytometry, respectively. Results: The expression level of HPK1 protein was lower in breast carcinoma tissue compared with adjacent tissue(P=0.036). The level of HPK1 protein and mRNA was lower in MCF-7 cells, compared with that of MCF10A cells(P<0.05). Compared with the control group, the expression level of HPK1 in the overexpression group was up-regulated, cell proliferation ability was decreased significantly, while the apoptosis rate and the proportion of G0/G1 were significantly increased(P<0.05). Conclusion: The expression of HPK1 in both breast carcinoma tissue and cell line is low, and overexpression of HPK1 could inhibit proliferation and induce apoptosis and block the cells in G0/G1 phase.
10.13705/j.issn.1671-6825.2017.05.005
*科技部科技惠民计划专项基金资助项目 2013GS410101;河南省重大科技专项基金资助项目 151100310800
R737.9