猴D型逆转录病毒p27基因的原核表达及流式免疫荧光微球检测技术的建立
刘助红,王 静,李秀珍,尹雪琴,张 钰,郭鹏举,黄 韧
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
研究报告
猴D型逆转录病毒p27基因的原核表达及流式免疫荧光微球检测技术的建立
刘助红,王 静,李秀珍,尹雪琴,张 钰,郭鹏举,黄 韧*
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
目的构建猴D型逆转录病毒的p27蛋白,并建立流式免疫荧光微球检测技术用于猴D型逆转录病毒的检测。方法通过PCR扩增p27基因片段,与pGEX-4T-1表达载体进行连接,转化至BL21(DE3)进行表达。通过SDS-PAGE分析蛋白表达的形式及最佳诱导时间。采取GST树脂纯化目标蛋白,包被磁珠,建立流式免疫荧光微球检测技术,用于临床样本的检测。结果重组蛋白以可溶的上清液进行表达,诱导的最佳时间为4 h。包被磁珠后,成功建立流式免疫荧光微球检测技术,对阳性血清稀释81倍仍可检测为阳性,对猴类其他病原的阳性血清无交叉反应,特异性强,与ELISA法同时对24份临床样本进行检测,其中3份样品的流式免疫荧光微球检测结果为阳性,ELISA检测结果为2份阳性,1份阴性,两种方法的检测结果符合率为96%。结论成功表达猴D型逆转录病毒p27蛋白,并运用该蛋白建立了灵敏度高,特异性强,样本需求少的流式免疫荧光微球检测技术,为后续推广应用多重流式免疫荧光微球检测技术奠定了基础。
猴D型逆转录病毒;p27基因;原核表达;流式免疫荧光微球检测技术
猴逆转录病毒(simian retrovirus,SRV)属于逆转录病毒科、肿瘤病毒亚科的D型病毒[1],感染的宿主主要是猕猴属的动物,如恒河猴、食蟹猴和豚尾猴等[2, 3]。该病毒在猴群中往往会引起较高的致病率和死亡率[4]。自1983年从英国发现第一例以来,目前已经被鉴定的SRV有7个血清型,其中SRV-1、SRV-2、SRV-3型已经成功进行分子克隆和基因组测序分析[5, 6]。
由于猴免疫缺陷病毒(simian immunodeficiency virus,SIV)感染猕猴后,引起的全身性淋巴腺病、脾肿大、腹膜后纤维瘤病等一系列症状与人感染HIV后极其相似[7-9],因此,猕猴往往被用于HIV致病机理研究和相关疫苗及药物开发与评估的动物模型[10]。而SRV的存在会给实验效果造成不可预料的影响。同时,当人被感染SRV的猴抓伤或咬伤后,会引起人感染SRV[11]。因此,在建立SIV感染模型之前,需要对SRV病原进行筛查,在猴的饲养过程中,也需要对该病原进行日常监测。目前,常用的实验室诊断方法有PCR法、酶联免疫吸附试验(ELISA)法、间接免疫荧光(IFA)法、免疫印迹(WB)法、病毒分离法等[12-16]。但是ELISA法和IFA法存在较高的假阳性率,而WB法操作程序复杂,且需要特定的专业技术人员,在一定程度上限制了这些方法的应用。因此,不论是为了保障整个猴群的健康,为科研实验提供高质量的动物模型,还是为了保证饲养人员、科研人员的人身安全,都有必要建立一种方便、快捷、灵敏、特异性强的检测方法。
1 材料和方法
1.1毒株、菌种和载体
SRV-1血清型毒株、Raji细胞、DH5α和BL21(DE3)感受态细胞由本实验室保存,克隆载体pMD19-T购自大连宝生物有限公司,表达载体pGEX-4T-1购自GE医疗集团有限公司。
1.2主要试剂和仪器
1.2.1 主要试剂
TRIzol®试剂、Premix TaqTMHot Start Version、逆转录试剂盒、EcoR I与XhoI限制性内切酶、蛋白质分子量标准购自大连宝生物有限公司,LB培养基购自青岛海博生物有限公司,Universal DNA纯化回收试剂盒、氨苄青霉素购自天根生化科技有限公司,GST融合蛋白纯化试剂盒购自Qiagen公司,Magplex磁珠包被试剂盒购自Luminex公司,IPTG购自上海生工生物工程有限公司,SRV ELISA检测试剂盒购自苏州西山生物技术有限公司。
1.2.2 主要仪器
冷冻离心机(Micro 21R,美国Thermo Scientific公司);PCR扩增仪(TGradient,德国Biometra公司);超微量分光光度计(NanoDrop 2000,美国Thermo Scientific公司);凝胶成像系统(Bio-Rad GelDoc XR,美国Bio-Rad公司);电泳仪(DYCP-32A,北京六一仪器厂);移液器(0.5~10 μL,10~100 μL,100~1000 μL,德国Eppendorf公司);超净工作台等。1.3实验方法
1.3.1 SRV基因组RNA的提取及cDNA合成
采用Raji细胞对SRV-1毒株进行细胞培养,当出现80%的致细胞病变效应(cytopathic effect,CPE)后,离心收取上清,用TRIzol®试剂进行病毒RNA的提取,然后采用逆转录试剂盒合成cDNA用于后续分析。
1.3.2 SRVp27目标基因的克隆
根据SRV-1的p27基因序列,设计引物,上游引物SRVF:GAATTCCCAGTAACTGAAACTGTCGA,下游引物SRVR:CTCGAGCATGGCTAAGCCCTGTTGA T,上游引物携带EcoR I位点,下游引物携带XhoI位点,引物由上海生工生物工程有限公司合成。以1.3.1中cDNA为模板,按如下体系和程序进行PCR反应:2 × Premix TaqTM12.5 μL,SRVF(10 μmol/L)1.0 μL,SRVR(10 μmol/L)1.0 μL,cDNA 5.0 μL,补水至25.0 μL。按如下PCR程序进行扩增:94℃预变性3 min,94℃变性40 s,55℃退火40 s,72℃延伸1 min,循环扩增35次,72℃终延伸5 min。扩增完后,电泳回收目标条带,与pMD19-T载体连接成pMD19-T-SRV p27,然后转化至DH5α中,挑取阳性克隆进行保存,同时扩大培养后提取质粒。
1.3.3 pGEX-4T-1-SRV p27重组质粒的构建
分别用EcoR I与XhoI限制性内切酶对pMD19-T-SRVp27载体和pGEX-4T-1进行双酶切,然后切胶回收pMD19-T-SRV p27中的SRVp27片段和pGEX-4T-1 中的大片段,通过连接酶构建pGEX-4T-1-SRV p27重组质粒,然后转化BL21(DE3)感受态细胞,培养后挑取阳性克隆进行测序分析,确认SRVp27基因片段序列的正确性,同时保存菌种。
1.3.4 重组蛋白的表达
挑取保存菌种涂布于含有氨苄青霉素的固体LB上培养12~16 h,挑取单克隆于37℃,220 r/min摇床培养至A600值约为0.6时添加终浓度为0.5 mmol/L的IPTG,分别于37℃诱导4 h、6 h、8 h、12 h、24 h,未加IPTG诱导剂的菌液作为阴性对照。离心收集菌体细胞,用PBS缓冲液重悬和洗涤两次,加入裂解液于冰浴中超声破碎菌体,分别离心收集上清和沉淀,沉淀用500 μL包涵体溶解液(8 mol/L尿素,50 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8.0)溶解,分别用于SDS-PAGE分析表达产物,确认最佳的诱导表达时间和蛋白表达形式。
1.3.5 重组蛋白的纯化
由于在上清和沉淀中均能发现表达的目标蛋白,为了后续纯化的方便,离心收集裂解后的上清GST纯化树脂进行目标蛋白纯化,对纯化后的蛋白进行SDS-PAGE分析蛋白纯度和测量重组蛋白的浓度。
1.3.6 流式免疫荧光微球检测技术建立
按照Antibody-Coupling试剂盒说明用纯化的蛋白对Magplex磁珠进行包被,最终包被成1000个磁珠/μL,然后稀释成50个/μL,移取50 μL加入96孔板中,加入50 μL血清,振动孵育60 min,用含有1% BSA的PBS溶液洗涤两次,加入100 μL生物素标记的兔抗猴二抗(浓度为10 μg/mL),振动孵育30 min,用含有1% BSA的PBS溶液洗涤两次,加入100 μL SAPE溶液(15 μg/mL),振动孵育30 min,用含有1% BSA的PBS溶液洗涤两次,加入100 μL的含1% BSA的PBS溶液,通过Luminex 200仪器进行检测,根据MFI值判定检测结果。
1.3.7 灵敏度分析
将制备的SRV阳性血清进行3倍的梯度稀释,根据1.3.6中建立的流式免疫荧光微球检测技术进行灵敏度的验证。
1.3.8 特异性分析
采用猴免疫缺陷病毒(SIV)阳性血清、猴B病毒(BV)阳性血清、猴嗜T淋巴细胞趋向性病毒(STLV)阳性血清对包被有SRV p27蛋白的磁珠进行流式免疫荧光微球检测分析,以进行特异性验证。
1.3.9 临床样本分析
收集来自临床样本的血清24份,通过ELISA法和建立的流式免疫荧光微球检测技术进行检测,统计两种检测方法的符合率。
2 结果
2.1SRVp27蛋白的结构分析
通过http://bioinf.cs.ucl.ac.uk/psipred和http://imed.med.ucm.es/Tools/antigenic.pl在线对SRV p27序列进行二级结构预测和抗原位点分析,预测结果显示该蛋白主要为螺旋结构(helix)和卷曲结构(coil),其中helix结构11个,coil结构12个(图1)。通过抗原位点预测,抗原倾向性系数为1.017,整个序列含有10个抗原位点(图2和表1)。
2.2PCR对SRVp27基因的扩增结果
经PCR扩增后获得大小约为750 bp的特异性片断(图3),与预期大小相符,连接pMD19-T载体测序,结果证实扩增片断723 bp,包含SRV-1p27的完整开放阅读框(open reading frame,ORF)共678 bp,编码226个氨基酸,通过双酶切后连接,成功构建pGEX-4T-1SRV p27重组质粒。
2.3原核表达条件的优化
pGEX-4T-1-SRV p27重组质粒转化BL21(DE3),在37℃和0.5 mmol/L IPTG条件下,诱导4 h、6 h、8 h后的表达量基本没有差异。表达产物的SDS-PAGE分析结果表明,重组蛋白主要以上清形式表达,目标蛋白分子量加上载体蛋白的分子量约45×103,与预期相符(图4)。
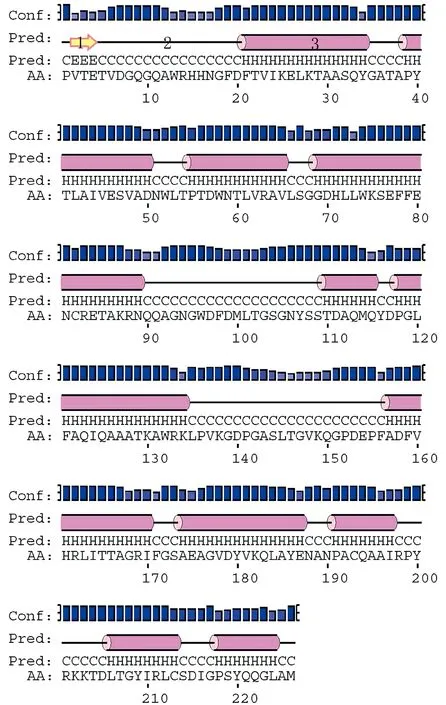
注:1:直链结构;2:卷曲结构;3:螺旋结构;Conf:预测结果的可信度;Pred:预测的二级结构;AA:氨基酸序列。图1 SRV p27蛋白二级结构分析Note. 1: Strand; 2: Coil; 3: Helix; Conf: Confidence of prediction; Pred: Predicted secondary structure; AA: Amino acid sequence.Fig.1 Secondary structure prediction of the SRV p27 protein

图2 SRV p27蛋白抗原位点预测Fig.2 Antigenic propensity of the SRV p27 protein

编号No.起始位置Startposition序列Sequence终点位置Endposition120DFTVIKE26228KTAASQYGATAPYTLAIVES47360TLVRAVLSGGDHLLWK754116YDPGLFAQIQAA1275132WRKLPVKG1396141PGASLTGVK1497156FADFVHRLIT1658174AEAGVDYVKQLA1859189ANPACQAAIR19810206LTGYIRLCSDIGPSYQ221
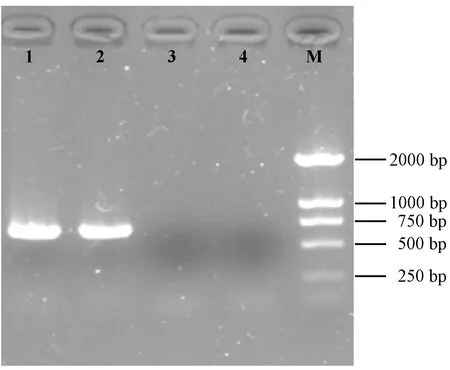
注:1,2:SRV p27基因扩增产物;3,4:阴性对照;M:DL2000 DNA分子量标准。图3 PCR扩增SRV p27基因结果Note. 1, 2: PCR products of SRV p27; 3, 4: Negative control; M: DL2000 DNA marker.Fig.3 Amplification of SRV p27 gene
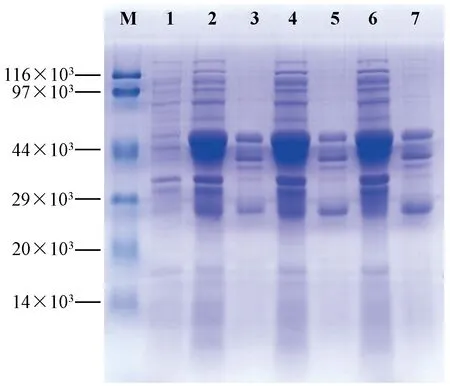
注:M:蛋白质分子量标准;1:未加IPTG;2,4,6:4、6、8 h诱导后上清;3,5,7:4、6、8 h诱导后沉淀。图4 不同诱导时间蛋白表达SDS-PAGE分析结果Note.M: Protein marker; 1: Without IPTG induction; 2, 4, 6: Supernatant after induction for 4 h, 6 h and 8 h, respectively; 3, 5, 7: Precipitation after induction for 4 h, 6 h and 8 h, respectively.Fig.4 SDS-PAGE analysis of protein expression after different periods of induction
2.4重组蛋白的纯化
通过扩大培养,37℃和0.5 mmol/L IPTG条件下,诱导4 h,收集100 mL菌液,超声破碎后收集上清,通过GST树脂进行挂柱、洗涤、洗脱等步骤,收集每一步过柱液进行SDS-PAGE分析,结果如图5所示,在第二次洗脱液中,蛋白的含量和纯度最高,通过BCA法,测得蛋白浓度为2.4 mg/mL。
2.5流式免疫荧光微球检测技术的灵敏度检测
通过3倍的梯度稀释阳性血清,与包被有SRV p27蛋白的磁珠进行流式免疫荧光微球检测技术分析,结果显示,随着血清的不断稀释,检测到的MFI值也呈梯度下降,当血清稀释至1∶81时,检测的MFI值接近临界值(阴性血清平均MFI值的3倍)(图6)。
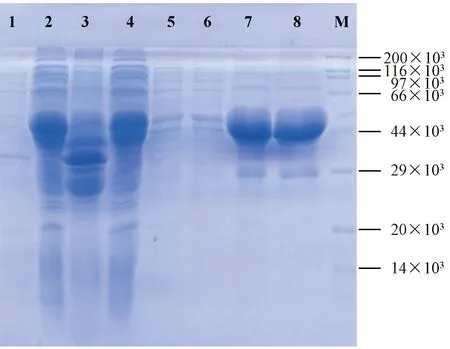
注:M:蛋白质分子量标准;1:未诱导蛋白;2:诱导后蛋白上清;3:诱导后蛋白沉淀;4:诱导后蛋白上清过柱后收集液;5:第一次洗涤收集液;6:第二次洗涤收集液;7:第一次洗脱液;8:第二次洗脱液。图5 SRV p27蛋白纯化后SDS-PAGE分析结果Note. M: Protein marker; 1: Without IPTG induction; 2: Supernatant after IPTG induction; 3: Precipitation after IPTG induction; 4: Supernatant collected after flowing through the column; 5: Solution collected after the first washing; 6: Solution collected after the second washing; 7: Solution collected after the first eluting; 8: Solution collected after the second eluting.Fig.5 SDS-PAGE analysis of the SRV p27 protein after purification
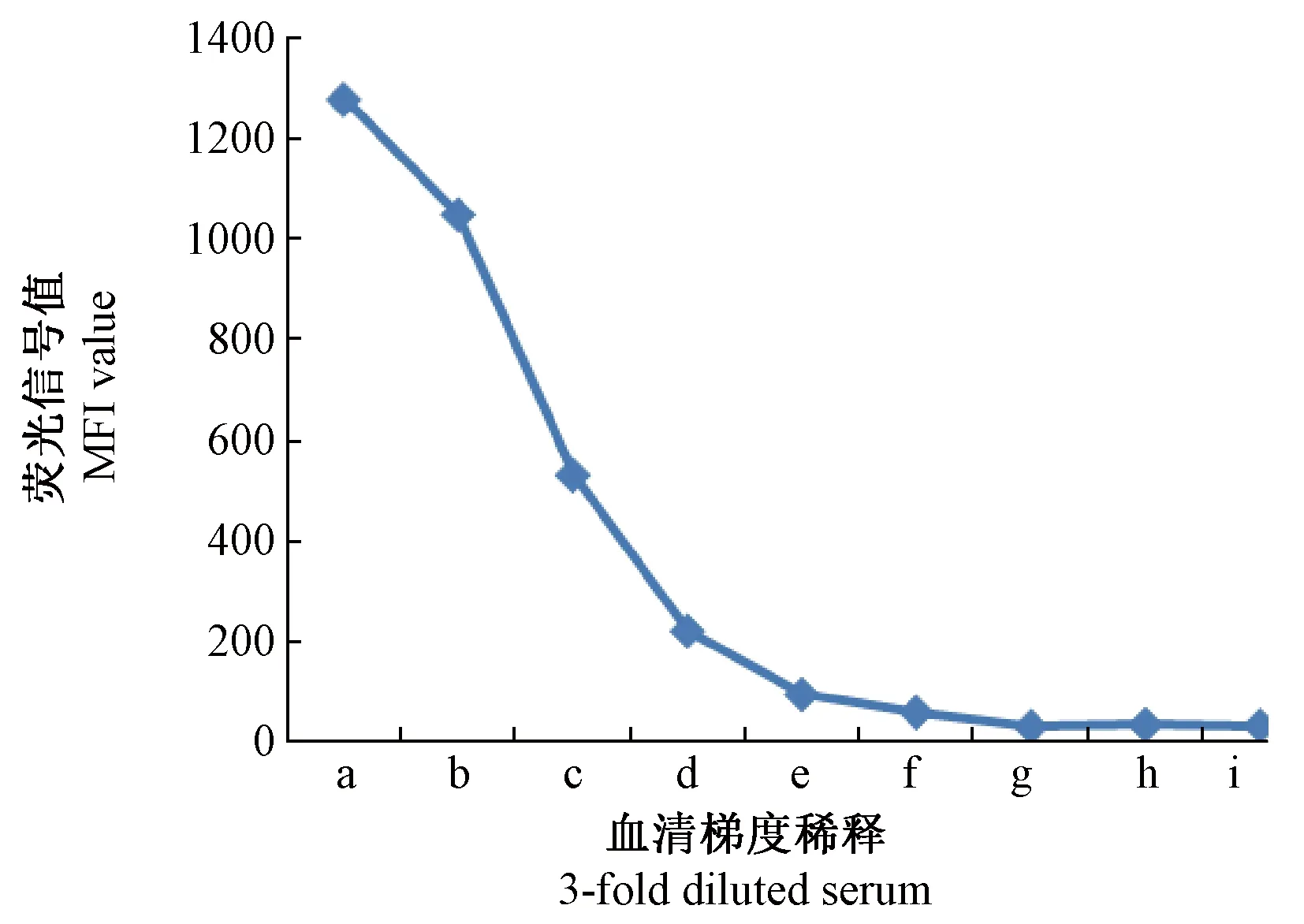
注:a:1∶1的血清;b:1∶3的血清;c:1∶9的血清;d:1∶27的血清;e:1∶81的血清;f:1∶243的血清;g:1∶729的血清;h:阴性血清;i:空白对照。图6 流式免疫荧光微球检测技术检测梯度稀释血清Note. a~g: Serum with dilution of 1∶1, 1∶3, 1∶9, 1∶27, 1∶81, 1∶243, 1∶729, respectively; h: Serum of negative control; i: Blank control.Fig.6 Detection of serially 3-fold diluted serum by flow microsphere immunofluorescence assay
2.6流式免疫荧光微球检测技术的特异性验证
通过猴免疫缺陷病毒(SIV)阳性血清、猴B病毒(BV)阳性血清、猴嗜T淋巴细胞趋向性病毒(STLV)阳性血清与包被有SRV p27蛋白的磁珠进行流式免疫荧光微球检测技术分析,SRV p27蛋白抗原对上述血清均没有交叉反应,特异性良好(图7)。
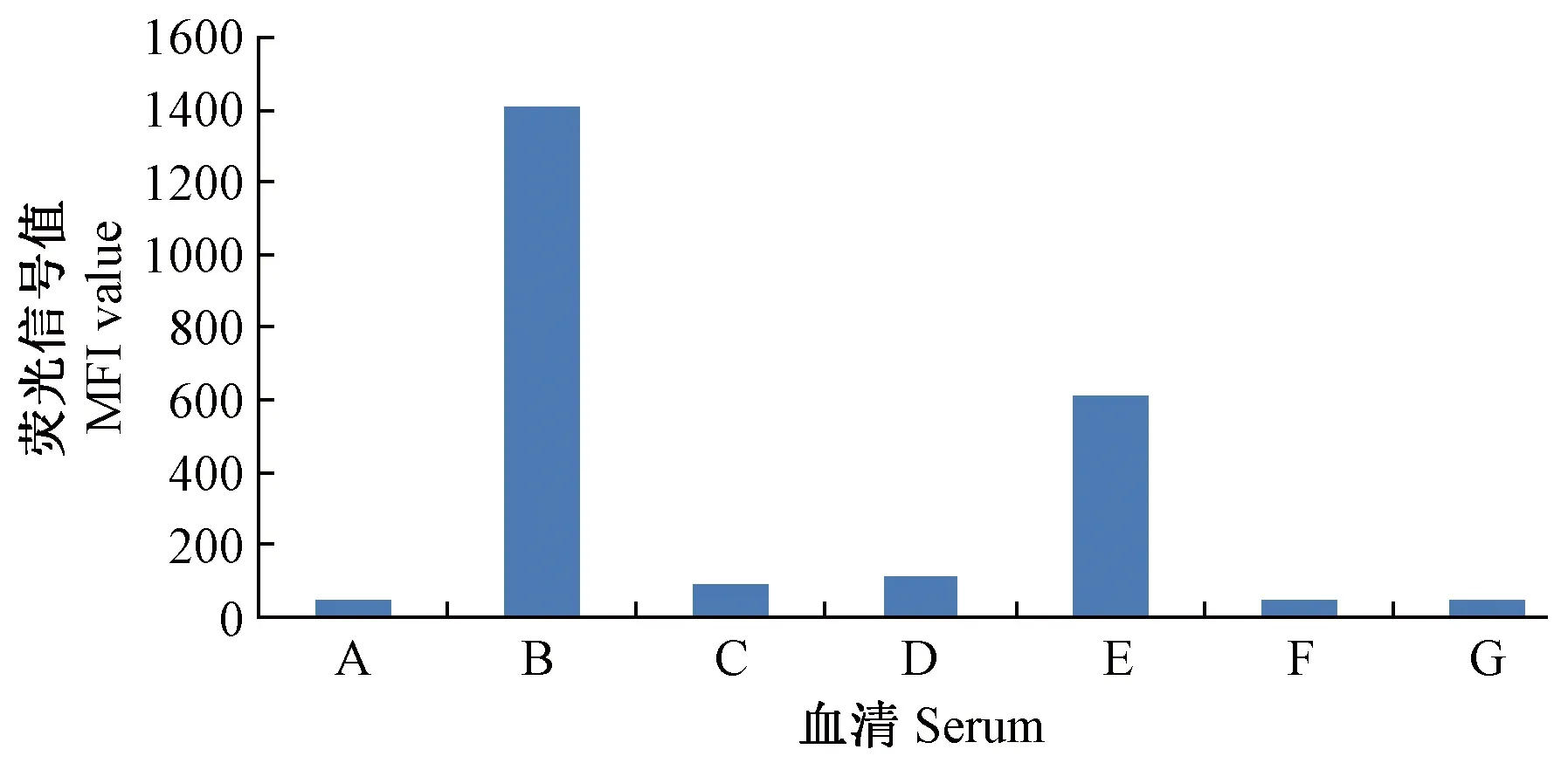
注:A:SIV阳性血清;B:SRV阳性血清;C:BV阳性血清;D:STLV阳性血清;E:四种阳性血清的混合物;F:阴性血清;G:空白对照。图7 流式免疫荧光微球检测技术特异性验证结果Note. A: SIV-positive serum; B: SRV-positive serum; C: BV-positive serum; D: STLV-positive serum; E: Mixture of SIV-, SRV-, BV- and STLV-positive serum; F: Serum of negative control; G: Blank control.Fig.7 Results of specificity validation of the flow microsphere immunofluorescence assay
2.7临床样本检测结果比对
收集24份临床血清样本,分别采用建立的流式免疫荧光微球检测技术和ELISA法进行检测分析,检测结果为,24份样品中有3份样品的流式免疫荧光微球检测结果为阳性,而ELISA检测结果为其中2份阳性,1份阴性;其余21份样品的两种检测结果一致,均为阴性。两种检测方法的符合率为96%。
3 讨论
猴D型逆转录病毒包括多个血清型,每个血清型之间的基因组DNA序列差异较大,因此,PCR等分子生物学的方法往往只能检测到某些血清型,诸如Lisaka建立的PCR方法只能检测到SRV-1,SRV-2,SRV-3型[5],Winkles通过引入简并碱基而设计通用PCR引物,也只能检测到SRV-1至SRV-5型[17]。另外,非人灵长类的基因组中含有内源性的逆转录病毒,这些病毒常常处于一种非感染的状态,随宿主的进化而进化,Fukumoto通过在日本人群中进行流行病学调查,发现这些内源性的病毒对人是基本没有感染力的,所以要区分内源性的逆转录病毒和感染性的外源性病毒,传统的PCR技术是无法做到的[1, 18]。
本研究表达的SRV p27蛋白,其序列在各个血清型中都非常保守,抗原位点多,非常适合用于免疫学的检测。程昀静和周洁等人均通过不同的原核表达载体成功对SRV p27蛋白进行融合表达,同时,周洁运用该蛋白建立了ELISA检测方法,证明其具有良好的诊断价值[19, 20]。
本研究建立的流式免疫荧光微球检测技术,吸取了传统的免疫学方法和Luminex荧光检测平台的优点,克服传统ELISA和IFA法操作复杂,样本需求大,无法进行多重检测的特点,且检测的灵敏度高,特异性强,同时,在后续的研究过程中,可建立多重流式免疫荧光微球检测技术,达到一份微量样本检测多个指标的目的,这将极大的提高养殖猴场和检测单位的效率,降低试剂与人工成本,因此,本研究建立的流式免疫荧光微球检测技术非常适合在配备有Luminex设备的检测单位或企业进行推广应用。
[1] 谭伟, 丁锡申. 逆转录病毒的最新分类方法 [J]. 病毒学报, 1993, 9(4): 390-396.
[2] 王芸, 吕龙宝, 马玉华, 等. 猴D型逆转录病毒的研究进展 [J]. 上海畜牧兽医通讯, 2012(6): 14-15.
[3] 张新生, 倪燕萍, 伍治平, 等. 中国猕猴逆转录病毒的分离 [J]. 中国病毒学, 1992, 7(2): 224-228.
[4] 王宏, 韦秋奖. 食蟹猴SPF种群建立过程中病毒抗体的动态监测 [J]. 中国实验动物学报, 2015, 23(6): 573-577.
[5] Liska V, Lerche NW, Ruprecht RM. Simultaneous detection of simian retrovirus type D serotypes 1, 2, and 3 by polymerase chain reaction [J]. AIDS Res Hum Retroviruses, 1997, 13(5): 433-437.
[6] Daniel MD, King NW, Letvin NL, et al. A new type D retrovirus isolated from macaques with an immunodeficiency syndrome [J]. Science, 1984, 223(4636): 602-605.
[7] 伍治平, 张新生, 倪燕萍, 等. 中国猕猴D型逆转录病毒(SRV)感染猴体的病理学改变 [J]. 西南国防医药, 1999, 9(2): 65-67.
[8] 伍治平, 倪燕萍, 张新生, 等. 猴D型逆转录病毒(SRV)感染恒河猴诱导脑细胞凋亡 [J]. 西南国防医药, 2001, 11(4): 242-244.
[9] 陈志斌, 贲昆龙. 猴D型逆转录病毒和猴艾滋病 [J]. 动物学研究, 1992, 13(2): 193-199.
[10] 贲昆龙, 陈志斌, 田保平, 等. 检测猴艾滋病D型逆转录病毒抗体的ELISA技术 [J]. 病毒学报, 1992, 8(4): 354-359.
[11] 郑霞. 非人灵长类SPF种群建立过程中病毒抗体监测研究 [D]. 苏州大学, 2012.
[12] 夏机良, 王涛, 季芳, 等. 巢式PCR检测食蟹猴和猕猴中SRV和SFV [J]. 中国比较医学杂志, 2010, 20(7): 40-43.
[13] Schultz KT, Thomas C, Toohey K, et al. ELISA for detection of antibodies to a type D retrovirus, SRV-W [J]. Viral Immunol, 1989, 2(1): 47-55.
[14] Liao Q, Guo H, Tang M, et al. Simultaneous detection of antibodies to five simian viruses in nonhuman primates using recombinant viral protein based multiplex microbead immunoassays [J]. J Virol Methods, 2011, 178(1-2): 143-152.
[15] Chung HK, Unangst T, Treece J, et al. Development of real-time PCR assays for quantitation of simian betaretrovirus serotype-1, -2, -3, and -5 viral DNA in Asian monkeys [J]. J Virol Methods, 2008, 152(1-2): 91-97.
[16] 熊炜, 蒋静, 张强, 等. 猴逆转录病毒RT-PCR和Real-time RT-PCR检测方法的建立 [J]. 动物医学进展, 2013, 34(12): 51-54.
[17] White JA, Todd PA, Rosenthal AN, et al. Development of a generic real-time PCR assay for simultaneous detection of proviral DNA of simianBetaretrovirusserotypes 1, 2, 3, 4 and 5 and secondary uniplex assays for specific serotype identification [J]. J Virol Methods, 2009, 162(1-2): 148-154.
[18] Fukumoto H, Hishima T, Hasegawa H, et al. Evaluation of Vero-cell-derived simian endogenous retrovirus infection in humans by detection of viral genome in clinicopathological samples and commercialized vaccines and by serology of Japanese general population [J]. Vaccine, 2016, 34(24): 2700-2706.
[19] 程昀静, 张利仙, 段纲, 等. 猴D型逆转录病毒p27基因的表达、纯化及重组蛋白的鉴定 [J].中国动物检疫, 2010, 27(5): 31-33.
[20] 周洁, 杨燕飞, 胡建华, 等. 猴D型逆转录病毒p27基因的克隆表达及诊断价值评价 [J]. 实验动物与比较医学, 2016, 36(4): 270-275.
Prokaryoticexpressionofp27geneofsimiantype-Dretrovirusandestablishmentofflowmicrosphereimmunofluorescenceassay
LIU Zhu-hong, WANG Jing, LI Xiu-zhen, YIN Xue-qin, ZHANG Yu, GUO Peng-ju, HUANG Ren*
(Guangdong Laboratory Animals Monitoring Institute, Key Laboratory of Experimental Animals in Guangdong Province, Guangzhou 510663, China)
ObjectiveThep27 gene of the simian type-D retrovirus was prokaryotically expressed to establish the flow microsphere immunofluorescence assay for detection of simian type-D retrovirus in nonhuman primates.MethodsThe gene ofp27 was amplified by PCR and linked to the pGEX-4T-1 expression vector digested with the restriction enzymes ofEcoR I andXhoI, and the recombinant pGEX-4T-1-p27 plasmid was transfected into the BL21 (DE3) cells for expression of target protein. The form of expressed protein and the optimal time for induction were analyzed by SDS-PAGE. The target protein was purified with GST resin and coupled with magnetic beads to establish the flow microsphere immunofluorescence assay for detection of simian type-D retrovirus in clinical specimens.ResultsThe recombinant protein was expressed in the soluble supernatant, and the optimal time for induction was 4 h. After coupling the protein with the magnetic beads, the flow microsphere immunofluorescence assay was successfully established. Using this method, 81-fold diluted serum could still be detected as positive, and no cross-reaction was found in the positive serum of other pathogens of nonhuman primates, indicating the strong specificity of this method.A total of 24 clinical specimens were tested by this flow microsphere immunofluorescence assay as well as ELISA. Among all the 24 specimens, 3 samples were positive detected by the flow microsphere immunofluorescence assay, of which 2 were positive and 1 was negative by ELISA. The coincidence rate of these two methods was 96%.ConclusionsThe prokaryotic expression of p27 protein of the simian type-D retrovirus is successful and the flow microsphere immunofluorescence assay with high sensitivity, strong specificity and tiny samples needed is established, which lays the foundation for further application of the multi-flow microsphere immunofluorescence technique.
Simian type-D retrovirus;p27 gene; Prokaryotic expression; Flow microsphere immunofluorescence assay
R-33
A
1671-7856(2017) 09-0017-07
10.3969.j.issn.1671-7856. 2017.09.004
2017-01-18
广东省科技计划项目(编号:2016A040403059,2014A040401035,2014B070706006);国家科技支撑计划项目(编号:2015BAI07B01)。
刘助红(1985-),男,助理研究员,理学硕士,研究方向:病原微生物的诊断及检测技术研究。E-mail: 290415174@qq.com
黄韧(1959-),男,研究员,理学博士,研究方向:比较医学和人类疾病动物模型。E-mail: hrlabking@126.com

