中枢神经元中SEL1L基因缺失对小鼠行为学的影响
王婧怡,刘青青,潘志雄,周正宇,龙乔明*
(1.苏州大学实验动物中心,江苏 苏州 215123; 2.苏州大学剑桥基因组研究中心,江苏 苏州 215123)
研究报告
中枢神经元中SEL1L基因缺失对小鼠行为学的影响
王婧怡1,刘青青2,潘志雄2,周正宇1,龙乔明2*
(1.苏州大学实验动物中心,江苏 苏州 215123; 2.苏州大学剑桥基因组研究中心,江苏 苏州 215123)
目的探究内质网蛋白SEL1L在维持哺乳动物中枢神经系统正常生理活动中的作用。方法利用Cre/loxp技术,构建神经元(neuron)特异性SEL1L基因敲除小鼠(NKO),按照不同性别分为实验组(NKO)与野生型组(WT),每组10只。比较分析小鼠在出生后不同日龄的存活时间、体重及抓力、平衡协调性、运动、焦虑情绪等行为学指标等差异,对SEL1L在中枢神经系统中的生理功能做出判断。结果NKO小鼠存活时间为(6±3)周;其体重在第3周、第5周、第8周分别为WT小鼠的54.64%、40.54%、38.57%;NKO雄性小鼠的抓力在第3、5、8周分别为WT雄性小鼠的44.24%、48.09%、49.04%,NKO雌性小鼠为WT雌性小鼠的39.39%、50.19%、49.69%;第3、5、8周的NKO雄性小鼠的平衡协调性反应出的运动时间分别为WT小鼠的26.92%、41.58%、37.48%,NKO雌性小鼠为WT小鼠的46.02%、47.67%、38.48%;第3、5、8周的NKO雄性小鼠在旷场实验中运动路程、进入中心区域时间分别为WT小鼠的(24.63%, 9.57%)、(25.87%, 11.63%)、(51.96%、9.97%),NKO雌性小鼠为WT小鼠的(35.62%, 25.93%)、(42.75%, 9.77%)、(34.77%, 14.49%),且表现出明显的焦虑情绪。差异有显著性(P< 0.001)。结论NKO小鼠在存活时间、体重、平衡协调性、运动、焦虑情绪等行为学指标等方面都明显差于野生型小鼠,说明SEL1L蛋白在维持中枢神经正常功能中是必须的。
SEL1L基因;小鼠模型;行为学研究
随着人口老龄化加速,老年痴呆症(即阿尔茨海默病)已成为威胁生命健康的四大疾病之一[1]。据统计,在我国60岁以上患病人群中,患老年痴呆症的比例约为1.6%,且随着人口老龄化而日趋严重[2]。神经退行性疾病(neurodegenerative diseases)是一类以脑部神经元发生退行性病变为特征的慢性疾病,其临床症状体现在不同程度的记忆力、感觉能力、判断力、思维能力和运动能力等受损[3]。
神经退行性疾病发病机制复杂[4, 5],但大脑特定区域的迟发性神经细胞退行性病变、细胞丢失是他们的共同特征[6]。值得注意的是最新一期Nature杂志发表评论,指出最有期望治疗阿尔兹海默症的一种内阻抗体药物(solanezumab),经过多家医疗机构的临床验证,其结果并没有获得任何短期内疗效,这使多位神经科学领域的学者怀疑目前研究的机制和研究的方向是否正确[7]。
寻找并成功构建神经退行性疾病的动物模型成为目前亟待解决的关键性问题。SEL1L(Suppressor/EnhancerofLin-12-Like)基因是内质网相关蛋白降解(ER-associated protein degradation,ERAD)系统中的一个重要组成部分[8, 9],早在2006年就有研究发现:SEL1L基因的缺失,可促使ATF6、IRE1等信号传导因子发生作用,诱导内质网发生应激,从而导致一系列损伤的发生,最直接的表现在抑制ERAD通路、抑制错误折叠蛋白质的降解[10]。在2012年,有研究表明SEL1L基因突变模型在犬齿类动物身上构建成功,可用于研究早发性小脑性共济失调,通过神经学、临床病理学和组织学的相关检查证明动物的小脑普遍存在共济失调、颤抖、个体发育迟缓等症状,可证明小脑确实发生神经退行性病变[11]。
本研究以神经元特异性SEL1L基因敲除小鼠(NKO)为研究对象,通过比较生长、存活及多个行为学指标,探讨SEL1L蛋白在维持中枢神经正常功能的必要性,结果显示:与WT小鼠相比,NKO小鼠在体重、存活时间、肌肉力量和平衡协调性等方面能力较差。这一结果为之后深入研究神经退行性疾病模型提供参考。
1 材料和方法
1.1实验设备
精密天平(OHAUS),转棒仪(Ugo Basile),抓力仪(Bioseb Bio-GS3);旷场实验所需录像设备:天敏USB系统;分析软件:TopScanLite TopView Behavior Analyzing System(Version 2.00);普通饲料。
1.2实验动物
1.2.1 动物来源
利用Cre/loxp技术,在C57BL/6 N-Atm1Brd小鼠上进行神经元(neuron)特异性敲除SEL1L基因的处理,小鼠购置于小鼠基因敲除计划库 [The Knockout Mouse Project (KOMP) Repository](ID: CSD44577,美国康奈尔大学,www.komp.org/geneinfo.php?project=44577),在苏州大学实验动物中心SPF级屏障系统中饲养,按照雄性与雌性1∶2的比例进行配种繁育,得到野生型小鼠和神经元特异性SEL1L基因敲除小鼠,繁育遵循孟德尔遗传定律。
1.2.2 动物分组
繁育出的小鼠(SPF级)进行SEL1L基因型鉴定。根据基因型鉴定结果,将小鼠分为雄性野生型组(WT)、雌性野生型组(WT)、雄性神经元特异性SEL1L基因敲除小鼠组(NKO)和雌性神经元特异性SEL1L基因敲除小鼠组(NKO),每组10只。
1.2.3 动物饲养
动物饲养在苏州大学实验动物中心SPF屏障设施内,自由进食饮水,室温保持在(25±2)℃,湿度保持在(55±5)%,12 h/12 h亮-暗循环光照,环境安静 [SYXK (苏) 2012-045]。所有实验操作符合苏州大学实验动物伦理委员会的要求(IACUC201701A032)。
1.3实验方法
1.3.1 存活率测试
记录小鼠出生日期、性别,按照饲养要求供应食物和水源;记录动物的死亡日期,按照不同性别,分别统计小鼠存活时间,截至到第12周。
1.3.2 体重测试
从小鼠一周龄开始,每周测量并记录动物的体重情况,持续至第8周。
1.3.3 肌肉力量测试
按照实验要求[12],选取第3、5、8周的小鼠进行前臂抓力测试,并记录实验数据。每只动物每次实验重复3次。
1.3.4 转棒(Rota-rod)测试
参考Justice和Hamlin等[12,13]的方法进行转棒(Rota-rod)实验,具体操作如下:选取第3、5、8周的小鼠进行实验。在实验之前,先对小鼠进行60 s的适应性训练,实验重复4次;正式实验,在5 min内从4 r/min加速到40 r/min,5 min后保持速度不变,当小鼠掉落后切断仪器电源,并记录实验数据。每只动物实验重复3次。清理消毒后测试下一组动物,整个实验过程在安静的环境中进行。
1.3.5 旷场测试
按照旷场实验的要求,选取第3、5、8周小鼠进行实验。小鼠放入直径49 cm,壁高40 cm正方形场内,距地面2 m处用一盏60 W白炽灯照明,并通过摄像头进行录像,记录小鼠20 min内的行为表现,清理消毒后测试下一组动物,整个实验过程在安静的环境中进行。小鼠在20 min内的行为表现分为进入中央区域的时间、粪便颗粒数、在实验区域运动的总距离以及运动的平均速度。视频录像经TopScanLite TopView Behavior Analyzing System软件和人工分析进行统计。
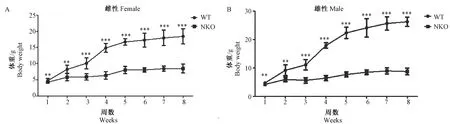
1.4统计学方法
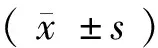
2 结果
2.1小鼠存活情况
如图1所示,与WT相比,NKO组小鼠从第2周开始出现死亡现象,到第9周基本全部死亡,存活率显著低于WT,差异有显著性(P< 0.05)。
2.2小鼠体重变化
如图2A、2B所示,从第1周开始,NKO组小鼠在体重方面显著低于WT组(P< 0.01);到第3周,差异更为显著(P< 0.0001)。
2.3小鼠运动情况测试
2.3.1 平衡协调能力
如图3A、3B、3C所示,在60 s适应性训练中,NKO组小鼠完成训练的情况明显差于WT组,其中雄性小鼠的完成情况差于雌性小鼠,差异有显著性(P< 0.05)。正式实验时,NKO组小鼠在加速转动棒上运动的时间明显小于WT组,同时NKO组小鼠在掉落时加速转动棒的速度也小于WT组,且差异有显著性(P< 0.0001)。
2.3.2 肌肉力量
如图4所示,从第3周开始,NKO组雄性、雌性小鼠抓力均明显小于WT组小鼠,且差异有显著性(P< 0.0001)。
注:A:雌性小鼠体重变化;B:雄性小鼠体重变化。与野生型组比较,**P< 0.01,***P< 0.0001。图2 不同性别NKO与WT小鼠体重变化Note. Changes of body weight in female (A) and male (B) mice. Compared with the WT group, **P< 0.01, ***P< 0.0001.Fig.2 Changes of body weight of the NKO and WT mice

注:3wF:3周龄雌性;3wM:3周龄雄性;5wF:5周龄雌性;5wM:5周龄雄性;8wF:8周龄雌性;8wM:8周龄雄性。与野生型组比较,***P<0.0001。图3 NKO组与WT组小鼠平衡协调能力、肌肉力量情况比较Note. 3wF:3-week-old female;3wM:3-week-old male;5wF:5-week-old female;5wM:5-week-old male;8wF:8-week-old female;8wM:8-week-old male.Compared with the WT group,***P< 0.0001.Fig.3 Comparison of balance coordination and muscle strength of the NKO and WT mice

注:3wF:3周龄雌性;3wM:3周龄雄性;5wF:5周龄雌性;5wM:5周龄雄性;8wF:8周龄雌性;8wM:8周龄雄性。与野生型组比较,***P<0.0001。图4 NKO组与WT组小鼠肌肉力量情况比较Note. 3wF:3-week-old female;3wM:3-week-old male;5wF:5-week-old female;5wM:5-week-old male;8wF:8-week-old female;8wM:8-week-old male.Compared with the WT group,***P< 0.0001.Fig.4 Comparison of grasping strength of the NKO and WT mice
2.3.3 运动能力与焦虑情绪测试
(1)排泄粪便数量:NKO组小鼠在测试时间内所排泄的粪便数量明显小于WT组,且差异有显著性(P< 0.0001)。见表1。
(2)运动总距离:第3周、第5周的NKO组小鼠运动总距离明显小于WT组,且差异有显著性(P< 0.0001);而第8周的NKO组小鼠与WT组小鼠之间的差距缩小,但NKO组小鼠运动总距离仍小于WT组(分别为P< 0.01,P< 0.05)。见表2。
(3)运动平均速度:NKO组小鼠在第3周时,运动的平均速度小于WT组(分别为P< 0.01,P< 0.05),第5周后,NKO组小鼠运动的平均速度与WT组相比差距明显增加,小于WT组,且差异有显著性(P< 0.0001)。见表3。
(4)进入中央区域时间:NKO组小鼠在测试时间内进入中央区域时间明显小于WT组,且差异有显著性(P< 0.0001)。见表4。
3 讨论
本研究通过分析神经元特异性SEL1L基因敲除小鼠(NKO)的生长、存活及多个行为学指标,探讨了SEL1L基因在维持神经系统正常生理活动中的作用,结果显示:与WT小鼠相比,NKO小鼠存活时间为3~9周、体重较轻、焦虑情绪显著,肌肉力量、平衡协调性、运动能力较差。这一研究结果充分说明SEL1L蛋白在维持中枢神经正常功能中是不可或缺。这也是首次在小鼠身上证明SEL1L基因功能正常与否直接与神经退行性疾病相关。
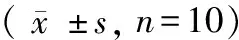
Tab.1Comparison amount of feces of the mice in each group during the open field test

组别Groups第3周3rdweek第5周5thweek第8周8thweekWT雄性WTMale52±1263±1365±11WT雌性WTFemale59±1255±0859±11NKO雄性NKOMale15±15a09±09a15±10aNKO雌性NKOFemale13±14a09±11a10±10a
注:与野生型组比较,aP< 0.0001。
Note. Compared with the WT group,aP< 0.0001.

Tab.2Comparison of total movement distance of the mice in each group during the open field test

组别Groups第3周3rdweek第5周5thweek第8周8thweekWT雄性WTMale5246252±20262.724318993±11090.763052850±15692.48WT雌性WTFemale3397651±9555.023294534±12958.892690966±7862.65NKO雄性NKOMale1292251±3004.5a1117487±12468.78a1586314±11653.51cNKO雌性NKOFemale1210130±3756.31a1408529±4078.62a935787±12468.78b
注:与野生型组比较,aP< 0.0001,bP< 0.01,cP< 0.05。
Note. Compared with the WT group,aP< 0.0001,bP< 0.01,cP< 0.05.
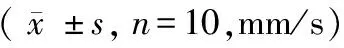
Tab.3Comparison of average speed of the mice in each group during the open field test
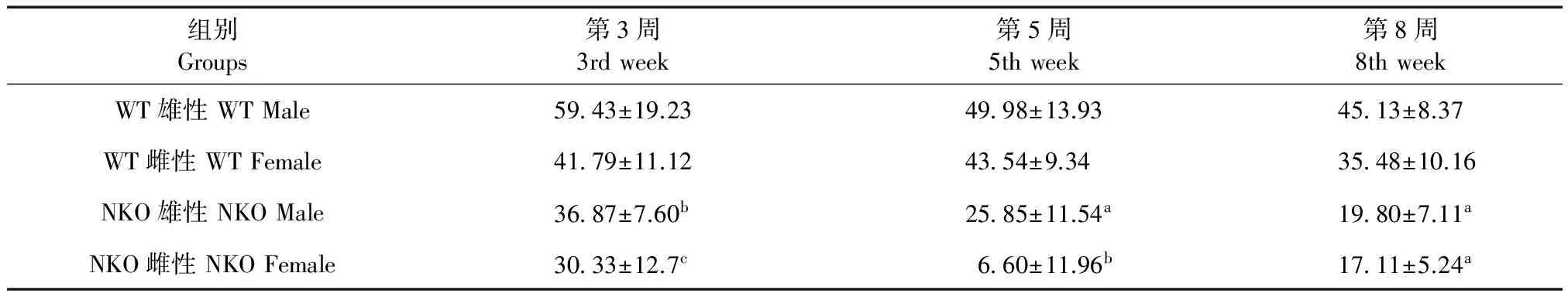
组别Groups第3周3rdweek第5周5thweek第8周8thweekWT雄性WTMale5943±19.234998±13.934513±8.37WT雌性WTFemale4179±11.124354±9.343548±10.16NKO雄性NKOMale3687±7.60b2585±11.54a1980±7.11aNKO雌性NKOFemale3033±12.7c660±11.96b1711±5.24a
注:与野生型组比较,aP< 0.0001,bP< 0.01,cP< 0.05。
Note. Compared with the WT group,aP< 0.0001,bP< 0.01,cP< 0.05.

Tab.4Comparison of the time spent to enter the central region of the mice in each group during the open field test

组别Groups第3周3rdweek第5周5thweek第8周8thweekWT雄性WTMale6726±64.1210232±32.0110777±38.44WT雌性WTFemale7627±23.7311612±52.198669±46.47NKO雄性NKOMale644±3.68a1190±13.86a1074±7.47aNKO雌性NKOFemale1978±21.86a1134±22.46a1256±16.92a
注:与野生型组比较,aP< 0.0001,bP< 0.01,cP< 0.05。
Note. Compared with the WT group,aP< 0.0001,bP< 0.01,cP< 0.05.
SEL1L基因缺失是如何导致中枢神经元退行性功能病变的呢?神经退行性疾病发病原因复杂,已有证据表明许多神经退行性疾病的发生,与病人脑中某些蛋白,如Tau蛋白、α-突出核蛋白(α-synuclein)、Aβ肽(β-amyloid)等蛋白的错误折叠和聚集有关[14]。而神经退行性疾病中错误折叠蛋白的形成则可能与内质网,特别是内质网相关降解通路的功能是否正常有关。SEL1L与泛素连接酶Hrd1共同构造内质网膜复合体,参与ERAD功能的正常进行[15]。我们的前期研究发现,SEL1L基因缺失诱导内质网发生应激,抑制ERAD通路、抑制错误折叠蛋白质的降解[15-18];基于目前已发表和我们的前期研究结果,可以推断SEL1L基因缺失可能主要影响中枢神经元中的内质网蛋白降解系统(即ERAD)功能,从而引发内质网应激反应,导致中枢神经元退行性功能病变。
神经退行性疾病临床表现可分为运动症状和非运动症状。对于运动症状的评估,本研究主要选择加速转轮、小鼠抓力器、旷场等实验装置分别评价小鼠的肌肉力量、平衡协调性、运动能力和焦虑情绪[12, 13]。研究发现NKO小鼠在抓力器、加速转轮上所展现的肌肉力量、运动能力和平衡协调能力明显弱于WT小鼠;在旷场实验中,NKO小鼠排泄物少于WT小鼠,反应出NKO小鼠焦虑情绪较WT小鼠严重,但由于排泄物数量受影响因素较多,不能充分反应其焦虑情况,需要辅助其他实验结果进行分析;NKO小鼠在运动距离、运动平均速度和进入中央区域时间方面与WT小鼠相比差异有显著性,NKO小鼠明显弱于WT小鼠,说明NKO小鼠偏好在角落静止不动或在旷场实验区域边缘活动,通过旷场实验结果,可以反映出NKO小鼠运动能力弱于WT小鼠,焦虑情况比WT小鼠严重。以上结果与Tomi等人对神经退行性疾病行为学研究结果一致[19-21]。从运动症状方面说明,SEL1L基因缺失导致小鼠在行为学方面有明显缺陷。
对于非运动症状的评估,NKO小鼠与WT小鼠相比存活时间明显缩短。本研究中个体周期的选择,主要参考预实验以及小鼠存活时间。正常小鼠的寿命为1.5~2年,而本研究中NKO小鼠平均寿命为6周,根据其他研究表明,SEL1L基因的缺失导致多种神经系统功能失常,影响诸如饮水、饮食、心律、血液循环等而导致死亡(参考未发表数据)。而小鼠寿命的缩短,也说明SEL1L基因缺失导致小鼠在生长方面存在缺陷。
而对于NKO小鼠体重的下降,有研究表明体重下降不是由于能量摄入减少, 而是由于能量消耗增加, 引起能量消耗的主要原因可能与肌肉僵直和非自主运动有关[22]。体重下降的发生可能和机体能量代谢失衡、疾病本身、吞咽困难、药物治疗、嗅觉下降、痴呆、瘦素、性别等因素有关。下丘脑广泛的神经元变性可能是导致体重下降的原因,因此神经退行性疾病患者体重下降与能量摄入和能量消耗的关系需要更多的研究加以证实[23]。体重下降的发生也可能与胰岛素样生长因子(insulin-like growth factor,IGF)有关,有研究表明,在脊髓性肌萎缩(spinal muscular atrophy,SMA)患病小鼠体内,IGF-1循环显著下降[24]。众所周知,在体内垂体-GH-GHR-IGF信号传导通路主要调控IGFs的表达,而IGF-1在体内起着重要的调节生长发育的作用[25]。NKO小鼠体重下降,推测可能与IGF-1分泌下降有关,最终影响个体正常生长,但具体的作用机制仍需要进一步加以证实。
动物模型的建立对探讨疾病分子机理和治疗手段十分关键。目前,用于神经退行性疾病研究的模型主要有斑马鱼[26, 27],线虫[28],果蝇和小鼠(药物诱导或基因改造)。而本研究所采用的NKO小鼠模型,通过神经元特异性SEL1L基因敲除,模拟体内ERAD通路受损,抑制脑内错误折叠蛋白质的降解,使其滞留在内质网内,导致内质网内环境的稳定发生变化,最终使细胞凋亡、神经元或髓鞘发生缺失。这一模型的建立将有助于从新的审视角度探究神经退行性疾病的发病机制,从而加速抗神经退行性疾病有效新药的研发。
综上所述,本研究发现中枢神经元特异性SEL1L基因敲除(NKO)小鼠无论从存活时间、体重、情绪等非运动水平,还是从肌肉力量、平衡协调性等运动水平上,都与WT小鼠存在较大差异,各项指标明显低于WT小鼠,说明SEL1L蛋白在维持中枢神经正常功能中是必须的。NKO小鼠所表现出的生长及行为学方面的特征,与神经退行性疾病患者运动、力量、平衡、情绪等症状具有一定相似性,为进一步深入研究神经退行性疾病的分子机制和治疗措施,提供了一个新的动物模型。本研究还存在许多不足之处,例如,仅从生长和行为学的运动、肌肉力量等方面验证NKO小鼠与WT小鼠的差异,而未对神经退行性疾病中典型的记忆行为学进行测试;其次,本研究也未从细胞和分子水平深入研究NKO小鼠模型中神经退行性病变的具体发病机理。
[1] 龙元先, 唐雨萌, 唐利军. 中国阿尔兹海默病主要影响因素的Meta分析 [J]. 中国预防医学杂志, 2013, 14(1): 59-63.
[2] Dong MJ, Peng B, Lin XT, et al. The prevalence of dementia in the People’s Republic of China: a systematic analysis of 1980-2004 studies [J]. Age Ageing, 2007, 36(6): 619-624.
[3] Friedlander RM. Apoptosis and caspase in neurodegenerative disease [J]. N Engl J Med, 2003, 348(14): 1365-1375.
[4] 薛小燕, 郭小华, 李敏, 等. 神经退行性疾病发病机制研究进展 [J]. 中国老年学杂志, 2015, 35(11): 3149-3152.
[5] 杨联勇. 阿尔茨海默病发病机制进展 [J]. 中国民康医学, 2014, 26(23): 79-80, 90.
[6] Hardy J. Pathways to primary neurodegenerative disease [J]. Ann N Y Acad Sci, 2000, 924: 29-34.
[7] Abbott A, Dolgin E. Failed Alzheimer’s trial does not kill leading theory of disease [J]. Nature, 2016, 540(7631): 15-16.
[8] Kaneko M, Nomura Y. ER signaling in unfolded protein response [J]. Life Sci, 2003, 74(2-3): 199-205.
[9] Lilley BN, Ploegh HL. Multiprotein complexes that link dislocation, ubiquitination, and extraction of misfolded proteins from the endoplasmic reticulum membrane [J]. Proc Natl Acad Sci U S A, 2005, 102(40): 14296-14301.
[10] Saltini G, Dominici R, Lovati C, et al. A novel polymorphism in SEL1L confers susceptibility to Alzheimer’s disease [J]. Neurosci Lett, 2006, 398(1-2): 53-58.
[11] Kyöstilä K, Cizinauskas S, Seppälä EH, et al. ASEL1Lmutation links a canine progressive early-onset cerebellar ataxia to the endoplasmic reticulum-associated protein degradation (ERAD) machinery [J]. PLoS Genet, 2012, 8(6): e1002759.
[12] Justice JN, Carter CS, Beck HJ, et al. Battery of behavioral tests in mice that models age-associated changes in human motor function [J]. Age (Dordr), 2014, 36(2): 583-592.
[13] Hamlin AS, Windels F, Boskovic Z, et al. Lesions of the basal forebrain cholinergic system in mice disrupt idiothetic navigation [J]. PLoS One, 2013, 8(1): e53472.
[14] Rusmini P, Crippa V, Cristofani R, et al. The role of the protein quality control system in SBMA [J]. J Mol Neurosci, 2016, 58(3): 348-364.
[15] Sun S, Shi G, Han X, et al. Sel1L is indispensable for mammalian endoplasmic reticulum-associated degradation, endoplasmic reticulum homeostasis, and survival [J]. Proc Natl Acad Sci U S A, 2014, 111(5): E582-E591.
[16] Li S, Francisco AB, Munroe RJ, et al. SEL1L deficiency impairs growth and differentiation of pancreatic epithelial cells [J]. BMC Dev Biol, 2010, 10: 19.
[17] Sha H, Sun S, Francisco AB, et al. The ER-associated degradation adaptor protein Sel1L regulates LPL secretion and lipid metabolism [J]. Cell Metab, 2014, 20(3): 458-470.
[18] Francisco AB, Singh R, Li S, et al. Deficiency of suppressor enhancer Lin12 1 like (SEL1L) in mice leads to systemic endoplasmic reticulum stress and embryonic lethality [J]. J Biol Chem, 2010, 285(18): 13694-13703.
[19] Rantamäki T, Kemppainen S, Autio H, et al. The impact ofBdnfgene deficiency to the memory impairment and brain pathology of APPSwe/PS1dE9 mouse model of Alzheimer’s disease [J]. PLoS One, 2013, 8(7): e68722.
[20] Milanese M, Giribaldi F, Melone M, et al. Knocking down metabotropic glutamate receptor 1 improves survival and disease progression in theSOD1G93Amouse model of amyotrophic lateral sclerosis [J]. Neurobiol Dis, 2014, 64: 48-59.
[21] Turner BJ, Alfazema N, Sheean RK, et al. Overexpression of survival motor neuron improves neuromuscular function and motor neuron survival in mutant SOD1 mice [J]. Neurobiol Aging, 2014, 35(4): 906-915.
[22] Chen H, Zhang SM, Hernán MA, et al. Weight loss in Parkinson’s disease [J]. Ann Neurol, 2003, 53(5): 676-679.
[23] 畅雪丽, 彭蓉, 张紫娟. 帕金森病和体重下降 [J]. 华西医学, 2009, 24(10): 2804-2806.
[24] Hua Y, Sahashi K, Rigo F, et al. Peripheral SMN restoration is essential for long-term rescue of a severe spinal muscular atrophy mouse model [J]. Nature, 2011, 478(7367): 123-126.
[25] 赵咏梅, 毛萌. GH-IGF-1轴的作用机制 [J]. 四川医学, 2005, 26(7): 808-810.
[26] 许大平, 张在军, 李铭源. 斑马鱼: 构建神经退行性疾病模型的新型模式生物 [J]. 四川生理科学杂志, 2012, 34(3): 119-123.
[27] Rink E, Wullimann MF. The teleostean (zebrafish) dopaminergic system ascending to the subpallium (striatum) is located in the basal diencephalon (posterior tuberculum) [J]. Brain Res, 2001, 889(1-2): 316-330.
[28] 许云, 阮秦莉, 王梦. 秀丽隐杆线虫在神经退行性疾病致病机制研究及中药干预作用中的应用 [J]. 上海中医药大学学报, 2016, 30(4): 92-97.
ImpactofSEL1Ldeletionincentralnervoussystemonthebehaviorofmice
WANG Jing-yi1, LIU Qing-qing2, PAN Zhi-xiong2, ZHOU Zheng-yu1, LONG Qiao-ming2*
(1.Research Center of Laboratory Animals, Soochow University, Suzhou 215123, China; 2.Genome Research Center of Cambridge-Soochow University, Suzhou 215123)
ObjectiveTo investigate the role of endoplasmic reticulum protein SEL1L in the maintenance of physiological activities of the central nervous system in mammals.MethodsNeuron-specificSEL1Lknockout mice (NKO) were generated using the Cre/loxp strategy. Both female and male mice were divided into experimental group (NKO) and wild-type group (WT), with 10 mice in each group and of both sexes. The postnatal survival time, body weight and behavioral indicators such as strength of skeletal muscle, balance coordination, locomotion and anxiety of the mice in each group were compared and analyzed to evaluate the physiological role of SEL1L in the central nervous system.ResultsThe survival time of the NKO mice was only (6±3) weeks on average. Although the neonatal body weight of the NKO mice was similar to that of the wild-type mice, both the male and female NKO mice were significantly more retarded in growth than the wild-type mice, since the body weight of the NKO mice was 54.64%, 40.54% and 38.57% of the WT mice at 3, 5 and 8 weeks of age, respectively. The strength of skeletal muscle of the male NKO mice was 44.24%, 48.09% and 49.04% of male WT mice, and as for the female NKO mice, it was 39.39%, 50.19% and 49.69% of the female WT mice at those three postnatal time points. The movement time, which indicates the balance coordination, of the male NKO mice was 26.92%, 41.58% and 37.48% of the male WT mice, and the movement time of the female NKO mice was 46.02%, 47.67% and 38.48% of the female WT mice. The movement distance in the open field test and the time spent to enter the central region of the male NKO mice were (24.63%, 9.57%), (25.87%, 11.63%) and (51.96%, 9.97%) of the male WT mice, and as for the female NKO mice, those two indicators were (35.62%, 25.93%), (42.75%, 9.77%) and (34.77%, 14.49%) of the female WT mice. In addition, the NKO mice showed more prominent anxiety. There were significant differences between the NKO group and the WT group for all of the experiments above (P< 0.001).ConclusionsThe data of the postnatal survival time, the body weight and the behavioral indicators such as balance coordination, locomotion and anxiety of the mice show that the condition of the NKO mice is significantly worse than that of the WT mice, indicating an important role of SEL1L in the maintenance of physiological functions of the central nervous system.
SEL1Lgene; Mouse model; Behavior studies
R-33
A
1671-7856(2017) 09-0053-07
10.3969.j.issn.1671-7856. 2017.09.010
2017-01-16
苏州大学特聘教授启动经费(编号:Q421600114)。
王婧怡(1992-),女,硕士研究生,专业:细胞生物学。E-mail: wjy13936595055@163.com
龙乔明(1963-),男,博士生导师,研究方向:神经退行性疾病的细胞与分子机理。E-mail: qmlong@suda.edu.cn

