miR-143通过负向调控Bcl-2抑制食管癌细胞的增殖
胡琛琛,张 莉
(湖北省肿瘤医院重症医学科,武汉 430079)
研究报告
miR-143通过负向调控Bcl-2抑制食管癌细胞的增殖
胡琛琛,张 莉*
(湖北省肿瘤医院重症医学科,武汉 430079)
目的探讨miR-143通过负向调控B淋巴细胞瘤-2(Bcl-2)抑制食管癌细胞的增殖。方法RT-PCR法检测食管癌细胞TE-1、EC109、EC9706、KYSE150、KYSE510、SEG-1及人正常食管上皮细胞HEEC中miR-143表达,使用脂质体LipofectamineTM2000将miR-143 mimics和miR-143 NC转入EC9706细胞中,48 h后,RT-PCR法检测miR-143表达,CCK-8法检测细胞活力,EdU染色检测细胞增殖情况,流式细胞术检测细胞周期,RT-PCR及Western blot检测Bcl-2蛋白及mRNA的表达。结果miR-143在食管癌细胞TE-1,EC109,EC9706,KYSE150,KYSE510及SEG-1中的表达量[(1.36±0.13),(1.08±0.10),(0.89±0.09),(0.95±0.09),(1.32±0.14),(0.96±0.11)]显著低于miR-143在人正常食管上皮细胞HEEC(2.38±0.15)中的表达量(P< 0.01)。与miR-143 NC组比较,miR-143 mimics组miR-143表达量显著升高(P< 0.01),细胞活力下降(P< 0.01),细胞增殖能力降低(P< 0.01),细胞周期阻滞在G1期(P< 0.01),同时Bcl-2蛋白及mRNA表达量显著降低(P< 0.01)。结论miR-143过表达能通过下调Bcl-2表达抑制EC9706细胞增殖。
miR-143;食管癌;EC9706;增殖;B淋巴细胞瘤-2,Bcl-2
食管癌是消化系统中常见的恶性肿瘤之一,我国每年约有15万人死于食管癌,占了世界病死率将近50%[1, 2]。目前食管癌的主要治疗方式为手术、放疗、化疗相结合,但是患者一旦确诊基本处于中晚期,5年生存率不足20%,因此寻找有效的能够早期诊断、治疗食管癌的生物标志物已成为食管癌等肿瘤领域研究的热点[1, 2]。miRNA是一类高度保守的非编码RNA分子,能与靶基因mRNA的3’非翻译区(untranslated region,UTR)结合,进而降解或者抑制靶基因的转录,从而参与细胞增殖、凋亡、细胞周期等生物学行为的调控[3, 4]。现研究已经显示miRNA的异常表达与肿瘤的发生发展密切相关[5, 6]。同时在食管癌组织及其正常组织中发现多种差异性表达的miRNA,miR-143就是其中的一种,且其在其它肿瘤中的作用机制已被深入探讨,但在食管癌的发生发展的具体作用机制尚未见报道[5-9]。此外肿瘤细胞呈现无限增殖与凋亡抑制,并受凋亡相关蛋白调控,Bcl-2就是其中的一种凋亡抑制蛋白,且有研究显示miR-143能通过下调Bcl-2表达抑制骨肉瘤细胞、宫颈癌细胞增殖[10, 11],因而本研究推测miR-143是否也可以通过靶向调控Bcl-2进而影响食管癌细胞增殖,本研究将对此推测展开以下实验研究。
1 材料和方法
1.1细胞株
食管癌细胞TE-1、EC109、EC9706、KYSE150、KYSE510及SEG-1购于中国科学院上海细胞库,人正常食管上皮细胞HEEC购于上海酶研生物科技有限公司。
1.2主要试剂和仪器
miR-143 mimics和miR-143 NC购于上海吉玛制药技术有限公司;兔抗Bcl-2单克隆抗体购于美国Epitomics公司;胎牛血清,DMEM培养基购于美国Gibco公司;辣根过氧化物酶标记山羊抗兔IgG(H+L),BCA试剂盒,Trizol法试剂盒,CCK-8试剂盒,细胞周期检测试剂盒购自碧云天生物技术有限公司;LipofectamineTM2000脂质体,一步法RT-PCR试剂盒购自大连宝生生物技术有限公司;EdU细胞增殖试剂盒购自广州市锐博生物科技有限公司。DYCZ-425D型双垂直电泳仪,DYCZ-40D型迷你转印电泳仪购于北京六一仪器厂;GelDoc XR System凝胶成像系统购于美国Bio-Rad公司;FACSCalibur型流式细胞仪,168-1000XC型酶标仪购于美国BD公司;AF6000型荧光显微镜购自德国莱卡公司。1.3实验方法
1.3.1 RT-PCR法检测细胞中miR-143及Bcl-2的表达
采用TRIzol法抽提细胞中总RNA,并检测RNA纯度,通过一步法RT-PCR逆转录RNA,扩增产物用于琼脂糖凝胶电泳。引物由上海生工生物工程有限公司合成。miR-143上游引物:5’-ACACTCC AGCTGGGTGAGATGAAGCACTGTAG-3’,下游引物:5’-CTCAACTGGTGTCGTGGA-3’;Bcl-2上游引物:5’-CAGCTGCACCTGACGCCCTT-3’,下游引物:5’-GCCTCCGTTATCCTGGATCC-3’;GAPDH上游引物:5’-AGCCACATCGCTCAGACA-3’,下游引物:5’-TG GACTCCACGACGTACT-3’。
1.3.2 细胞转染
当EC9706细胞汇合度达到50%~70%左右时候,利用LipofectamineTM2000脂质体转染miR-143 mimics和miR-143 NC,6 h以后换成含10%血清的DMEM培养基;37℃,CO2培养箱培养48 h。应用RT-PCR法检测细胞中的miR-143。
1.3.3 CCK-8法检测EC9706细胞活力
将5×104个细胞接种于96孔板,分别于24 h、48 h、72 h、96 h加入CCK-8试剂,继续培养4 h后,于酶标仪中检测OD值,波长设置为570 nm,所测OD值即细胞活力。
1.3.4 EdU染色检测细胞增殖
将5×104个细胞接种于96孔板,48 h后,消化收集细胞,加入含有EdU的培养基孵育2 h,PBS洗涤后,4%多聚甲醛固定30 min后,按试剂盒说明书要求分别加入试剂B、C、D、E进行孵育,接着PBS洗涤,最后用Hoechst33342染色液室温孵育30 min,后PBS洗涤,并于荧光显微镜下进行观察拍照,最后用Image J进行统计分析。
1.3.5 流式细胞术检测细胞周期
将1×105个细胞接种于6孔板,48 h后,消化收集细胞,接着根据细胞周期检测试剂盒说明书对细胞进行固定,染色并于1 h内在流式细胞仪中进行检测。
1.3.6 Western blot检测细胞中Bcl-2蛋白表达
将1×105个细胞接种于6孔板,48 h后,收集细胞,并加入适量的细胞裂解液,裂解30 min,离心收集上清液,即收获总蛋白。接着采用BCA试剂盒测定蛋白浓度,蛋白经煮沸变性后上样,进行十二烷基苯磺酸钠凝胶电泳,后湿法转膜30 min。5%脱脂奶粉室温封闭1 h,一抗溶液(兔Bcl-2单克隆抗体,稀释度为1∶100)4℃过夜孵育,次日室温二抗溶液[辣根过氧化物酶标记山羊抗兔IgG (H+L)]孵育1~2 h,在凝胶成像系统中曝光,最后采用“Quantity One”软件分析各个抗体条带的灰度值。
1.3.7 荧光素酶报告基因表达分析
miR-143及Bcl-2重组载体共转染到EC9706细胞中。分组如下:(miR-143 mimics) + (pMIR Bcl-2 3’UTR-Wt),(miR-143 NC) + (pMIR Bcl-2 3’UTR-Mut),(miR-143 mimics) + (pMIR Bcl-2 3’UTR-Mut),(miR-143 NC) + (pMIR Bcl-2 3’UTR-Mut)。应用双荧光素酶检测系统检测转染好的荧光素酶活性,计算公式:相对荧光值=萤火虫荧光素酶荧光值/海肾荧光素酶荧光值。每个实验组三个平行复孔。
1.4统计学方法
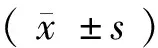
2 结果
2.1miR-143在食管癌及正常食管上皮细胞中的表达
如图1所示,miR-143在食管癌细胞TE-1、EC109、EC9706、KYSE150、KYSE510及SEG-1中的表达量 [(1.36±0.13),(1.08±0.10),(0.89±0.09),(0.95±0.09),(1.32±0.14),(0.96±0.11)] 显著低于miR-143在人正常食管上皮细胞HEEC(2.38±0.15)中的表达量,且差异有显著性(P< 0.01)。
注:1.HEEC;2.TE-1;3.EC109;4.EC9706;5.KYSE150;6.KYSE510;7.SEG-1。与HEEC比较,**P< 0.01。图1 miR-143在食管癌细胞及正常食管上皮细胞中的表达Note.1.HEEC; 2.TE-1; 3.EC109; 4.EC9706; 5.KYSE150; 6.KYSE510; 7.SEG-1.Compared with HEEC,**P< 0.01.Fig.1 Expression levels of miR-143 in the esophageal cancer cells and normal esophageal epithelial cells
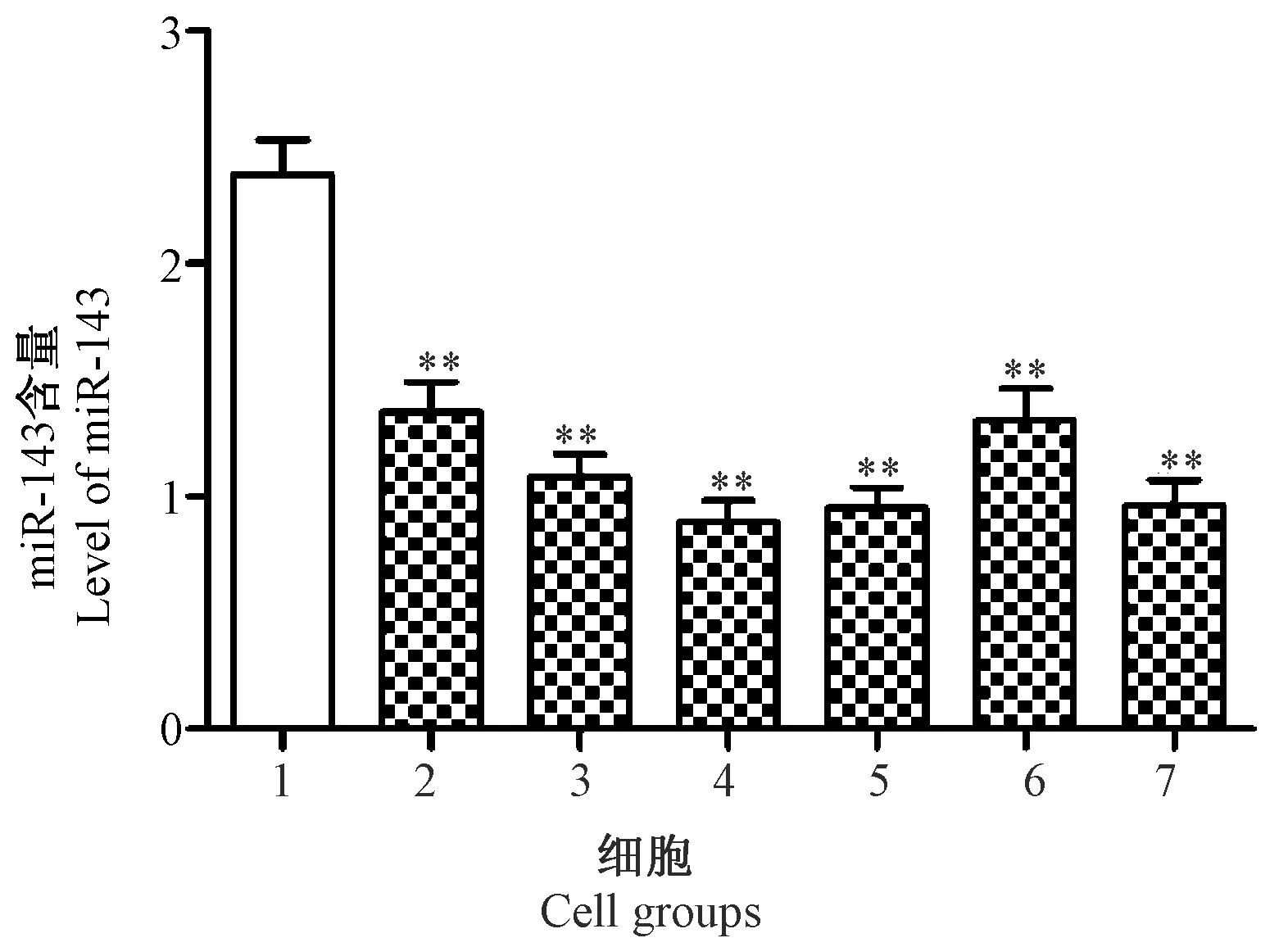
注:与miR-143 NC组比较,**P< 0.01。图2 miR-143 mimics转染效果的检测Note. Compared with the miR-143 NC group,**P< 0.01.Fig.2 Efficiency of transfection of miR-143 mimics
2.2miR-143mimics转染效果的检测
如图2所示,与miR-143 NC组(0.76±0.07)比较,miR-143 mimics组(1.56±0.15)中miR-143表达量显著上调,差异有显著性(P< 0.01)。
2.3miR-143mimics对EC9706细胞活力的影响
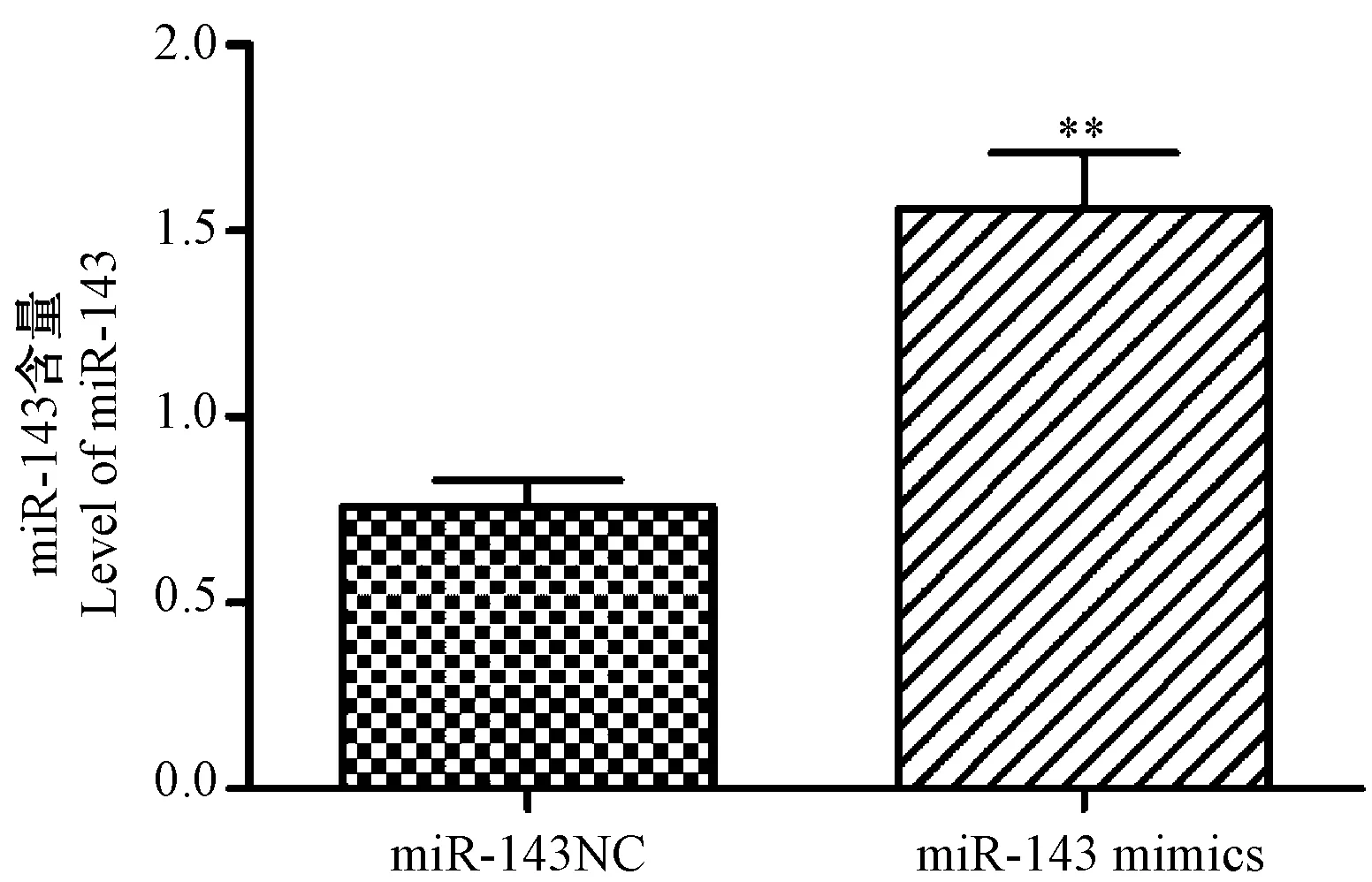
如图3所示,随着转染时间的延长,与miR-143 NC组比较,miR-143 mimics组细胞活力均显著降低,差异有显著性(P< 0.01)。
注:与miR-143 NC组比较,**P< 0.01。图3 miR-143 mimics对EC9706细胞活力的影响Note. Compared with the miR-143 NC group,**P< 0.01.Fig.3 Effect of miR-143 mimics on the viability of EC9706 cells
2.4miR-143mimics对EC9706细胞增殖的影响
如图4所示,与miR-143 NC组(128.58±12.51)比较,miR-143 mimics组(21.74±0.22)细胞增殖数目显著降低,差异有显著性(P< 0.01)。

图4 miR-143 mimics对EC9706细胞增殖的影响(×200)Fig.4 Effect of miR-143 mimics on the proliferation of EC9706 cells
2.5miR-143mimics对EC9706细胞周期的影响
如图5、表1所示,与miR-143 NC组比较,miR-143 mimics组细胞周期阻滞在G1期(P< 0.01)。
2.6报告基因分析
将miR-143 mimics、miR-143 NC及野生型载体pMIR Bcl-2 3’UTR-Wt、突变型载体pMIR Bcl-2 3’UTR-Mut转入EC9706细胞中,结果发现,miR-143 mimics与野生型载体pMIR Bcl-2 3’UTR-Wt共转染组的荧光信号强度明显弱于其它转染组(P< 0.01)。而对于突变型载体pMIR Bcl-2 3’UTR-Mut来说,各组间荧光强度差异无显著性(P> 0.05),见图6。

Tab.1Effect of miR-143 mimics on the cell cycle of EC9706 cells

组别GroupsG1期G1phaseS期SphaseG2期G2phasemiR⁃143NC5238±5251674±1723088±172miR⁃143mimics6457±621∗∗1246±125∗∗2297±260∗∗
注:与miR-143 NC组比较,**P< 0.01。
Note. Compared with the miR-143 NC group,**P< 0.01.

注:与pMIR Bcl-2 3’UTR-Wt比较,**P< 0.01。图6 报告基因分析Note. Compared with pMIR Bcl-2 3’UTR-Wt,**P< 0.01.Fig.6 Analysis of the reporter genes
2.7miR-143mimics对EC9706细胞中Bcl-2蛋白及mRNA表达的影响
如图7所示,与miR-143 NC组比较,miR-143 mimics组Bcl-2蛋白及mRNA表达量下调(P< 0.01)。

注:与miR-143 NC组比较,**P< 0.01。图7 miR-143 mimics对EC9706细胞中Bcl-2蛋白及mRNA表达量的影响Note. Compared with the miR-143 NC group,** P < 0.01.Fig.7 Effect of miR-143 mimics on the expression of Bcl-2 protein and mRNA in EC9706 cells
3 讨论
1993年Ambros等学者在秀丽隐杆线虫中第一次发现了miRNA,即lin-4,随后又有学者于2000年在秀丽隐杆线虫中发现了第二个miRNA,即let-7。往后的二十几年间学者陆续于脊椎动物、植物及病毒中发现了上千种的miRNA,在这期间有学者于2002年发现了miRNA与肿瘤的关系,在慢性淋巴细胞白血病中存在着miR-15与miR-16的表达量下调或者缺失,并且这两个miRNA还与白血病的发生发展密切相关,引起了研究者深厚的兴趣,并进一步的深入研究miRNA在肿瘤中的作用机制[3, 4]。miRNA在食管癌组织及正常组织中存在着差异性表达,miR-143就是其中的一种。miR-143位于人类染色体5q32,最早被发现于鼠类,具有显著的组织特异性。Wu等[7]利用miRNA微阵列分析方法发现了miR-143在食管癌组织及正常组织中存在差异性表达,进一步用RT-PCR也证实了miR-143在食管鳞状细胞癌患者中的表达量是下调的,且将稳定表达miR-143的质粒转染到食管癌细胞后,发现细胞迁移能力显著的降低。后续Liu等[12],Ni等[13]也都证实了miR-143在食管癌中的低表达。同时miR-143在其他肿瘤中的具体作用机制已深入报道,在食管癌中的具体作用还尚未可知[8, 9],因此本研究将对此展开讨论。
本研究首先利用RT-PCR法检测了6株食管癌细胞中(TE-1,EC109,EC9706,KYSE150,KYSE510及SEG-1)及1株人正常食管上皮细胞HEEC中miR-143的表达,结果表明miR-143在组织标本中的表达趋势一致,食管癌细胞中的miR-143表达量也显著低于正常食管细胞。接着利用脂质体转染miR-143 NC和miR-143 mimics,转染效果通过RT-PCR验证,结果也表明转染成功。进一步的利用CCK-8及EdU染色检测miR-143 mimics对EC9706食管癌细胞活力及增强情况的影响,结果表明miR-143 mimics能显著的降低EC9706细胞活力,并抑制细胞增殖能力,与miR-143在结直肠癌细胞中的作用效果一致[8, 9]。说明提高EC9706细胞中miR-143表达量能显著的抑制细胞的增殖能力。另外肿瘤细胞的无限增殖源自于细胞周期的不可控制,细胞周期关键调控点包括G1,S及G2期,且这3个调控点是众多肿瘤药物作用于肿瘤细胞的靶点之一[14, 15]。因此本研究进一步探讨miR-143 mimics对EC9706细胞周期的影响,结果表明miR-143 mimics能显著延长G1期,使细胞周期阻滞在G1期,抑制细胞的复制与增殖,与miR-143在肝癌细胞中作用效果一致[16]。从而说明miR-143 mimics能通过阻滞EC9706细胞周期于G1期,从而抑制细胞的增殖与活力。
肿瘤细胞的无限增殖与凋亡抑制受到细胞凋亡蛋白的调控作用,其中Bcl-2家族是最常见的细胞凋亡调控家族。Bcl-2是研究最为广泛的凋亡抑制蛋白,是第一个在淋巴细胞中被发现的能抑制细胞凋亡的蛋白,能与促凋亡蛋白Bax形成异二聚体,进而调控细胞的增殖与凋亡。而miRNA对于细胞生物学行为的调控作用,主要是通过对其下游靶基因的调控作用实现的[17],且已有研究表明miR-143能通过下调Bcl-2表达抑制骨肉瘤细胞、宫颈癌细胞增殖[10, 11],但是否能够此作用机制抑制食管癌细胞的增殖还尚不可知。所以本研究首先利用荧光素酶报告基因检测了miR-143 mimics对野生型Bcl-2载体及突变型Bcl-2载体荧光信号的影响,结果证实只有野生型Bcl-2载体的信号减弱,说明miR-143 mimics能够结合于Bcl-2的3’ UTR区域,进而抑制其表达。接着利用Western blot及RT-PCR进一步证实了miR-143 mimics能通过下调Bcl-2蛋白及mRNA表达,从而说明miR-143 mimics通过负向调控Bcl-2表达,进而使EC9706细胞周期阻滞于G1期,并抑制细胞增殖与活力。
综上所述,miR-143在TE-1,EC109,EC9706,KYSE150,KYSE510及SEG-1细胞中的表达量显著低于其在HEEC细胞中的表达量,因此上调EC9706细胞中miR-143表达量能显著降低Bcl-2表达,进而抑制细胞活力及增殖能力,并使细胞周期阻滞在G1期。
[1] 叶韬, 孙苏平. 食管癌术后放射治疗的研究进展 [J]. 癌症进展, 2012, 10(6): 576-579.
[2] 李定安, 彭开桂. 食管癌术前同步放化疗的临床研究进展 [J]. 中华全科医学, 2014, 12(9): 1466-1468.
[3] Gambari R, Brognara E, Spandidos DA, et al. Targeting oncomiRNAs and mimicking tumor suppressor miRNAs: New trends in the development of miRNA therapeutic strategies in oncology (Review) [J]. Int J Oncol, 2016, 49(1): 5-32.
[4] 许文剑, 苏秀兰, 刘明. miRNA与肿瘤关系的研究进展 [J]. 医学综述, 2013, 19(17): 3120-3123.
[5] 蔡晓波, 李庆, 郭俊明, 等. MicroRNA与食管癌的研究进展 [J]. 中国细胞生物学学报, 2013, 35(9): 1405-1411.
[6] Sharma P, Sharma R. miRNA-mRNA crosstalk in esophageal cancer: from diagnosis to therapy [J]. Crit Rev Oncol Hemat, 2015, 96(3): 449-462.
[7] Wu BL, Xu LY, Du ZP, et al. miRNA profile in esophageal squamous cell carcinoma: downregulation of miR-143 and miR-145 [J]. World J Gastroenterol, 2011, 17(1): 79-88.
[8] Yang F, Xie YQ, Tang SQ, et al. miR-143 regulates proliferation and apoptosis of colorectal cancer cells and exhibits altered expression in colorectal cancer tissue [J]. Int J Clin Exp Med, 2015, 8(9): 15308-15312.
[9] Su J, Liang H, Yao W, et al. miR-143 and miR-145 regulate IGF1R to suppress cell proliferation in colorectal cancer [J]. PLoS One, 2014, 9(12): e114420.
[10] Li WH, Wu HJ, Li YX, et al. MicroRNA-143 promotes apoptosis of osteosarcoma cells by caspase-3 activation via targeting Bcl-2 [J]. Biomed Pharmacother, 2016, 80: 8-15.
[11] Liu L, Yu X, Guo X, et al. miR-143 is downregulated in cervical cancer and promotes apoptosis and inhibits tumor formation by targeting Bcl-2 [J]. Mol Med Rep, 2012, 5(3): 753-760.
[12] Liu R, Liao J, Yang M, et al. The cluster of miR-143 and miR-145 affects the risk for esophageal squamous cell carcinoma through co-regulating fascin homolog 1 [J]. PLoS One, 2012, 7(3): e33987.
[13] Ni Y, Meng L, Wang L, et al. MicroRNA-143 functions as a tumor suppressor in human esophageal squamous cell carcinoma [J]. Gene, 2013, 517(2): 197-204.
[14] Sommariva S, Tarricone R, Lazzeri M, et al. Prognostic value of the cell cycle progression score in patients with prostate cancer: a systematic review and meta-analysis [J]. Eur Urol, 2016, 69(1): 107-115.
[15] Vermeulen K, Van Bockstaele DR, Berneman ZN. The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer [J]. Cell Prolif, 2003, 36(3): 131-149.
[16] Liu X, Gong J, Xu B. miR-143 down-regulates TLR2 expression in hepatoma cells and inhibits hepatoma cell proliferation and invasion [J]. Int J Clin Exp Pathol, 2015, 8(10): 12738-12747.
[17] 龚勇, 谢海龙. 肿瘤中miRNA异常表达的分子调控机制及研究进展 [J]. 临床与实验病理学杂志, 2014, 30(10): 1152-1155.
InhibitionofproliferationofesophagealcancercellsbymiR-143throughnegativeregulationofBcl-2expression
HU Chen-chen, Zhang Li*
(Department of Intensive Care Medicine, Hubei Cancer Hospital, Wuhan 430079, China)
ObjectiveTo investigate the effect of miR-143 on proliferation of esophageal cancer cells by negative-regulation of B-cell lymphoma-2 (Bcl-2).MethodsThe expression levels of miR-143 in the esophageal cancer cells TE-1, EC109, EC9706, KYSE150, KYSE510 and SEG-1 and human normal esophageal epithelial cells HEEC were detected by RT-PCR. miR-143 mimics and miR-143 NC were transfected into EC9706 cells by LipofectamineTM2000. After 48 h, the expression levels of miR-143 were detected by RT-PCR, the viability and proliferation of the cells were measured using CCK-8 and EdU staining, the cell cycle was analyzed by flow cytometry, and the expression of Bcl-2 protein and mRNA was detected by Western blot and RT-PCR.ResultsThe expression levels of miR-143 in esophageal cancer cells TE-1, EC109, EC9706, KYSE150, KYSE510 and SEG-1 [(1.36±0.13), (1.08±0.10), (0.89±0.09), (0.95±0.09), (1.32±0.14) and (0.96±0.11)] were significantly lower than that in the human normal esophageal epithelial cells HEEC (2.38±0.15) (P< 0.01). Compared with the miR-143 NC group, the expression level of miR-143 was significantly increased (P< 0.01), the cell viability and proliferation were decreased (P< 0.01), the cell cycle was arrested in the G1 phase (P< 0.01), and the expression of Bcl-2 protein and mRNA was significantly decreased (P< 0.01) in the miR-143 mimics group.ConclusionsOver-expression of miR-143 can inhibit the proliferation of esophageal cancer EC9706 cells through down-regulation of Bcl-2 expression.
miR-143; Esophageal cancer; Cell line EC9706; Proliferation; B-cell lymphoma-2, Bcl-2
R-33
A
1671-7856(2017) 09-0065-06
10.3969.j.issn.1671-7856. 2017.09.012
2016-12-19
胡琛琛(1979-),女,医学硕士,研究方向:重症医学。E-mail: 1789972061@qq.com
张莉(1978-),女,副主任医师,医学硕士,研究方向:肿瘤重症。E-mail: koshenshen@sina.com.cn

