气滞血瘀证大鼠舌部基因表达谱变化初探
梁耀月,董世芬,程 龙,宋敬怡,施佳晨,马 丹,孙建宁
(北京中医药大学中药学院中药药理系,北京 100102)
研究报告
气滞血瘀证大鼠舌部基因表达谱变化初探
梁耀月,董世芬,程 龙,宋敬怡,施佳晨,马 丹,孙建宁*
(北京中医药大学中药学院中药药理系,北京 100102)
目的采用基因芯片技术研究气滞血瘀证模型大鼠舌部全基因表达谱的变化以及差异基因涉及的生物过程和通路,以期为研究血瘀证相关理论和药物治疗提供科学依据。方法采用高脂饲料复合慢性不可预知刺激复制气滞血瘀动物模型,利用基因芯片技术分析正常大鼠与模型大鼠舌中全基因表达谱的变化以及所涉及通路。结果气滞血瘀证大鼠与正常大鼠比较,结果显示差异表达基因有277个,其中上调基因68个,下调基因209个。GO和Pathway分析结果显示气滞血瘀证分别与炎症、脂代谢、免疫反应等生物过程以及补体与凝血级联通路、PPAR信号通路、细胞色素P450异物代谢通路等7条通路的改变有关。结论CYP450以及补体与凝血级联通路、PPAR信号通路中的差异基因可能涉及血瘀证的发病机制,为血瘀证以及相关药物的研究提供依据。
气滞血瘀证;舌;基因芯片;大鼠
血瘀证通常指因气虚、气滞、寒凝、血热、痰阻和外伤等原因,导致血行不畅、壅阻血脉或出血未能及时消散而引起的病证[1],一般认为与血液循环和微循环障碍、血液高黏滞状态、血小板活化和黏附聚集、血栓形成、组织和细胞代谢异常、免疫功能障碍等多种病理变化有关[2]。同时与多种疾病的形成有关,包括心血管系统、免疫系统、代谢系统等疾病[3]。舌诊是血瘀证临床诊断的主要组成部分,对于不同疾病血瘀证量化诊断有重要贡献,如舌质紫黯、舌脉曲张均入选高血压、冠心病和脑血管病的血瘀证诊断危险因子[4],提示血瘀证发生时舌部的生物物质基础研究对血瘀证发生时疾病网络变化及相关药物研究有重要意义。
在本课题组前期实验研究中,我们采用高脂饲料饲养复合慢性不可预知刺激可模拟出气滞血瘀证症状,发现模型大鼠情志出现异常,甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)上升,心功能检测显示收缩末期左室前壁厚度、后壁厚度、舒张期左心室指数均发生异常[5]。此外通过色度分析观测到模型大鼠的舌质出现瘀斑、暗紫等表征变化。因此本研究在此基础之上,利用基因芯片技术研究气滞血瘀证模型大鼠与正常大鼠舌部位全基因表达谱的差异,以期为研究血瘀证相关理论和药物治疗提供科学依据。
1 材料和方法
1.1实验动物
SPF级SD大鼠20只,4周龄,体重(120±10) g,雄性,由斯贝福(北京)实验动物科技有限公司提供【SCXK(京)2011-0004】,在北京中医药大学无特定病原体(specific pathogen-free,SPF)的实验动物室【SYXK(京)2011-0024】饲养,每日光照12 h,房间温度和湿度保持在(23±1)℃和(65±5)%。
1.2药品与试剂
RNA 6000试剂盒(Agilent,批号:5067-1511),荧光标记Cy5(GE,批号:PA15106),无核酸酶水(Sigma,批号:W4502),OneArray Amino Allyl aRNA扩增试剂盒,预杂交液,标记和杂交试剂盒,全基因组表达芯片,洗涤缓冲液I,洗涤缓冲液II,洗涤缓冲液III,以上试剂均由华联生物科技股份有限公司提供。
1.3仪器
G2940CA安捷伦2100生化分析仪(美国安捷伦科技公司);ND1000超微量分光光度仪(赛默飞世尔科技公司);Alpha Imager 2200凝胶成像系统(美国Alpha Innotech公司);5415R微型离心机(德国Eppendorf公司);9700 PCR仪(美国Applied Biosystems公司);HR-80杂交炉(华联生物科技股份有限公司);G2505C安捷伦微阵列芯片扫描仪(美国安捷伦科技公司)。
1.4实验方法
1.4.1 动物的模型建立与标本采集
适应性喂养3 d,将动物随机分为正常对照组和高脂饲料+慢性刺激组2组,每组10只。高脂饲料+慢性刺激组大鼠采用高脂饲料喂养并给予慢性不可预知刺激(chronic unpredictable mild stress,CUMS),刺激因素包括噪声(40 kHz,1 min/只,每间隔5 min给予刺激1次,1天60次)、夹尾(1 min)、禁食(24 h)、禁水(24 h)、电刺激(30 V,1 min)、昼夜颠倒(24 h)。上述刺激每日一种,随机安排,使动物不能预知次日的刺激,持续6周。6周后麻醉,快速取动物舌并迅速放入液氮,后转移至-80℃保存备用。实验过程中按实验动物使用的3R原则给予人道主义关怀。
1.4.2 总RNA的提取、纯化及芯片杂交
RNA提取分离、探针标记与杂交、基因芯片制作检测等均由华联生物科技股份有限公司提供服务。采用TRIzol试剂进行舌的总RNA提取,所得总RNA经紫外分光光度计测定浓度、毛细管电泳质检合格后对样品总RNA中的mRNA进行放大和荧光染料标记并纯化标记后的aRNA。产物纯化后与Phalanx OneArrayTM进行杂交反应,经清洗及讯号侦测后进入分析流程。
1.4.3 芯片扫描及数据分析
芯片杂交结果用安捷伦微阵列芯片扫描仪进行扫描,再利用GenePixTM4进行影像数据撷取,然后应用Rosetta Resolver®系统(Rosetta Biosoftware)进行数据前处理(含数据筛选、校正)与统计计算等过程,根据|log2(Ratio)| ≥ 1与差异表达的P值≤ 0.05筛选差异有显著性的基因。并对差异基因进行GO功能富集和Pathway分析。
2 结果
2.1RNA的质检结果
紫外线分光光度计结果显示:A260/A280均大于或等于1.8;A260/A230均大于或等于1.5,表明总RNA纯度高且总含量均在5 μg以上,毛细管电泳RIN均大于或等于6(图1、图2),证明总RNA的完整性较好,符合基因芯片的实验要求。
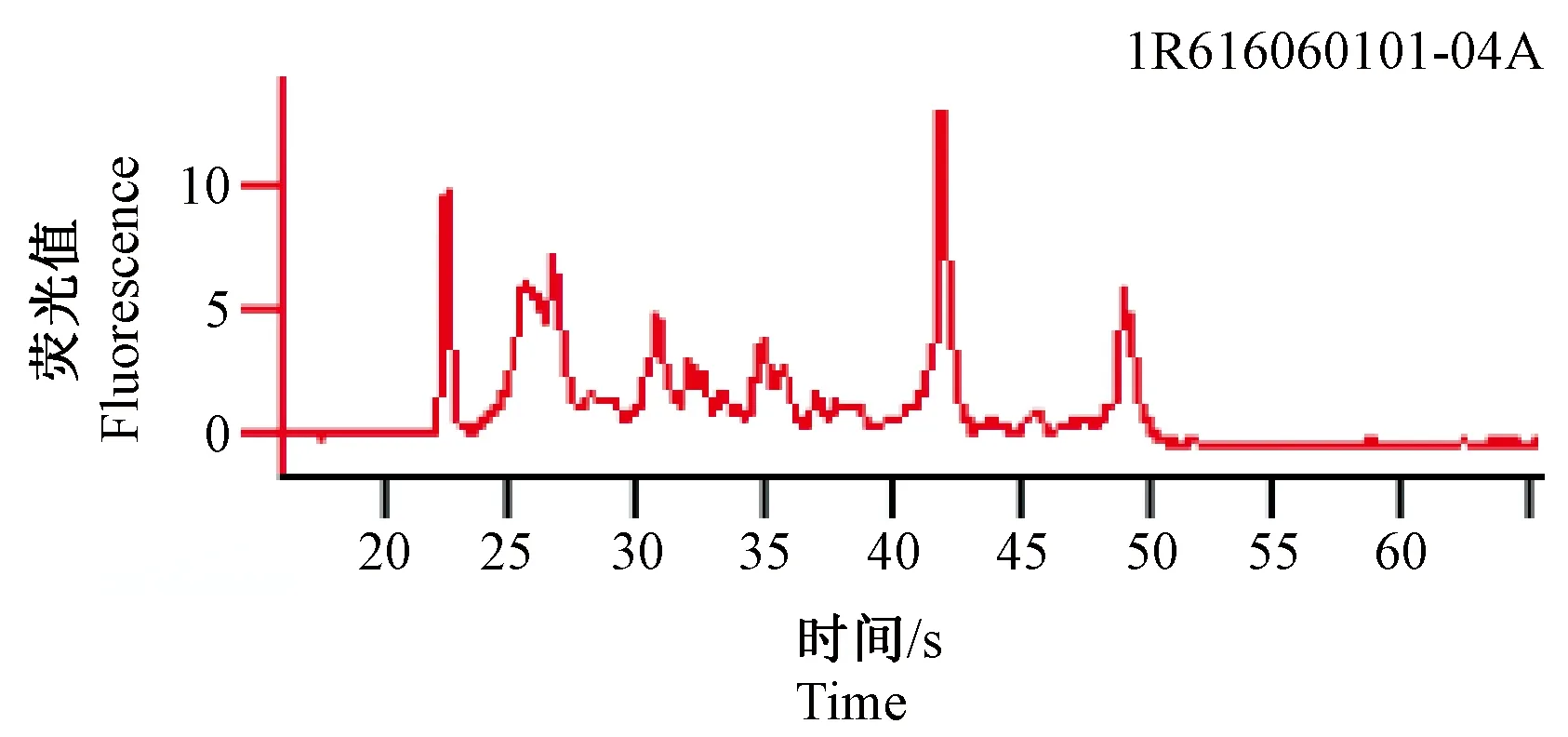
图1 正常组大鼠舌头RNA质检结果Fig.1 Results of quality inspection of the tongue RNA in normal rats
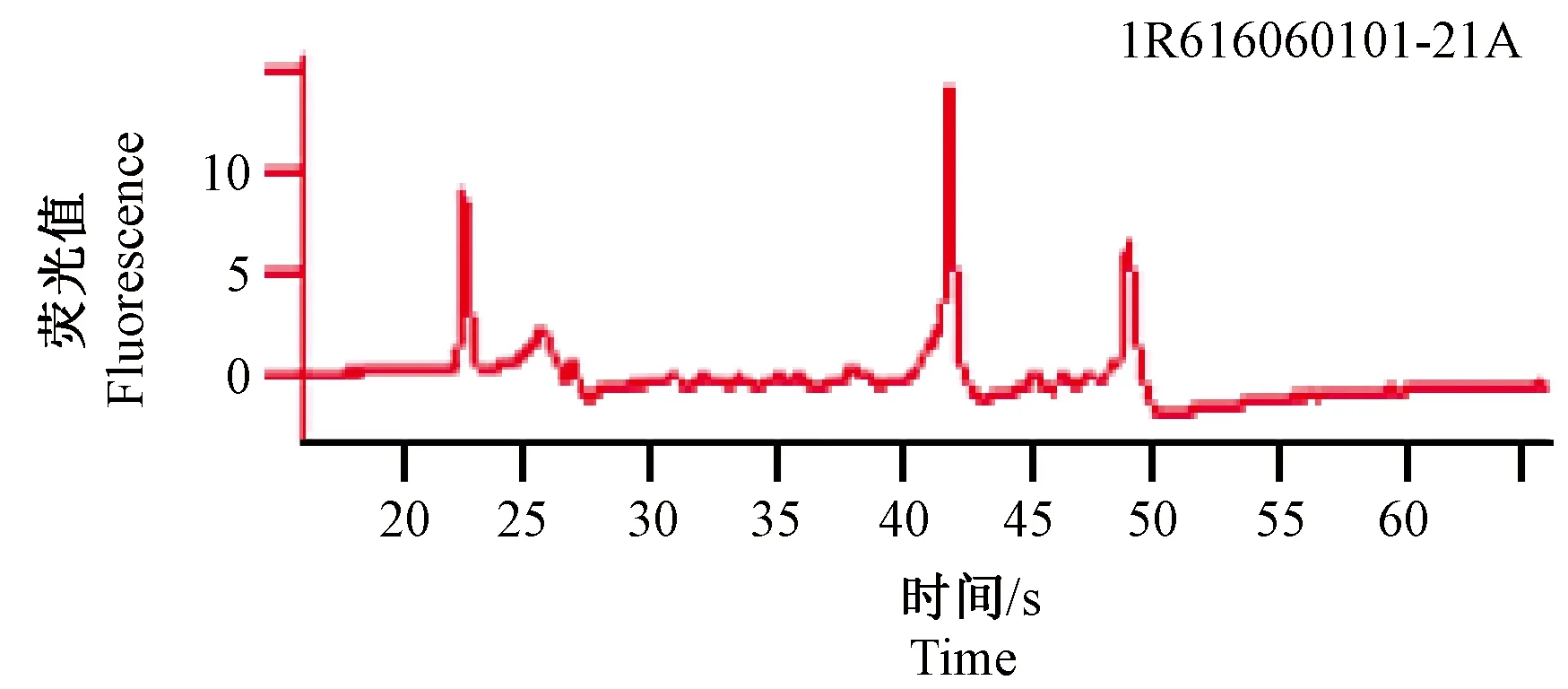
图2 高脂+慢性刺激组大鼠舌头RNA质检结果Fig.2 Results of quality inspection of the tongue RNA in rats treated with high-fat diet combined with chronic unpredictable mild stress
2.2芯片杂交结果
2.2.1 芯片扫描图
图中荧光点亮度的强弱代表了样品中基因表达的强弱,越亮表示基因表达越强;信号很弱,甚至不明显的点是表达很弱甚至不表达的基因。图中芯片杂交信号清晰、均衡,从中可以看出,用一张芯片、一次杂交反应就能在全基因组范围内同时检测近万个基因的表达情况以及它们之间相互调节的关系(图3、图4)。

图3 正常组大鼠基因芯片扫描图Fig.3 Gene chip scanning of the normal rats
2.2.2 差异基因的筛选结果
本实验应用全基因组表达谱芯片对正常组大鼠与气滞血瘀证大鼠味蕾中基因进行分析,高脂+慢性刺激组与正常组相比有277个基因差异表达,其中上调基因68个,下调基因209个,部分差异表达基因见表1、2。以差异倍数(log2|Fold change|)为横坐标,以-lg(P值)为纵坐标作图。红/绿色虚线分别代表P值及倍数筛选的阈值,即|Fold change| ≥ 1且P< 0.05。图中每一个点为一个检出的基因探针(不含控制探针及flagged探针),差异探针标示为蓝色点,见图5。
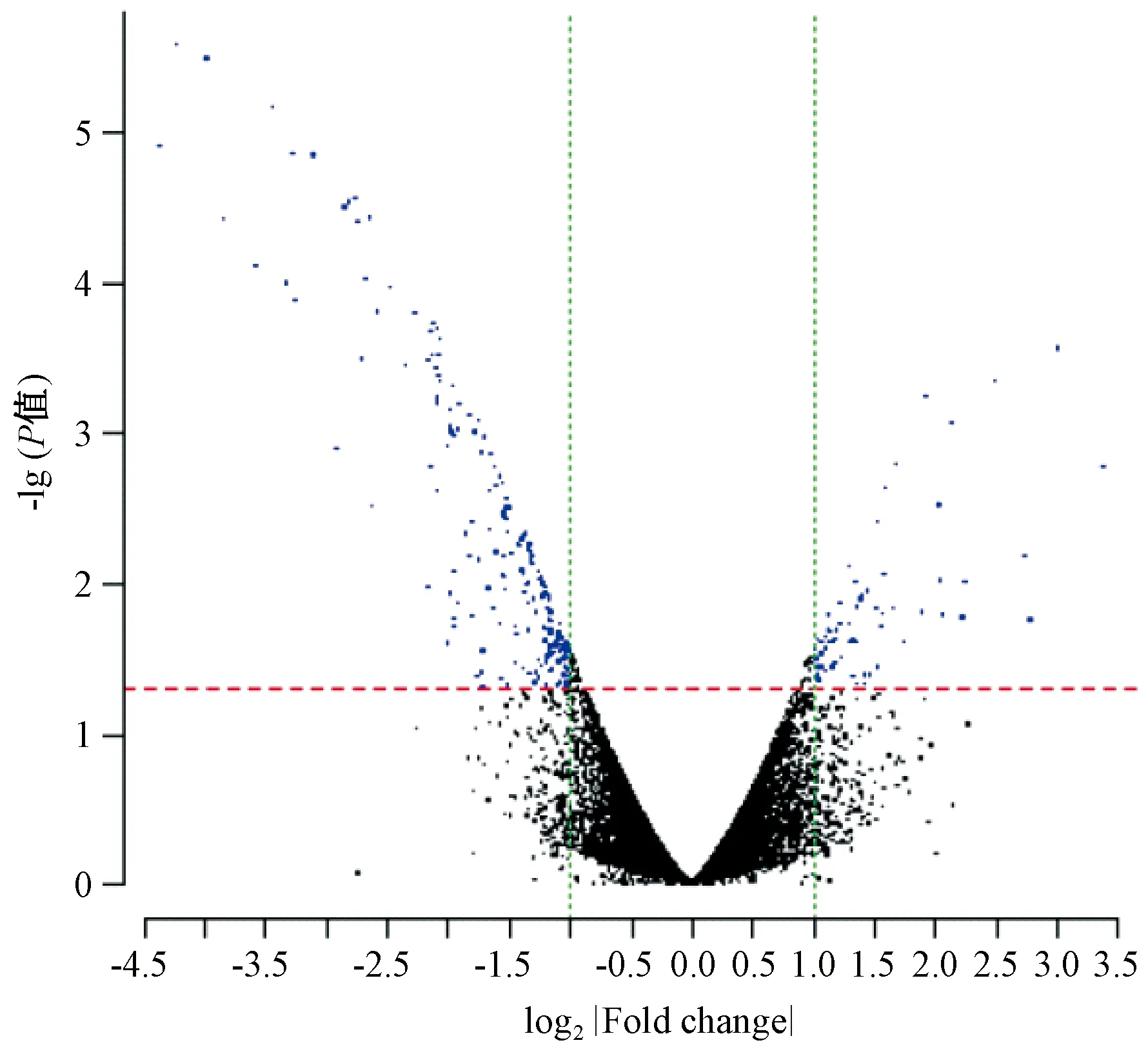
图5 高脂+慢性刺激组/正常组火山图Fig.5 Volcano figure of the rats treated with high-fat diet combined with chronic unpredictable mild stress vs.the normal rats
2.2.3 差异基因GO聚类及Pathway分析结果
GO将基因功能划分为生物过程、分子功能和细胞组成三个方面,通过GO分析可以找到差异基因出现富集的GO分类条目,寻找不同组别的差异基因可能和哪些基因功能的改变有关。GO分析结果显示,涉及54项生物过程,20项分子功能,5项细胞组成,其中血瘀证的发生与脂代谢、炎症反应、免疫反应等多个生物过程有关,部分结果见表3。Pathway分析结果显示,以上差异基因主要涵盖了7条通路,主要涉及免疫、脂代谢方面,具体见表4。

表1 部分上调表达基因
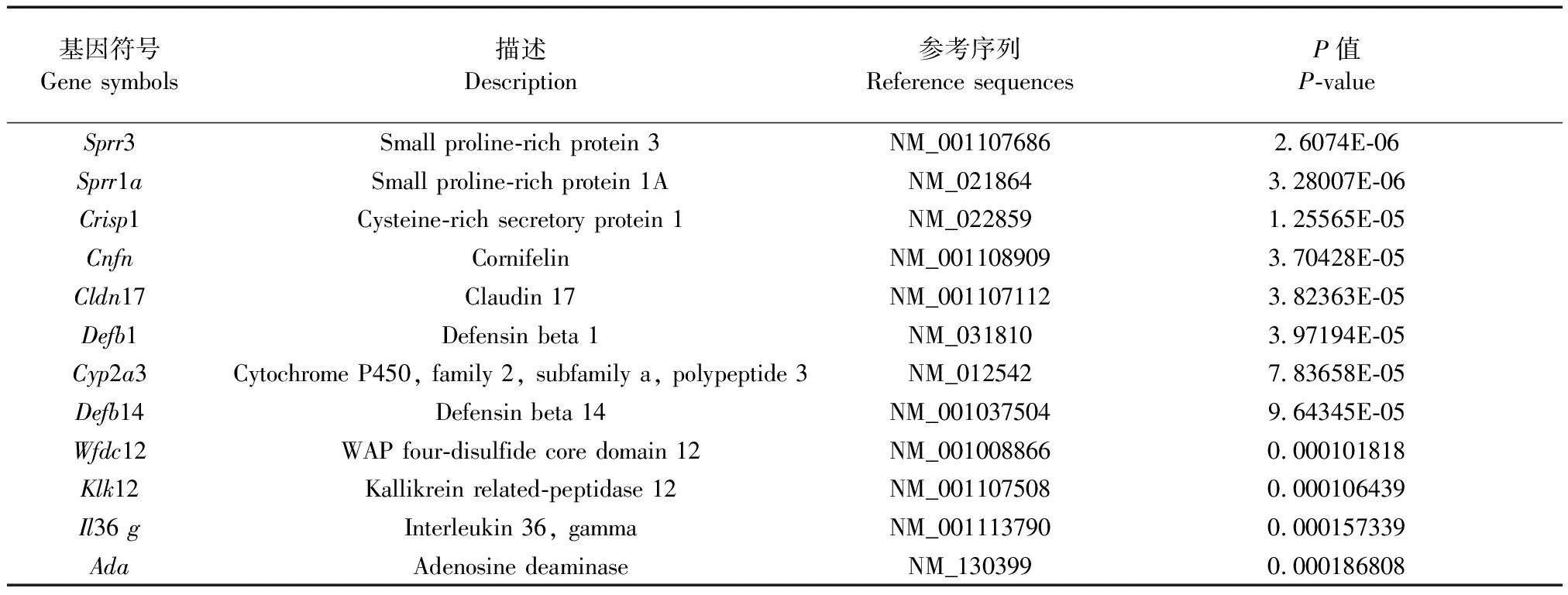
表2 部分下调表达基因

表3 差异基因的部分GO功能注释
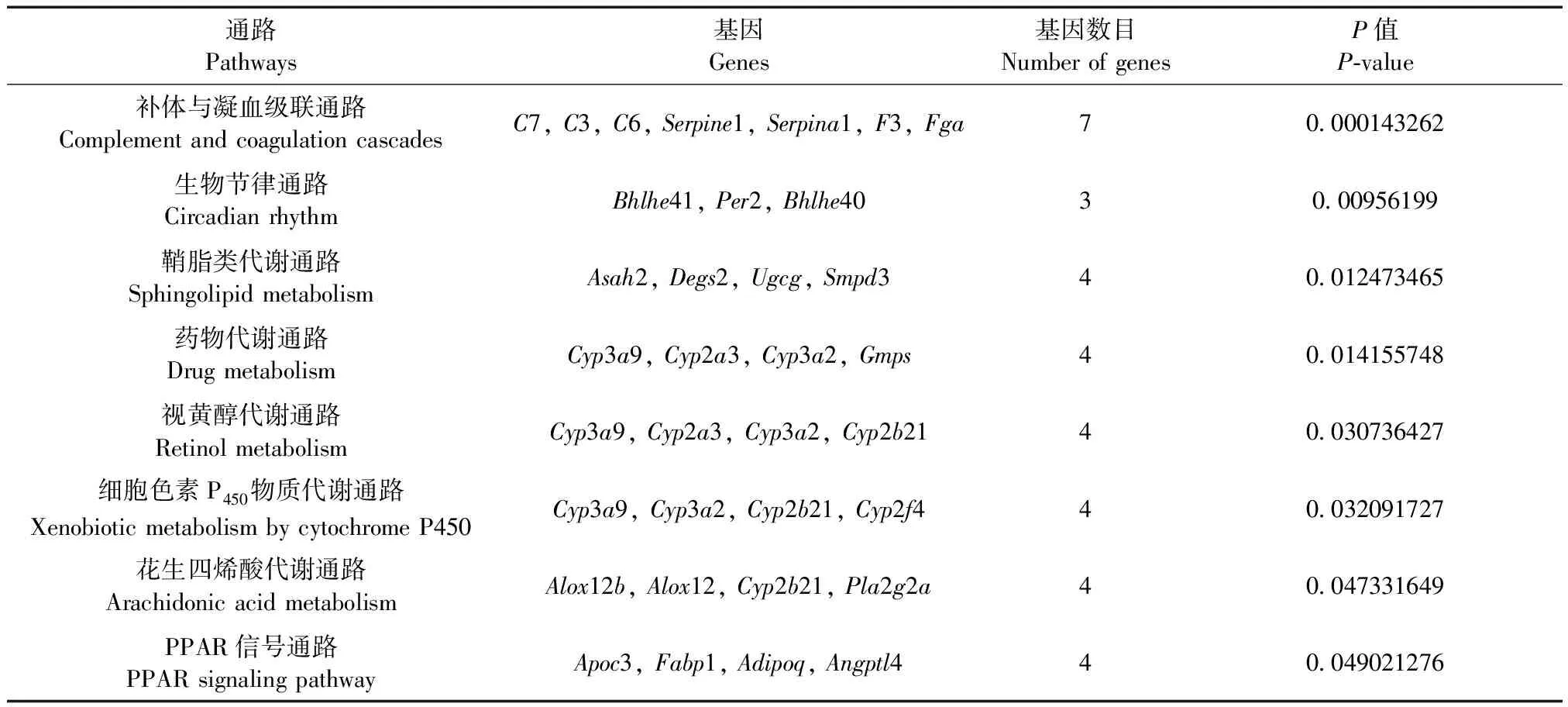
表4 Pathway功能分析结果
3 讨论
血瘀证诊断是中医传统特色诊断之一,多由血行不畅或血流瘀滞形成,传统观点认为久病多瘀、慢病多瘀,血瘀为百病之源[3],临床主要表现特征包括舌暗、有瘀点或瘀斑、舌下静脉曲张、唇痿舌青、口燥但欲漱水不欲咽、疼痛夜甚或痛处不移、脉微大来迟或涩等[1]。舌象临床表征是临床诊断血瘀的重要依据[6],中医舌诊专家系统根据计算机色彩视觉理论,运用色彩分析技术,对舌质、舌苔进行量化诊断,结果发现血瘀舌象变化以舌质暗紫、瘀斑瘀点,舌脉曲张青紫为主,舌苔也有一定变化[7]。同时,整体动物研究也提供了相关依据。吴晏等人在构建的糖尿病大鼠模型中发现模型大鼠较正常大鼠舌色鲜红比率、舌干少津比率升高[8]。郭淑贞等[9]采用舌苔RGB值(三基色,R为红色,G为绿色,B为蓝色)定量分析气虚血瘀证小型猪舌色变化的方法,发现差异蛋白Spot20、Spot6、Spot20分别与舌R、G、B值呈线性相关。舌象临床表征的变化体现的是血瘀证的内在病理变化,必然存在其内在的生物学物质基础,因此观察舌的生物学物质变化可能是研究血瘀证以及相关治疗药物的切入点。
本课题组前期采用高脂膳食负荷慢性不可预知性刺激建立了拟临床气滞血瘀证变化的大鼠模型,该模型表现出行为学、血液黏度、心脏功能、血脂等指标的异常,同时采用色度分析观测到大鼠的舌质出现瘀斑、暗紫等变化。基因芯片(gene chip)技术是用于检测大数据量核酸的生物医学技术,该技术是利用已知的DNA片段排列于固相载体,并应用逆转录原理扩增样品中的未知DNA并与芯片结合,从而推测样品DNA种类的技术。本技术的特点就是高通量筛选出与疾病关系最密切的候选基因。本研究观察到气滞血瘀证大鼠与正常大鼠比较,舌部的显著差异基因有277个,与炎性反应、脂质代谢、免疫反应、细胞黏附等病理过程有关,反映了舌部的基因所体现的病理过程与血瘀证的病理过程高度一致。同时,这些差异基因的通路功能主要集中在补体与凝血级联通路、细胞色素P450物质代谢通路、PPAR信号通路等7条通路,为深入研究血瘀证发生时舌部的生物信号网络变化提供了依据。详述如下:
补体系统由三个相互独立但相互作用的途径组成,即经典、替代和凝集素途径[10],除了增强适应性免疫反应外,在先天免疫中起着基础性的作用[11]。Nijmeijer等[12]研究发现C反应蛋白可以作为激活补体经典途径的激动剂,在急性心肌梗死疾病中可能是通过激活补体起到促炎介质的作用。此外多项研究表明动脉粥样硬化的加速发展和血栓形成的易感性增加与替代补体调节的缺陷有关[13-15]。近期研究发现,新的分子在补体和凝血级联通路中发挥着重要作用,这是由于C1抑制物既是补体经典和凝集素途径的主调节因子,同时也是接触激活系统的重要调节因子[16-19]。在本实验中我们可以发现舌部位补体与凝血级联通路的改变最为明显,这提示我们血瘀证的发病可能与该通路的改变有密切关系,至于具体的机制有待进一步研究。
细胞色素P450(cytochrome P450,CYP450)最初仅在肝脏中发现,后陆续在其他组织器官中发现,并且随着研究的不断深入,人们逐渐发现CYP家族中的成员的功能与疾病的发生与治疗密切相关。Edin等[20]研究发现心肌细胞中细胞色素P4502J2的表达对于缺血再灌注损伤起到保护作用,但内皮细胞CYP2J2的表达对于缺血再灌注损伤几乎是没有任何作用的。而内皮细胞CYP2C8的表达增加了活性氧的生成,使冠状动脉血管收缩增强,梗死面积增加并减少了左心室功能恢复。此外,Pingili等[21]研究发现在雄性小鼠中,CYP1B1的睾酮代谢物可能是高血压的一个致病因素,并且与心肌肥厚、纤维化、NADPH氧化酶活性增加、氧化应激有关。在本实验中可以发现药物代谢通路、视黄醇代谢通路、细胞色素P450物质代谢通路以及花生四烯酸代谢通路中均涉及到CYP450家族成员CYP2A3,CYP2B21,CYP2F4,CYP3A2,Cyp3A9以及未富集到通路中的差异基因CYP2C7,可以推测CYP450可能与血瘀证的发生有密切关系,需要进一步实验验证。
过氧化物酶体增值剂激活受体(peroxisome proliferators-activated receptors,PPARs)基因属于类固醇/甲状腺/维甲酸受体超家族,有3个亚型:PPAR-α、PPAR-β和PPAR-γ,具有多种生物学功能,尤其在脂肪分化、生成等多方面起到重要调节作用[22]。PPAR-γ在脂肪分化中起着关键作用,是脂质和碳水化合物代谢的主要调节剂[23]。采用网络分析方法从化学成分、靶点、疾病三个层面对补阳还五汤进行研究,挖掘补阳还五汤作用的关键靶点,得到COX-2与PPAR-γ两个重要靶点,这两个靶点可能是参与气虚血瘀型疾病病理过程的重要靶点[24]。在本实验中,差异基因富集到PPAR信号通路,可以推测PPAR信号通路可能与血瘀证的发生有密切关系,在该通路中的差异基因可能是其主要病变因素,至于具体机制有待进一步研究。
综上,本研究采用全基因芯片技术,初步探讨气滞血瘀证发病过程中可能存在的差异基因,阐明气滞血瘀证的发病机制并寻找到药物改善疾病潜在的作用靶点。至于具体机制有待进一步研究。
[1] 时晶, 田金洲, 王永炎, 等. 血瘀证的生物学基础研究 [J]. 中华中医药杂志, 2006, 21(6): 363-364.
[2] 陈可冀, 李连达, 翁维良. 血瘀证与活血化瘀研究 [J]. 中西医结合心脑血管病杂志, 2005, 3(1): 1-2.
[3] 陈可冀. 血瘀证与活血化瘀治疗的研究 [J]. 中国中医药现代远程教育, 2005, 3(11): 10-12.
[4] 姚魁武, 王阶, 朱翠玲, 等. 不同疾病血瘀证量化诊断的比较研究 [J]. 辽宁中医杂志, 2006, 33(11): 1381-1383.
[5] 梁耀月, 李佳佳, 董世芬, 等. 3种不同血瘀证动物模型的建立与评价 [J]. 中国药理学通报, 2016, 32(10): 1468-1473.
[6] 王阶, 陈可冀, 翁维良, 等. 血瘀证诊断标准的研究 [J]. 中国中西医结合杂志, 1988, 8(10): 585-587, 589, 580.
[7] 翁维良, 黄世敬, 洪尚杓. 血瘀证舌诊研究 [A]. 中国中医科学院, 世界中医药学会联合会. 第三届国际传统医药大会文集[C]. 北京: 中国中医科学院, 世界中医药学会联合会, 2004. 3.
[8] 吴晏, 韩静, 黄黎明, 等. 糖尿病模型大鼠表征及其证候动态演变研究 [J]. 辽宁中医杂志, 2011, 38(11): 2279-2283.
[9] 郭淑贞, 啜文静, 付帮泽, 等. 基于双向凝胶电泳-质谱技术的小型猪心肌缺血气虚血瘀证血浆特征蛋白质研究 [J]. 中西医结合心脑血管病杂志, 2013, 11(11): 1349-1351.
[10] Ricklin D, Hajishengallis G, Yang K, et al. Complement: a key system for immune surveillance and homeostasis [J]. Nat Immunol, 2010, 11(9): 785-797.
[11] Carroll MC. Complement and humoral immunity [J]. Vaccine, 2008, 26(Suppl 8): 128-133.
[12] Nijmeijer R, Lagrand WK, Lubbers YT, et al. C-reactive protein activates complement in infarcted human myocardium [J]. Am J Pathol, 2003, 163(1): 269-275.
[13] Sherer Y, Zinger H, Shoenfeld Y. Atherosclerosis in systemic lupus erythematosus [J]. Autoimmunity, 2010, 43(1): 98-102.
[14] Fang CJ, Richards A, Liszewski MK, et al. Advances in understanding of pathogenesis of aHUS and HELLP [J]. Br J Haematol, 2008, 143(3): 336-348.
[15] Markiewski MM, Nilsson B, Ekdahl KN, et al. Complement and coagulation: strangers or partners in crime? [J]. Trends Immunol, 2007, 28(4): 184-192.
[16] Bossi F, Peerschke EI, Ghebrehiwet B, et al. Cross-talk between the complement and the kinin system in vascular permeability [J]. Immunol Lett, 2011, 140(1-2): 7-13.
[17] Kaplan AP, Ghebrehiwet B. The plasma bradykinin-forming pathways and its interrelationships with complement [J]. Mol Immunol, 2010, 47(13): 2161-2169.
[18] Wiegner R, Chakraborty S, Huber-Lang M. Complement-coagulation crosstalk on cellular and artificial surfaces [J]. Immunobiology, 2016, 221(10): 1073-1079.
[19] Wu MA, Zanichelli A, Mansi M, et al. Current treatment options for hereditary angioedema due to C1 inhibitor deficiency [J]. Expert Opin Pharmacother, 2016, 17(1): 27-40.
[20] Edin ML, Wang Z, Bradbury JA, et al. Endothelial expression of human cytochrome P450 epoxygenase CYP2C8 increases susceptibility to ischemia-reperfusion injury in isolated mouse heart [J]. FASEB J, 2011, 25(10): 3436-3447.
[21] Pingili AK, Kara M, Khan NS, et al. 6β-hydroxytestosterone, a cytochrome P450 1B1 metabolite of testosterone, contributes to angiotensin II-induced hypertension and its pathogenesis in male mice [J]. Hypertension, 2015, 65(6): 1279-1287.
[22] 柳晓峰, 李辉. PPAR基因与脂肪代谢调控 [J]. 遗传, 2006, 28(2): 243-248.
[23] Savage DB. PPAR gamma as a metabolic regulator: insights from genomics and pharmacology [J]. Expert Rev Mol Med, 2005, 7(1): 1-16.
[24] 丁凡, 张倩茹, 胡元佳, 等. 基于网络分析的补阳还五汤防治气虚血瘀型疾病机制研究 [J]. 中国中药杂志, 2014, 39(22): 4418-4425.
PreliminarystudyonchangesingenomeexpressionprofilesofthetongueinratswithQi-stagnationandbloodstasis
LIANG Yao-yue, DONG Shi-fen, CHENG Long, SONG Jing-yi, SHI Jia-chen, MA Dan, SUN Jian-ning*
(Department of Pharmacology of Traditional Chinese Medicine, School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100102, China)
ObjectiveTo study the changes in whole genome expression profiles of the tongue in a rat model of Qi-stagnation and blood stasis by gene chip microarray as well as the biological processes and pathways related to the differentially expressed genes, and to provide scientific evidence for studies of the related theories and drug therapies of blood stasis syndrome.MethodsThe rat model of Qi-stagnation and blood stasis was established by high-fat diet combined with chronic unpredictable mild stress (CUMS). Changes of the whole genome expression profiles of the tongue in normal rats and model rats and the involved pathways were analyzed by gene chip microarray.ResultsCompared with the normal rats, the rats with Qi-stagnation and blood stasis showed 277 differentially-expressed genes, including 68 up-regulated and 209 down-regulated genes. Gene ontology (GO) and pathway analysis showed that the syndrome of Qi-stagnation and blood stasis is related to biological processes such as inflammation, lipid metabolism and immune responses, as well as the alterations in 7 pathways including the complement and coagulation cascade pathway, the PPAR signaling pathway, and the pathway of xenobiotic metabolism by cytochrome P450.ConclusionsThe differentially-expressed genes, which are involved in CYP450 and complement and coagulation cascade pathway and PPAR signal pathway, may be related to the pathogenesis of blood stasis syndrome, and provide evidence for studies of blood stasis and related drug development.
Syndrome of Qi-stagnation and blood stasis; Tongue; Gene chip; Rats
R-33
A
1671-7856(2017) 09-0011-06
10.3969.j.issn.1671-7856. 2017.09.003
2017-01-13
国家自然科学基金资助项目(编号:81503287,81430094);教育部博士点基金(编号:20130013120002)。
梁耀月(1989 -),女,硕士,研究方向:中药防治心脑血管疾病的研究。E-mail: lyy2610@163.com
孙建宁(1952 -),女,教授,博士生导师。E-mail: jn_sun@sina.com

